- Stroke mimics et Stroke chaméléons
Le diagnostic clinique d’un accident vasculaire cérébral (AVC) en situation d’urgence représente un grand défi pour les médecins, d’autant plus qu’il faut prendre la bonne thérapie sous la pression du temps et sachant qu’un diagnostic erroné risque un pronostic défavorable. Cet article traite des «stroke mimics» et des «stroke chameleons», qui constituent des difficultés fréquentes dans le diagnostic clinique d’un ACV.
The clinical diagnosis of stroke in an emergency situation is a major challenge for physicians, especially since the correct therapy should be chosen under time pressure and a misdiagnosis can be associated with an unfavorable prognosis. This article is about “stroke mimics” and “stroke chameleons”, which are common pitfalls in clinical stroke diagnosis.
Key Words: Stroke Mimics, Stroke Chameleons, Stroke.
L’ AVC présente une incidence globale en augmentation rapide et constitue une urgence médicale absolue. C’ est dans la situation préhospitalière sans imagerie (p. ex. au cabinet médical) qu’un diagnostic clinique rapide et correct est d’une grande importance pour permettre au patient de bénéficier au plus vite d’une thrombolyse. Les signes et symptômes typiques d’un AVC sont les suivants : l’apparition soudaine d’un déficit neurologique focal d’intensité maximale au début. Il existe cependant des témoignages cliniques atypiques qui peuvent compliquer le diagnostic ou conduire à un diagnostic erroné.
Il convient de distinguer les 2 groupes suivants:
I) stroke mimics: nous entendons par là un syndrome clinique qui ressemble à une attaque cérébrale aiguë, mais dont la cause n’ est pas imputable à une ischémie cérébrale («diagnostic faussement positif»).
II) stroke caméléons: il s’ agit de syndromes cliniques atypiques par rapport à une attaque cérébrale et qui ne font donc pas penser au diagnostic différentiel d’ un AVC, mais dont la cause peut être attribuée à une ischémie cérébrale («faux diagnostic négatif»).
Un diagnostic correct est décisif pour un traitement adéquat et le pronostic. En effet, les diagnostics erronés de stroke mimics entraînent des examens (CT/IRM) et des traitements (thrombolyse, antithrombotiques) pas nécessaires qui, d’ une part, génèrent des coûts inutiles et, d’autre part, exposent les patients à des risques thérapeutiques supplémentaires (notamment risque d’hémorragie). En revanche, les diagnostics erronés de stroke caméléons sont liés à un traitement aigu manqué ou omis (thrombolyse), ce qui entraîne un pronostic défavorable. L’ omission de la prévention secondaire est en outre liée à un risque accru de récidive. Nous allons maintenant aborder plus en détail ces diagnostics différentiels de l’ AVC.
Stroke mimics
Les causes les plus fréquentes de stroke mimics sont les crises de migraine, les crises d’ épilepsie ou les troubles fonctionnels, suivies par des causes plus rares telles que l’ hypoglycémie, les infections ou les déséquilibres électrolytiques.
Migraine avec aura
La migraine avec aura est l’une des causes les plus fréquentes de stroke mimics. Typiquement, les crises de migraine avec aura motrice ou dysphasique peuvent être mal interprétées en tant qu’ attaque cérébrale. Pour compliquer encore les choses, les causes les plus fréquentes d’ AVC chez les jeunes patients (foramen ovale persistant et dissections) sont souvent associées à des migraines. En outre, il n’ est pas rare que l’ attaque cérébrale aiguë soit accompagnée de céphalées, en particulier en cas d’ infarctus postérieur ou, plus souvent, d’ hémorragie cérébrale (1). Concernant la migraine, la plupart des auras sont sensitives ou visuelles, ce qui peut être mal interprété comme un déficit focal. Une extension rapide des symptômes pendant quelques minutes est un signe d’aura, surtout si elle est précédée ou suivie de maux de tête. En cas d’aura visuelle, les deux yeux sont typiquement concernés (binoculaire).
De plus, les patients rapportent des phénomènes de stimulation positifs, tels que des sensations d’éblouissement ou des phénomènes de flash, qui persistent même lorsque les paupières se ferment. En cas de troubles visuels dus à l’ ischémie, le début est toutefois très aigu, en cas d’ amaurose fugace, seul un œil est concerné (monoculaire) et les patients rapportent des phénomènes négatifs (« tout est noir/obscur »). Il faut tenir compte du fait qu’ en cas de migraine, les maux de tête se font de plus en plus rares avec l’ âge et que les auras peuvent être isolées. D’ autre part, la prudence est de mise lors de la première présentation d’une symptomatologie d’aura, pour laquelle on recommanderait plutôt généreusement une imagerie (IRM) en cas de doute. Enfin, il ne faut pas oublier que la migraine peut se manifester de manière très différente (avec de grandes variations dans la durée et la dynamique des céphalées et des phénomènes d’aura ainsi que dans l’intensité des troubles), de sorte que la migraine elle-même est discutée comme mimic et caméléon de maladies neurologiques (2,3).
L’ évaluation est particulièrement difficile chez les patients qui ne remplissent pas les critères de la migraine et qui se présentent avec le premier épisode de symptômes sensoriels ou aphasiques transitoires. La migraine hémiplégique est très rare : les premiers épisodes surviennent généralement avant l’ âge de 20 ans et ont tendance à être moins fréquents avec l’ âge, mais à durer plus longtemps (4).
Crise d’épilepsie
Les crises d’ épilepsie sont également une cause très fréquente de stroke mimics. Un déficit moteur post-ictal peut faire suite à une crise focale de courte durée non diagnostiquée. Le développement d’une faiblesse focale après une crise a été décrit par Robert Bentley Todd en 1849 et est probablement dû à une suractivité suivie d’un épuisement du cortex moteur primaire. Le diagnostic peut être difficile lorsqu’une crise constitue la première manifestation d’un accident vasculaire cérébral ou lorsque la cause de la crise d’épilepsie est un accident vasculaire cérébral touchant la circulation antérieure, dans le sens d’ une épilepsie d’origine structurelle. L’ IRM avec les séquences DWI et ADC (coefficient de diffusion apparent) sont essentielles pour distinguer les anciens et les nouveaux AVC ischémiques (5). En fonction des zones cérébrales touchées, d’ autres déficits peuvent apparaître, comme des troubles du langage, des symptômes sensitifs ou des pertes du champ visuel.
Troubles fonctionnels
Les troubles fonctionnels se manifestent souvent par une faiblesse aiguë ou des troubles sensitifs difficiles à localiser sur le plan neuro-anatomique. Il existe souvent un facteur déclenchant, comme une situation de panique ou de stress aiguë. Lors du diagnostic de troubles fonctionnels, les résultats positifs de l’ état neurologique, l’ incohérence (p. ex. la jambe ne peut pas bouger pendant l’examen, mais le patient peut aller normalement aux toilettes) et les incongruités (p. ex. hémiparésie avec préservation complète du visage) ainsi que l’ indifférence par rapport au degré de gravité de l’atteinte peuvent être utiles pour le diagnostic. Le signe de Hoover et la déviation sans pronation en cas de paralysie du bras sont d’autres exemples qui parlent en faveur d’une faiblesse fonctionnelle.
Autres causes
Une hypoglycémie se présente normalement avec des symptômes autonomes, mais elle peut aussi se présenter seule avec des symptômes neurologiques focaux. C’est pourquoi il est toujours recommandé de déterminer la glycémie en cas de défaillance aiguë, en particulier chez les patients à risque (p. ex. traitement à l’insuline ou aux sulfonylurées). Une septicémie ou des déséquilibres électrolytiques tels que des hyponatrémies peuvent également simuler un stroke mimic, notamment chez les patients multimorbides âgés. Mais la septicémie peut également favoriser une attaque cérébrale par le biais d’une hypercoagulabilité.
En cas de vertige aigu, le test HINTS (Head impulse, Nystagmus, Test du Skew – test de l’inclinaison) (6, 7) peut être utile pour différencier un vertige central d’un vertige périphérique. Un test d’impulsion de la tête négatif avec un nystagmus changeant de direction et une skew déviation a une sensibilité et une spécificité très élevées pour un AVC. Il ne faut pas oublier non plus que des maladies chroniques peuvent parfois débuter de manière aiguë (p. ex. crise myasthénique aiguë, sclérose en plaques avec présentation apoplectiforme, hémorragie de tumeurs ou abcès épiduraux).
Stroke mimics et thrombolyse
La prévalence des stroke mimics est élevée (jusqu’à 25%) dans les centres qui disposent d’un scanner en situation aiguë (5). Cela signifie que même les patients sans attaque cérébrale peuvent être traités par thrombolyse intraveineuse. Un symptôme important chez ces patients est par exemple une aphasie sévère sans hémiparésie (3). Heureusement, le taux de complications est extrêmement faible chez ces patients (hémorragie cérébrale 0,5%, œdème oral/au niveau de la langue 0,3%) (8). Dans les centres disposant d’ une IRM pour les diagnostics aigus, le taux de faux positifs peut être réduit. Le taux de diagnostics erronés peut être nettement réduit.
Stroke caméléons
Une attaque cérébrale peut être confondue à tort avec une lésion périphérique des nerfs, un délire ou une syncope. Le risque d’erreur de diagnostic est justement plus élevé chez les jeunes patients et ceux qui présentent des symptômes légers ou un coma. Les AVC touchant la circulation postérieure sont plus souvent ignorés, notamment lorsque ces patients se présentent avec des symptômes plutôt atypiques, comme une confusion sans signes de latéralisation (9, 10).
Diminution de la vigilance
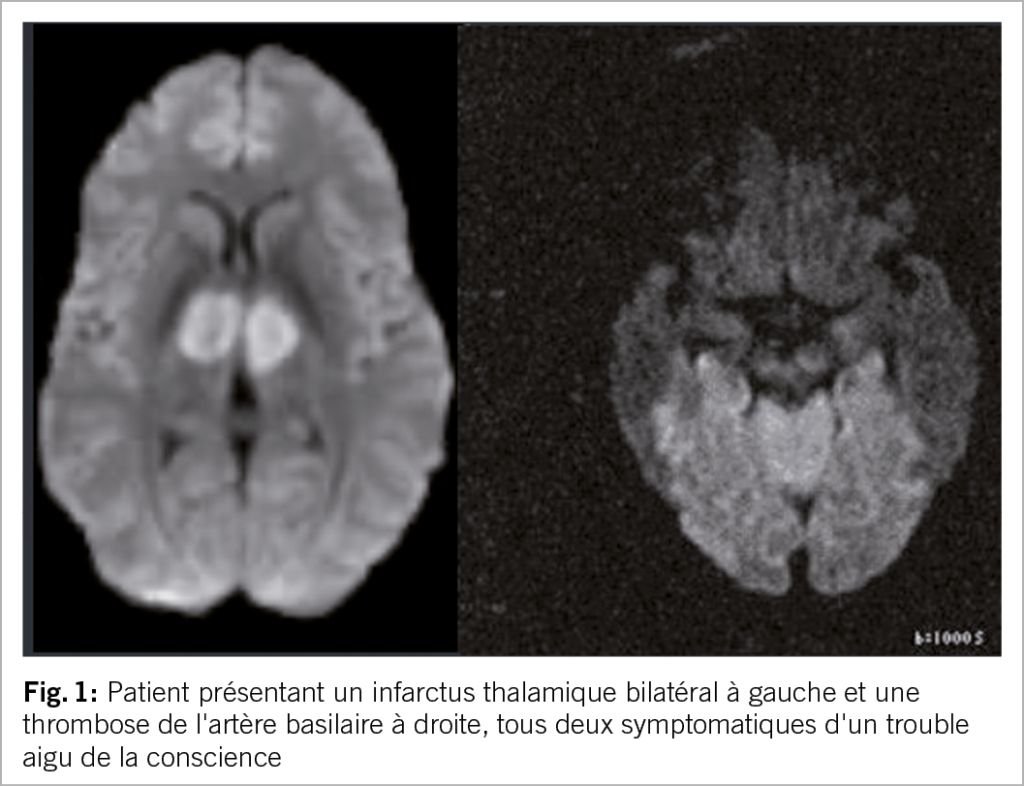
Le syndrome « top of the basilar » est causé par une occlusion de la partie distale de l’ artère basilaire ; les patients peuvent se présenter avec une perte de conscience et une tétraplégie (11). Les modifications pupillaires et les signes oculomoteurs fournissent des indices, mais un scanner ou une angiographie par résonance magnétique sont généralement nécessaires pour confirmer le diagnostic (11). Des troubles de la conscience peuvent également survenir en cas d’ infarctus thalamique bilatéral, généralement en association avec une paralysie du regard vertical (12). Les situations insidieuses sont celles où le patient est victime d’ un AVC peropératoire touchant la circulation postérieure et présente des troubles de la conscience persistants post-opératoires, attribués à l’ anesthésie (fig. 1).
Confusion aiguë
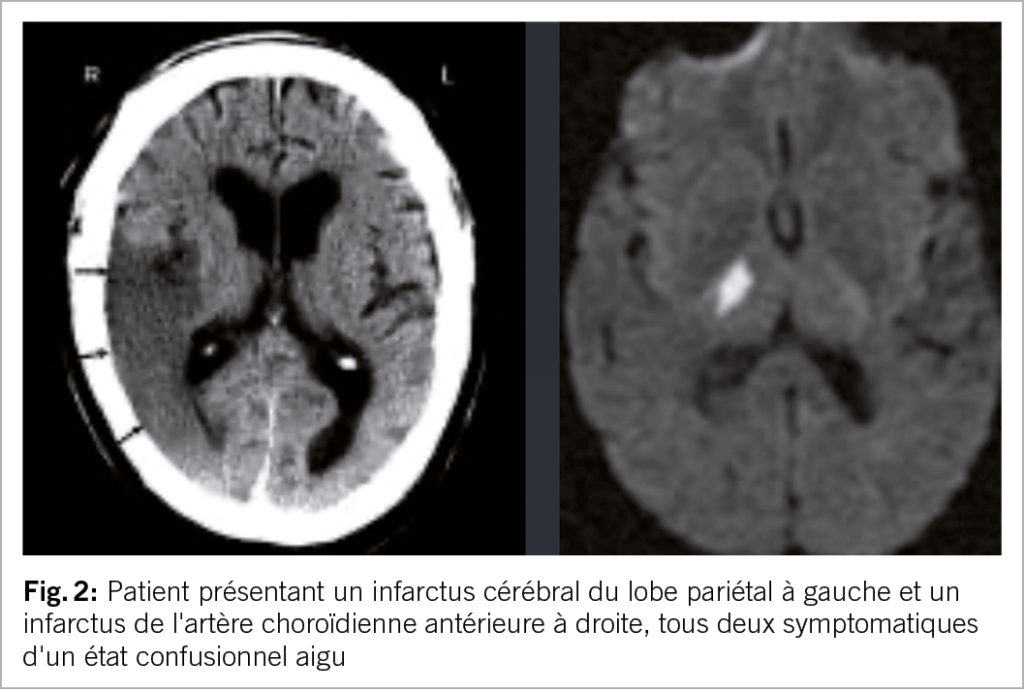
Les AVC peuvent s’accompagner de confusion, d’ excitation ou d’ agitation et être pris à tort pour un délire. Les infarctus du lobe pariétal ou ceux au niveau du territoire de l’artère choroïdienne antérieure sont typiques et peuvent provoquer une confusion aiguë. Un indice clinique utile est l’ apparition soudaine de la confusion (phase très aiguë) chez un patient auparavant asymptomatique (fig. 2).
Troubles moteurs aigus
L’ hémichorée, l’ hémidystonie ou l’ hémiballisme se produisent en cas de lésions touchant les ganglions de la base. Des mouvements toniques rythmiques peuvent parfois indiquer une ischémie du tronc cérébral.
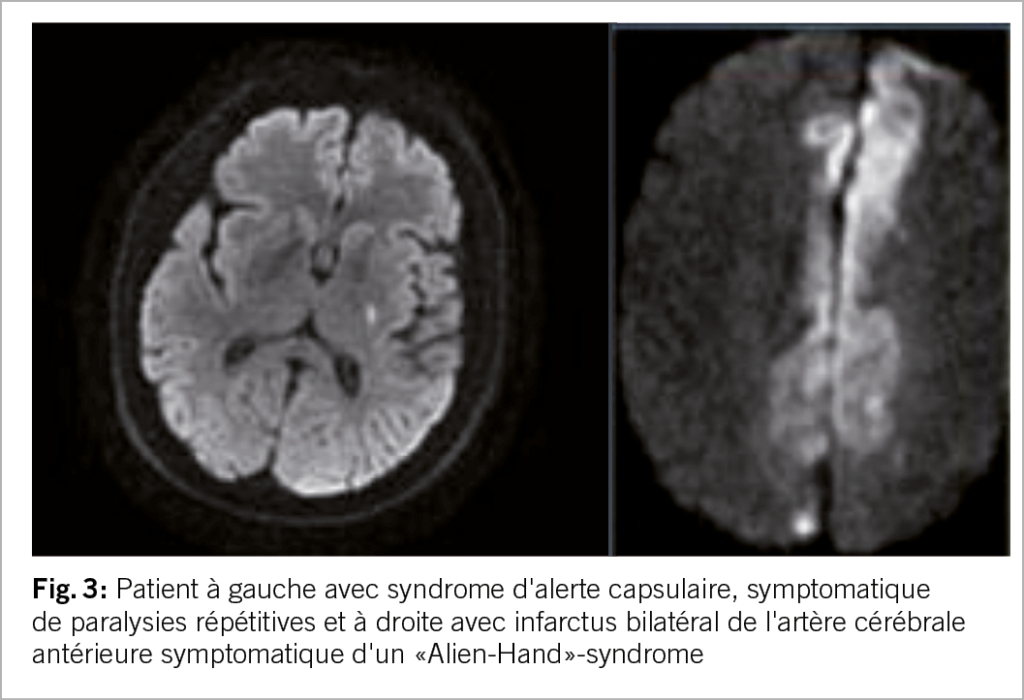
Ces mouvements peuvent être des secousses rythmiques en forme de crise, parfois accompagnées de contractions musculaires toniques prolongées. Les AIT (accidents ischémiques transitoires) de type limb shaking se manifestent par des mouvements rythmiques, involontaires et saccadés des membres dus à une sténose sévère de l’ artère carotide interne. Ces AIT hémodynamiques peuvent être déclenchées par une diminution du débit sanguin cérébral, par exemple lors d’un changement de position ou d’un effort physique, et peuvent être confondues avec des crises d’épilepsie focales. Le syndrome de la main étrangère est défini comme un mouvement involontaire et incontrôlable, mais apparemment ciblé, d’un membre supérieur. En cas d’ infarctus dans la région du corps calleux, différents comportements moteurs anormaux et involontaires peuvent se produire (12) (fig. 3).
Monoparésie pseudo-périphérique
Moins de 5% de tous les AVC se manifestent par une monoparésie isolée (touchant généralement le bras), qui peut être diagnostiquée à tort comme une paralysie nerveuse périphérique (12). La plupart de ces AVC sont dus à des lésions sous-corticales, mais 30% sont causés par des lésions corticales. Cependant, une parésie isolée de la main est généralement d’ origine corticale (hand knob infarction) et peut typiquement simuler une lésion des nerfs périphériques (13, 14).
Cet article est une traduction de « der informierte arzt » 04_2023
Copyright Aerzteverlag medinfo AG
Hôpital universitaire Inselspital
service de neurologie
Freiburgstrasse
3010 Berne
Hôpital universitaire Inselspital
service de neurologie
Freiburgstrasse
3010 Berne
Hôpital universitaire Inselspital
service de neurologie
Freiburgstrasse
3010 Berne
Les auteurs n’ ont pas déclaré de conflits d’ intérêt en relation avec cet article.
Le diagnostic clinique d’un AVC peut s’avérer difficile dans la phaseaiguë sans imagerie. La connaissance des stroke mimics et des caméléons est utile pour un diagnostic précis, d’une part pour éviter des investigations et des traitements inutiles (dans le cas des stroke mimics), de l’autre part pour le dépistage et le traitement des présentations atypiques d’AVC (dans le cas des stroke caméléons).
1. Tentschert, S., Wimmer, R., Greisenegger, S., Lang, W., & Lalouschek, W. (2005).
Headache at stroke onset in 2196 patients with ischemic stroke or transient ischemic attack. Stroke; a Journal of Cerebral Circulation, 36(2). https://doi.org/10.1161/01.str.0000151360.03567.2b
2. Fernandes, P. M., Whiteley, W. N., Hart, S. R., & Al-Shahi Salman, R. (2013, February). Strokes: Mimics and chameleons. Practical Neurology. https://doi.org/10.1136/practneurol-2012-000465
3. Sarikaya, H., Yilmaz, M., Luft, A. R., & Gantenbein, A. R. (2012). Different
pattern of clinical deficits in stroke mimics treated with intravenous thrombolysis. European Neurology, 68(6), 344–349. https://doi.org/10.1159/000337677
4. Thomsen, L. L., Eriksen, M. K., Roemer, S. F., Andersen, I., Olesen, J., & Russell, M. B. (2002). A population-based study of familial hemiplegic migraine suggests revised diagnostic criteria. Brain, 125(6), 1379–1391. https://doi.org/10.1093/brain/awf132
5. Moulin, S., & Leys, D. (2019, February 1). Stroke mimics and chameleons. Current Opinion in Neurology. Lippincott Williams and Wilkins. https://doi.org/10.1097/WCO.0000000000000620
6. Kattah, J. C. (2018). Use of HINTS in the acute vestibular syndrome. An Overview. Stroke and Vascular Neurology, 3(4), 190–196. https://doi.org/10.1136/svn-2018-000160
7. Kattah, J. C., Talkad, A. V., Wang, D. Z., Hsieh, Y. H., & Newman-Toker, D. E. (2009). HINTS to diagnose stroke in the acute vestibular syndrome: Three-step bedside oculomotor examination more sensitive than early MRI diffusion-weighted imaging. Stroke, 40(11), 3504–3510. https://doi.org/10.1161/STROKEAHA.109.551234
8. Erbguth, F. (2017). Stroke Mimics und Stroke Chamäleons-Differenzialdiagnose des Schlaganfalls. Stroke Mimics Und … Fortschr Neurol Psychiatr, 85, 747–764.
9. Arch, A. E., Weisman, D. C., Coca, S., Nystrom, K. V., Wira, C. R., & Schindler,
J. L. (2016). Missed Ischemic Stroke Diagnosis in the Emergency Department by Emergency Medicine and Neurology Services. Stroke, 47(3), 668–673. https://doi.org/10.1161/STROKEAHA.115.010613
10. Richoz, B., Hugli, O., Dami, F., Carron, P. N., Faouzi, M., & Michel, P. (2015). Acute stroke chameleons in a university hospital: Risk factors, circumstances, and outcomes. Neurology, 85(6), 505–511.
11. Luengo-Fernandez, R., Paul, N. L. M., Gray, A. M., Pendlebury, S. T., Bull, L. M., Welch, S. J. V., … Rothwell, P. M. (2013). Population-Based Study of Disability and Institutionalization After Transient Ischemic Attack and Stroke. Stroke, 44(10), 2854–2861. https://doi.org/10.1161/strokeaha.113.001584
12. Tucha, O., Naumann, M., Berg, D., Alders, G. L., & Lange, K. W. (2001). Bilateral thalamic infarction: Clinical, etiological and mri correlates. Acta Neurologica Scandinavica, 103(1), 35–42. https://doi.org/10.1034/j.1600-0404.2001.00141.x
13. Edlow, J. A., & Selim, M. H. (2011, June). Atypical presentations of acute cerebrovascular syndromes. The Lancet Neurology. https://doi.org/10.1016/S1474-4422(11)70069-2
14. Peters, N., Müller-Schunk, S., Freilinger, T., Düring, M., Pfefferkorn, T., & Dichgans, M. (2009). Ischemic stroke of the cortical “hand knob” area: Stroke mechanisms and prognosis. Journal of Neurology, 256(7), 1146–1151. https://doi.org/10.1007/s00415-009-5104-8
la gazette médicale
- Vol. 11
- Ausgabe 4
- Juni 2023