- Update: Metastasiertes Pankreaskarzinom
Das Pankreaskarzinom zeichnet sich besonders durch seinen aggressiven Verlauf und die schlechte Prognose aus. Die palliative Kombinationschemotherapie stellt weiterhin den Behandlungsstandard beim metastasierten Pankreaskarzinom dar. Mit dem stetig wachsenden Verständnis der Karzinogenese und der Tumorbiologie ergeben sich zunehmend neue Therapiemöglichkeiten.
Pancreatic cancer is characterized by its aggressive course and poor prognosis. Palliative combination chemotherapy still represents the state of the art treatment of patients with metastatic pancreatic cancer. The increasing knowledge on carcinogenesis and tumor biology results in new treatment options.
Key Words: Metastasiertes Pankreaskarzinom; palliative Erstlinientherapie; palliative Zweitlinientherapie; zielgerichtete Therapie
Das Adenokarzinom des Pankreas zeichnet sich durch sein aggressives Wachstumsverhalten und seinen ungünstigen Krankheitsverlauf aus. In der Schweiz verzeichnen wir ca. 1600 Neuerkrankungen und 1400 Todesfälle pro Jahr. Bei Diagnosestellung befindet sich die Hälfte der Patienten im metastasierten Stadium.
Die Prognose des metastasierten duktalen Adenokarzinoms des Pankreas (mPDAC) ist weiterhin sehr schlecht, mit einem medianen Überleben (mOS) unter 12 Monaten. Ursächlich hierfür sind u.a. der initial häufig okkulte Krankheitsverlauf sowie die immunosuppressive Tumorumgebung. Eine Verbesserung des Überlebens konnte durch Kombinationschemotherapien und Optimierung der Supportivmassnahmen erreicht werden. Ein überschaubarer Teil der Patienten profitiert bereits heute von der Suche nach Treibermutationen und neuen Erkenntnissen zu mutierten DNA-Reparaturgenen. Durch ein besseres Verständnis des «tumor microenvironment» und der Rolle des Immunsystems werden sich in der Zukunft weitere therapeutische Ansätze ergeben.
Erstlinientherapie
Mit dem Ziel einer Lebenszeitverlängerung, Symptomkontrolle und möglichst langer Aufrechterhaltung der Lebensqualität ist eine palliative Chemotherapie bei Patienten mit mPDAC in Abhängigkeit des Gesundheitszustandes empfohlen. Der Einsatz der Triplet-Therapie FOLFIRINOX bei Patienten in gutem Allgemeinzustand (ECOG 0-1) basiert auf den Resultaten der PRODIGE-Studie, welche die Kombinationschemotherapie mit Gemcitabin (Gem) verglich (mOS 11.1 vs. 6.8 Monate, HR 0.57 (95% KI 0.45-0.73); p<0.001) (1). Die erhöhte Toxizität der Therapie schränkt den Einsatz bei älteren Patienten und solchen mit reduziertem Allgemeinzustand ein. Eine Alternative stellt der Einsatz des modifizierten (m) FOLFIRINOX dar, wobei Irinotecan in erniedrigter Dosierung (150mg/m2 anstelle 180mg/m2) verabreicht und der 5-FU-Bolus weggelassen wird. In einer Metaanalyse mit 1461 Patienten aus 32 Studien ergab sich kein statistisch signifikanter Unterschied im mOS, mPFS und ORR im Vergleich zu den Daten der PRODIGE-Studie bei besserer Verträglichkeit.
In der MPACT-Studie zeigte nab-Paclitaxel (NabP) in Kombination mit Gem vs. Gem alleine ein längeres Gesamtüberleben bei Patienten mit einem ECOG von 0-2 (mOS 8.5 vs. 6.7 Monate, HR 0.72 (95% KI 0.62-0.83); p<0.001) (2). In Entbehrung eines direkten Vergleiches von NabP und Gem mit FOLFIRINOX implizieren retrospektive real-world Daten ein längeres Gesamtüberleben unter der Therapie mit FOLFIRINOX. In der kürzlich am Gastrointestinal Cancers Symposium 2023 vorgestellten Phase III NAPOLI-3 Studie konnte gezeigt werden, dass die Dreierkombination NALIRIFOX (nanoliposomales Irinotecan, 5-FU, Leucovorin (LV) und Oxaliplatin) bei Patienten mit einem ECOG von 0-1 mit einem längeren mOS assoziiert ist als die Zweiertherapie mit Gem und NabP (mOS 11.1 vs. 9.2 Monate, HR 0.83 (95% KI 0.70-0.99); p=0.04). Im NALIRIFOX-Arm war der Anteil an Grad 3-4 gastrointestinaler Toxizität höher als im Gem/NabP-Arm, während mit der Zweiertherapie signifikant mehr Grad 3-4 Neutropenien auftraten (3). Inwiefern NALIRIFOX einen zusätzlichen Benefit gegenüber der kostengünstigeren und bereits etablierten Tripletvariante FOLFIRINOX zeigt, kann nicht beurteilt werden, scheint jedoch eher unwahrscheinlich zu sein.
Eine kleine Phase Ib/II Studie, welche den Einsatz von Cisplatin in Kombination mit Gem und NabP untersuchte, brachte erfolgsversprechende Resultate mit einer ORR von 71% und einem mOS von 16.4 Monaten hervor. Eine weitere Phase Ib/II Studie (GABRINOX) prüfte die Effizienz von Gem und NabP alternierend mit FOLFIRINOX. Diese Kombinationstherapie führte zu einer ORR von 64.9% und einem mOS von 15.1 Monaten. Diese beiden Phase Ib/II Studien zeigen vielversprechende Therapieansätze, die jedoch in dieser Form noch keine Verwendung in der Klinik finden.
In der am ASCO 2022 präsentierten Phase II SEQUENCE Studie war der alternierende Einsatz von Gem und NabP in Kombination mit FOLFOX bei Patienten mit einem ECOG von 0-1 mit einem besseren 1-Jahres OS und mOS assoziiert als die Therapie mit Gem und NabP (55.3% vs. 35.4%; p=0.016 und 13.2 vs. 9.7 Monate, HR 0.68 (95% KI 0.48-0.95); p=0.023) (4). Ob dieser sequentielle Ansatz besser ist als eine upfront FOLFIRINOX Therapie kann nicht beurteilt werden.
Bei älteren Patienten mit mPDAC und einem ECOG Status von 2 besteht die Möglichkeit einer Monotherapie mit Gem. Bei einem ECOG Status >2 ist eine «best supportive care» Strategie angezeigt.
Zusammenfassend implizieren die Studienergebnisse bei «fitten» Patienten eine leichte Überlegenheit einer Mehrfachkombination gegenüber der Zweierkombination Gem/NabP.
Erhaltungstherapie
5-7% der Patienten mit PDAC weisen eine Keimbahnmutation in den Genen der DNA-Reparatur BRCA1/2 oder PALB2 auf. In der POLO Studie konnte gezeigt werden, dass eine Erhaltungstherapie mit Olaparib vs. Placebo nach einer mindestens 4-monatigen platin-basierten Chemotherapie ohne Progression zu einer Verlängerung des mPFS (6.7 vs. 3.7 Monate, HR 0.49 (95% KI 0.33-0.73); p=0.0004), jedoch nicht zu einer Verlängerung des mOS (19.0 vs. 19.2 Monate) führt (5). Einer der Kritikpunkte der Studie ist, dass im Vergleichsarm mit Placebo anstatt einer zytotoxischen Therapie verglichen wurde. In der PRODIGE 35 PANOPTIMOX Phase II Studie war eine Erhaltungstherapie mit 5-FU/LV nach 8 Zyklen Erstlinientherapie mit FOLFIRINOX und Wiederbeginn mit FOLFIRINOX bei Tumorprogression verglichen mit 12 Zyklen FOLFIRINOX mit einem ähnlichen Outcome assoziiert (6 Monate PFS 42.9% vs. 47.1%, mOS 11.2 vs. 10.1 Monate). Das statistische Design der Studie erlaubt jedoch keinen direkten Vergleich der Behandlungsarme. Interessanterweise war der Anteil an Grad 3-4 Neurotoxizität höher im Erhaltungstherapie-Arm als im FOLFIRINOX-Arm. Dies könnte am ehesten auf die höhere kumulative Oxaliplatin-Dosis im Erhaltungstherapie-Arm zurückzuführen sein.
Zweitlinienchemotherapie
Bei weniger als der Hälfte der Patienten erlaubt der Gesundheitszustand nach Progression unter der Erstlinientherapie die Evaluation einer Zweitlinientherapie. Die Datenlage hierzu ist jedoch spärlich. Nach Progression unter FOLFIRINOX kann eine Therapie mit Gem +/- NabP erfolgen. In einer retrospektiven, multizentrischen real-world Studie konnte nach Progression unter FOLFIRINOX mit Gem/NabP ein statistisch signifikant längeres mOS verzeichnet werden als mit Gem alleine (7.1 vs. 4.7 Monate, HR 0.67 (95% KI 0.53-0.86). Interessanterweise zeigte sich in der kürzlich am ESMO 2022 präsentierten Phase III GEMPAX Studie nach Progression unter FOLFIRINOX kein Unterschied im mOS zwischen Gem und Gem/Paclitaxel(P) (5.9 vs. 6.4 Monate, p=0.41). Hier wurde jedoch anstelle von Gem/NabP mit Gem/P verglichen.
Nach Progression unter einer gemcitabinhaltigen Erstlinientherapie konnte die Phase III NAPOLI-1 Studie aufzeigen, dass der Einsatz von nanoliposomalem Irinotecan in Kombination mit 5-FU mit einem längeren OS assoziiert ist als eine Therapie mit 5-FU/LV alleine (mOS 6.2 vs. 4.2 Monate, HR 0.75 (95% KI 0.57-0.99); p=0.039) (6). Alternativ kann eine oxaliplatin-basierte Chemotherapie (OFF respektive FOLFOX) erfolgen. Diesbezüglich zeigte die Phase III CONKO-003 Studie, dass eine Therapie mit 5-FU und Oxaliplatin (OFF) vs. 5-FU/LV mit einem längeren mOS assoziiert ist (5.9 vs. 3.3 Monate, HR 0.66 (95% KI 0.48-0.91); p=0.010).
Eine kleine Phase II Studie (RUCAPANC) zeigte, dass der PARP-Inhibitor Rucaparib nach Progression unter platin-basierter Chemotherapie bei BRCA1/2-mutierten lokal fortgeschrittenen PDAC oder mPDAC nicht effizient ist.
Potentiell prädiktive Marker für eine platinhaltige Chemotherapie
Mutationen in Genen, die an der homologen Rekombinationsreparatur (HRR) beteiligt sind (BRCA, PALB2 etc.) verfügen über eine gesteigerte Chemosensitivität für platinhaltige Systemtherapien. In retrospektiven Studien konnte bei Patienten mit mPDAC, die Mutationen in HRR relevanten Genen aufwiesen, unter einer Therapie mit FOLFIRINOX ein verlängertes OS beobachtet werden. Eine Phase II Studie, die bei lokal fortgeschrittenen und mPDAC mit BRCA und PALPB2 Keimbahnmutationen Cisplatin/Gem +/- einem PARP-Inhibitor prüfte, zeigte zwar kein längeres OS mit der Hinzugabe von Veliparib, jedoch insgesamt hervorragende OS Daten beim Einsatz der platin-basierten Chemotherapie (15.5 vs. 16.4 Monate, p=0.6).
Immuntherapie und Anti-Tumorstroma-Therapie
Während die Einführung der Immuncheckpoint-Inhibitoren einen grossen Fortschritt in der Behandlung diverser Krebsarten bedeutete, spielt die Immuntherapie bei Patienten mit mPDAC weiterhin eine untergeordnete Rolle. Bei mPDAC mit einer Mismatch Repair-Defizienz (dMMR) / hoher Mikrosatelliteninstabilität (ca. 1%) kann ab der 2. Therapielinie Pembrolizumab eingesetzt werden, wobei in der Phase II KEYNOTE-158 Studie die Ansprechrate mit 18.2% relativ tief und das mPFS sowie das mOS mit 2.1 respektive 4.0 Monaten kurz ausfielen (7). Die Kombination von Nivolumab mit Gem und NabP führte in der mehrarmigen Phase II PRINCE Studie zu einem 1-Jahres OS von 57.7%. Verglichen wurde mit den historischen Daten der MPACT Studie, in welcher das 1-Jahres OS mit Gem/NabP 35% betrug (p=0.006). Eine Phase III Studie zum Einsatz des PD-1-Antikörpers Sintilimab in Kombination mit mFOLFIRINOX blieb im Vergleich zu mFOLFIRINOX ohne Nachweis eines OS-Benefits. Ein möglicher Erklärungsansatz für die bisher beobachtete eingeschränkte Wirksamkeit der Immuntherapie bei Patienten mit mPDAC liegt in der Zusammensetzung des Tumorstromas des Pankreaskarzinoms, welches sich durch seine hohe Dichte und die Infiltration durch immunsuppressive Zellen auszeichnet.
Eine Phase III Studie zum Einsatz von pegylierter Hyaluronidase mit dem Ziel die Dichte des Tumorstromas zu reduzieren und die Penetranz der Chemotherapeutika zu erhöhen in Kombination mit NabP und Gem führte im Vergleich zur alleinigen Chemotherapie zu keiner Verlängerung des mOS (11.2 vs. 11.5 Monate).
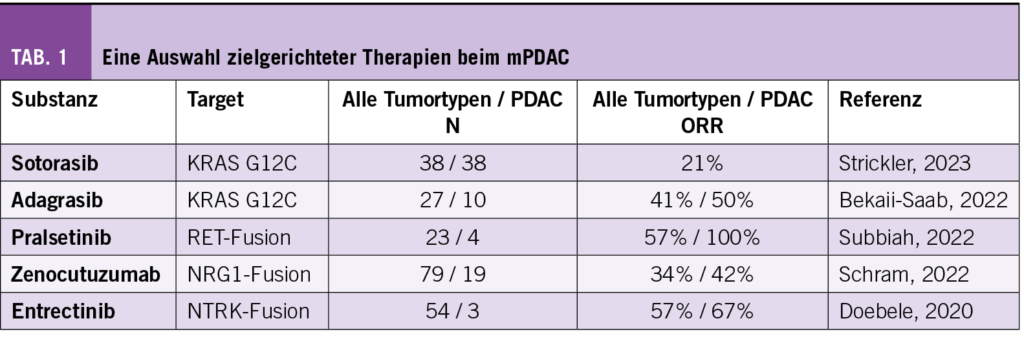
Zielgerichtete Therapie (Tab. 1)
Mit einer Prävalenz von über 90% bilden Mutationen im KRAS-Gen die häufigsten genetischen Alterationen des Pankreaskarzinoms. Mit Einführung der Wirkstoffe Sotorasib und Adagrasib ergaben sich neue Therapiemöglichkeiten bei Vorliegen einer KRAS G12C Mutation, welche beim Pankreaskarzinom in geringer Anzahl vorkommt (ca. 1-2%). In der KRYSTAL-1 Studie führte Adagrasib in vorbehandelten Patienten mit mPDAC und einer KRAS G12C Mutation zu einer ORR von 50%. Etwas weniger deutlich fiel das Ansprechen mit Sotorasib in der Phase I/II CodeBreaK100 Studie aus mit einer ORR von 21% (8). Studien zur zielgerichteten Therapie anderer KRAS-Mutationen (KRAS G12D/G12V) beim mPDAC sind derzeit im Gange.
In einer Phase I/II Basket-Studie führte der Einsatz von Pralsetinib bei Patienten mit mPDAC und einer RET-Fusion (ca. 1%) zu einem Ansprechen bei allen 4 Patienten (ORR 100%) inkl. einer kompletten Remission (9). Ebenfalls selten (<1%) ist das Vorliegen einer NRG1-Fusion bei KRASwt mPDAC. Der Einsatz des bispezifischen Antikörpers Zenocutuzumab führte in einer Phase II Basket-Studie zu einer ORR von 42% (8/19 Patienten) bei Patienten mit mPDAC. Doebele et al. rapportierten für Patienten mit mPDAC und einer NTRK-Fusion (<1%) mit dem Einsatz von Entrectinib eine ORR von 67% (10). Die Phase II Destiny-PanTumor02 Studie testet zur Zeit den Einsatz von Trastuzumab deruxtecan bei HER2 exprimierenden soliden Tumoren, unter anderem auch bei Patienten mit mPDAC. Eine weitere Phase II Studie prüft aktuell eine Kombinationstherapie mit Binimetinib (MEK-Inhibitor) und Encorafenib (BRAF-Inhibitor) u.a. auch bei Patienten mit vorbehandelten BRAF V600E mutierten mPDAC.
Inselspital, Universitätsspital Bern,
Universitätsklinik für Medizinische Onkologie
3010 Bern
Inselspital, Universitätsspital Bern,
Universitätsklinik für Medizinische Onkologie
3010 Bern
Die Autoren haben keinen Interessenskonflikt
in Zusammenhang mit diesem Artikel deklariert.
◆ Die Chemotherapie ist weiterhin die initiale Standardtherapie
bei Patienten mit mPDAC.
◆ Next Generation Sequencing (NGS) ermöglicht es genetische
Alterationen zu identifizieren, die ev. in weiteren Therapielinien
zielgerichtet angegangen werden können.
◆ Das Pankreaskarzinom zeichnet sich durch seine stromareiche und immunosuppressive Tumormikroumgebung aus.
◆ Im Gegensatz zu anderen soliden Tumoren spielt die Immuncheckpoint Therapie im Behandlungsalgorithmus beim MSS mPDAC noch keine Rolle.
◆ Vorbehandelte Patienten, deren Tumor eine KRAS G12C Mutation aufweist, können vom Einsatz von Tyrosinkinase-Inhibitoren profitieren.
1. Conroy T, Desseigne F, Ychou M et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011;364(19):1817-1825.
2. Von Hoff DD, Ervin T, Arena FP et al. Increased Survival in Pancreatic Cancer with nab-Paclitaxel plus Gemcitabine. N Engl J Med. 2013;369(18):1691-1703.
3. Weinberg ZA, Melisi D, Macarulla T et al. NAPOLI-3: A randomized, open-label phase 3 study of liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX) versus nab-paclitaxel + gemcitabine in treatment-naïve patients with metastatic pancreatic ductal adenocarcinoma (mPDAC). J Clin Oncol 2023;41:suppl 4; abstr LBA661
4. Carrato A, Pazo-Cid R, Macarulla T et al. Sequential nab-paclitaxel/gemcitabine followed by modified FOLFOX for first-line metastatic pancreatic cancer: The SEQUENCE trial. J Clin Oncol 2022;40:16_suppl:4022
5. Kindler HL, Hammel P, Reni M et al. Overall Survival Results From the POLO Trial: A Phase III Study of Active Maintenance Olaparib Versus Placebo for Germline BRCA-Mutated Metastatic Pancreatic Cancer. J Clin Oncol. 2022;40(34):3929-3939.
6. Wang-Gillam A, Hubner RA, Siveke JT et al. NAPOLI-1 phase 3 study of liposomal irinotecan in metastatic pancreatic cancer: Final overall survival analysis and characteristics of long-term survivors. Eur J Cancer. 2019;108:78-87.
7. Marabelle A, Le DT, Ascierto PA et al. Efficacy of Pembrolizumab in Patients with Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results from the Phase II KEYNOTE-158 Study. J Clin Oncol. 2020;38(1):1-10.
8. Strickler JH, Satake H, George TJ et al. Sotorasib in KRAS p.G12C–Mutated Advanced Pancreatic Cancer. N Engl J Med. 2023;388(1):33-43.
9. Subbiah V, Cassier PA, Siena S et al. Pan-cancer efficacy of pralsetinib in patients with RET fusion-positive solid tumors from the phase 1/2 ARROW trial. Nat Med. 2022;28(8):1640-1645.
10. Doebele RC, Drilon A, Paz-Ares L et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1–2 trials. Lancet Oncol. 2020;21(2):271-282.
info@onco-suisse
- Vol. 13
- Ausgabe 4
- Juli 2023