- Neuste Erkenntnisse zum Vorhofsohrverschluss
In den letzten Jahren hat sich das Gebiet des Verschlusses des linken Vorhofohrs (LAAC) rasch entwickelt. Es wurden neue klinische Indikationen evaluiert, neue Devices zugelassen, die unterstützenden Bildgebungstechnologien haben sich weiterentwickelt und die Resultate mehrerer wichtiger Studien wurden publiziert. Dies führte insgesamt zu einer deutlichen Verbesserung der klinischen Resultate im Vergleich zu den ersten Zulassungsstudien, die vor mehr als 10 Jahren durchgeführt wurden. Allerdings gibt es nach wie vor Evidenzlücken, insbesondere in Bezug auf die antithrombotische Therapie nach LAAC, bei Thromben auf dem Device oder bei peridevice Lecks. Ziel dieser Übersicht ist es daher, die neuesten Erkenntnisse und die verbleibenden Herausforderungen im Zusammenhang mit der perkutanen LAAC zu beleuchten.
Over the past few years, the field of left atrial appendage closure (LAAC) has rapidly expanded. New clinical indications have been reported, clinical practice have matured over time, new devices have been approved, imaging technologies have evolved and results from several important studies have been published. The expansion of knowledge about the field of LAAC led to a significant improvement of clinical outcomes as compared to the first pivotal studies conducted more than 10 years ago. However, still evidence gap remain, especially related to the management of post-LAAC antithrombotic therapy, in particular in case of device related thrombus or peridevice leak. Thus, this review aims at evaluating the latest evidence and the remaining challenges related to percutaneous LAAC.
Key Words: left atrial appendage closure, evidence, clinical indication, imaging
Evidenzbasierter Einsatz des LAAC
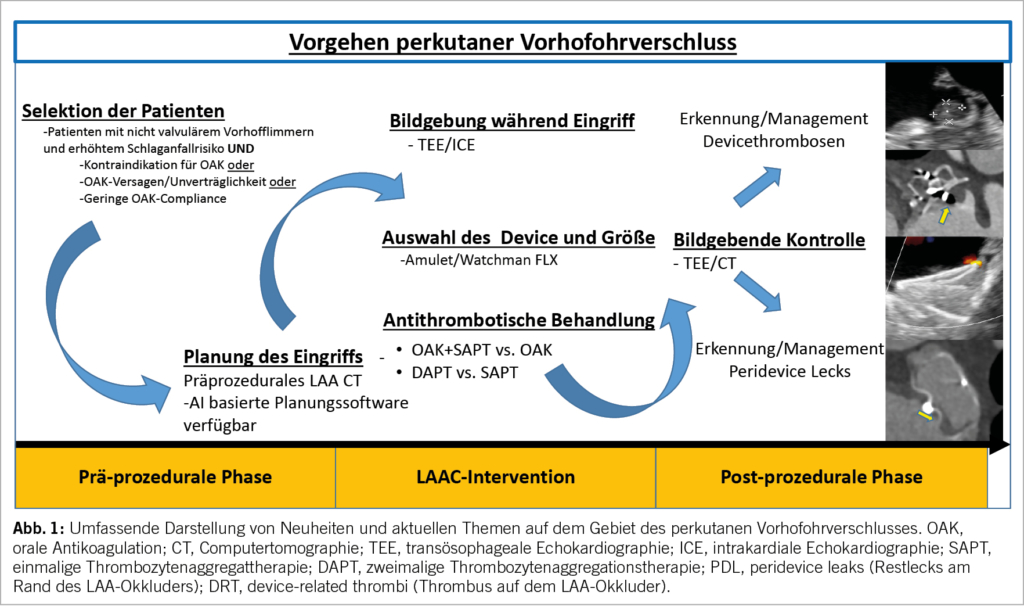
Der perkutane Vorhofohrverschluss (LAAC) hat sich in der klinischen Praxis als mögliche Alternative zur oralen Antikoagulation (OAK) zur Schlaganfallprävention bei Patienten mit nicht valvulärem Vorhofflimmern (AF) etabliert. In den letzten 2 Jahrzehnten hat sich viel bewegt: Die Zahl der LAAC-Eingriffe ist exponentiell gestiegen (1), neue Devices wurden zugelassen oder befinden sich in der klinischen Entwicklung (2), Bildgebungstechnologien haben sich weiterentwickelt (3-5), das technische Fachwissen und der Implantationsprozess haben sich gefestigt (1) und es wurden Resultate von mehreren wichtigen Studien publiziert (2, 6-9). Das Konzept einer verbesserten Thromboembolieprophylaxe durch einen vollständigen Verschluss des linken Vorhofs wurde in der multizentrischen, randomisierten LAAOS III Studie eindrücklich demonstriert. Bei fast 5’000 Patienten mit Vorhofflimmern, die sich aufgrund einer anderen Indikation einer Herzoperation unterzogen, hat sich gezeigt, dass die chirurgische Ligatur des linken Vorhofsohrs das Risiko eines Schlaganfalls oder einer systemischen Embolie wesentlich reduziert (Hazard Ration [HR]: 0.67; 95% Confidence Interval [CI]: 0.53-0.85; p=0.001) während einem durchschnittlichen Follow-up von 3,8 Jahren (9). Interessanterweise wurde in beiden Studiengruppen die OAK fortgesetzt, was auf eine synergistische Wirkung von OAK und LAAC hindeutet.
PRAGUE-17 war die dritte randomisierte, kontrollierte Studie nach zwei amerikanischen Studien, die vor mehr als 10 Jahren durchgeführt wurden und alle einen LAAC mit OAK verglichen (8). In der Prague-17 Studie wurden 402 Patienten mit nicht valvulärem Vorhofflimmern (CHA2DS2-VASc ≥3) randomisiert und bis zu 3,5 Jahre lang mit LAAC im Vergleich zu OAK (95 % Apixaban) behandelt. Der primäre Studienendpunkt war eine Kombination aus kardio-embolischen Ereignissen, kardiovaskulärem Tod, klinisch relevanter Blutung oder peri-prozeduralen Komplikationen. Der LAAC war der OAK nicht unterlegen (HR: 0.81; 95 % CI: 0.56-1.18; p= 0.27; p for non-inferiority = 0.006)(8). Aufgrund des kombinierten primären Endpunkts und der kleinen Patientenzahl ist die Studie allerdings nicht abschliessend konklusiv. Wir müssen daher noch die primären Ergebnisse von weiteren, gross angelegten, randomisierten Studien abwarten (Champion-AF [ClinicalTrials.gov-NCT04394546] und Catalyst [ClinicalTrials.gov-NCT04226547]), um abschliessend beurteilen zu können, ob der LAAC der NOAK Therapie ebenbürtig ist.
LAAC Indikation
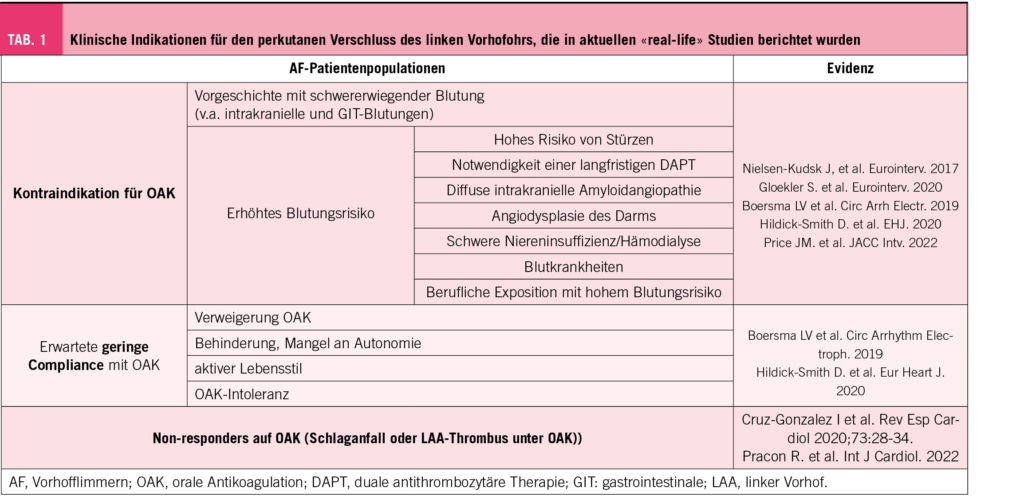
Die aktuellen Leitlinien der Europäischen (10) und der Amerikanischen (11) Gesellschaft für Kardiologie ziehen den LAAC in Betracht, falls eine langfristige OAK nicht in Frage kommt (Indikationslevel IIb, Evidenzgrad: B). Patienten mit schweren Blutungen in der Vorgeschichte oder hohem Blutungsrisiko gehören zu dieser Gruppe (Tab. 1) (12). Darüber hinaus kann ein LAAC auch in anderen klinischen Szenarien in Betracht gezogen werden, die mit einem «Versagen» der OAK-Strategie einhergehen, wie z. B. einer OAK-Unverträglichkeit/Allergie, einer fehlenden Compliance, einem embolischen Schlaganfall trotz OAK («breakthrough stroke») oder einem Thrombus im linken Vorhofohr trotz OAK. Eine Substudie des Amplatzer Cardiac Plug Registry mit 115 Patienten, die aufgrund eines Schlaganfalls unter OAK mit LAAC behandelt wurden, ergab nach einer mittleren klinischen Nachbeobachtungszeit von 16,2 Monaten eine jährliche Schlaganfall-/Transitorische Ischämische Attacke Inzidenz von 2,6 %, was einer 65 % Risikoreduktion im Vergleich zu dem durch den CHA2DS2VASC-Score vorhergesagten Risiko entspricht (13).
Ein interventioneller Verschluss des linken Vorhofohrs ist auch bei Vorliegen eines Thrombus im linken Vorhofohr möglich. Dies wurde in einer kürzlich von uns mitorganisierten, multizentrischen, retrospektiven Studie bei 53 Patienten mit LAAC und Thrombus im linken Vorhofohr gezeigt (14). Mögliche Szenarien für dieses Vorgehen sind Patienten mit LAA Thrombus und Schlaganfall trotz OAK oder Patienten, die wegen Tachykardiomyopathie dringlich elektrokonvertiert werden sollten. Technisch war der Eingriff bei allen Patienten erfolgreich, und nur in einem Fall wurde innerhalb von 30 Tagen nach dem LAAC ein ischämischer Schlaganfall beobachtet, der allerdings nicht peri-prozedural auftrat (14). Zusammenfassend lässt sich sagen, dass der perkutane LAAC für Hochrisikopatienten mit Vorhofflimmern eine geeignete therapeutische Alternative darstellt.
Allerdings sollten die Patienten eine angemessene Lebenserwartung (mindestens >2-3 Jahre) und Lebensqualität haben, um von einem LAAC zu profitieren (1).
In den letzten Jahren haben mehrere Studien den klinischen Nutzen des Einsatzes bildgebender Verfahren zur Planung und/oder Steuerung der LAAC gezeigt. In einer grossen Studie am Inselspital zeigte sich bei insgesamt 811 Eingriffen, dass die Verwendung der intraprozeduralen Echokardiographie zur Steuerung des Eingriffs zusätzlich zum Angiographie-gesteuerten Vorgehen mit einem geringeren Risiko für Eingriffskomplikationen verbunden war als ein rein Angiographie-gesteuertes Vorgehen ([OR]: 0.31; 95% CI: 0.11-0.90; p = 0.030) (4). Auch konnten wir in einer kürzlich durchgeführten Subanalyse der SWISS-APERO RCT Studie zeigen, dass die Verfügbarkeit einer prä-interventionellen CT vor dem Eingriff mit einer höheren Rate an kurzfristigem Behandlungserfolg verbunden war (adjOR: 2.76; 95% CI: 1.05-7.29; p=0.040) und auch den langfristigen Erfolg erhöhte (adjOR:2.12; 95%CI: 1.03-4.35; p=0.041)(3).
LAAC Devices
Die beiden weltweit am häufigsten verwendeten Devices für den perkutanen LAAC sind Watchman Flx (Boston Scientific) und Amulet (Abbott). Die kürzlich durchgeführte Amulet-IDE-Studie, eine multizentrische, randomisierte Studie zum Vergleich von Watchman 2.5 und Amulet bei 1.878 Patienten mit klinisch indiziertem LAAC ergab, dass das Amulet Device dem Watchman Device nicht unterlegen war bezüglich des primären Sicherheitsendpunkts (14,5 % vs. 14,7 %; p<0,001 für non-inferiority) und für den primären Endpunkt (Ischämischer Schlaganfall oder systemische Embolie nach 18 Monaten: 2,8 % vs. 2,8 %; p<0,001 für non-inferiority) (15). Die Vollständigkeit des LAA-Verschlusses nach 45 Tagen war mit dem Amulet Device höher als mit dem Watchman Device (98,9 % vs. 96,8%; p<0,001 für non-inferiority; p=0,003 für superiority), aber verfahrensbedingte Komplikationen waren mit dem Amulet Device häufiger als mit dem Watchman 2.5 Device (4,5 % vs. 2,5 %). Insbesondere traten Perikardergüsse häufiger auf mit dem Amulet Device und ein diesbezüglicher Risikofaktor war eine fortgeführte OAK Therapie (15). Derzeit sind weitere Devices für den perkutanen LAAC in Europa zugelassen und auf dem Markt, wie WaveCrest (Biosense Webster), Ultraseal LAA Occluder (Cardia) oder LAmbre (Lifetech). Die verfügbaren Daten über diese Implantate sind jedoch sehr begrenzt.
LAAC Komplikationen
Verfahrensbedingte Komplikationen stellen eine der grössten Einschränkungen des LAAC dar. Aufgrund des präventiven Charakters des Eingriffes sollte eine Nulltoleranz für Komplikationen bestehen. Basierend auf der grössten Registerstudie zu LAAC, die 38’158 Eingriffe umfasste, welche zwischen 2016 und 2018 in den USA mit Watchman 2.5 durchgeführt wurden, traten bei 2,2 % der Patienten schwerwiegende, unerwünschte Ereignisse im Krankenhaus auf. Die häufigsten Komplikationen waren ein Perikarderguss, welcher eine Intervention erforderte (1,4 %), und schwere Blutungen (1,3 %), während Schlaganfall (0,2 %) und Tod (0,2 %) äussert selten waren (16). Ähnliche kurzfristige klinische Ergebnisse wurden in prospektiven Studien nach Implantation eines Amulet Devices (Raten im Krankenhaus: Tod 0,2 %, Schlaganfall 0,2 %, schwere Blutungen 2,4 %) (17) und Watchman FLX Devices (45-Tage Follow-up: Tod 0,5 %, Schlaganfall 0,7 %, schwere Blutungen 3,0 %) beobachtet (2).
Die beiden wichtigsten LAAC spezifischen Komplikationen in Zusammenhang mit dem Implantat sind ein Thrombus auf dem LAA-Okkluder und ein Leck am Rand des LAA-Okkluders. Ein LAA-Device Thrombus ist mit einem höheren Risiko für einen ischämischen Hirnschlag verbunden (18). Das Management eines Thrombus auf einem LAA-Okkluder ist schwierig und die Vorgehensweise heterogen. Sedaghat et al. zeigten im multinationalen EUROC-DRT-Register, welches 156 Patienten mit einem Thrombus auf einem LAA-Okkluder umfasste, dass die Mehrheit der Pa-tienten mit OAK behandelt wurden (32.1 % mit DOAK und 22.3 % mit VKA), gefolgt von Heparin (31.3 %), und Thrombozytenaggregationshemmern (6.3 %) (19). Eine vollständige Auflösung des Thrombus wurde in fast 80 % der Fälle etwa 3 Monate nach dessen Erkennung erreicht, wobei die Auflösungsraten zwischen den verschiedenen anfänglichen Behandlungsschemata vergleichbar waren.
Anders als bei einem LAA-Okkluder-Thrombus sind die Erkenntnisse über die klinische Relevanz eines Lecks am Rand des LAA-Okkluders noch umstritten und bedürfen weiterer Studien.
Ein Thrombus und auch ein Leck können sowohl mit der transösophagealen Echokardiographie (TEE) als auch mit einer CT nachgewiesen und beurteilt werden. Das CT hat eine höhere Sensitivität als die TEE für den Nachweis eines Thrombus wie auch eines Lecks (6, 20). Aufgrund der vorliegenden Evidenz scheint eine serielle bildgebende Nachuntersuchung, die aus einer doppelten Kontrolle sowohl kurz- (45 Tage bis 3 Monate) als auch langfristig (12 Monate) nach LAAC besteht, angemessen. Simard et al. beobachteten, dass sich ein Drittel der LAA-Okkluder-Thrombi erst später als 6 Monate nach der LAAC entwickelten. Umgekehrt bestand ein signifikanter Prozentsatz der nach 45 Tagen entdeckten Lecks auch nach 1 Jahr noch weiter (18, 21).
Antithrombotische Therapie nach LAAC
Die US-amerikanische Food and Drug Administration (FDA) empfiehlt eine OAK plus Aspirin für 45 Tage, gefolgt von einer 4,5-monatigen dualen Thrombozytenaggregationshemmer-Therapie (DAPT) und dann Aspirin allein nach der Implantation eines Watchman-Okkluders; nach der Amulet-Implantation sollte eine DAPT oder OAK plus Aspirin für 45 Tage folgen, gefolgt von einer DAPT für 4,5 Monate und dann Aspirin allein. Die Mehrheit der Patienten, die mit LAAC behandelt werden (vorab in Europa), kommt aufgrund des hohen Blutungsrisikos selbst für eine kurzfristige OAK oder eine 6-monatige DAPT eher nicht in Frage. Andererseits ist es denkbar, dass eine vorzeitige Umstellung von DAPT auf SAPT oder eine direkte Entlassung unter SAPT das Risiko einer Thrombusbildung auf dem LAA-Okkluder im Verlauf erhöhen könnte. Die bislang begrenzte Evidenz stützt diese Bedenken jedoch nicht. Patti et al. zeigten in einer retrospektiven, multizentrischen Beobachtungsstudie mit 610 konsekutiven LAACs, dass die SAPT unabhängig mit einer Verringerung schwerer Blutungen verbunden war (adj. HR 0,37; 95%CI: 0,16-0,88; p = 0,024), ohne dass es zu einem signifikanten Anstieg von Thromben kam (7.8 % vs 7.4 %; adj HR 1.34; 95%CI: 0.70-2.55; p = 0.38)(22). Zusammengefasst lässt sich sagen, dass bei Patienten mit erhöhtem Blutungsrisiko eine kurzfristige DAPT von 1 Monat und bei Patienten mit sehr stark erhöhtem Blutungsrisiko die SAPT ein sinnvolles antithrombotisches Therapieregime nach LAAC darstellt.
Dr. med. Roberto Galea
PD Dr. med. Dr. phil. Georgios Siontis
Prof. Dr. med. Laurent Roten
Prof. Dr. med. Dr. phil. Lorenz Räber
Leiter Herzkatheterlabor
Universitätsklinik für Kardiologie
Universität Bern
3010 Bern
Copyright bei Aerzteverlag medinfo AG
Universitätsklinik für Kardiologie
Universität Bern
3010 Bern
Universitätsklinik für Kardiologie
Universität Bern
3010 Bern
Leiter Herzkatheterlabor
Universitätsklinik für Kardiologie
Inselspital
Freiburgstrasse 18
3010 Bern
lorenz.raeber@insel.ch
Lorenz Räber berichtet über Forschungszuschüsse für seine Institution von Abbott-Vascular, Boston-Scientific, Biotronik, Infraredx, Heartflow, Sanofi, Regeneron. Er berichtet über Honorare für Vorträge/Beratungen von Abbott-Vascular, Amgen, Canon, Medtronic, Novo Nordisk, Occlutech, Sanofi. Laurent Roten hat Honorare für Vorträge/Beratungen von Medtronic und Abbott erhalten sowie Forschungszuschüsse für seine Institution von Medtronic. Alle anderen Autoren haben mitgeteilt, dass sie keine für den Inhalt dieses Artikels relevanten Beziehungen offenlegen müssen.
◆ Der LAA-Verschluss hat sich bei Patienten mit absoluten oder relativen Kontraindikationen für eine Antikoagulation als Alternative zur Antikoagulation bei Patienten mit Vorhofflimmern etabliert.
◆ Der LAA-Verschluss ist dank verbesserter intraprozeduraler Bildgebung und Prozesse sowie dank neuen LAA-Okkludern eine sichere und effiziente Intervention.
◆ In Kürze werden konklusive Daten verfügbar sein, welche aufzeigen, ob der LAA-Verschluss einer NOAK Therapie ebenbürtig ist.
◆ Es bestehen weiterhin mehrere Evidenzlücken, insbesondere in Bezug auf die optimale, antithrombotische Therapie nach LAA-Verschluss und dem Management von Thromben auf dem LAA-Okkluder und Restlecks am Rande des LAA-Okkluders.
1. Saw J, Holmes DR, Cavalcante JL et al. SCAI/HRS Expert Consensus Statement on Transcatheter Left Atrial Appendage Closure. JACC Cardiovascular interventions 2023.
2. Kar S, Doshi SK, Sadhu A et al. Primary Outcome Evaluation of a Next-Generation Left Atrial Appendage Closure Device: Results From the PINNACLE FLX Trial. Circulation 2021;143:1754-1762.
3. Galea R AA, Meneveau N, De Marco F, Heg D, Anselme F, Gräni C, Huber T, Teiger E, Iriart X, Franzone A, Vranckx P, Fischer U, Pedrazzini G, Bedogni F, Valgimigli M and Räber L. Impact of preprocedural computed tomography on left atrial appendage closure success: a Swiss-Apero trial sub-analysis. JACC Cardiovascular interventions 2023;In press.
4. Galea R RL, Fuerholz M, Häner J, Siontis J, Brugger N, Moschovitis A, Heg D, Fischer U, Meier B, Windecker S, Valgimigli M. Impact of echocardiographic guidance on safety and efficacy of left atrial appendage closure: an observational study. JACC Cardiovascular interventions 2021;14:1815-1826.
5. Nielsen-Kudsk JE, Berti S, Caprioglio F et al. Intracardiac Echocardiography to Guide Watchman FLX Implantation: The ICE LAA Study. JACC Cardiovascular interventions 2023;16:643-651.
6. Galea R, De Marco F, Meneveau N et al. Amulet or Watchman Device for Percutaneous Left Atrial Appendage Closure: Primary Results of the SWISS-APERO Randomized Clinical Trial. Circulation 2021.
7. Lakkireddy D, Thaler D, Ellis CR et al. Amplatzer Amulet Left Atrial Appendage Occluder Versus Watchman Device for Stroke Prophylaxis (Amulet IDE): A Randomized, Controlled Trial. Circulation 2021;144:1543-1552.
8. Osmancik P, Herman D, Neuzil P et al. 4-Year Outcomes After Left Atrial Appendage Closure Versus Nonwarfarin Oral Anticoagulation for Atrial Fibrillation. Journal of the American College of Cardiology 2022;79:1-14.
9. Whitlock RP, Belley-Cote EP, Paparella D et al. Left Atrial Appendage Occlusion during Cardiac Surgery to Prevent Stroke. N Engl J Med 2021;384:2081-2091.
10. Hindricks G, Potpara T, Dagres N et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. European heart journal 2021;42:373-498.
11. January CT, Wann LS, Calkins H et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation 2019;140:e125-e151.
12. Tzikas A, Holmes DR, Jr., Gafoor S et al. Percutaneous left atrial appendage occlusion: the Munich consensus document on definitions, endpoints, and data collection requirements for clinical studies. Europace : European pacing, arrhythmias, and cardiac electrophysiology : journal of the working groups on cardiac pacing, arrhythmias, and cardiac cellular electrophysiology of the European Society of Cardiology 2017;19:4-15.
13. Cruz-Gonzalez I, Gonzalez-Ferreiro R, Freixa X et al. Left atrial appendage occlusion for stroke despite oral anticoagulation (resistant stroke). Results from the Amplatzer Cardiac Plug registry. Rev Esp Cardiol (Engl Ed) 2020;73:28-34.
14. Sebag FA, Garot P, Galea R et al. Left atrial appendage closure for thrombus trapping: the international, multicentre TRAPEUR registry. EuroIntervention : journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2021.
15. Lakkireddy D, Thaler D, Ellis CR et al. Amplatzer Amulet Left Atrial Appendage Occluder Versus Watchman Device for Stroke Prophylaxis (Amulet Ide): A Randomized Controlled Trial. Circulation 2021.
16. Freeman JV, Varosy P, Price MJ et al. The NCDR Left Atrial Appendage Occlusion Registry. Journal of the American College of Cardiology 2020;75:1503-1518.
17. Landmesser U, Schmidt B, Nielsen-Kudsk JE et al. Left atrial appendage occlusion with the AMPLATZER Amulet device: periprocedural and early clinical/echocardiographic data from a global prospective observational study. EuroIntervention : journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2017;13:867-876.
18. Simard T, Jung RG, Lehenbauer K et al. Predictors of Device-Related Thrombus Following Percutaneous Left Atrial Appendage Occlusion. Journal of the American College of Cardiology 2021;78:297-313.
19. Sedaghat A, Vij V, Al-Kassou B et al. Device-Related Thrombus After Left Atrial Appendage Closure: Data on Thrombus Characteristics, Treatment Strategies, and Clinical Outcomes From the EUROC-DRT-Registry. Circulation Cardiovascular interventions 2021;14:e010195.
20. Kramer AD, Korsholm K, Jensen JM et al. Cardiac computed tomography following Watchman FLX implantation: device-related thrombus or device healing? European heart journal cardiovascular Imaging 2022.
21. Viles-Gonzalez JF, Kar S, Douglas P et al. The clinical impact of incomplete left atrial appendage closure with the Watchman Device in patients with atrial fibrillation: a PROTECT AF (Percutaneous Closure of the Left Atrial Appendage Versus Warfarin Therapy for Prevention of Stroke in Patients With Atrial Fibrillation) substudy. Journal of the American College of Cardiology 2012;59:923-9.
22. Patti G, Sticchi A, Verolino G et al. Safety and Efficacy of Single Versus Dual Antiplatelet Therapy After Left Atrial Appendage Occlusion. The American journal of cardiology 2020;134:83-90.
info@herz+gefäss
- Vol. 13
- Ausgabe 4
- September 2023