- Virale respiratorische Infektionen
Respiratorische Viren sind die häufigsten Erreger von Atemwegsinfektionen. Obwohl die Infektionen meist unkompliziert und selbstlimitiert verlaufen, führen sie doch zu einer erheblichen vorübergehenden gesundheitlichen Beeinträchtigung und können von Komplikationen wie einer Asthma- oder COPD-Exazerbation oder von einer bakteriellen Superinfektion begleitet sein. Dies gilt besonders bei kleinen Kindern, Betagten und bei Personen mit Grunderkrankungen oder Immunsuppression. Eine Erregerdiagnostik ist nur bei gefährdeten Personen sinnvoll. Eine antivirale Therapie und eine Prophylaxe mittels Impfung ist jedoch einzig gegen Grippeviren und gegen SARS-CoV-2 verfügbar.
Viruses are the most common cause of respiratory infections. Although the infection mostly proceeds uncomplicated and self-limited, they do lead to significant temporary health impairment and can be accompanied by complications such as asthma or COPD exacerbations or by bacterial superinfection. This is particularly the case in young children, the elderly and in people with underlying diseases or immunosuppression. Diagnosis of the viral etiology is only sensible for persons at risk. However, an antiviral therapy and a prophylaxis by means of vaccination are solely available against influenza viruses and SARS-CoV-2.
Key Words: Atemwegsinfektion, Tröpfchenübertragung, respiratorische Schutzmassnahmen, Antigen-Schnelltest, Prophylaxe.
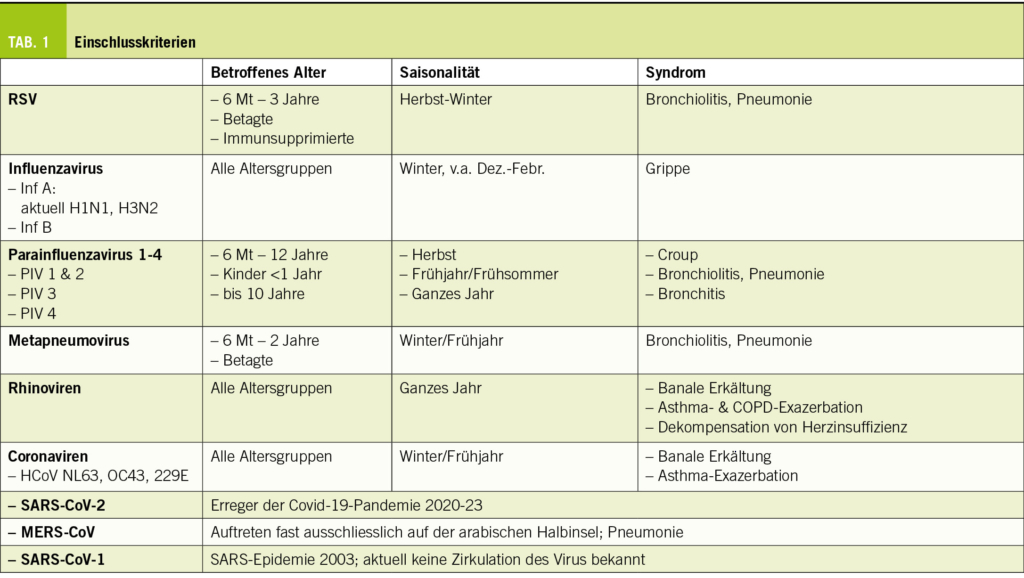
Viren verursachen >80% der Atemwegsinfektionen und sie können sowohl die oberen, wie auch die unteren Atemwege befallen. Infektionen treten grundsätzlich bei Personen in allen Altersgruppen auf. Bei immunkompetenten Kindern und Erwachsenen sind virale respiratorische Infektionen in der Regel mild und auf die oberen Atemwege beschränkt. Ein schwerer Krankheitsverlauf ist häufiger bei Kleinkindern, Betagten, Personen mit Begleiterkrankungen und bei Immunkompromittierten. Symptome variieren mit dem Alter, allenfalls vorhandenen Begleiterkrankungen, Impfstatus und dem aktuell zirkulierenden Virusstamm. Als Symptome können laufende oder verstopfte Nase, Halsweh, Husten, Niessen oder Kopfschmerzen auftreten. Die Erkrankung dauert in der Regel 5 bis 10 Tage, doch kann es 2-3 Wochen oder länger bis zur vollständigen Erholung dauern. Da die verschiedenen Viren sich in unterschiedlichen anatomischen Bereichen der Atemwege vermehren, können sie unterschiedliche Syndrome auslösen: Rhinitis, Pharyngitis, Laryngitis, Laryngotracheobronchitis (Croup), Bronchiolitis oder Pneumonie, bis hin zu respiratorischem Versagen (1-4). Die Abgrenzung ist jedoch unscharf, so dass keine Erregerdiagnose aufgrund des klinischen Bildes möglich ist. Wenn durch die Ausschüttung von Zytokinen Allgemeinsymptome wie Fieber, Frösteln, Gliederschmerzen, Schwäche oder Appetitlosigkeit verursacht werden, spricht man von einer influenza-ähnlichen Erkrankung. Respiratorische Viren sind auch wichtige Auslöser von Exazerbationen von Asthma und COPD und können zur Dekompensation einer Herzinsuffizienz führen (5-7). Eine weitere Komplikation sind sekundäre bakterielle Infektionen von Lunge, paranasalem Sinus oder Mittelohr.
Infektionen mit respiratorischen Viren treten in aller Regel saisonal gehäuft auf, in der nördlichen Hemisphäre von November bis April, wobei der Zeitpunkt der höchsten Prävalenz von Virus zu Virus leicht unterschiedlich ist (8, 9). Infektionen hinterlassen eine transiente, nur partiell protektive Immunität. Deshalb sind Reinfektionen häufig. Alle wichtigen respiratorischen Viren sind RNA-Viren (Tab. 1).
Das Respiratorische Syncytialvirus (RSV) infiziert bis zum Alter von 2-3 Jahre fast alle Kinder und ist in dieser Altersgruppe der wichtigste Erreger von Bronchiolitis und Pneumonie (10-12). Auch bei Personen mit einer Immunsppression kann RSV eine Pneumonie verursachen.
Die humanen Influenzaviren werden in 3 Genera unterteilt (13):
Influenzaviren A (INA) können viele verschiedene Tiere und den Menschen infizieren. Sie werden nach den Subtypen der Oberflächenproteine Hämagglutinin (HA) und Neuraminidase (NA) eingeteilt. Bei den menschlichen INA kommen 3 HA-Subtypen (H1, H2, H3) und 2 NA-Subtypen (N1, N2) vor. INA sind häufigen genetischen Mutationen unterworfen (antigenic drift), was zu jährlichen epidemischen Ausbrüchen führt. Diese treten meist zwischen Dezember und Februar auf und führen zu einer erheblichen Morbidität und Mortalität in der Gesellschaft. Grössere genetische Veränderungen (antigenic shift) können zu grossen, weltweiten Pandemien führen.
Influenzaviren B infizieren v.a. Menschen und sind genetisch weniger divers. Der antigenic drift ist weniger ausgeprägt und es gibt keinen antigenic shift (und somit auch keine Pandemien).
Influenzaviren C sind weniger häufig und meist mit dem Krankheitsbild einer banalen Erkältung assoziiert.
Die 4 Serotypen von Parainfluenza (PIV 1-4) und das Metapneumovirus sind bei Kindern zwischen 6 Monaten und 12 Jahren die Verursacher von Bronchiolitis und Pneumonie (v.a. PIV3 bei Kleinkindern) (1,14). PIV 1 ist der Erreger des Croup (Laryngotracheobronchitis).
Rhinoviren und Coronaviren sind vor allem die Erreger der banalen Erkältung. Infektionen mit Rhinoviren können zudem Exazerbationen von Asthma und COPD, oder die Dekompensation einer latenten Herzinsuffizienz auslösen. Drei besondere Coronaviren haben in den letzten Jahren als Verursacher schwerer Pneumonien eine besondere Rolle gespielt. Das severe acute respiratory syndrome corona virus (SARS-CoV-1) war der Verursacher des SARS-Ausbruchs von 2003. Das Virus hat sein Reservoir in Tieren und führte zu mehr als 8000 erkrankten Personen mit rund 800 Todesfällen. Seit 2004 sind keine weiteren Fälle mit SARS-CoV-1 aufgetreten. Das middle east respiratory syndrome corona virus (MERS-CoV) tritt fast ausschliesslich auf der Arabischen Halbinsel auf. Reservoir des Virus sind wahrscheinlich Kamele. Im Dezember 2019 ist ausgehend von Tieren und wiederum in Südost-China das SARS-CoV-2 aufgetreten, das die Covid-19-Pandemie 2020 bis 2023 ausgelöst hatte.
Transmission
Respiratorische Viren werden v.a. durch Tröpfchen/Aerosole leicht von Person zu Person übertragen (15). Tröpfchen weisen einen Durchmesser von >5 μm auf und fliegen bis zu 2 m weit. Die Erfahrung aus der Covid-Pandemie haben dieses Konzept in Frage gestellt (16-17).
Bei allen Aktivitäten der Atemwege (Atmen, Sprechen, Husten, Niesen, Singen etc.) werden grosse und kleine Tröpfchen gebildet, die alle Viren transportieren können. Die Partikeldichte ist am höchsten nahe der Quelle und Aerosole werden in einem Raum angereichert, wenn die Lüftung nicht ausreichend ist. Die Inkubationszeit nach einer Exposition beträgt 1-4 Tage. Die Virusausscheidung durch infizierte Personen setzt bereits 24 bis 48 Std. vor Auftreten von respiratorischen Symptomen ein. Die Inokulation erfolgt über den oberen Respirationstrakt, primär die Nase oder die Augen und die Viren vermehren sich im Epithel der grossen oder kleinen Atemwege, ohne eine systemische Infektion hervorzurufen. Je nach Virus führt dies zu einer Entzündung mit erhöhter mukosaler Sekretion, Leukozyten-Infiltration. Das Ziliarepithel der Atemwege kann zerstört werden, wodurch der Reinigungsmechanismus des Epithels und die Funktion der Phagozyten gestört wird. Dies erhöht die Empfänglichkeit für bakterielle Superinfektionen. Erst wenn von aktivierten Lymphozyten Zytokine freigesetzt werden, treten systemische Krankheitszeichen auf (18).
Diagnostik
Die Infektionen sind meist selbstlimitiert und eine konkrete Erregerdiagnose deshalb in der Regel nicht notwendig. Aus epidemiologischen Gründen kann dies dennoch wünschenswert sein. Bei Patienten mit einem schweren Krankheitsverlauf und bei Patienten mit einem hohen Risiko für Komplikationen, ist sie sogar notwendig, um die Möglichkeit einer antiviralen Therapie beurteilen zu können.
In diesen Fällen sollte die Probenentnahme so früh als möglich nach Beginn der Symptome erfolgen, da die Menge des Virus im Sekret im Verlauf rasch abnimmt. Generell haben Kinder eine höhere Viruslast und scheiden das Virus länger aus als Erwachsene. Bei Immunschwäche ist die Dauer der Virusausscheidung verlängert. Nasopharyngeale Aspirate sind besonders bei kleinen Kindern, die reichlich muköses Sekret produzieren, hilfreich (19-21). Bei älteren Kindern und bei Erwachsenen, die weniger Sekret produzieren, sind nasopharyngeale oder nasale Abstriche besser geeignet. Die kombinierte Entnahme eines Abstriches von Nasopharynx und Rachen ergibt oft eine höhere Ausbeute.
Die Probenentnahme sollte von einer ausgebildeten und erfahrenen Person vorgenommen werden, die eine Mund-Nasen-Maske und einen Augenschutz trägt.
Zurzeit stehen zwei Testverfahren für den Nachweis von respiratorischen Viren im Vordergrund: Festphasen-Immunoassays und Nukleinsäure-Amplifikations-Verfahren, insbesondere die reverse-transcriptase polymerase chain reaction (RT-PCR).
Festphasen-Immunoassays
Sogenannte Antigen-Schnelltests basieren auf der Technik der Immunchromatographie. Ihr Vorteil ist die einfache Anwendung und der Umstand, dass das Resultat sofort verfügbar ist. Es ist wichtig zu beachten, dass die Tests auf jeweils genau definiertes Probenmaterial (Nasen- bzw. Nasopharyngeal-Abstrich bzw. Nasopharyngeal-Aspirat) abgestimmt wurden und entsprechend verwendet werden sollten. Antigen-Schnelltests stehen nur für ausgewählte virale Erreger zur Verfügung: Influenza A und B, RSV, SARS-CoV-2. Ein wesentlicher Nachteil der Schnelltests ist deren begrenzte Sensitivität, die im Bereich von ca. 70% liegt (22-24). Bei tiefer Virusprävalenz ist zudem der Anteil falsch positiver Resultate erhöht. Schnelltests sollten deshalb nur in der epidemischen Phase angewandt werden.
Reverse-transcriptase polymerase chain reaction (RT-PCR)
Molekularbiologische Verfahren haben sich in den letzten Jahren als sehr sensitiv und spezifisch für den Nachweis und die Identifikation von respiratorischen Viren erwiesen und sie gelten als Referenzmethode. Die real-time RT-PCR ist heute die meist verwendete Methode und kann für den Nachweis eines breiten Spektrums von Erregern verwendet werden (25-26).
Es ist auch möglich, innerhalb von sehr kurzer Zeit Tests für neue Erreger zu entwickeln. Dies konnte in der Covid-19-Pandemie ausgenutzt werden. Die Methode erlaubt es auch, die Menge der nachgewiesenen Viren zu bestimmen. Die RT-PCR ist jedoch nur in spezialisierten Labors verfügbar und das Resultat steht somit nicht unmittelbar zur Verfügung.
Behandlung und Impfung
Die Behandlung von viralen Atemwegsinfektionen ist primär symptomatisch: Symptomminderung, Flüssigkeitsersatz und Sauerstoff. Eine antivirale Therapie ist nur gegen Influenza A und B sowie gegen SARS-CoV-2 verfügbar und kommt vor allem bei Personen mit einem Risiko für einen schweren Verlauf zum Einsatz. Im Falle von SARS-CoV-2 erleiden nach Impfungen und durchgemachten Infektionen fast nur noch immunsupprimierte Personen Komplikationen. Zur Prävention stehen Impfungen nur gegen die erwähnten Viren zur Verfügung. Die jährliche Influenza-Impfung ist für alle Risikopersonen gemäss den Richtlinien des BAG empfohlen. Das BAG/die EKIF hat kürzlich auch die Covid-Impfempfehlungen des Herbst 2023 veröffentlicht: Eine Boosterimpfung ist besonders gefährdeten Personen (BGP) und solchen über 65 Jahren empfohlen (sofern die letzte Impfung bzw. Infektion mehr als 6 Monate zurückliegt), nicht jedoch der übrigen Bevölkerung. Während der Covid-19-Pandemie konnte immungeschwächten Personen, vor allem solchen mit einer B-Zell-Depletion, eine passive Immunisierung mit Antikörpern angeboten werden. Wegen dem raschen Auftreten von immer neuen Virusvarianten neutralisieren die aktuell zur Verfügung stehenden Antikörperpräparate die aktuell zirkulierenden Viren nur sehr unzuverlässig und können deshalb nicht empfohlen werden. Als Prophylaxe einer schweren RSV-Pneumonie kann Kleinkindern mit einem relevanten Risiko (Frühgeborene vor der 35 Schwangerschaftswoche, Kinder mit einer bronchopulmonalen Dysplasie und solche mit einem hämodynamisch signifikanten angeborenen Herzvitium) Palivizumab angeboten werden. Die europäische Zulassungsbehörde EMA hat am 6. Juni 2023 einen RSV-Impfstoff für Erwachsene ab 60 Jahren zugelassen: Ein Impfstoff für Säuglinge wird bald folgen. Swissmedic hat jedoch noch keine Zulassung erteilt. Eine weitere Diskussion von Therapie und Impfung im Zusammenhang von Influenza und Covid-19 kann in dieser kurzen Übersicht nicht erfolgen.
Copyright bei Aerzteverlag medinfo AG
Chefarzt Infektiologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Virale Atemwegsinfektionen verlaufen meist selbstlimitierend.
◆ Bei sehr jungen und bei betagten Patienten kann eine Infektion Asthma auslösen oder zu einer Exazerbation einer kardiopulmonalen Erkrankung führen.
◆ Immunkompromittierte Personen eliminieren das Virus schlechter und können zu langanhaltenden Virusausscheidern werden.
◆ Eine Diagnostik zum Virusnachweis ist nur bei gefährdeten Personen und besonders bezüglich Influenza und SARS-CoV-2 sinnvoll. Bei Kleinkindern vor allem aber auch bezüglich RSV.
1. Papenburg J, Boivin G. The distinguishing features of human metapneumovirus and respiratory syncytial virus. Rev Med Virol . 2010;20(4):245–260.
2. Call SAVollenweider MA, Hornung CA, Simel DL, McKinney WP. Does this patient have influenza? JAMA 2005;293(8):987–997.
3. Heinonen S, Peltola V, Silvennoinen H, Vahlberg T, Heikkinen T. Signs and symptoms predicting influenza in children: a matched case-control analysis of prospectively collected clinical data. Eur J Clin Microbiol Infect Dis 2012;31(7):1569–1574.
4. Shorr AF, Fisher K, Micek ST, Kollef MH. The burden of viruses in pneumonia associated with acute respiratory failure. Chest 2018;154(1): 84-90.
5. Busse WW, Lemanske RF Jr, Gern JE. Role of viral respiratory infections in asthma and asthma exacerbations. Lancet 2010;376(9743):826–834.
6. Matsumoto K, Inoue H. Viral infections in asthma and COPD. Respir Investig 2014;52(2):92–100.
7. Zwaans WA, Mallia P, van Winden ME, Rohde GG. 2014. The relevance of respiratory viral infections in the exacerbations of chronic obstructive pulmonary disease-a systematic review. J Clin Virol 2014;61(2):181– 188.
8. Monto AS. Occurrence of respiratory virus: time, place and person. Pediatr Infect Dis 2004;23(1Suppl):S58–S64.
9. Monto AS. 2002. Epidemiology of viral respiratory infections. Am J Med 2002;112(Suppl 6A):4S–12S.
10. Hall CB. Respiratory syncytial virus and parainfluenza virus. N Engl J Med 2001;344(25):1917-28.
11. Pickles R, De Vincenzo JP. Respiratory syncytial virus (RSV) and its propensity for causing bronchiolitis. J Pathol 2015;235(2):266–276.
12. Murata Y, Falsey AR. Respiratory syncytial virus infection in adults. Antiviral Ther 2007;12(4):659–670
13. Nicholson KG, Wood JM, Zambon M. Influenza. Lancet 2003;362(9397):1733–1745.
14. Schildgen V, van den Hoogen B, Fouchier R, Tripp RA, Alvarez R, Manoha C, Williams J, Schildgen O. 2011. Human metapneumovirus: lessons learned over the first decade. Clin Microbiol Rev 24(4):734–754.
15. Hall CB. 2007. The spread of influenza and other respiratory viruses: complexities and conjectures. Clin Infect Dis 2007;45(3):353–359.
16. Pan M, Lednicky JA and Wu CY. Collection, particle sizing and detection of airborne viruses. J. Appl. Microbiology 2019;127(6): 1596-1611
17. Wang CC, Prather KA, Sznitman J, Jimenez JL, Lakdawala SS, Tufecki Z, Marr LC. Airborne transmission of respiratory viruses. Science 2001;373(6558): 981
18. Tisoncik JR, Korth MJ, Simmons CP, Farrar J, Martin TR, Katze MG. Into the eye of the cytokine storm. Microbiol Mol Biol Rev 2012;76(1):16– 32.
19. Macfarlane P, Denham J, Assous J, Hughes C. RSV testing in bronchiolitis: which nasal sampling method is best? Arch Dis Child 2005;90(6):634–635.
20. Lambert SB, Whiley DM, O’Neill NT, Andrews EC, Canavan FM, Bletchly C, Siebert DJ, Sloots TP, Nissen MD. Comparing nosethroat swabs and nasopharyngeal aspirates collected from children with symptoms for respiratory virus identification using real-time polymerase chain reaction. Pediatrics 2008;122:e615–e620.
21. de laTabla VO, Masiá M, Antequera P, Martin C, Gazquez G, Buñuel F, Gutiérrez F. 2010. Comparison of combined nose-throat swabs with nasopharyngeal aspirates for detection of pandemic influenza A/H1N1 2009 virus by real-time reverse transcriptase PCR. J Clin Microbiol 2010;48(10):3492–3495.
22. Chartrand C, Tremblay N, Renaud C, Papenburg J. 2015. Diagnostic accuracy of rapid antigen detection tests for respiratory syncytial virus infection: systematic review and meta-analysis. J Clin Microbiol 2015;53(12):3738–3749.
23. Grijalva CG, Poehling KA, Edwards KM, Weinberg GA, Staat MA, Iwane MK, Schaffner W, Griffin MR. 2007. Accuracy and interpretation of rapid influenza tests in children. Pediatrics 119:e6–e11.
24. Chartrand C, Leeflang MM, Minion J, Brewer T, Pai M. Accuracy of rapid influenza diagnostic tests: a meta-analysis. Ann Intern Med 2012;156(7):500–511
25. Mackay IM, Arden KE, Nitsche A. Real-time PCR in virology. Nucleic Acids Res 2002;30(6):1292–1305.
26. Espy MJ, Uhl JR, Sloan LM, Buckwalter SP, Jones MF, Vetter EA, Yao JD, Wengenack NL, Rosenblatt JE, Cockerill FR III, Smith TF. Real-time PCR in clinical microbiology: applications for routine laboratory testing. Clin Microbiol Rev 2006;19(1):165–256.
der informierte @rzt
- Vol. 13
- Ausgabe 10
- Oktober 2023