- Langzeitnebenwirkungen der Immuncheckpoint-Inhibitoren
Der Einsatz von Immuncheckpoint-Inhibitoren (ICI) hat die Behandlung solider Tumore in den letzten Jahren grundlegend verändert. Gerade in fortgeschrittenen Tumor-Stadien oder bei Tumoren mit historisch schlechter Prognose, wie dem Triple-negativen Mammakarzinom, konnte das progressionsfreie Überleben sowie das Gesamtüberleben der betroffenen Patientinnen und Patienten verbessert werden. Vor dem Hintergrund der deutlich verbesserten Prognose, gewinnt das Management von Nebenwirkungen und Langzeitfolgen der verbesserten Therapie an Bedeutung, deren Erkennung und Behandlung Gegenstand dieses Artikels sein soll.
Einführung
Das Immunsystem
Eine wichtige Aufgabe unseres Immunsystems ist das Erkennen und Bekämpfen maligner Zellen, wobei die Unterscheidung zwischen gesunden Körperzellen und Tumorzellen aufgrund der Erkennung von tumorspezifischen Antigenen durch die Immunzellen gewährleistet ist. Nach Präsentation des Antigens durch antigenpräsentierende Zellen, werden sogenannte naive T-Zellen aktiviert und bilden sich zu antigen-spezifischen CD4+ T-Helfer-Zellen (TH) und CD8+ zytotoxischen-T-Zellen (CTL) aus. Diese dringen in die Tumorumgebung ein, erkennen Antigene mittels T-Zell-Rezeptor (TCR), greifen die Tumorzellen durch toxische Moleküle an, und initiieren die Apoptose der Tumorzelle. Als Antigene fungieren zum einen tumorspezifische Antigene, wie beispielsweise das Melanom-Antigen A1 (MAGE – 1) bei Melanomen und Keimzelltumoren, aber auch das Carcinoembryonale Antigen (CEA), Prostata-spezifische Antigen (PSA) und der Human epidermal growth factor receptor 2 (HER2/neu). Daneben exprimieren Tumoren eine Reihe von Neo-Epitopen, welche durch die somatischen Mutationen der Tumorzelle hervorgerufen werden. Für die Aktivierung von T-Zellen ist nebst Antigenerkennung über den TCR auch eine Co-Stimulation, beispielsweise über die Bindung von CD80/86 an CD28 nötig. Tumorassoziierte Antigene, die auch von gesunden Körperzellen exprimiert werden und nicht zuletzt Virusproteine, wie bei HPV-assoziierten Tumoren, sind weitere mögliche Stimulatoren einer Immunreaktion. [1]
Tumorzellen besitzen jedoch die Fähigkeit, eine immunsuppressive Umgebung zu schaffen, in der weiteres Tumorwachstum toleriert wird, ein Prozess der Evasion genannt wird. Sie entgehen der Elimination durch das Immunsystem durch Minderung der Antigenpräsenz auf ihrer Zelloberfläche, Hemmung der Co-Stimulation, Mobilisierung von immunsuppressiven regulatorischen T-Zellen und Zytokinen und nicht zuletzt durch eine Inhibition der T-Zell-Wirkung durch Überexpression von Immuncheckpoints, wie Programmed Cell Death Protein 1 (PD-1), Cytotoxic T-lymphocyte associated protein 4 (CTLA4) und dem B- and T- lymphocyte attenuator (BTLA). [2, 3] Zwar sind die Immuncheckpoints durch ihren hemmenden Einfluss auf die T-Zell-Aktivität entscheidende Regulatoren in der Homöostase der körperlichen Immunantwort und beugen einer übermäßigen Aktivierung des Immunsystems mit dem Risiko der Autoimmunität vor, sie können aber der Tumorzell-Evasion Unterstützung leisten.
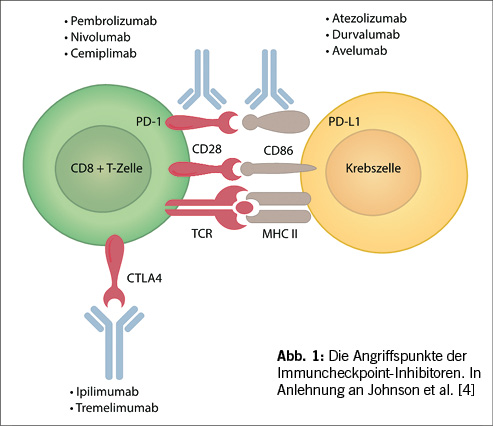
ICI stellen durch Bindung der Immuncheckpoints als monoklonale Antikörper eine therapeutische Möglichkeit dar, den hemmenden Einfluss der Immuncheckpoints auf die T-Zell-vermittelte Tumorabwehr aufzuheben und somit die Sichtbarkeit der Tumorzellen für das Immunsystem zu verbessern.
Seit vor mehr als zehn Jahren der erste Immuncheckpoint-Inhibitor Ipilimumab in der Therapie des metastasierten Melanoms zugelassen wurde, sind Immuntherapien für eine Vielzahl weiterer Tumorerkrankungen erfolgreich getestet und als Erstlinientherapeutika in die Tumortherapie integriert worden. Die Bedeutung der CTLA-4 (Ipilimumab, Tremelimumab), PD-1 (Pembrolizumab, Nivolumab, Cemiplimab, Dostarlimab, Retifanlimab) und PD-L1 (Atezolizumab, Durvalumab und Avelumab ) gerichteten Immuntherapie ist groß, da sie das progressionsfreie Überleben und das Gesamtüberleben vieler Patienten bei günstigem Nebenwirkungsprofil entscheidend positiv beeinflusst haben. Besonders hervorzuheben ist die Verbesserung bei Tumorerkrankungen mit traditionell schlechter Prognose, wie der Einsatz von Atezolizumab und Pembrolizumab in der Behandlung des Triple-negativen Mammakarzinoms zeigen konnte. Zur Etablierung neuer ICI gehört die Suche nach weiteren Angriffspunkten, wie dem Lymphocyte activation gene-3 (LAG3, CD223), T cell immunoglobulin-3 (TIM3) und Natural killer group protein 2 a (NKG2A)[2]. Relatlimab wurde kürzlich als erster anti-LAG3 Antikörper in Kombination mit Nivolumab zugelassen.
Eingeschränkt wird die Einsetzbarkeit der Immuntherapie durch Tumorprogression, das Auftreten von Rezidiven, Resistenzentwicklung und Nebenwirkungen. Letztere sind insbesondere durch den Eingriff in die feine Regulation zwischen (Gewebe-)Toleranz und Autoimmunität bedingt.
Immunvermittelte Nebenwirkungen
Neben allgemeinen Nebenwirkungen, wie Appetitlosigkeit, Fatigue und Pyrexie, handelt es sich bei typischen Checkpoint-Inhibitor-bedingten Nebenwirkungen um immunvermittelte Nebenwirkungen (immune related adverse events, irAEs), die Haut, endokrine Drüsen, den Gastrointestinaltrakt, Lunge, Augen oder das muskuloskelettale System und selten das zentrale Nervensystem betreffen.
Obwohl die zugrundeliegenden Mechanismen der irAEs nicht gänzlich erforscht sind, scheint eine Dysbalance zwischen proinflammatorischen T-Helferzellen und immunsuppressiven regulatorischen T-Zellen in einer übermäßigen T-Zell-Aktivierung sowie Produktion von Zytokinen und Auto-Antikörpern zu münden. Zusätzlich reagieren T-Zellen auf tumorassoziierte Antigene, die auch von gesundem Körpergewebe exprimiert werden [6-8]. So zeigt sich beispielsweise bei der Behandlung des malignen Melanoms mit CTLA-4-Inhibitoren das Auftreten von Vitiligo im Sinne einer Kreuzreaktivität auf gemeinsame Antigene der Melanomzellen und gesunden Melanozyten [9]. ICI vermittelte CTLA4-Inhibition hemmt regulatorische T-Zellen auch direkt und führt zu erhöhter T-Zell-Proliferation und Zytotoxizität. [10]
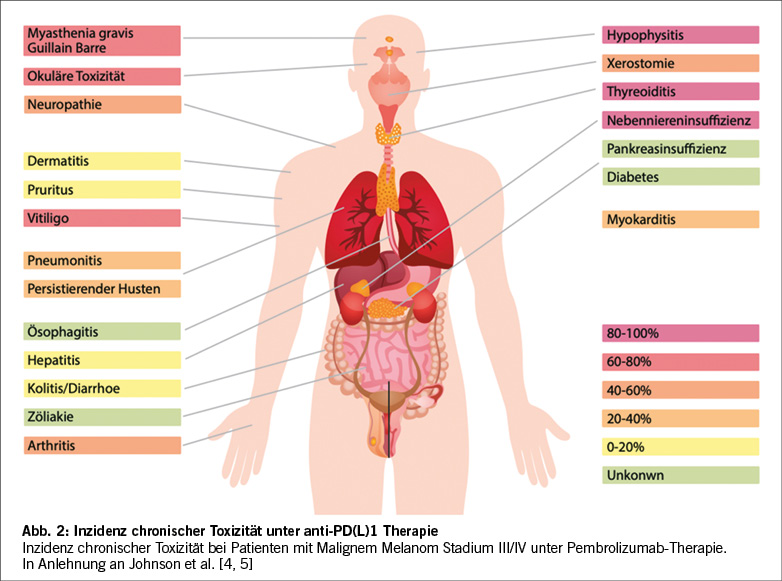
Man unterscheidet akute, verspätete und chronische Nebenwirkungen nach zeitlichem Auftreten. Akute Nebenwirkungen werden binnen drei Monaten nach Therapiebeginn, verspätete Nebenwirkungen ein Jahr nach Abschluss der Therapie auffällig [11]. Die chronischen Folgen zeigen eine Persistenz über zwölf Monate nach Beendigung der ICI Therapie und betreffen bis zu 40% der Patienten [4]. Insbesondere bei Patienten mit langanhaltendem Ansprechen auf die Therapie bilden sich T-Gedächtniszellen aus, die jedoch auch die chronischen Therapiefolgen vermitteln [12, 13]. So zeigte sich bei Patienten mit höhergradigen irAE auch häufiger ein langanhaltendes Therapieansprechen [14, 15]. Die Erkennung chronischer irAEs kann durch ihren schleichenden Beginn, die zusätzlich bestehenden Begleitsymptome fortgeschrittener Tumorerkrankungen und Komorbiditäten erschwert sein. Nichtsdestotrotz wird davon ausgegangen, dass 43% der Patienten von chronischen irAEs betroffen sind, wobei Arthritiden, Myalgien, Endokrinopathien, Xerostomie und Neurotoxizität, sowie okuläre Nebenwirkungen besonders häufig chronifizieren [5, 16].
Besonders in der Kombinationstherapie zeigen sich vermehrt Nebenwirkungen. Das Update der Keynote 189 Studie zeigte bei 616 Patienten mit nicht-kleinzelligem Bronchialkarzinom (NSCLC) ein signifikant verlängertes Überleben unter Chemotherapie mit Pembrolizumab (n= 410) gegenüber Chemotherapie mit Placebo (n = 206) (OS HR 0.49; 95% CI 0.38 – 0.64), unabhängig von der PD-L1 Expression. Jedoch kam es häufiger zu allgemeinen Nebenwirkungen wie Nausea, Fatigue, Obstipation/Diarrhoe, Anämie und Neutropenie, aber auch zu mehr irAEs. Am häufigsten traten Hypothyreose (7.9%), Hyperthyreose (4.9%), Pneumonitis (4.9%) und Colitis (3.2%) auf. [17] In der Keynote-024 wurde die ICI – Monotherapie mit der Chemotherapie als Erstlinientherapie bei PD-L1 Expression > 50% bei NSCLC verglichen. Die 305 Patienten erhielten entweder Pembrolizumab (n = 154) oder Carboplatin + Pemetrexed (n = 67), wobei das progressionsfreie Überleben unter Pembrolizumab-Monotherapie 10.3 Monate vs. 6.0 Monate mit Chemotherapie betrug. Unter Therapie mit Pembrolizumab traten Nebenwirkungen wie Übelkeit und Erbrechen, Fatigue, Anämie und Neutropenie deutlich seltener auf. Jedoch zeigte die Pembrolizumab-Monotherapie mehr irAEs, wobei Hypothyreose (9.1%), Hyperthyreose (7.8%), Pneumonitis (5.8%) und Hauttoxizität (3.9%) am häufigsten und unter Chemotherapie kaum auftraten [18]. In der Checkmate 067, einer klinischen Phase III Studie, wurde bei 945 Patienten mit fortgeschrittenem malignem Melanom die Kombinationstherapie aus Ipilimumab und Nivolumab (n=314) mit der Nivolumab (n=316) und Ipilimumab (n=315) Monotherapie verglichen. Hier zeigte sich unter der Kombinationstherapie zwar ein deutlich längeres medianes Überleben, jedoch bei 59% der Patienten unter Kombinationstherapie höhergradige Nebenwirkungen, gegenüber 23% und 28% bei der Monotherapie. Auffallend war das häufigere Auftreten von endokrinen, hepatischen und pulmonalen Nebenwirkungen im Vergleich zur Monotherapie. [19] Auch die Kombination aus Durvalumab und Tremelimumab in der Erstlinientherapie beim fortgeschrittenen Lungenkarzinom, untersucht in der Mystic Studie, zeigte gegenüber der Durvalumab-Monotherapie und Chemotherapie vermehrt immun-vermittelte Nebenwirkungen, hierbei traten insbesondere Hypothyreose, Pneumonitis und Diarrhoe auf (28.3% vs. 13.6%, 3.4%). Es sollte jedoch angemerkt werden, dass die alleinige Chemotherapie insgesamt mehr allgemeine Nebenwirkungen zeigte [20]. Ebendiese ICIs wurden in Kombination (Tremelimumab plus Durvalumab, n=393) in der Himalaya-Studie als Erstlinientherapie bei 1171 Patienten mit inoperablem Hepatozellulären Karzinom mit der Sorafenib-Monotherapie (n=389) und Durvalumab-Monotherapie (n=389) verglichen. Hierbei zeigte sich ein verlängertes medianes Überleben unter der Kombinationstherapie von 16.43 Monaten im Vergleich zu 13.77 Monaten unter der Sorafenib-Monotherapie und nach 36 Monaten Follow-up Überlebensraten von 30.7% für die Kombinationstherapie gegenüber 20.02% für die Sorafenib-Monotherapie. Ausserdem wurde eine ausbleibende Krankheitsprogression in 12.5% vs. 4.9% beobachtet. Unter der Kombinationstherapie wurden insgesamt weniger insbesondere höhergradige allgemeine Nebenwirkungen als unter Sorafenib-Monotherapie beobachtet. Grad 3-4 IrAEs waren unter Kombinationstherapie (12.6%) jedoch häufiger als unter Durvalumab und Sorafenib-Monotherapie (6.2%, 2.4%), wobei insbesondere die Hepatitis mit Transaminasenerhöhung, Hauttoxizität und Hypothyreose häufiger vorkamen als unter der Sorafenib-Monotherapie. [21]
Im Pacific-Trial, wo der Anti-PD-L1 IgG1 Antikörper Durvalumab zur Therapie des NSCLC im Stadium III für zwölf Monate zur Konsolidation nach Radiochemotherapie verwendet wurde, konnte ein deutlicher Überlebensvorteil gegenüber dem Placebo gezeigt werden. Grad 3-4 Nebenwirkungen zeigten sich in 30.5% gegenüber 26.1% in der Placebo-Gruppe. Husten und Pneumonitis waren die häufigsten Nebenwirkungen mit 35.4% und 33.9% gegenüber 25.2% und 24.8% in der Placebo Gruppe [22]. Besonders toxisch scheinen Kombinationen aus ICI und zielgerichteten Therapien zu sein. [7, 23].
Nebenwirkungen
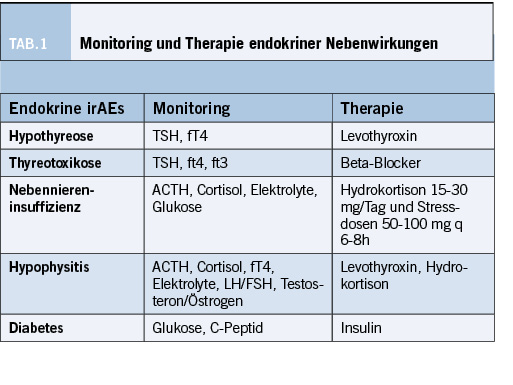
Zu den endokrinen irAEs gehört die Hypophysitis, die Schilddrüsendysfunktion, der Diabetes Typ I und die Nebenniereninsuffizienz. Endokrine Nebenwirkungen treten vergleichsweise früh auf, beispielsweise tritt im Median vier bis sechs Wochen nach Therapiebeginn eine Thyreotoxikose mit folgender Hypothyreose auf [23]. Während die Hypophysitis selten ist und häufiger bei Kombinationstherapien aus Nivolumab und Ipilimumab (6.4%) beobachtet wird, kommt die Thyreoiditis häufiger bei PD-1/PD-L1 Inhibition vor und wurde in bis zu 10% der Patienten beobachtet [4, 24]. Die Hypophysitis zeigt sich durch Kopfschmerzen, Fatigue, Muskelschwäche, Gewichtsverlust, Obstipation und Symptome der Hypothyreose bei Beteiligung der thyreoidalen Hormonachse oder auch mit erektiler Dysfunktion und Amenorrhoe bei Beeinträchtigung der gonadalen Hormonachse [25]. Bei 48 Patienten, die Pembrolizumab bei NSCLC im Rahmen der Keynote 001 Studie erhielten, zeigte sich in 21% eine neu aufgetretene, therapiewürdige Schilddrüsendysfunktion, wobei eine transiente Hyperthyreose bei 6 von 10 Patienten vor Hypothyreose auffiel. Auffällig war das signifikant verlängerte Überleben bei Patienten mit thyreoidaler Dysfunktion (median 40 vs. 14 Monate HR 0.29; 95% CI 0.09-0.94) [26]. Bei 16.7% der Patienten, die bei unterschiedlichen Tumoren eine Behandlung mit Nivolumab oder Pembrolizumab erhielten, zeigte sich eine Schilddrüsendysfunktion. Auch hier konnte ein positiver Einfluss auf das Progressionsfreie Überleben (Median 66 vs. 27 Wochen, HR: 0.50, 95% CI: 0.26-0.89) und Gesamtüberleben (median: 156 vs. 59 Wochen, HR 0.34, 95% CI: 0.13-0.75) gezeigt werden [27]. In der Behandlung des malignen Melanoms zeigte sich eine höhere Inzidenz für eine Schilddrüsendysfunktion in der Kombinationstherapie aus PD-1 Inhibition und CTLA4-Inhibition mit 14.6% (gegenüber 3.6% bei CTLA4-Inhibition und 7.5% bei PD-1 Blockade) [26]. Nebenniereninsuffizienz und Diabetes Typ I wurden im Rahmen der Keynote-522 Studie bei 2.3% und 0.3% festgestellt, in deren Rahmen Pembrolizumab neoadjuvant begleitend zur Chemotherapie zur Behandlung des Triple-negativen Mammakarzinoms verabreicht wurde [28]. Endokrinologische Nebenwirkungen bedürfen keiner Behandlung mit Glukokortikoiden sondern einer Substitution von Schilddrüsenhormonen bei Hypothyreose, Insulin bei Diabetes Typ I oder Hydrokortison bei der Nebenniereninsuffizienz, da es nicht selten zur dauerhaften Einschränkung der endokrinen Organfunktion kommt und diese nicht durch die Gabe von Steroiden verhindert werden kann.
Gastrointestinale Nebenwirkungen betreffen 30-40% der Patienten und zeigen sich als Diarrhoe, Kolitis, Hepatitis, Pankreatitis oder auch selten Ösophagitis, Mukositis, Xerostomie und Zöliakie. Während die Kolitis bei PD-1/PDL-1 Inhibition selten (5%) beobachtet wird, kommen Diarrhoe und Kolitis bei CTLA-4 Inhibition häufiger vor [11]. Entzündliche Darmerkrankungen treten im Median nach 8-16 Wochen auf, während die Hepatitis im Median nach 13-22 Wochen auftritt [23]. Die Kolitis geht im Gegensatz zur Diarrhoe mit abdominellen Schmerzen, Hämatochezie sowie objektivierbarem Nachweis einer Darmschleimhautentzündung mit Erythem und Ulzeration einher und sollte zur Diagnosesicherung bioptisch gesichert werden [25]. Zur Therapie werden primär Glukokortikoide eingesetzt, wobei auch Infliximab und Vedolizumab in schwersten Fällen Einsatz finden können. Die Hepatitis kann nach Ausschluss relevanter Virusinfektionen bei erhöhten Transaminasen in Betracht kommen und sich asymptomatisch, mit Ikterus oder als akutes Leberversagen zeigen. Autoimmunhepatitis-Antikörper sind meistens negativ, jedoch kann bioptisch eine T-Zell-Invasion des Leberparenchyms festgestellt werden. Auch die Hepatitis kann mit Glukokortikoiden behandelt werden.
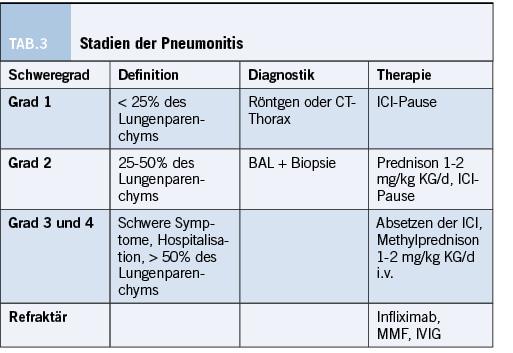
Zu den pulmonalen Nebenwirkungen gehört die interstitielle Pneumonitis, die insgesamt 5% der Patienten betrifft und somit zu den seltenen Nebenwirkungen gehört. Die Pneumonitis tritt insbesondere bei Patienten mit Lungentumoren und unter Kombinationstherapien auf, sie geht mit einer hohen Morbidität einher. [4] Patienten präsentieren sich mit Dyspnoe, trockenem Husten, Sauerstoffpflichtigkeit und Thoraxschmerzen. Im CT-Thorax zeigen sich möglicherweise Ground-Glass-Opazitäten, Bronchiolitis und Tree-in-Bud-Phänomene, die mitunter Jahre persistieren können. Zur Sicherung der Diagnose wird eine bronchoalveoläre Lavage (BAL) angestrebt und therapeutisch eine Glukokortikoidtherapie initiiert.
Eine große Belastung für die Patienten stellen rheumatische Folgeerkrankungen dar. Die meist seronegative Rheumatoide Arthritis, Polymyalgia Rheumatica, Polymyositis, und das Sjögren Syndrom. Beschwerden sind Arthritiden, insbesondere der großen Gelenke und Myalgien bis hin zur Muskelschwäche, die noch bis zu zwölf Monate nach Therapieende persistieren können. Zur Therapie kommen neben Glukokortikoiden auch Disease Modifying Antirheumatic Drugs (DMARDs) in Betracht. [4]
Die kutanen Nebenwirkungen gehören zu den frühen Nebenwirkungen, die zwei bis drei Wochen (kombinierte CTLA-4- und PD(L)1-Inhibition) oder fünf Wochen (PD-1-Inhibition mono) nach Therapiebeginn auftreten und sich durch Juckreiz, Exanthem, Vitiligo, Psoriasis oder das bullöse Pemphigoid zeigen [7]. Symptomkontrolle kann durch topische oder systemische Steroide und GABA-Agonisten wie Pregabalin erreicht werden.
Zu den hämatologischen Nebenwirkungen zählen neben Thrombozytopenien im Rahmen einer ITP (1% der Patienten) hämolytische Anämien oder die hämophagozystische Lymphohistiozytose (HLH), die zwar selten ist, jedoch bei Zytopenien mit Multiorganversagen mit einer erhöhten Letalität einhergeht. [29]
Zu den seltenen Nebenwirkungen zählen auch Beteiligungen des Nervensystems, okuläre und kardiale irAEs. Nebenwirkungen des Nervensystems betreffen die Synapsen, zentrale oder periphere Nerven. Eine Beteiligung des okulären Systems tritt insbesondere bei CTLA-4-Inhibitoren auf. Sie präsentieren sich durch trockene Augen oder eine Uveitis [30]. Kardiale Toxizität ist selten, tritt früh auf und kann neben der Myokarditis, eine Perikarditis, Kardiomyopathien und Reizleitungsstörungen umfassen. Kardiale Nebenwirkungen treten ebenfalls häufiger bei Kombinationstherapien auf und zeigen sich klinisch mit Dyspnoe, Ödemen und Palpitationen. Erhöhte Biomarker sind insbesondere die Creatin-Kinase (CK) und das Troponin I. Weitere mögliche Langzeitfolgen der ICI sind akute kardiale Ereignisse, da die proinflammatorische Umgebung bei erhöhter T-Zellaktivität ein erhöhtes Risiko für Atherosklerose mitbringt. Außerdem sind PD-1 und CTLA-4 an der Plaquestabilisierung beteiligt. [31]
Therapie
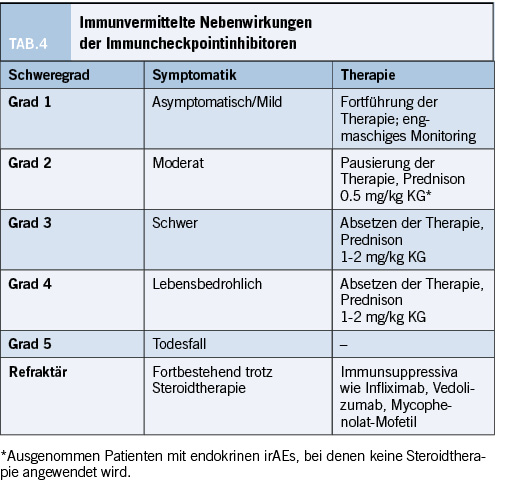
Viele der irAEs sind sensibel für die Therapie mit Steroiden und bilden sich binnen drei Monaten zurück. Dabei sollten Steroide je nach Schweregrad dosiert werden und über mindestens vier Wochen ausgeschlichen werden [25].
Dabei sollte die Prophylaxe opportunistischer Infektionen (z.B. Pneumocystis-Pneumonien) und eine Osteoporoseprophylaxe erfolgen. Für steroidrefraktäre Verläufe stehen TNF α-Inhibitoren wie Infliximab, Azathioprin, MMF oder Vedolizumab als Anti–Integrin α4β7 Antikörper zur Verfügung.
Ob eine Immunsuppression zur Behandlung der irAES auch die antitumorale Aktivität beeinträchtigt und die Wirkung der ICI abschwächt, ist nicht gänzlich gesichert, wobei sich in retrospektiven Analysen kein schlechteres Outcome für Patienten mit Einnahme von Immunsuppressiva zeigte. [32] Andererseits scheint früher Glukokortikoid-Einsatz und ein Wiederbeginn nach immunsuppressiver Therapie mit einer geringeren Wirkung der ICI einherzugehen. So konnte der Wiederbeginn einer ICI-Therapie nach Auftreten von irAE das Überleben von Patienten bei verschiedenen Tumorentitäten nicht verlängern. [14]
Ob ein erneuter Therapiebeginn nach initialer Pausierung bei irAEs sicher ist, wurde retrospektiv bei 482 Patienten mit fortgeschrittenem NSCLC, die eine PD-1 oder PD-L1 Inhibition als Monotherapie (90%) oder in Kombination mit einem CTLA-4-Inhibitor (10%) erhalten hatten, untersucht. Bei 68 Patienten wurden irAEs festgestellt, wobei Pneumonitis (19%), Colitis (17%), Ausschlag (16%) und Transaminasenerhöhung (10%) auftraten. Nach Re-Exposition entwickelten 39 der 68 Patienten (51%) keine irAEs, 26% zeigten ein Wiederauftreten gleicher irAEs und 23% der Patenten entwickelten neue irAEs [33]. Eine erneute Therapie sollte bei schwerwiegenden irAEs wie Myokarditis und Pneumonitis nicht erfolgen. Auch bei Notwendigkeit hoher Glukokortikoiddosen sollte von einer Re-Exposition abgesehen werden. Bei erneuter Therapie sind PD-1/PD-L1 Inhibitoren den CTLA-4 Inhibitoren vorzuziehen, da letztere mit einer erhöhten Rezidivrate von bis zu 88% einhergehen. [34]
Prävention
Für die Therapie ist es entscheidend Hochrisikogruppen zu identifizieren und regelmäßig auf irAEs zu untersuchen. Zu den Risikofaktoren gehören das weibliche Geschlecht, vorbestehende Autoantikörper, Autoimmunerkrankungen, Vaskulitiden oder eine positive Familienanamnese. Für eine verlässliche Aussage über die Folgen für diese Patientengruppe mangelt es jedoch an Forschungsdaten, da Patienten mit Autoimmunerkrankungen oder vorbestehenden Autoantikörpern häufig nicht in klinische Studien eingeschlossen wurden. Auch bestimmte genetische Polymorphismen wie HLA-QQB1 03:01 zeigten ein gehäuftes Auftreten der Kolitis, während eine diverse Darmflora sowie hohes Vorkommen von Faecalibacterium, Ruminococcaceae, Bifidobakterium und Bacteroides fragilis mit einem verbesserten Ansprechen auf ICI beim Melanom assoziiert sind. Bei endokrinen irAEs zeigte sich eine erhöhte Rate von Schilddrüsendysfunktionen bei Patienten mit vorbestehenden Autoantikörpern, eine Myositis gehäuft bei positivem Nachweis von mAchR-Antikörpern [7, 35].
Auf der Suche nach geeigneten Prädiktoren für irAEs, korrelierten folgende Laborveränderung mit irAEs: CRP-Erhöhung, Abnahme der Lymphozyten, Anstieg der Leukozyten, eine erhöhte Il17-Baseline, eine geringere Baseline von Il6, die Zytokine CXCL9 – 11 mit steilem Anstieg 3 und 6 Wochen nach Therapiebeginn. Beispielsweise zeigte sich ein erhöhtes Risiko für die Entwicklung einer Kolitis bei Il-17-Erhöhung unter Ipilimumab-Therapie. [7, 36, 37]
Fazit
Insbesondere chronifizierende Nebenwirkungen stehen in klinischen Studien selten im Fokus, gehen jedoch mit einem erheblichen Verlust der Lebensqualität einher. Nebenwirkungen der ICI sollten zur Optimierung der Therapie von Betroffenen im Rahmen interdisziplinärer Boards besprochen werden, in denen über Therapie (-pausen), begleitende immunsuppressive Medikation und den Wiedereinsatz der Therapie gemeinsam entschieden wird. Bisher mangelt es an Biomarkern zur Prädiktion von ICI-induzierten Nebenwirkungen, sodass der engmaschigen Betreuung der Patientinnen und Patienten eine wichtige Bedeutung zukommt. Vor dem Hintergrund des wachsenden Einsatzes der ICI sollte das Bewusstsein für ICI-induzierte Nebenwirkungen gestärkt werden, da das Erkennen sowohl in der ambulanten PatientInnenbetreuung, als auch in Notaufnahmen und spezialisierten Fachbereichen für die Therapie essentiell ist.
Klinik für Medizinische Onkologie und Hämatologie
Universitätsspital Zürich
Rämistrasse 100
8006 Zürich
helena.stricker@usz.ch
Helena Stricker: keine
Andreas Wicki: Institutional Research Grant: Roche. Travel Grant: Amgen
1. Kumar, A.R., et al., Harnessing the immune system against cancer: current immunotherapy approaches and therapeutic targets. Mol Biol Rep, 2021. 48(12): p. 8075-8095.
2. Marin-Acevedo, J.A., E.O. Kimbrough, and Y. Lou, Next generation of immune checkpoint inhibitors and beyond. Journal of Hematology & Oncology, 2021. 14(1): p. 45.
3. Vinay, D.S., et al., Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology, 2015. 35: p. S185-S198.
4. Johnson, D.B., et al., Immune-checkpoint inhibitors: long-term implications of toxicity. Nature Reviews Clinical Oncology, 2022. 19(4): p. 254-267.
5. Patrinely, J.R., Jr., et al., Chronic Immune-Related Adverse Events Following Adjuvant Anti-PD-1 Therapy for High-risk Resected Melanoma. JAMA Oncol, 2021. 7(5): p. 744-748.
6. Callahan, M.K., et al., Evaluation of serum IL-17 levels during ipilimumab therapy: Correlation with colitis. Journal of Clinical Oncology, 2011. 29(15_suppl): p. 2505-2505.
7. Ramos-Casals, M., et al., Immune-related adverse events of checkpoint inhibitors. Nat Rev Dis Primers, 2020. 6(1): p. 38.
8. Berner, F., et al., Association of Checkpoint Inhibitor-Induced Toxic Effects With Shared Cancer and Tissue Antigens in Non-Small Cell Lung Cancer. JAMA Oncol, 2019. 5(7): p. 1043-1047.
9. Guida, M., et al., Immune checkpoint inhibitor associated vitiligo and its impact on survival in patients with metastatic melanoma: an Italian Melanoma Intergroup study. ESMO Open, 2021. 6(2): p. 100064.
10. Walker, L.S.K. and D.M. Sansom, The emerging role of CTLA4 as a cell-extrinsic regulator of T cell responses. Nature Reviews Immunology, 2011. 11(12): p. 852-863.
11. Gumusay, O., J. Callan, and H.S. Rugo, Immunotherapy toxicity: identification and management. Breast Cancer Res Treat, 2022. 192(1): p. 1-17.
12. Principe, N., et al., Tumor Infiltrating Effector Memory Antigen-Specific CD8(+) T Cells Predict Response to Immune Checkpoint Therapy. Front Immunol, 2020. 11: p. 584423.
13. Reschke, R. and T.F. Gajewski, Tissue-resident memory T cells in immune-related adverse events: friend or foe? Oncoimmunology, 2023. 12(1): p. 2197358.
14. Albandar, H.J., et al., Immune-Related Adverse Events (irAE) in Cancer Immune Checkpoint Inhibitors (ICI) and Survival Outcomes Correlation: To Rechallenge or Not? Cancers (Basel), 2021. 13(5).
15. Shankar, B., et al., Multisystem Immune-Related Adverse Events Associated With Immune Checkpoint Inhibitors for Treatment of Non-Small Cell Lung Cancer. JAMA Oncol, 2020. 6(12): p. 1952-1956.
16. Schulz, T.U., et al., Persistent immune-related adverse events after cessation of checkpoint inhibitor therapy: Prevalence and impact on patients’ health-related quality of life. European Journal of Cancer, 2022. 176: p. 88-99.
17. Garassino, M.C., et al., Pembrolizumab Plus Pemetrexed and Platinum in Nonsquamous Non–Small-Cell Lung Cancer: 5-Year Outcomes From the Phase 3 KEYNOTE-189 Study. Journal of Clinical Oncology, 2023. 41(11): p. 1992-1998.
18. Reck, M., et al., Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer. New England Journal of Medicine, 2016. 375(19): p. 1823-1833.
19. Larkin, J., et al., Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. New England Journal of Medicine, 2019. 381(16): p. 1535-1546.
20. Rizvi, N.A., et al., Durvalumab With or Without Tremelimumab vs Standard Chemotherapy in First-line Treatment of Metastatic Non-Small Cell Lung Cancer: The MYSTIC Phase 3 Randomized Clinical Trial. JAMA Oncol, 2020. 6(5): p. 661-674.
21. Abou-Alfa, G.K., et al., Tremelimumab plus Durvalumab in Unresectable Hepatocellular Carcinoma. NEJM Evidence, 2022. 1(8): p. EVIDoa2100070.
22. Antonia, S.J., et al., Durvalumab after Chemoradiotherapy in Stage III Non–Small-Cell Lung Cancer. New England Journal of Medicine, 2017. 377(20): p. 1919-1929.
23. Wang, F., et al., Real-world data analyses unveiled the immune-related adverse effects of immune checkpoint inhibitors across cancer types. npj Precision Oncology, 2021. 5(1): p. 82.
24. Barroso-Sousa, R., et al., Incidence of Endocrine Dysfunction Following the Use of Different Immune Checkpoint Inhibitor Regimens: A Systematic Review and Meta-analysis. JAMA Oncology, 2018. 4(2): p. 173-182.
25. Michot, J.M., et al., Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer, 2016. 54: p. 139-148.
26. Osorio, J.C., et al., Antibody-mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small-cell lung cancer. Ann Oncol, 2017. 28(3): p. 583-589.
27. Sakakida, T., et al., Clinical features of immune-related thyroid dysfunction and its association with outcomes in patients with advanced malignancies treated by PD-1 blockade. Oncol Lett, 2019. 18(2): p. 2140-2147.
28. Schmid, P., et al., Pembrolizumab for Early Triple-Negative Breast Cancer. New England Journal of Medicine, 2020. 382(9): p. 810-821.
29. Noseda, R., et al., Haemophagocytic lymphohistiocytosis in patients treated with immune checkpoint inhibitors: analysis of WHO global database of individual case safety reports. J Immunother Cancer, 2019. 7(1): p. 117.
30. Dalvin, L.A., et al., CHECKPOINT INHIBITOR IMMUNE THERAPY: Systemic Indications and Ophthalmic Side Effects. RETINA, 2018. 38(6).
31. Calabretta, R., et al., Immune Checkpoint Inhibitor Therapy Induces Inflammatory Activity in Large Arteries. Circulation, 2020. 142(24): p. 2396-2398.
32. Postow, M.A., R. Sidlow, and M.D. Hellmann, Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med, 2018. 378(2): p. 158-168.
33. Santini, F.C., et al., Safety and Efficacy of Re-treating with Immunotherapy after Immune-Related Adverse Events in Patients with NSCLC. Cancer Immunol Res, 2018. 6(9): p. 1093-1099.
34. Abu-Sbeih, H., et al., Resumption of Immune Checkpoint Inhibitor Therapy After Immune-Mediated Colitis. J Clin Oncol, 2019. 37(30): p. 2738-2745.
35. Martins, F., et al., Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol, 2019. 16(9): p. 563-580.
36. Hommes, J.W., et al., Biomarkers of Checkpoint Inhibitor Induced Immune-Related Adverse Events-A Comprehensive Review. Front Oncol, 2020. 10: p. 585311.
37. Mehra, T., et al., Pre-treatment comorbidities, C-reactive protein and eosinophil count, and immune-related adverse events as predictors of survival with checkpoint inhibition for multiple tumour entities. Cancer Medicine. DOI: 10.1002/cam4.5919 .
Therapeutische Umschau
- Vol. 80
- Ausgabe 8
- Oktober 2023