- Übersicht und Therapie-Update Morbus Crohn
Morbus Crohn (MC) ist eine chronisch entzündliche Darmerkrankung die den gesamten Magendarmtrakt befallen kann. Ursächlich ist ein fehlgeleitetes Wechselspiel von Darmbakterien, Darmimmunsystem und der Darmoberfläche bei genetisch anfälligen Individuen, das im Detail unverstanden ist. Die konventionelle Therapie umfasst in der Akutphase Steroide, daneben stehen fortgeschrittene Therapien zur Verfügung. Drei Tumor-Nekrosefakter (TNF) Inhibitoren (Infliximab, Adalimumab und Certolizumab pegol (Schweiz)) sind für MC zugelassen. Neuere Therapieoptionen sind Interleukin (IL)-12/ 23-Inhibitoren (Ustekinumab) und Integrin-Inhibitoren (Vedolizumab). Im Jahr 2022 wurde mit Risankizumab ein erster IL-23 Inhibitor für MC von der EMA zugelassen und seit 2023 ist der Janus-Kinase-1 Inhibitor Upadacitinib für die Behandlung des MC in der EU ebenfalls verfügbar. Bei lokalisiertem MC ist auch eine elektive chirurgische Resektion eine Therapiealternative mit guten Langzeitergebnissen. Fisteln bei MC bleiben schwierig behandelbar und verlangen eine enge interdisziplinäre Zusammenarbeit zwischen Gastroenterologen und Viszeralchirurgen. Eine chirurgische Fistelbehandlung mit kurativem Ansatz sollte nur bei gut kontrolliertem MC versucht werden. Die beste Evidenz für den Einsatz beim fistulierenden MC besteht für Infliximab und Adalimumab, wahrscheinlich sind die anderen Therapien jedoch ebenfalls wirksam. Die Zulassung der neuen Wirkstoffe bei MC ist grundsätzlich zu begrüssen da immer mehr sichere und wirksame Therapien zur Verfügung stehen. Dennoch bleibt MC eine nicht heilbare Krankheit und bei jeder Behandlung spricht nur ein Teil der Patient/-innen auf die Therapie an. Im Interesse der Patient/-innen sollte die Entwicklung neuer Therapien daher weitergehen.
Aetiopathogenese, klinische Präsentation und Phänotypen
Morbus Crohn (MC), benannt im Jahre 1932 nach einem der Erstbeschreiber, dem amerikanischen Gastroenterologen Burrill Bernard Crohn (1) ist eine der beiden wichtigsten Formen einer chronisch entzündlichen Darmerkrankung (englisch: inflammatory bowel disease, IBD). Die Bezeichnung «Enteritis regionalis» umschreibt das segmentale gastrointestinale Befallsmuster der Erkrankung treffend: typischerweise befinden sich Erosionen, Aphten oder Ulcera direkt in Nachbarschaft von nicht-entzündlichen Arealen. An den entzündeten Stellen kann die Schleimhaut auch in Submukosa und gesamter Tiefe befallen sein, was die Neigungen zu Fisteln oder Fibrosierungen mit konsekutiven Stenosen erklärt.
Die klinische Präsentation umfasst abdominale Schmerzen, Diarrhoe, je nach Inflammationsgrad und Lokalisation auch blutig oder schleimig, und Allgemeinsymptome wie Fieber, Gewichtsverlust, Anämie und Leistungsschwäche. Zusätzlich können bei MC auch Entzündungen mit Befallsmustern ausserhalb des Gastrointestinaltraktes, sogenannte extraintestinale Manifestationen (EIM), bestehen. Diese umfassen periphere und/oder axiale Arthralgien und Arthritiden (30%), entzündliche Hautveränderungen wie
Erythema nodosum oder Pyoderma gangrenosum, Augenentzündungen wie Episcleritis, Uveitis oder Iridozyklitis und eine Entzündung der Gallenwege als primär sklerosierende Cholangitis (PSC) (2, 3).
Die Aetiopathogenese der Erkrankung ist wahrscheinlich multifaktoriell und nach wie vor nicht eindeutig im Detail geklärt. Am ehesten führen in genetisch anfälligen Individuen Umwelteinflüsse zu einer Veränderung der Darmbakterien und einer Aktivierung des intestinalen Immunsystems mit konsekutiver intestinaler Entzündung. Der Dickdarm und distale Dünndarm sind dicht mit Bakterien besiedelt, die Bakterienkonzentration beträgt dort 1011 pro ml (in anderen Worten 100 Milliarden pro cm3). Über 99% aller den Menschen besiedelnden Bakterien befinden sich im Dickdarm (4). Das Immunsystem muss somit einerseits den Gastrointestinaltrakt verteidigen, andererseits nützliche kommensale Bakterien erhalten. Dies ist angesichts der schieren Bakterienmasse und des kurzen (mikroskopischen) Abstandes von Darmlumen zur Submukosa eine Herausforderung. IBD ist eine Fehlregulation der Interaktion zwischen Immunsystem, Darmschleimhaut und Darmbakterien. IBD kann daher als «komplexe Barrierestörung» der Darmoberfläche aufgefasst werden. Es handelt sich um eine immunvermittelte aber nicht per se autoimmune
Erkrankung.
Bei aktiver IBD finden sich ubiquitäre Veränderungen: Defekte der Schleimschicht, gestörte Zell-Zell- Verbindungen («tight junctions»), verminderte Panethzellen (die unter anderem antibakterielle Verteidigungsmoleküle, «Defensine», produzieren) und eine Aktivierung intrazellulärer Pathways (z.B. für «Autophagie» und «Stress im endosplasmatischen Retikulum»). Es findet sich zudem eine Aktivierung der angeborenen (innate) Immunantwort (z.B. Makrophagen, Inflammasom) und des T-Zellsystems mit Aktivierung und Einwanderung von Th1 und Th17-Zellen und einer Inaktivierung regulatorischer T-Suppressorzellen. Zudem werden wichtige Zytokine wie Tumornekrosefaktor (TNF) und Interleukin (IL)-23 aktiviert. Welche dieser Veränderungen «primär» bzw. direkte oder indirekte Folgen anderer Veränderungen sind, ist unbekannt. Wichtige therapeutische Angriffspunkte sind die Einwanderung von Immunzellen (Integrin-Inhibitoren) sowie die Zytokine TNF und IL-23 (siehe unten).
Interessanterweise war MC im 19. Jahrhundert unbekannt, bei danach steigender Inzidenz im Laufe des 20. Jahrhunderts. Massgeblich mag eine Änderung der Ernährung gewesen sein: Fisch, Früchte, Gemüse werden als günstig, rotes und prozessiertes Fleisch, Nahrungszusätze und Transfettsäuren als ungünstig beschrieben, bei insgesamt sehr unbefriedigender Studienlage (5). Weitere Umweltfaktoren, die das Risiko für MC fördern, sind Antibiotikaexposition in der Kindheit, Rauchen (6, 7) und Appendektomie. Interessanterweise sind die letzten beiden Risikofaktoren (anhaltendes Rauchen und stattgehabte Appendektomie) bei Colitis ulcerosa (CU) protektiv. Protektive Umweltfaktoren bei MC umfassen Muttermilch (in der frühen Kindheit), Haustiere, Nutztiere, ländliche Umgebung, sowie Zugang zu einer Toilette und heissem Wasser. Diese Umweltfaktoren beeinflussen somit entweder das intestinale Immunsystem oder betreffen eine optimale Hygiene (weder zu wenig noch zu strikt) mit optimaler Exposition des Organismus bzgl.
verschiedener Bakterien.
Bei aktiver IBD findet sich eine veränderte Darmmikrobiota mit vermehrt Protobakterien, die als Pathobionten in geeignetem Kontext auch eine Entzündung auslösen oder fördern können. Andererseits findet sich eine verminderte Zahl bestimmter Kommensalen: Bakterien, die über komplexe Stoffwechselwege Kohlenhydrate metabolisieren können und immunmodulatorische kurzkettige Fettsäuren (englisch: short chain fatty acids, SCFA) bilden (8, 9).
Etwa die Hälfte des Krankheitsrisikos für MC ist genetisch bedingt (10). Somit ist das Krankheitsrisiko bei erstgradigen Verwandten mit MC 8-fach erhöht und auch eine CU in der Verwandtschaft erhöht das Erkrankungsrisiko (11). Da MC jedoch insgesamt eine seltene Erkrankung ist (Lebenszeitprävalenz 0.3%) (12), erkranken die meisten Verwandten von MC Patient/-innen nicht. Die relevanteste einzelne Genmutation ist eine Frameshiftmutation im NOD2 Gen (13, 14). Je jünger das Erkrankungsalter desto höher ist die genetische Belastung und bei Säuglingen und Kleinkindern können Punktmutationen, z.B. im IL-10 Rezeptor, die Krankheit mit autosomal rezessivem Erbgang bedingen (15). Dennoch handelt es sich bei MC im Erwachsenenalter grundsätzlich nicht um eine mono- oder oligogenetische Erkrankung. Mit genomweiten Assoziationsstudien (GWAS), zuletzt in multi-ethnischen Populationen, wurden weitere genetische Marker für IBD entdeckt, so dass aktuell von über 300 involvierten Genabschnitten ausgegangen wird (16). Viele dieser Gene finden sich in Pathways die für die Pathogenese von IBD wichtig sind (innate Immunsystem, Immunzellmigration, IL-23). GWAS konnten zudem interessanterweise eine Verbindung von IBD zu Zöliakie, ankylosierender Spondylitis, Psoriasis, und Tuberkulose zeigen.
Phänotypen: Ein MC kann den gesamten Magendarmtrakt von Mundhöhle bis Anus befallen, die häufigsten Lokalisationen sind jedoch Ileozökalregion (90%) und Anal- und Perianalregion (30%). Eine Crohn-Colitis (20% der Fälle) befindet sich klinisch, phänomenologisch und genetisch zwischen MC und CU und ist wahrscheinlich als eigene Krankheit aufzufassen (17, 18). Zudem gibt es ösophageale, gastrale, duodenale oder jejunale Befallsmuster (19).
In Bezug auf den zeitlichen Verlauf wechseln sich meist ruhigere Krankheitsphasen mit Phasen vermehrter Krankheitsaktivität ab. Phasen vermehrter Krankheitsaktivität werden als Schub (englisch: «Flare») bezeichnet. Ist die Krankheit nicht symptomatisch oder messbar aktiv spricht man von Remission. Der Verlauf ist jedoch variabel, neben einem typischen schubweisen Verlauf kommen auf der einen Seite jahrelange Remissionen auf der anderen Seite auch Daueraktivität oder ein progressiver Krankheitsverlauf vor. Bei den meisten Patient/-innen nimmt die Krankheitsaktivität jedoch über die Lebensdauer sukzessive ab und schwere klinische Verläufe sind im Alter selten (20). Dies ist bemerkenswert da die funktionelle Reservekapazität des Magendarmtraktes, z.B. bzgl. Kontinenz im Alter abnimmt. Bei stabiler klinischer Situation kann z.B. ab dem 50.
Lebensjahr ein Therapiestopp diskutiert werden.
Therapie u. Therapieausblick, Krankheitsaktivität
Das grundsätzliche Therapieziel in der Behandlung von IBD ist das Erreichen und Erhalten einer Remission. Dies ist nicht trivial denn IBD und MC sind komplexe Krankheiten und Remission kann sowohl klinisch unter Berücksichtigung vieler Beschwerden, also auch biochemisch, endoskopisch, histologisch oder sonographisch definiert werden. Für die klinische Aktivitätserfassung stehen bei MC zusammengesetzte (Composite)-Scores wie der Crohn‘s Disease Activity Index (CDAI) (21) oder der Harvey-Bradshaw Index (HBI)(22) zur Verfügung. Dafür wird beim CDAI die Anzahl Stuhlgänge, Bauchschmerzen, allgemeines Befinden, abdominelle Resistenzen, Gewichts- und Anämieverlauf erfasst. Der HBI ist eine vereinfachte Form, berücksichtigt beispielsweise nicht die Anämie und kann somit ohne Laboruntersuchung ausgewertet werden. Die teilweise subjektive Natur von CDAI und HBI ist Anlass für Kritik und Variabilität in klinischen Studien, dennoch werden Veränderungen des CDAI unverändert als wichtigste Endpunkte klinischer Studien verwendet. In der klinischen Praxis können z.B. bei Diarrhoe und Abdominalschmerzen unter Therapie residuelle entzündliche Beschwerden klinisch oft nicht von funktionellen post-entzündlichen Beschwerden unterschieden werden (23, 24), was objektive Entzündungsmarker notwendig macht.
Fäkales Calprotectin (FC) ist ein sehr sensitiver, GI-spezifischer, nicht-invasiver Entzündungsmarker der einfach verwendet werden kann (25). Bei normwertigem FC ist eine relevante intestinale Entzündung unwahrscheinlich. Erhöhte Werte haben dagegen eine breite Differentialdiagnose (z.B. NSAR oder GI-Blutungen (26)) und falsch positive Befunde kommen vor allem bei älteren Patient/-innen vor. In unserer Praxis verwenden wir Calprotectinmessungen eher für eine längerfristige Monitorisierung mit sequentiellen Erhebungen mehrmals jährlich um patienten- und situationspezifische Referenzwerte zu erlangen. Progrediente Abweichungen von der Baseline oder repetitiv erhöhte FC-Werte können dann (bei übereinstimmender Klinik) ein intensiveres Management (z.B. häufigere Visiten, Dosisintensivierung, Endoskopie) veranlassen.
Die Endoskopie gilt als Goldstandard für die Bestimmung der luminalen Entzündungsaktivität des MC in Kolon und terminalem Ileum und eine endoskopische Remission kann mit dem SES-CD Score objektiviert werden. Noch einen Schritt weiter geht die histologische Remission, mit Fehlen von Lymphozyteninfiltraten, Kryptenabszessen oder Granulomen. Die streng lokalisierte Entzündungsaktivität mit entzündeten Arealen in Nachbarschaft von entzündungsfreien Arealen machen jedoch auch Sampling Errors möglich (27). Die endoskopische und histologische Remission werden immer häufiger in der Praxis verwendet und werden in klinischen Studien meist als sekundäre Endpunkte mitbestimmt. Bei symptomfreien Patient/-innen, normalem Labor einschliesslich Calprotectin, muss die Remission jedoch nicht endoskopisch dokumentiert werden.
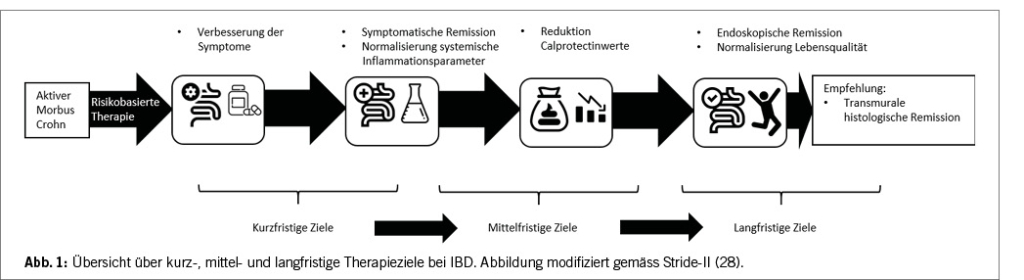
Therapieziele bei IBD wurden in den STRIDE-Guidelines (28) umfassend und patientennah definiert. Es werden kurz-, mittel- und langfristige Ziele unterschieden. Kurz- und mittelfristig geht es um die Besserung bzw. das Verschwinden der Krankheitssymptome, die Normalisierung des CRPs und die Senkung des Calprotectinwertes auf akzeptable Werte. Langfristig geht es um endoskopische Heilung und eine normale Lebensqualität für die Patient/-innen ohne Einschränkung (Abbildung 1). Die sonographische «transmurale» Heilung mit Erreichen einer normalen Wanddicke des terminalen Ileums wird als zusätzlicher Endpunkt betrachtet. Jeweils wird bei nicht-Erreichen eines Endpunktes in entsprechender Frist eine Modifikation der Therapie empfohlen.
Neben diesen Endpunkten geht es auch grundsätzlich um die Erhaltung der Funktionalität des Magen-Darmtraktes. Durch wiederholte Entzündungen mit Vernarbungen und Fisteln sowie repetitiven Operationen kann es bei schwerer Krankheitsaktivität zu einer irreversiblen und kaum noch therapierbaren Beschädigung des GI-Traktes kommen. Die Darmpassage und Nahrungsabsorption ist dann durch
Stenosen, Briden, Dysmotilität und Kurzdarm limitiert und kann durch antientzündliche Therapien nicht verbessert werden. Es gibt bei Patient/-innen mit schwerem MC somit ein therapeutisches Fenster das nicht verpasst werden sollte und effektive Therapien werden heute früher eingesetzt als in der Vergangenheit.
Therapieupdate:
Für die Therapie des MC unterscheiden die aktuellen Leitlinien der European Crohn´s and Colitis Organisation (ECCO) (29) drei Grundpfeiler:
1] Induktionstherapie
2] Erhaltungstherapie
3] Therapie eines fistulierenden perianalen Morbus Crohn
Zusätzlich muss die Therapie gemäss Schwergrad der Erkrankung, Krankheitslokalisation, Komplikationen und EIM, bisheriges Therapieansprechen und Begleiterkrankungen individualisiert werden.
Dafür haben die Möglichkeiten in den letzten 20 Jahren deutlich zugenommen, und weitere Veränderungen sind abzusehen. Die Therapievielfalt ist einerseits für Patient/-innen und Ärzte positiv denn es ist immer häufiger möglich individuelle Therapien für Patient/-innen zu finden. Andererseits darf dies nicht darüber hinwegtäuschen, dass MC nach wie vor nicht heilbar ist und jede neue Therapie die Therapiesituation nur stückweise (inkremental) verbessert.
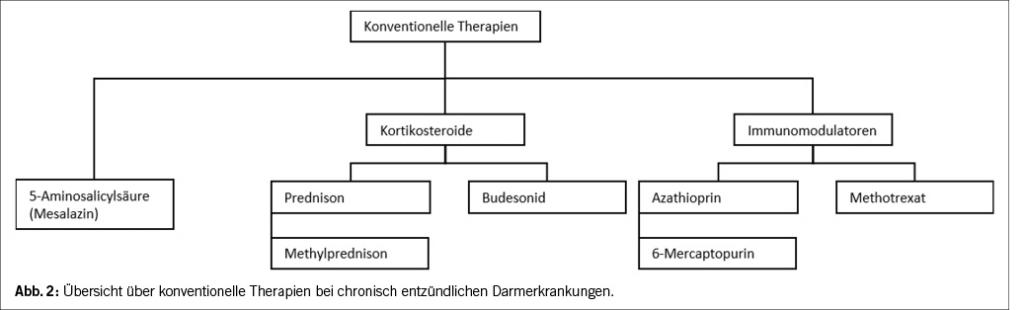
Um trotz der zunehmenden Komplexität einen Überblick zu behalten lohnt es sich die Therapien in konventionelle (Abbildung 2) und fortgeschrittene Therapien (Abbildung 3) einzuteilen. Konventionelle Therapie beinhalten verschiedene Kortikosteroide in systemischen und rektalen Applikationsformen und die Antimetaboliten Azathioprin (AZA), 6-Mercaptopurin (MP) und Methotrexat (MTX), die unter dem Begriff Immunomodulatoren zusammengefasst werden. Immunomodulatoren hemmen über verschiedene Wege die Zellteilung und damit die Proliferation von Immunzellen. Ebenfalls zu den Immunomodulatoren zählt Mesalazin oder 5-Aminosalicylsäure (5-ASA). 5-ASA ist Basismedikament bei CU spielt bei MC jedoch nur eine untergeordnete Rolle. In den aktuellen ECCO-Guidelines (29) wird die Anwendung von Mesalazin bei Morbus Crohn auch nicht mehr formal empfohlen, beruhend auf Daten mehrerer Studien und Meta-Analysen. In Einzelfällen kann bei sehr mildem Krankheitsverlauf, entsprechender Patientenpräferenz und seriösem Monitoring eine Erhaltungstherapie mit Mesalazin dennoch eine sinnvolle Option sein.
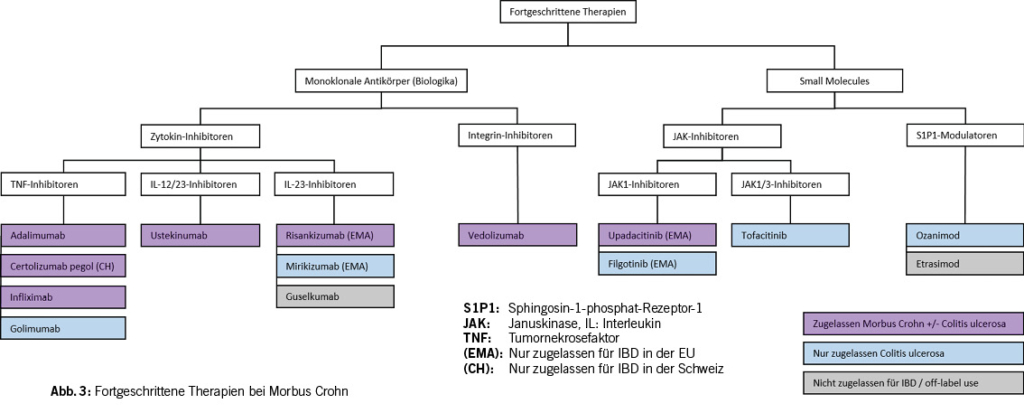
Bei den fortgeschrittenen Therapien für MC stehen aktuell 3 Klassen von monoklonalen Antikörpern zur Verfügung: TNF-Inhibitoren, IL-12/23- Inhibitoren und Integrin- Inhibitoren. Zudem gibt es Janus-Kinase (JAK)-Inhibitoren, «small molecules», welche in der Schweiz teilweise für die CU schon zugelassen sind jedoch noch nicht für MC.
Bei den TNF-Inhibitoren sind seit 2016 Biosimilars auf dem Markt. Im Gegensatz zu Generika, die bzgl. chemischer Zusammensetzung mit den Originalprodukten identisch sind, handelt es sich bei Biosimilars um ähnliche Substanzen, da Details des Herstellungsprozesses die resultierenden Antikörper beeinflussen können (z.B. Proteinfaltung). Biosimilars haben sich in Vergleichsstudien jedoch als gleichermassen wirksam herausgestellt und in der Praxis bewährt. Die ECCO empfiehlt grundsätzlich die Anwendung oder sogar den Wechsel auf Biosimilars nach erfolgter Patientenrücksprache (29, 30). Der Vorteil bei einem Wechsel liegt vor allem in einer Kosteneinsparung. Zusätzlich bringen Biosimilars Innovationsdruck und bewirken patientenfreundlichere Applikationsformen (z.B. Infliximab-subkutangabe bei Veblocema®) und die Entwicklung neuer Medikamentenklassen.
Induktionstherapie
Bei der Induktionstherapie einer leichten bis mittelschweren Krankheit welche das terminale Ileum u. Colon ascendens betrifft, empfiehlt sich gemäss ECCO-Guidelines die Induktionstherapie mit dem topischen Steroid Budesonide mit 9mg/d. Der starke First-Pass-Effekt mit rascher Metabolisierung in der Leber nach Resorption bedingt zudem den Vorteil geringerer systemischer Steroidnebenwirkungen. Bei bis zu 60% der Patient/-innen kann dadurch eine Remission nach 8 Wochen erreicht werden. Liegt eine mittlere bis schwere Krankheitsaktivität vor sind systemische Steroide Medikamente der Wahl, entweder als perorale (Prednison) oder intravenöse Applikation (Methylprednisolon) mit einer Startdosis von 0.5 – 1mg/kg Körpergewicht. Die intravenöse Applikation ist insbesondere bei schwerem Verlauf empfohlen. Der Wechsel auf die perorale Form erfolgt nach klinischer Besserung (z.B. <8 Stuhlgänge pro 24h). Sehr wichtig ist die initial enge Anbindung ambulanter Patient/-innen: Nach spätestens 2 Wochen sollte eine erneute klinische Beurteilung erfolgen. Für eine Überlegenheit eines Steroidtaperings gibt es keine Evidenz, dennoch wird dies in der klinischen Praxis so gehandhabt und spätestens nach 2 Wochen sollte damit begonnen werden.
Die Steroidtherapie ist die am längsten verfügbare Therapie. Bei einer ersten Steroidtherapie kann von einer Wirksamkeit in bis zu 80% der Patient/-innen nach 3 Wochen ausgegangen werden, wobei es bei rund 50% der Patient/-innen zu einer kompletten Remission kommt. Die verbleibenden 50% der Patient/-innen sprechen entweder nicht auf die Steroidtherapie an oder es kommt nach Dosisreduktion zu erneuter Krankheitsaktivität und einem steroidabhängigen Verlauf. (31)
Zweite Linie für die Induktionstherapie sind fortgeschrittene Therapien, insbesondere Biologika. Alle Klassen monoklonaler Antikörper (TNF-Inhibitoren, Integrin-Inhibitoren und IL-12/23 Inhibitoren) sind zur Induktionstherapie geeignet und werden von der ECCO zur Induktionstherapie empfohlen (29). Die längste Erfahrung besteht mit TNF-Inhibitoren von denen Infliximab i.v. (32), Adalimumab s.c. (33) von der EMA für Morbus Crohn zugelassen wurden (Schweiz: zusätzlich Certolizumab pegol s.c. (34)). Die Zulassung der EMA für Infliximab besteht seit 1999 und Infliximab ist auch heute ein sehr wichtiges Therapeutikum. Infliximab stand lange nur als intravenöse Applikationsform zur Verfügung, seit 2022 gibt es mit dem Biosimilar Veblocema® erfreulicherweise auch die Möglichkeit zur subkutanen Anwendung mit gleichmässigeren Plasmaspiegeln und gleicher Wirkung als bei der i.v.-Gabe (35).
Die Nebenwirkungen von TNF-Inhibitoren umfassen Infektionen, insbesondere die Reaktivierung von Tuberkulose im Mittel 12 Wochen nach Induktion (36), und Lymphome, ausserdem können Allergien, Psoriasis, Herzinsuffizienz, Leberwerterhöhungen, multiple Sklerose und andere Autoimmunphänomene wie drug-induced Lupus erythematodes auftreten (37, 38).
In Bezug auf die Wahl des initialen TNF-Inhibitors gibt es keine Vergleichsstudien und keine Empfehlungen. Daher spielen primär Dosierungsintervall, Patientenpräferenz und Kosten, sowie die Verfügbarkeit eine Rolle. Meta-Analysen bestehender Studien haben nur begrenzte Aussagekraft aber gemäss einer kürzlich durchgeführten Analyse sind Infliximab und Adalimumab in der Induktionstherapie Certolizumab pegol überlegen (39).
Zusätzlich gibt es die Möglichkeit einer Kombinationstherapie von Infliximab und Azathioprin zur Induktionstherapie. Diese wurde in der SONIC-Studie (40) getestet. Dabei erreichten 57% der Patient/-innen mit einer Kombinationstherapie (Infliximab und Azathioprin), 44% der Patient/-innen mit einer Infliximab-Monotherapie und 30% der Patient/-innen mit einer Azathioprin-Monotherapie eine steroidfreie, klinische Remission. Die Kombination von Infliximab und Azathioprin wird somit von der ECCO empfohlen (29). Infliximab ist als monoklonaler Antikörper ursprünglich ein Mausprotein. Trotz gentechnischer
Humanisierung verbleiben bei Infliximab relevante murine Proteinanteile. Später zugelassene Biologika sind vollständiger humanisiert worden. Somit hat Infliximab die höchste Immunogenität aller bei IBD zugelassenen Biologika (ca. 28% bei Infliximab vs. 7.5% bei Adalimumab) (41). Die Verstärkung der Wirkung von Infliximab durch Azathioprin ist somit zumindest teilweise durch die Verhinderung Bildung von Anti-Drug Antikörpern bedingt. Entsprechend konnte die Überlegenheit einer Kombinationstherapie von Azathioprin und Adalimumab gegenüber einer Adalimumab-Monotherapie nicht gezeigt werden (42) und für die Kombination von Azathioprin mit anderen fortgeschrittenen Therapien gibt es ebenfalls keine Evidenz. Eine Monotherapie von Immunomodulatoren (AZA, MP, MTX) ist auch aufgrund des langsamen Wirkungseintritts von 8 – 12 Wochen zur Induktionstherapie nicht geeignet und wird für diese Indikation nicht empfohlen.
Der optimale zeitliche Ablauf der Induktionstherapie bei schwerem MC ist unklar und die Medikamentensequenz bleibt eine individuelle Entscheidung (29). Gezielte Studien die eine frühe Therapie mit monoklonalen Antikörper mit einer schrittweisen Therapieeskalierung vergleichen gibt es jedoch kaum und stellen zurzeit gemäss ECCO eine wissenschaftliche Lücke dar. Hierzu gibt es die gegensätzlichen Konzepte einer Step-Up und einer Top-Down Therapie. Eine Step-up Therapie startet mit Steroiden und Tapering, bei nicht-Ansprechen oder Rezidiv folgen Immunsuppressiva bzw. fortgeschrittene Therapien. Bei der Top-Down Therapie erfolgt die Induktion sofort mit Steroiden und Biologika +/- Immunsuppressiva. Das Risiko einer Top-Down Therapie ist eine Übertherapie während bei einer Step-Up Therapie die Zeit bis zum Erreichen einer Remission im Mittel länger dauert. In den letzten Jahren wurden ausserdem durch die Zunahme der Anzahl zugelassener Biologika und sinkende Medikamentenpreise Therapiewechsel und Therapieoptimierungen relevanter. Allerdings sollten erste MC-Symptome in der Regel nicht sofort eine langjährige Biologikagabe triggern da der Verlauf und allenfalls auch die Diagnose in den ersten 3 (bis 12) Monaten meist noch unsicher ist. Die Zulassung der EMA und von Swissmedic beinhaltet vor Verschreibung aller fortgeschrittenen Therapien eine erfolglose Vortherapie mit mindestens einer anderen konventionellen oder fortgeschrittenen Therapie.
Eine weitere Klasse monoklonaler Antikörper sind IL-12/23-Inhibitoren. Ustekinumab (Stelara®, Erstzulassung EMA 2009) blockiert die gemeinsame p40 Untereinheit von IL-12 und IL-23 und blockiert somit die Wirkung beider Zytokine. In den UNITI-1 und UNITI-2 Studien konnte die Wirksamkeit von Ustekinumab bei mittelschwerem bis schwerem MC gezeigt werden (43) und Ustekinumab wird von der ECCO für diese Indikation empfohlen. Die Wirksamkeit bei Anti-TNF erfahrenen Patient/-innen war erwartungsgemäss geringer gewesen als bei Anti-TNF naiven Patient/-innen aber dennoch in beiden Subgruppen signifikant besser als Placebo gewesen. Zulassungsstudien und Langzeitbeobachtungen konnten zudem auch die Sicherheit von Ustekinumab demonstrieren (43, 44). Interessanterweise wurde Ustekinumab mit Adalimumab in einer «Head-to-head» Studie bei Biologika-naiven Patient/-innen direkt verglichen (44). In Bezug auf den primären Endpunkt klinische Remission (CDAI score <150) zeigten sich keine signifikanten Unterschiede zwischen beiden Wirkstoffen.
Selektive IL-23 Inhibitoren sind die neueste Klasse von Medikamenten bei IBD. Aktuell befinden sich drei Medikamente dieser Klasse im Einsatz: Risankizumab (Skyrizi®), Mirikizumab (Omvoh®) und Guselkumab (Tremfya®). Risankizumab wurde 2023 von der EMA bei MC zugelassen, Mirikizumab bei CU und Risankizumab und Guselkumab bei Psoriasis. Die Swissmedic Zulassung von IL-23 Inhibitoren bei IBD ist noch ausstehend. Während Ustekinumab an p40 bindet und so IL-12 und IL-23 blockiert, wird bei der selektiven IL-23 Blockade lediglich die IL-23-Untereinheit p19 blockiert, was IL-23 (p19-p40), nicht aber IL-12 (p35-p40) inaktiviert. In der Therapie der Psoriasis waren selektive IL-23-Inhibitoren regelrechte «Gamechanger» und hatten sehr hohe Ansprechraten von ca. 80% erreicht (45, 46). Die Wirkung bei MC ist jedoch geringer und mit der anderer Biologika vergleichbar.
Risankizumab hatte in den ADVANCE, MOTIVATE und FORTIFY-Studien die co-primären Endpunkte klinische und endoskopische Response erreicht und somit die Überlegenheit gegenüber Placebo bei Induktions- und Erhaltungstherapie bei MC nachgewiesen (47, 48). Ob bei IBD die selektive IL-23 Blockade der kombinierten IL-12/ IL-23 Blockade (mit Ustekinumab) überlegen ist, bleibt vorerst offen. Bei Psoriasis konnte mit Risankizumab (IL-23 Blockade) im Vergleich zu Ustekinumab signifikant häufiger der primäre Endpunkt erreicht werden (49). Erfreulicherweise haben IBD-Studien mit Risankizumab (bei MC) und Mirikizumab (bei CU) ebenfalls einen Ustekinumab-Vergleichsarm und unveröffentlichte Daten legen eine leichte Überlegenheit von Risankizumab bei MC nahe. Zudem ist das Sicherheitsprofil der IL-23 Inhibitoren sehr gut und IL-23 Inhibitoren scheinen eine Bereicherung der IBD-Therapie darzustellen.
Der Integrin-Inhibitor Vedolizumab blockiert als monoklonaler IgG1 Antikörper α4β7 Integrin auf Lymphozyten. Integrin α4β7 kann dann nicht mehr mit MAdCAM-1 auf Endothelzellen interagieren. Dies verhindert das Einwandern von Lymphozyten in die Darmmukosa und in lymphoides Gewebe (Gut associated lymphatic tissue, GALT). Die Wirksamkeit von Vedolizumab für Induktion und Maintenance einer Remission bei MC konnte in der GEMINI-2 Studie gezeigt werden (50). Die GEMINI Studien und Langzeitbeobachtungsstudien haben die Sicherheit von Vedolizumab gezeigt (51). Die Integrin α4β7-Blockade betrifft jedoch neben dem Darmimmunsystem auch die oberen Atemwege und obere Atemwegsinfekte waren in der GEMINI-2 Studie eine relevante Nebenwirkung gewesen.
Janus-Kinase (JAK)-Inhibitoren sind Tyrosinkinaseinhibitoren und zählen zu den «small molecules» oder krankheitsmodifizierenden Antirheumatika (disease-modifying anti-rheumatic drugs, DMARDs) welche oral eingenommen werden können. Sie hemmen den intrazellulären JAK-STAT-Signalweg der die Signaltransduktion von vielen Zytokinrezeptoren in die Zelle vermittelt. Der breite Wirkungsmechanismus erklärt die starke Wirkung der JAK-Inhibitoren, lässt aber auch vielfältige Nebenwirkungen befürchten. Es sind vier Januskinasen (JAK1-3 und TYK) mit teilweise überlappenden Funktionen bekannt. Von drei bei IBD getesteten JAK-Inhibitoren hemmt Tofacitinib (Xeljanz®) JAK1 und JAK3 während Upadacitinib (Rinvoq®) und Filgotinib (Jyseleca®) relativ selektiv JAK1 inhibieren. Die JAK1-Selektivität ist ein theoretischer Vorteil, der eine stärkere antiinflammatorische Wirkung und ein besseres Nebenwirkungsprofil zur Folge haben könnte. Von der EMA wurde Ustekinumab für MC und CU, Filgotinib und Tofacitinib nur für CU zugelassen. In der Schweiz ist bzgl. IBD lediglich Tofacitinib für CU offiziell zugelassen.
Upadacitinib hatte in den Induktions- und Maintenance-Studien U-EXCEL, U-EXCEED und U-ENDURE bei Patient/-innen mit MC signifikant häufiger als Placebo eine klinische Remission induziert (52). Die geteste Dosis lag bei 45 mg pro Tag in den ersten 12 Wochen und 15 oder 30 mg pro Tag bis Woche (52). Nebenwirkungen waren Herpes Zoster Infektionen, Leberwerterhöhungen und Neutropenien gewesen (52). Vor oder unmittelbar bei Anwendung eines JAK-Inhibitors ist somit eine Herpes-Zoster Impfung indiziert und während der Anwendung sollten bei entsprechenden Symptomen niederschwellig infektiöse Komplikationen gesucht werden. Dennoch ist gemäss den aktuell vorliegenden Daten das Nebenwirkungsprofil der JAK-Inhibitoren bei IBD insgesamt vertretbar.
In Beobachtungsstudien hatte sich bei älteren Patient/-innen mit rheumatoider Arthritis unter Behandlung mit Tofacitinib ein Risiko für Infektionen, thromboembolischen und kardiovaskulären Erkrankungen und Malignomen gezeigt (53, 54). Das Nebenwirkungsprofil von Upadacitinib war in einem grossen Kollektiv von 6991 Patient/-innen mit rheumatoider Arthritis, Psoriasis, ankylosierener Spondylitis und atopischer Dermatitis über eine Beobachtungszeit von 2.75 – 5.45 Jahren jedoch insgesamt vertretbar gewesen (55). Ob die selektive JAK-1 Inhibition von Upadacitinib auch bei Langzeitanwendung vorteilhaft bleibt muss abgewartet werden und JAK-Inhibitoren werden immer mit den extrem sicheren neueren Biologika verglichen werden. JAK-Inhibitoren sind zudem wie andere «small molecules» im Gegensatz zu monoklonalen Antikörpern zu jedem Zeitpunkt Plazenta-gängig. Unserer Meinung nach sollten JAK-Inhibitoren vorerst schwer therapierbaren Patient/-innen vorbehalten bleiben. In diesem Patientengut kann diese Medikamentenklasse jedoch oft gute Wirksamkeit entfalten.
Welches Medikament bei MC und IBD am wirksamsten ist, ist unbekannt. Ein direkter Vergleich der Wirksamkeit der Präparate aus den jeweiligen placebokontrollierten Studien ist problematisch. In einer kürzlich veröffentlichten Metaanalyse wurden 25 Trials mit insgesamt 8720 Patient/-innen zusammengefasst. Es zeigte sich bei Induktion die stärkste Wirksamkeit von Infliximab, gefolgt von Risankizumab und Upadacitinib. Bzgl. Erhaltungstherapien waren Upadacitinib, gefolgt von Adalimumab und Infliximab besonders wirksam gewesen (56). Direkte Vergleichsstudien gibt es, wie oben erwähnt, bei MC nur von Adalimumab und Ustekinumab, die sich als ebenbürtig erwiesen hatten (44).
Zuletzt ist auch eine elektive chirurgische Resektion bei beschränktem schweren Ileozökalbefall und initialem Therapieversagen auf monoklonale Antikörper eine Alternative. Chirurgische Ileozökalresektionen und Infliximab waren in einer direkten Vergleichsstudie bzgl. resultierender Lebensqualität nach 12 Monaten bei Patient/-innen mit isoliertem Ileozökalbefall gleichwertig gewesen (57, 58).
Erhaltungstherapie
Für Patient/-innen mit mildem Krankheitsverlauf bestehen keine eindeutigen Daten und Empfehlungen von Seiten der ECCO für eine spezifische Therapiestrategie oder Monitoring in der Remissionsphase (29). Es ist somit auch vertretbar diese Patient/-innen nur im akuten Schub zu behandeln und keine Erhaltungstherapie zu etablieren.
Die effektivsten Therapien zur Erhaltungstherapie bei mittelschwerem bis schwerem Morbus Crohn sind die bei der Induktionstherapie bereits vorgestellten fortgeschrittenen Therapien. Falls die Induktionstherapie mit einer fortgeschrittenen Therapie erfolgte, wird von der ECCO (29) empfohlen den gleichen Wirkstoff auch für die Erhaltungstherapie zu verwenden. Dies gilt für alle verfügbaren Klassen, also TNF-, Interleukin-12/23-, Integrin- und JAK-Inhibitoren. Möglicherweise ist es sinnvoll, nach Erreichen einer stabilen Remission den potentiell nebenwirkungsreicheren JAK-Inhibitor durch einen monoklonalen Antikörper zu ersetzen. Für diese Strategie gibt es bisher keine Daten und die Entscheidung muss individualisiert werden.
Steroide werden aufgrund der zahlreichen Nebenwirkungen nicht zur Erhaltungstherapie empfohlen. Auch perorales Budesonid
ist nicht als Dauertherapie geeignet und die Gabe von Steroiden bzw. Budesonid sollten nach 3 bzw. 12 Monaten beendet sein.
Die Gabe von Immunomodulatoren (AZA; MP; MTX) zur Erhaltungstherapie von MC ist unter Diskussion. Für Azathioprin und andere Immunomodulatoren sprechen die niedrigen Medikamentenpreise und die langjährige medizinische Erfahrung mit diesen Medikamenten in Patient/-innen mit sehr unterschiedlichen Indikationen, z.B. seit 1963 zur Verhinderung von Transplantatabstossungen (59). Somit ist das Sicherheitsprofil dieser Medikamente sehr gut verstanden. Nachteile sind die enge therapeutische Breite mit Notwendigkeit von Laborkontrollen alle 3 Monate, die limitierte Effektivität und die limitierte Evidenzlage mit einer Studiendauer bei MC von maximal 18 Monaten (29). Zudem bestehen relevante Nebenwirkungen wie akute gastrointestinale Effekte (Übelkeit, Erbrechen, Unwohlsein in 15% aller Patient/-innen vor allem bei Therapiebeginn), akute Pankreatitis (4%), eine Knochenmarksuppression mit Zytopenien, Lebertoxizität einschliesslich nodulär-regenerativer Hyperplasie und Leberfibrose, Infektionen, Stomatitis, Gewichtsverlust und anderes. Zudem ist das Risiko von Lymphomen und weissem Hautkrebs (non-Melanoma skin cancer) 4-5-fach erhöht (daher regelmässige dermatologische Kontrollen und Sonnenschutz)(60). Fairerweise muss gesagt werden, dass sich einige der Risiken moderner Therapien noch zeigen könnten, und einige Nebenwirkungen von Azathrioprin durch genetisches oder phänotypisches Testen der Thiopurin-S-Methyltransferase abgefangen werden könnten. Gemäss ECCO-Richtlinien besteht somit eine Empfehlung der Anwendung einer Azathioprin-Monotherapie zur Erhaltung einer Remission bei Morbus Crohn (29). Dies entspricht der klinischen Erfahrung des guten und langfristigen Ansprechens einzelner Patient/-innen auf diese Therapie.
Zu Exitstrategien gibt es nur wenig Daten und Empfehlungen. Wurde eine Kombinationstherapie von Infliximab und Thiopurinen bereits als Induktionstherapie angewendet empfiehlt sich ein Stoppen des Thiopurins nach Erreichen einer stabilen Remission (z.B. nach 6-12 Monaten): gemäss einer Meta-Analyse war in dieser Situation die Rückfallrate gleich gewesen (61). Eine kürzlich publizierte randomisiert-kontrollierte Studie zeigte ebenfalls, dass das Beenden von Azathioprin die Relapse-Rate nicht beeinflusst hatte, während ein Stopp von Infliximab mit erneuten Flares assoziiert gewesen war (62). Das Lymphomrisiko ist jedoch bei einer Kombinationstherapie von TNF-Inhibitoren und Thiopurinen höher als mit jeder Monotherapie, obwohl es sich absolut gesehen immer noch um ein kleines Risiko handelt (ca. 6 Fälle pro 10‘000 Patientenjahre) (63).
Bei langjähriger Biologikatherapie ist bei asymptomatischen Patient/-innen ein Therapiestopp immer wieder Gegenstand der Diskussion in Arzt-Patientengesprächen. Nach Anti-TNF Stopp beträgt das Risiko eines Relapses 30-40% nach 1 Jahr und ≥50% nach 2 Jahren. Bei klinischer, biochemischer und endoskopischer Remission, bei guten Medikamentenspiegeln, unkompliziertem Verlauf ohne Dosiseskalation, jüngeren Patient/-innen, Nichtrauchern ist dieses Risiko jedoch geringer (64). Letztlich bleibt die Entscheidung eines Therapiestopps jedoch individuell.
Therapie von fistulierendem perianalen Morbus Crohn
Der perianale fistulierende Verlauf des MC ist ein komplexes Erkrankungsbild und ist ein Risiko auch für einen sonstigen schwereren Verlauf. Fistelbeschwerden werden von Patient/-innen oft nicht berichtet, sie müssen aktiv erfragt werden und der Lokalstatus sollte bei jeder Visite inspektorisch und palpatorisch (evtl. ohne digital-rektale Untersuchung) erhoben werden. Entscheidend ist die Kenntnis über die genaue Anatomie des Fistelleidens, wofür MRI, Endosonographie und die manuelle digital-rektale Untersuchung in Narkose zur Verfügung stehen. Fisteln werden in «einfach» und «komplex» unterteilt. Einfache Fisteln verlaufen niedrig (oberflächlich, tief intersphinkterisch, tief transsphinkterisch), haben eine einzelne externe Öffnung, sind schmerzlos ohne lokale Fluktuationen hinweisend für einen Abszess, verlaufen weder rektovaginal noch rektovesikal und sind nicht von anorektalen Strikturen begleitet (65).
Primäres Therapieziel bei perianalen Fisteln ist es, die Symptome zu lindern und die Lebensqualität der Patient/-innen zu verbessern und die Funktionalität des Rektums und des Analkanals, insbesondere die Stuhlkontinenz zu erhalten. Daher ist ein Fistelverschluss nicht primäres Therapieziel und nicht in jeder Situation sinnvoll. Andererseits können floride Abszesse und aktive Fisteln durch Gewebepenetration und -vernarbung die Anorektalregion dauerhaft schädigen.
Die Therapie perianaler Fisteln bei Morbus Crohn erfolgt interdisziplinär unter Zusammenarbeit von Gastroenterologen und Viszeralchirurgen. Ein florider, aktiver Abszess sollte stets drainiert werden, um weitere Gewebepenetration und fortlaufende Fistelbildung zu verhindern. Eine aktive Fistel kann durch eine Setoneinlage ruhiggestellt werden. Medikamente für akute Abszess- oder Fistelbeschwerden sind Antibiotika (z.B. Metronidazol und Ciprofloxacin). Zur länger dauernden medikamentösen Behandlung und Beruhigung der Fistelaktivität stehen viele fortgeschrittene Therapien zur Verfügung (siehe unten).
Im Rahmen der interdisziplinären Zusammenarbeit ist es die Aufgabe der Gastroenterologen, die Krankheitsaktivität des Morbus Crohn endoskopisch zu erfassen und optimal medikamentös zu behandeln sowie die Ernährungssituation des Patient/-innen zu verbessern. Ein chirurgischer Fistelverschluss sollte nur unter optimalen Bedingungen probiert werden: i) minimale oder fehlende entzündliche Aktivität des M. Crohn mit optimierter medikamentöser Therapie, ii) sistierter Nikotinkonsum, iii) gute Ernährungssituation. Abweichungen von diesen Empfehlungen haben höhere Komplikationsraten zur Folge.
Eine medikamentöse Fisteltherapie kann bestehende Fisteln verschliessen, die Symptome von Fisteln (Sekretion, Schmerzen) vermindern, einen operativen Fistelverschluss ermöglichen (z.B. nach 3-6 Monaten Therapie) und das Auftreten neuer Fisteln verhindern. Von den verfügbaren medikamentösen Therapien gibt es die beste Evidenz für den TNF-Inhibitor Infliximab, gefolgt von Adalimumab. Infliximab wurde in einer randomisiert-kontrollierten Studie mit Fistelverschluss als primären Endpunkt getestet (66). Adalimumab wurde ebenfalls in einer randomisierten kontrollierten Studie getestet, mit Fistelheilung als sekundärem Endpunkt (67). Somit gilt Infliximab als Medikament der Wahl zur Therapie eines komplizierten Fistelleidens. Ein hoher Infliximabspiegel (>10mcg/ml) scheint dabei die Fistelheilung zu begünstigen (68). Kritisch sind die Endpunkte der Studie, so wird Fistelheilung in der Infliximab-Studie lediglich durch einen Verschluss der äusseren Fistelöffnung (=«fistel drainage assessment») erfasst. Dabei wird mit dem palpierenden Finger der Fistelausgang komprimiert bis ggf. Sekret austritt. Diese «Fistelheilung» ist somit nicht mit einer vollständigen klinischen oder radiologischen (MRI) Fistelheilung gleichzusetzen.
Für Ustekinumab, Vedolizumab und dem JAK-Inhibitor Filgotinib fanden sich positive Effekte in unverblindeten Beobachtungsstudien (69). Momentan ist nicht abzusehen, welche medikamentöse Strategie bei fistulierendem M. Crohn die günstigste ist und weitere Studien sind dringend geboten. Eine Monotherapie mit Langzeitantibiotika oder Immunomodulatoren wird bei fehlendem Evidenz gemäss ECCO-Guidelines nicht empfohlen (29). Steroide sind bei fistulierendem MC kontraproduktiv.
Bei Patient/-innen mit fistulierendem MC gibt es zudem die Möglichkeit der Anwendung mesenchymaler Stammzellen. Das Medikament Darvadstrocel (Alofisel®) besteht aus allogenen humanen mesenchymalen Stammzellen die aus dem Fettgewebe von gesunden, erwachsenen Fremdspendern gewonnen und in vitro vermehrt wurden. Die Suspension wird intraoperativ in den Fistelgang appliziert und in das Gewebe um den Fistelgang gespritzt. Die Behandlung ist teuer und logistisch aufwändig da die Stammzellen innerhalb von 48h nach der Herstellung im Behandlungszentrum verwendet werden müssen. Die Anwendung ist auf Patient/-innen die auf mindestens eine medikamentöse Therapie nicht angesprochen haben beschränkt und es darf maximal eine milde Krankheitsaktivität bestehen. Die Effektivität konnte primär in einer randomisiert kontrollierten Studie nachgewiesen werden (70) und auch eine Langzeiteffektivität (3 Jahre) gegenüber Placebo konnte gezeigt werden (71, 72).
Therapiemonitoring
Für verschiedene Biologika stehen mittlerweile Zielspiegelbereiche als Referenzwerte zur Verfügung. Hohe Talspiegel korrelieren mit mukosaler Heilung und Remission (73) und sind ein Prädiktor für einen guten weiteren klinischen Verlauf ohne Rezidive nach Stoppen der Therapie. Für die Talspiegel von Infliximab und Adalimumab gibt es die meisten Daten, die Referenzwerte anderer Biologika sind weniger gut interpretierbar. Talspiegel sind zudem bei subkutanen Therapien nicht etabliert. Von Seiten der ECCO gibt es somit aufgrund mangelnder Daten keine Empfehlung für ein routinemässiges Monitoring. Die Talspiegel bei s.c. Therapien können aber zur groben Einschätzung der Compliance genutzt werden.
Zum Monitoring der Wirksamkeit von biologischen Therapien stehen zudem Messungen für Anti-Drug Antikörper zur Verfügung, da es im Verlauf zur Bildung von neutralisierenden Antikörpern gegen die künstlich hergestellten biologischen Substanzen mit sekundärem Wirkungsverlust kommen kann (siehe oben).
Für die Purinanaloga Azathioprin und 6-Mercaptopurin können Spiegel für den aktiven Metaboliten 6-Thioguanin-Nukleotid (6-TGN) und das Abbauprodukt 6-Methylmercaptopurin (6-MMP) gemessen werden. 6-TGN-Spiegelmessungen sind ein Mass für die Effektivität und 6-MMP-Spiegel korrelieren mit Hepatotoxizität. Anhand der Spiegel dieser beider Metaboliten kann die Medikamentendosis angepasst werden (60).
Therapieausblick
Sphingosin-1 Phosphat (S1P1)-Rezeptormodulatoren (Ozanimod, Etrasimod) sind neue Medikamente die wie die JAK-Inhibitoren zu den «small molecules» zählen jedoch wurde bisher lediglich Ozanimod für CU zugelassen. Klinische Studien laufen jedoch auch bei MC. In der Entwicklung befinden sich auch noch andere Substanzen mit neuen Therapieansätzen. Obefazimod (Abx464) kann oral eingenommen werden und bindet intrazellulär an das 5’-Ende der messanger RNA und an den dort befindlichen CAP-Komplex. Dies beeinflusst das weitere Prozessieren der mRNAs und es wird eine einzelne regulatorische mRNA (miR-124) hochreguliert. Dies führt wiederum zur Downregulation von Zytokinen wie TNF, CCL2/ MCP-1 und IL-17 in Entzündungszellen, was letztlich die Entzündung reduzieren sollte (74). Ein anderes neues Molekül ist Efavaleukin, ein verändertes IL-2 Protein (ein sogenanntes Mutein), welches zu einer selektiven Expansion von regulatorischen T-Zellen führt. Dadurch soll ein antiinflammatorisches Gleichgewicht und vermehrte immunologische Toleranz wiederhergestellt werden (74, 75). Beide Moleküle nutzen also physiologische Bremsen des Immunsystems und es bleibt abzuwarten, ob so eine Darmentzündung nebenwirkungsarm behandelt werden kann. Ein anderer spannender Ansatz ist die Kombination zweier bereits bekannter Klassen fortgeschrittener Therapien. Ein Beispiel dafür ist eine Kombinationsstudie mit dem TNF-Inhibitor Golimumab und dem IL-23 Inhibitor Guselkumab (76). Auch andere Medikamenten-Kombinationen sind denkbar (77) und werden möglicherweise bald klinisch getestet werden.
Die Zukunft der IBD-Therapien ist schwer voraussehbar. Für eine Heilung des MC gibt es momentan kein plausibles Konzept und würde ein grundlegend besseres Krankheitsverständnis voraussetzen. Alle aktuellen Therapien sind jeweils nur bei einem Teil der Patient/-innen wirksam. Fortschritte in der Krankheitskontrolle sind somit durch neue Therapien, durch Kombination bestehender Therapien oder durch Personalisierung der Behandlung bei der die individuell wirksamste Therapie für jede Patient:in vorausgesagt werden kann (78, 79), denkbar. Die Weiterentwicklung der IBD-Therapien wird daher auch die nächsten Jahre spannend bleiben.
Leitender Arzt Gastroenterologie
Universitätsklinik für Viszerale Chirurgie
und Medizin Klinik, Inselspital Bern und Universität Bern.
Freiburgstrasse 18
3010 Bern
benjamin.misselwitz@insel.ch
Der Autor hat keine Interessenkonflikte.
1. CROHN BB, GINZBURG L, OPPENHEIMER GD. REGIONAL ILEITIS: A PATHOLOGIC AND CLINICAL ENTITY. Journal of the American Medical Association 1932;99:1323-1329.
2. Vavricka SR, Schoepfer A, Scharl M, et al. Extraintestinal Manifestations of Inflammatory Bowel Disease. Inflamm Bowel Dis 2015;21:1982-92.
3. Greuter T, Rieder F, Kucharzik T, et al. Emerging treatment options for extraintestinal manifestations in IBD. Gut 2021;70:796-802.
4. Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol 2016;14:e1002533.
5. Sugihara K, Kamada N. Diet-Microbiota Interactions in Inflammatory Bowel Disease. Nutrients 2021;13.
6. Biedermann L, Zeitz J, Mwinyi J, et al. Smoking cessation induces profound changes in the composition of the intestinal microbiota in humans. PLoS One 2013;8:e59260.
7. Cosnes J, Beaugerie L, Carbonnel F, et al. Smoking cessation and the course of Crohn’s disease: an intervention study. Gastroenterology 2001;120:1093-9.
8. Yilmaz B, Juillerat P, Oyas O, et al. Microbial network disturbances in relapsing refractory Crohn’s disease. Nat Med 2019;25:323-336.
9. Pascal V, Pozuelo M, Borruel N, et al. A microbial signature for Crohn’s disease. Gut 2017;66:813-822.
10. Baumgart DC, Sandborn WJ. Crohn’s disease. Lancet 2012;380:1590-605.
11. Moller FT, Andersen V, Wohlfahrt J, et al. Familial risk of inflammatory bowel disease: a population-based cohort study 1977-2011. Am J Gastroenterol 2015;110:564-71.
12. Ng SC, Shi HY, Hamidi N, et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet 2017;390:2769-2778.
13. Barrett JC, Hansoul S, Nicolae DL, et al. Genome-wide association defines more than 30 distinct susceptibility loci for Crohn’s disease. Nat Genet 2008;40:955-62.
14. Ogura Y, Bonen DK, Inohara N, et al. A frameshift mutation in NOD2 associated with susceptibility to Crohn’s disease. Nature 2001;411:603-6.
15. Glocker EO, Kotlarz D, Boztug K, et al. Inflammatory bowel disease and mutations affecting the interleukin-10 receptor. N Engl J Med 2009;361:2033-45.
16. Liu Z, Liu R, Gao H, et al. Genetic architecture of the inflammatory bowel diseases across East Asian and European ancestries. Nat Genet 2023;55:796-806.
17. Cleynen I, Boucher G, Jostins L, et al. Inherited determinants of Crohn’s disease and ulcerative colitis phenotypes: a genetic association study. Lancet 2016;387:156-67.
18. Yu YR, Rodriguez JR. Clinical presentation of Crohn’s, ulcerative colitis, and indeterminate colitis: Symptoms, extraintestinal manifestations, and disease phenotypes. Semin Pediatr Surg 2017;26:349-355.
19. Ingle SB, Hinge CR, Dakhure S, et al. Isolated gastric Crohn’s disease. World J Clin Cases 2013;1:71-3.
20. Butter M, Weiler S, Biedermann L, et al. Clinical manifestations, pathophysiology, treatment and outcome of inflammatory bowel diseases in older people. Maturitas 2018;110:71-78.
21. Best WR, Becktel JM, Singleton JW, et al. Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study. Gastroenterology 1976;70:439-44.
22. Harvey RF, Bradshaw JM. A simple index of Crohn’s-disease activity. Lancet 1980;1:514.
23. Perez de Arce E, Quera R, Beltran CJ, et al. Irritable bowel syndrome in inflammatory bowel disease. Synergy in alterations of the gut-brain axis? Gastroenterol Hepatol 2022;45:66-76.
24. Tozlu M, Cash B, Younes M, et al. Dilemma in post-IBD patients with IBS-D symptoms: A 2020 overview. Expert Rev Gastroenterol Hepatol 2021;15:5-8.
25. Schoepfer AM, Beglinger C, Straumann A, et al. Fecal calprotectin correlates more closely with the Simple Endoscopic Score for Crohn’s disease (SES-CD) than CRP, blood leukocytes, and the CDAI. Am J Gastroenterol 2010;105:162-9.
26. Vavricka SR, Heinrich H, Buetikofer S, et al. The Vampire Study: Significant elevation of faecal calprotectin in healthy volunteers after 300 ml blood ingestion mimicking upper gastrointestinal bleeding. United European Gastroenterol J 2018;6:1007-1014.
27. Geboes K. Is histology useful for the assessment of the efficacy of immunosuppressive agents in IBD and if so, how should it be applied ? Acta Gastroenterol Belg 2004;67:285-9.
28. Turner D, Ricciuto A, Lewis A, et al. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology 2021;160:1570-1583.
29. Torres J, Bonovas S, Doherty G, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment. J Crohns Colitis 2020;14:4-22.
30. Danese S, Fiorino G, Raine T, et al. ECCO Position Statement on the Use of Biosimilars for Inflammatory Bowel Disease-An Update. J Crohns Colitis 2017;11:26-34.
31. Munkholm P, Langholz E, Davidsen M, et al. Frequency of glucocorticoid resistance and dependency in Crohn’s disease. Gut 1994;35:360-2.
32. Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002;359:1541-9.
33. Sandborn WJ, Hanauer S, Loftus EV, Jr., et al. An open-label study of the human anti-TNF monoclonal antibody adalimumab in subjects with prior loss of response or intolerance to infliximab for Crohn’s disease. Am J Gastroenterol 2004;99:1984-9.
34. Schreiber S, Rutgeerts P, Fedorak RN, et al. A randomized, placebo-controlled trial of certolizumab pegol (CDP870) for treatment of Crohn’s disease. Gastroenterology 2005;129:807-18.
35. Schreiber S, Ben-Horin S, Leszczyszyn J, et al. Randomized Controlled Trial: Subcutaneous vs Intravenous Infliximab CT-P13 Maintenance in Inflammatory Bowel Disease. Gastroenterology 2021;160:2340-2353.
36. Keane J, Gershon S, Wise RP, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001;345:1098-104.
37. Vaz JL, Andrade CA, Pereira AC, et al. Systematic review of infliximab-induced autoantibodies and systemic lupus erythematosus. Rev Bras Reumatol 2013;53:358-64.
38. Bjornsson HK, Gudbjornsson B, Bjornsson ES. Infliximab-induced liver injury: Clinical phenotypes, autoimmunity and the role of corticosteroid treatment. J Hepatol 2022;76:86-92.
39. Hazlewood GS, Rezaie A, Borman M, et al. Comparative effectiveness of immunosuppressants and biologics for inducing and maintaining remission in Crohn’s disease: a network meta-analysis. Gastroenterology 2015;148: 344-54 e5; quiz e14-5.
40. Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010;362:1383-95.
41. Bots SJ, Parker CE, Brandse JF, et al. Anti-Drug Antibody Formation Against Biologic Agents in Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis. BioDrugs 2021;35:715-733.
42. Matsumoto T, Motoya S, Watanabe K, et al. Adalimumab Monotherapy and a Combination with Azathioprine for Crohn’s Disease: A Prospective, Randomized Trial. J Crohns Colitis 2016;10:1259-1266.
43. Feagan BG, Sandborn WJ, Gasink C, et al. Ustekinumab as Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med 2016;375:1946-1960.
44. Sands BE, Irving PM, Hoops T, et al. Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn’s disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial. Lancet 2022;399:2200-2211.
45. Reich K, Gordon KB, Strober BE, et al. Five-year maintenance of clinical response and health-related quality of life improvements in patients with moderate-to-severe psoriasis treated with guselkumab: results from VOYAGE 1 and VOYAGE 2. Br J Dermatol 2021;185:1146-1159.
46. Blauvelt A, Tsai TF, Langley RG, et al. Consistent safety profile with up to 5 years of continuous treatment with guselkumab: Pooled analyses from the phase 3 VOYAGE 1 and VOYAGE 2 trials of patients with moderate-to-severe psoriasis. J Am Acad Dermatol 2022;86:827-834.
47. D’Haens G, Panaccione R, Baert F, et al. Risankizumab as induction therapy for Crohn’s disease: results from the phase 3 ADVANCE and MOTIVATE induction trials. Lancet 2022;399:2015-2030.
48. Ferrante M, Panaccione R, Baert F, et al. Risankizumab as maintenance therapy for moderately to severely active Crohn’s disease: results from the multicentre, randomised, double-blind, placebo-controlled, withdrawal phase 3 FORTIFY maintenance trial. Lancet 2022;399:2031-2046.
49. Gordon KB, Strober B, Lebwohl M, et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. Lancet 2018;392:650-661.
50. Sandborn WJ, Feagan BG, Rutgeerts P, et al. Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2013;369:711-21.
51. Vermeire S, Loftus EV, Jr., Colombel JF, et al. Long-term Efficacy of Vedolizumab for Crohn’s Disease. J Crohns Colitis 2017;11:412-424.
52. Loftus EV, Jr., Panes J, Lacerda AP, et al. Upadacitinib Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med 2023;388:1966-1980.
53. Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. N Engl J Med 2022;386:316-326.
54. Wollenhaupt J, Lee EB, Curtis JR, et al. Safety and efficacy of tofacitinib for up to 9.5 years in the treatment of rheumatoid arthritis: final results of a global, open-label, long-term extension study. Arthritis Res Ther 2019;21:89.
55. Burmester GR, Cohen SB, Winthrop KL, et al. Safety profile of upadacitinib over 15 000 patient-years across rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis and atopic dermatitis. RMD Open 2023;9.
56. Barberio B, Gracie DJ, Black CJ, et al. Efficacy of biological therapies and small molecules in induction and maintenance of remission in luminal Crohn’s disease: systematic review and network meta-analysis. Gut 2023;72:264-274.
57. Ponsioen CY, de Groof EJ, Eshuis EJ, et al. Laparoscopic ileocaecal resection versus infliximab for terminal ileitis in Crohn’s disease: a randomised controlled, open-label, multicentre trial. Lancet Gastroenterol Hepatol 2017;2:785-792.
58. Stevens TW, Haasnoot ML, D’Haens GR, et al. Laparoscopic ileocaecal resection versus infliximab for terminal ileitis in Crohn’s disease: retrospective long-term follow-up of the LIR!C trial. Lancet Gastroenterol Hepatol 2020;5:900-907.
59. Murray JE, Merrill JP, Harrison JH, et al. Prolonged survival of human-kidney homografts by immunosuppressive drug therapy. N Engl J Med 1963;268:1315-23.
60. Frei P, Biedermann L, Nielsen OH, et al. Use of thiopurines in inflammatory bowel disease. World J Gastroenterol 2013;19:1040-8.
61. Boyapati RK, Torres J, Palmela C, et al. Withdrawal of immunosuppressant or biologic therapy for patients with quiescent Crohn’s disease. Cochrane Database Syst Rev 2018;5:CD012540.
62. Louis E, Resche-Rigon M, Laharie D, et al. Withdrawal of infliximab or concomitant immunosuppressant therapy in patients with Crohn’s disease on combination therapy (SPARE): a multicentre, open-label, randomised controlled trial. Lancet Gastroenterol Hepatol 2023;8:215-227.
63. Siegel CA, Marden SM, Persing SM, et al. Risk of lymphoma associated with combination anti-tumor necrosis factor and immunomodulator therapy for the treatment of Crohn’s disease: a meta-analysis. Clin Gastroenterol Hepatol 2009;7:874-81.
64. Doherty G, Katsanos KH, Burisch J, et al. European Crohn’s and Colitis Organisation Topical Review on Treatment Withdrawal [‘Exit Strategies’] in Inflammatory Bowel Disease. J Crohns Colitis 2018;12:17-31.
65. American Gastroenterological Association Clinical Practice C. American Gastroenterological Association medical position statement: perianal Crohn’s disease. Gastroenterology 2003;125:1503-7.
66. Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med 1999;340:1398-405.
67. Colombel JF, Schwartz DA, Sandborn WJ, et al. Adalimumab for the treatment of fistulas in patients with Crohn’s disease. Gut 2009;58:940-8.
68. Yarur AJ, Kanagala V, Stein DJ, et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease. Aliment Pharmacol Ther 2017;45:933-940.
69. Reinisch W, Colombel JF, D’Haens GR, et al. OP18 Efficacy and safety of filgotinib for the treatment of perianal fistulizing Crohn’s Disease: Results from the phase 2 DIVERGENCE 2 study. Journal of Crohn’s and Colitis 2022;16:i019-i021.
70. Panes J, Garcia-Olmo D, Van Assche G, et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016;388:1281-90.
71. Garcia-Olmo D, Gilaberte I, Binek M, et al. Follow-up Study to Evaluate the Long-term Safety and Efficacy of Darvadstrocel (Mesenchymal Stem Cell Treatment) in Patients With Perianal Fistulizing Crohn’s Disease: ADMIRE-CD Phase 3 Randomized Controlled Trial. Dis Colon Rectum 2022;65:713-720.
72. Panes J, Bouma G, Ferrante M, et al. INSPECT: A Retrospective Study to Evaluate Long-term Effectiveness and Safety of Darvadstrocel in Patients With Perianal Fistulizing Crohn’s Disease Treated in the ADMIRE-CD Trial. Inflamm Bowel Dis 2022;28:1737-1745.
73. Wu JF. Therapeutic Drug Monitoring of Biologics for Patients with Inflammatory Bowel Diseases: How, When, and for Whom? Gut Liver 2022;16:515-524.
74. Vermeire S, Sands BE, Tilg H, et al. ABX464 (obefazimod) for moderate-to-severe, active ulcerative colitis: a phase 2b, double-blind, randomised, placebo-controlled induction trial and 48 week, open-label extension. Lancet Gastroenterol Hepatol 2022;7:1024-1035.
75. Apolit C, Campos N, Vautrin A, et al. ABX464 (Obefazimod) Upregulates miR-124 to Reduce Proinflammatory Markers in Inflammatory Bowel Diseases. Clin Transl Gastroenterol 2023;14:e00560.
76. Feagan BG, Sands BE, Sandborn WJ, et al. Guselkumab plus golimumab combination therapy versus guselkumab or golimumab monotherapy in patients with ulcerative colitis (VEGA): a randomised, double-blind, controlled, phase 2, proof-of-concept trial. Lancet Gastroenterol Hepatol 2023;8:307-320.
77. Danese S, Solitano V, Jairath V, et al. The future of drug development for inflammatory bowel disease: the need to ACT (advanced combination treatment). Gut 2022;71:2380-2387.
78. Bhamidipati K, Wei K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol 2022;36:101742.
79. You S, Koh JH, Leng L, et al. The Tumor-Like Phenotype of Rheumatoid Synovium: Molecular Profiling and Prospects for Precision Medicine. Arthritis Rheumatol 2018;70:637-652.
Therapeutische Umschau
- Vol. 80
- Ausgabe 9
- Dezember 2023