- Extraintestinale Manifestationen bei chronisch entzündlichen Darmkrankheiten
Bei chronisch entzündlichen Darmkrankheiten (CED) treten entzündliche Veränderungen nicht nur im Gastrointestinaltrakt auf, sondern es können auch verschiedene andere Organsysteme mit betroffen sein. Ein Befall ausserhalb des Gastrointestinaltraktes wird extraintestinale Manifestation (EIM) genannt und macht die CED zu einer Systemkrankheit. Die häufigsten EIM beinhalten muskuloskeletale, ophthalmologische, dermatologische und hepatobiliäre Erkrankungen. Es können prinzipiell jedoch alle Organsysteme betroffen sein. Diese tragen signifikant zur Morbidität von Patienten mit CED bei und schränken die Lebensqualität deutlich ein. Die Betreuung sollte aufgrund der Vielfalt der betroffenen Organsysteme durch ein interdisziplinäres Team erfolgen. Ein frühes Erkennen von EIM ermöglicht eine gezielte Therapie und verringert die Gesamtmorbidität der betroffenen Patienten. Wichtig ist die Tatsache, dass solche EIM bei bis zu 25% aller CED-Patienten vor dem Auftreten des ersten Schubes auftreten können. Deshalb sollten insbesondere Hausärzte, aber auch alle anderen Ärzte inklusive Dermatologen, Ophthalmologen und auch Rheumatologen bei EIM und gleichzeitigem Auftreten von Darmsymptomen an diese mögliche Assoziation denken.
Einleitung
Chronisch entzündliche Darmkrankheiten (CED) beinhalten die beiden Hauptkrankheiten Morbus Crohn und die Colitis ulcerosa. Die CED manifestiert sich normalerweise zwischen dem 20. und 30. Lebensjahr, sie kann aber einerseits bei sehr jungen Patienten als auch im späteren Alter auftreten (1). Die Colitis ulcerosa ist etwas häufiger als der Morbus Crohn. Sowohl der Morbus Crohn als auch die Colitis ulcerosa treten in Nordeuropa und Nordamerika deutlich häufiger auf als in anderen Regionen der Welt. Beide Krankheiten werden jedoch auch zunehmend in Regionen wie Asien und Afrika diagnostiziert. Der Morbus Crohn und die Colitis ulcerosa haben viele Gemeinsamkeiten, sie unterscheiden sich aber auch in wesentlichen Punkten: einerseits kann die Entzündung beim Morbus Crohn im gesamten Gastrointestinaltrakt angetroffen werden (jedoch bevorzugt am Übergang vom terminalen Ileum zum Zökum). Zudem ist die Entzündung transmuraler Natur und teilweise mit Granulomen in der Histologie assoziiert. Diese Granulome sind zwar pathognomonisch, werden aber eher selten in Biopsien gefunden. Deshalb ist die Diagnosestellung für den Pathologen immer wieder eine Herausforderung. Für die Diagnose eines Morbus Crohn werden verschiedene Faktoren zusammengezogen wie die Klinik, die Lokalisation der Entzündung (dargestellt in Endoskopien oder in Bildgebungen), die Histologie und das Labor (2). Demgegenüber ist die Entzündung bei der Colitis ulcerosa auf die Mukosa des Dickdarmes beschränkt und weist eine vom Rektum ausgehende kontinuierliche Ausbreitung nach proximal aus. Man unterscheidet drei Formen der Colitis ulcerosa, nämlich die Proktitis, die linksseitige Kolitis und die Pankolitis (3).
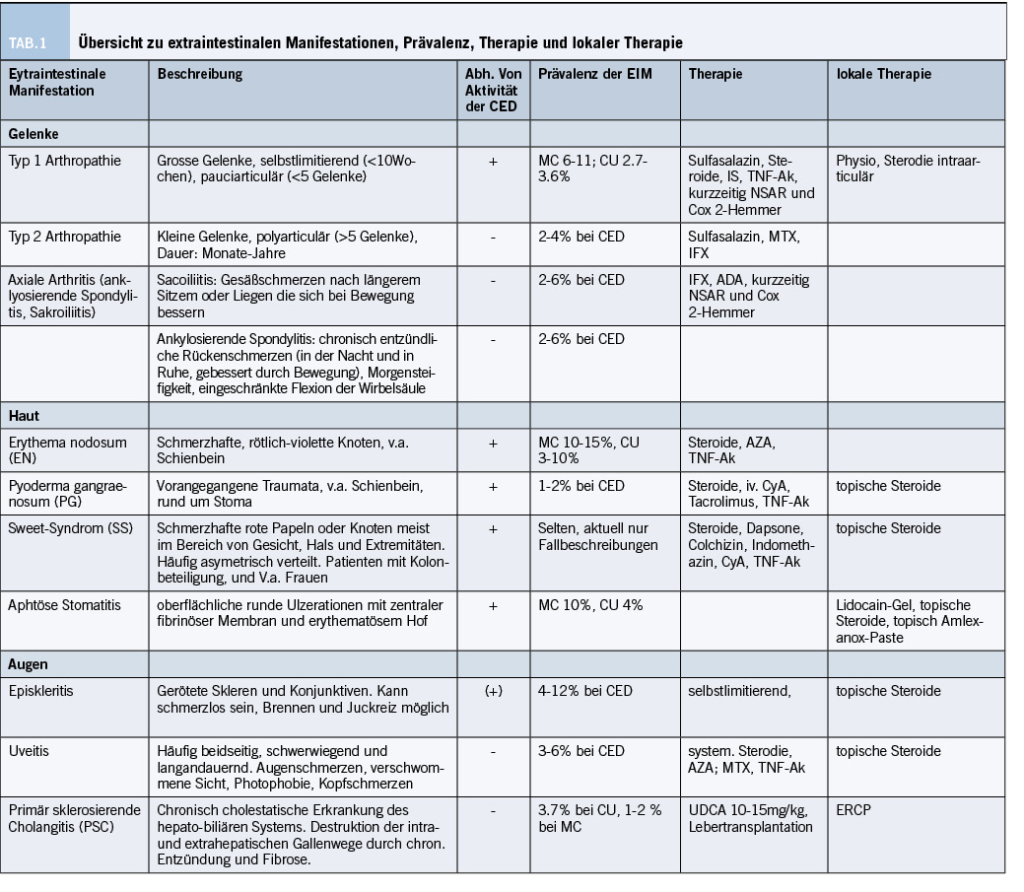
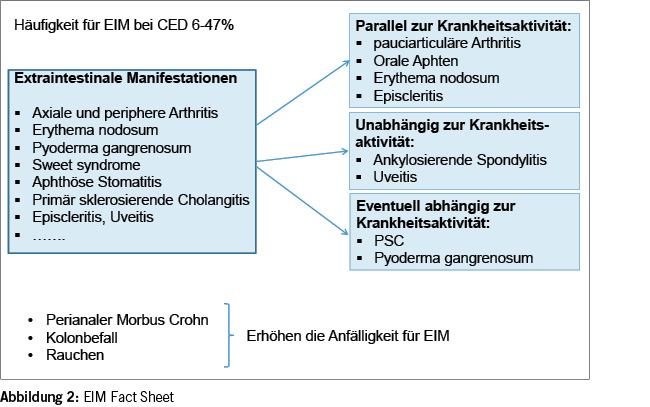
Bei den CED können neben dem Gastrointestinaltraktes auch andere Organsysteme befallen sein. Diese Manifestationen werden dann extraintestinale Manifestation (EIM) genannt und macht die CED zu einer Systemkrankheit. Die häufigsten EIM beinhalten rheumatologische (zum Beispiel axiale Arthropathie, periphere Arthropathie), ophthalmologische (Uveitis, Episkleritis), dermatologische (Erythema nodosum und Pyoderma gangraenosum) und hepato-biliäre Erkrankungen (primär sklerosierende Cholangitis). Es können prinzipiell jedoch alle Organsysteme betroffen sein. Die extraintestinalen Manifestationen werden bei 6 – 47% der Patienten mit chronisch entzündlichen Darmkrankheiten beschrieben. Das Auftreten von extraintestinalen Manifestationen kann wesentlich zur Morbidität und Mortalität bei Patienten mit chronisch entzündlichen Darmkrankheiten beitragen (4-7). Eine Zusammenfassung der wichtigsten extraintestinalen Manifestationen, der Prävalenz und der (lokalen) Therapien findet sich in Tabelle 1.
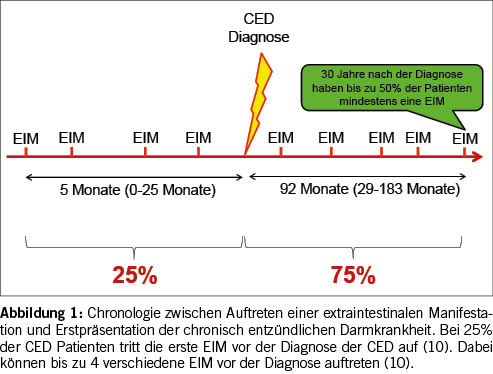
Die Diagnose von Morbus Crohn und Colitis ulcerosa wird in der Schweiz leider immer noch viel zu spät gestellt. In einer in der Schweiz durchgeführten Studie – der sogenannten „Schweizerischen IBD Kohortenstudie“ – wurde die diagnostische Verzögerung bei Morbus Crohn und Colitis ulcerosa-Patienten untersucht (8). Im Durchschnitt vergehen zwischen dem Auftreten der ersten Symptome bis zur Diagnose der Krankheit bei Morbus Crohn 9 Monate und bei der Colitis ulcerosa 4 Monate. Die Diagnose der Colitis ulcerosa erfolgt schneller, da diese sich initial häufiger mit dem Alarmsymptom Blut im Stuhl präsentiert. Morbus Crohn-Patienten auf der anderen Seite klagen eher über abdominale Schmerzen und Durchfälle. Die verzögerte Diagnosestellung kann aber auch sehr lang sein. Bei einem Viertel der Patienten mit Morbus Crohn dauert es über 24 Monate bis zur Diagnose und bei einem Viertel der Colitis ulcerosa-Patienten mehr als 12 Monate. Die verzögerte Diagnosestellung kann relevant sein. In einer Studie der Schweizerischen IBD-Kohorte konnte nämlich gezeigt werden, dass bei Patienten mit einer verzögerten Diagnosestellung häufiger Komplikationen im weiteren Verlauf auftreten können (9). Diese diagnostische Verzögerung von chronisch entzündlichen Darmkrankheiten ist auch deshalb wichtig, weil sich teilweise vor der Diagnose der chronisch entzündlichen Darmkrankheit bereits bei Patienten extraintestinale Manifestationen zeigen können (Abbildung 1). So können bei einem Viertel der Patienten bereits mehrere extraintestinale Manifestationen auftreten, bevor die Diagnose der chronisch entzündlichen Darmkrankheit gestellt wird (10). Deshalb ist es wichtig, dass bei Auftreten solcher Manifestationen in der hausärztlichen aber auch in der dermatologischen, ophthalmologischen und rheumatologischen Praxis an die Differenzialdiagnosen eines Morbus Crohn oder einer Colitis ulcerosa gedacht wird. Dies insbesondere bei gleichzeitigem Auftreten von Durchfällen oder abdominellen Schmerzen mit der extraintestinalen Manifestation.
Extraintestinale Manifestationen und Komplikationen
Typische CED-assoziierte extraintestinale Manifestationen befallen vor allem die Gelenke, die Augen, die Haut oder die Leber. Diese können entweder parallel zur Darmentzündung verlaufen (z. Bsp. periphere Arthritis, Erythema nodosum, orale Aphten) oder aber unabhängig davon (Pyoderma gangraenosum, Uveitis, Spondylarthropathien und primär sklerosierende Cholangitis). Vergleiche hierzu auch Abbildung 2 (EIM FACTS sheet). Weitere seltenere extraintestinale Manifestationen beinhalten nicht CED-spezifische autoimmune Krankheiten wie z. Bsp. Schilddrüsenkrankheiten, hämolytische Anämie, Vitiligo und insulinabhängiger Diabetes mellitus, welche bei CED-Patienten gehäuft vorkommen. Es können aber auch Komplikationen von chronisch entzündlichen Darmkrankheiten auftreten wie z. Bsp. Osteopathien, Nephrolithiasis oder thromboembolische Ereignisse. Diese werden nicht zu den klassischen EIMs gezählt. Die meisten Patienten mit Morbus Crohn und Colitis ulcerosa, welche an einer solchen extraintestinalen Manifestation leiden, zeigen einen extensiven Befall des Kolons und haben häufig auch eine positive Familienanamnese für chronisch entzündliche Darmkrankheiten. Im Folgenden werden die typischen EIM behandelt.
Rheumatologische extraintestinale Manifestationen bei chronisch entzündlichen Darmkrankheiten
Wie vorgängig erwähnt, werden verschiedene rheumatologische extraintestinale Manifestationen bei Patienten mit chronisch entzündlichen Darmkrankheiten beschrieben. Die Europäische Morbus Crohn und Colitis ulcerosa Vereinigung (ECCO) hat hierzu soeben eine neue Guideline veröffentlicht (11).
Arthritis und Arthropathie
Es werden die i) nicht-axiale und die ii) axiale Arthritis unterschieden.
Nicht-axiale Arthritis: Die Diagnose einer mit chronisch entzündlichen Darmkrankheit-assoziierten nicht axialen Arthritis und Arthropathie ist eine klinische Diagnose, die sich auf charakteristische Eigenschaften stützt nach Ausschluss anderer spezifischer Formen der Arthritis. Eine Einteilung wurde durch die Oxfordgruppe vorgeschlagen, die jedoch nicht immer den im klinischen Alltag widerspiegelt (12). Die Unterscheidung wird durch die Unterschiede der genetischen Dispositionen gestützt. Der Typ I ist eine akute, selbstlimitierende (Dauer <10 Wochen), pauciarticuläre (<5 Gelenke betreffend) Arthropathie der grossen Gelenke. Die betroffenen Gelenke entsprechen vor allem die Gewicht-tragenden Gelenke einschliesslich Knöchel, Knie, Hüfte, Handgelenke, Ellenbogen und Schultern. In der klinischen Untersuchung präsentieren sich schmerzhafte empfindliche geschwollene Gelenke. Solange keine alternative Diagnose vermutet wird, ist eine Aspiration von Gelenksflüssigkeit nicht notwendig. Als Differenzialdiagnose kommen unter anderem Osteoarthritis, septische Arthritis, Pyrophosphatarthropathie, eine gleichzeitige rheumatoide Arthritis oder gelegentlich Gicht infrage. Wenn nur ein Hüftgelenk betroffen ist, sollte die Steroid-induzierte Osteonekrose differenzialdiagnostisch in Erwägung gezogen werden.
Der Typ II hingegen ist eine polyartikuläre Arthropathie und betrifft die kleinen Gelenke. Die Symptome können für Monate bis Jahre persistieren. Während der Typ I im Rahmen der Aktivität der CED auftritt, ist der Typ II größtenteils unabhängig von der zugrunde liegenden CED (12). Die Prävalenz der nicht-axialen Typ II Arthritis beträgt 2-4% bei Patienten mit CED. Häufig sind die kleinen Gelenke beider Hände im Sinne einer symmetrischen Arthropathie befallen. Die Schmerzen sind in der Regel nicht proportional zu den Zeichen der Arthritis. Sie besteht im Allgemeinen für Monate oder Jahre und steht nicht im Zusammenhang mit Aktivität der chronisch entzündlichen Darmerkrankung. Sie kann nach einer Kolektomie bestehen bleiben und auch nach einer Ileopouchanastomose beginnen. Als Differenzialdiagnose kommen die Osteoarthritis aber auch Nebenwirkungen der Therapie wie der Steroid-induzierte Pseudorheumatismus, welcher nach einem Absetzen nach langjähriger Steroidtherapie häufig auftritt, (Mesalazin, Azathioprin-induzierte Arthropathien oder ein durch Infliximab hervorgerufenes Lupus-ähnliches Syndrom) infrage.
Axiale Arthritis: Zu der axialen Arthritis werden die Sakroiliitis und die ankylosierende Spondylitis gezählt. Beide Krankheiten treten bei 2 bis 6% der Patienten mit CED auf (13). Die axiale Arthritis tritt häufiger bei Morbus Crohn Patienten auf. Zudem sind Frauen und Patienten mit einer Kolonbeteiligung häufiger betroffen (4, 12, 14). Die axiale Arthritis wird mittels konventioneller rheumatologischer Diagnostik gestellt und wird durch charakteristische radiologische Veränderungen gestützt, wobei die Magnetresonanztomographie am sensitivsten ist. Obwohl HLA-B27 bei der Colitis ulcerosa und Morbus Crohn-assoziierten axialen Arthritis überrepräsentiert ist, hat es keinen diagnostischen Wert.
Sacroiliitis: Eine asymptomatische Sacroiliitis ist bei bis zu 50% der IBD-Patienten radiologisch nachweisbar. Eine symptomatische Sacroiliitis ist durch Gesässschmerzen nach längerem Sitzen oder Liegen, die sich bei Bewegung verbessern, gekennzeichnet. Hinweisend können bei der klinischen Untersuchung Schmerzen bei beidseitigem Druck auf das Becken sein.
Ankylosierende Spondylitis: Gemäss den modifizierten Rom-Kriterien ist die ankylosierende Spondylitis durch chronisch entzündliche Rückenschmerzen (in der Nacht und in Ruhe gebessert durch Bewegung), Morgensteifigkeit, eingeschränkte Flexion der Wirbelsäule und in späteren Stadien eine reduzierte Ausdehnung des Thorax gekennzeichnet. Meist treten diese Symptome vor dem 30. Lebensjahr auf. Konventionelle radiologische Aufnahmen sind in frühen Stadien der Erkrankung meist unauffällig. Spinale computertomographische Aufnahmen sind sensitiver als konventionelle Röntgenaufnahmen. Der Goldstandard ist jedoch die Magnetresonanztomographie, in welcher entzündliche Veränderungen nachgewiesen werden können, noch bevor Knochenläsionen auftreten. In fortgeschrittenen Stadien können Blockwirbel, randständige Syndesmophyten und Knochenproliferationen mit Ankylos auftreten. Durch diese Veränderungen entsteht dann die sogenannte „Bambuswirbelsäule“. Eine Assoziation mit HLA-B27 ist bei bis zu 75% der Patienten mit axialer Arthritis nachweisbar. Diese Assoziation ist jedoch nicht so häufig wie bei Patienten mit ankylosierender Spondylitis ohne zugrundeliegende chronisch entzündliche Darmerkrankung. HLA-B27 positive Patienten scheinen ein erhöhtes Risiko zu tragen eine ankylosierende Spondylositis zu entwickeln. Die axiale Arthropathie besteht unabhängig von spezifischen Genen der chronisch entzündlichen Krankheiten wie z. Bsp. das NOD-Gen.
Die Behandlung einer mit CED assoziierten Arthritis und Arthropathie ist hauptsächlich empirisch und sollte sich am Schweregrad der Symptome und der Assoziation mit der Aktivität der zugrundeliegenden CED orientieren. Die Behandlung der Typ I Arthritis orientiert sich an der Behandlung der zugrundeliegenden CED, da der Krankheitsverlauf eng mit der Aktivität dieser verknüpft ist. Zur Verwendung kommen Steroide, Immunmodulatoren und TNF-Antikörpertherapien (15, 16). Da diese Form der Arthritis selbstlimitierend ist, zeigen sich die Symptome meist nach spätestens 10 Wochen rückläufig (12). Zur Linderung der Symptome kommen zusätzlich Physiotherapie und Ruhigstellung zur Anwendung. Als analgetische Therapie kommen COX-2 Inhibitoren (und NSAR) zum Einsatz. Es ist zu beachten, dass insbesondere NSAR, wenn überhaupt, nur über einen kurzen Zeitraum verwendet werden sollen, da NSAR einen Schub der CED auslösen können (17). Zusätzlich können Sulfasalazine zu einer Verbesserung der Symptome führen (18). Symptomatische Schmerzlinderung kann durch Ruhe und Physiotherapie erreicht werden. Des Weiteren kann eine Steroidinjektion in die am stärksten betroffenen Gelenke versucht werden, was jedoch meist nur eine temporäre Linderung der Beschwerden verschafft.
Da die Symptome bei der Typ II Arthritis über Jahre persistieren können ist häufig eine Langzeitbehandlung indiziert. Zur Verwendung kommt Sulfasalazin oder auch bei schwereren Verlaufsformen Methotrexat (MTX) und systemische Steroide. In einigen Studien konnte auch ein beeindruckender Effekt einer TNF-Hemmer Therapie mit Infliximab (IFX) gezeigt werden (19, 20).
Bei der Behandlung der axialen Arthritis spielt intensive Physiotherapie eine entscheidende Rolle. Die Hauptstützen der medikamentösen Therapie bleiben jedoch NSAR (die aber restriktiv eingesetzt werden sollen) (15). Sulfasalazin, Methotrexat und Azathioprine sind nur mässig effektiv bei der ankylosierenden Spondylitis (AS) mit axialer Symptomatik. In therapierefraktären Fällen können TNF-Antikörper eingesetzt werden (21).
Dermatologische extraintestinale Manifestationen
Die Prävalenz von verschiedenen Hautbeteiligungen im Rahmen einer CED wird zwischen 2-34% angegeben (22). Die Diagnose einer Hautmanifestation bei CED ist eine klinische Diagnose, basierend auf ihren charakteristischen klinischen Merkmalen und dem Ausschluss anderer spezifischer Hauterkrankungen (11). Die häufigsten Hautbeteiligungen umfassen Erythema nodosum, Pyoderma gangraenosum und die aphtöse Stomatitis.
Erythema nodosum: Das Erythema nodosum tritt meist während aktiver Phasen der CED auf und ist durch schmerzhafte, erhabene rötlich-violette Knoten häufig im Bereich der Schienbeine charakterisiert. Patienten mit Morbus Crohn (10-15%) sind häufiger betroffen als solche mit Colitis ulcerosa (3-10%) (11, 23, 24). Bei der Therapie des Erythema nodosum steht die Behandlung der zugrundeliegenden CED im Vordergrund. Dabei kommen Steroide zum Einsatz, in schwereren oder bei steroidrefraktären Fällen kann eine immunmodulatorische Therapie oder eine TNF-Hemmer Therapie mit Infliximab oder Adalimumab, allein oder in Kombination, diskutiert werden (11).
Pyoderma ganrenosum: Den Hautläsionen des Pyoderma gangraenosum geht häufig ein Trauma voraus, welches auch viele Jahre zurückliegen kann. Das Pyoderma gangrenosum kann am ganzen Körper auftreten, meist, wie auch im Falle des Erythema nodosum, im Bereich der Schienbeine oder auch an angrenzenden Bereichen von Stomata. Es ist eine Ausschlussdiagnose und wird womöglich häufig fehldiagnostiziert. Das Pyoderma gangrenosum ist mit 1-2% bei sowohl Morbus Crohn als auch Colits ulcerosa deutlich seltener anzutreffen als das EN. Da das Pyoderma gangraenosum invalidisierend sein kann, sollte das primäre therapeutische Ziel eine schnelle Heilung sein. Kern der Behandlung ist eine effektive Immunsuppression. Am häufigsten kommen dabei hoch-dosierte systemische Steroide zum Einsatz (0.5-2 mg/kg/d). Bei steroidrefraktären Fällen werden intravenöses Ciclosporin oder Tacrolimus verwendet (11, 25, 26, 27). Seit der Einführung einer TNF-hemmenden Therapie mit Infliximab haben sich neue Möglichkeiten für eine effektive Therapie des Pyoderma gangrenosum ergeben. In einer ersten multicenter, randomisierten, placebokontrollierten Studie liess sich ein klinisches Ansprechen von insgesamt 69% nach 4 und 6-wöchiger Behandlung mit 5mg/kg intravenösem IFX erreichen, 21% waren bei Woche 6 in kompletter Remission (27).
Aphtöse Stomatitis: Die aphtöse Stomatitis ist bei 10% der Morbus Crohn und 4% der Colitis ulcerosa Patienten anzutreffen, in einer schweizer Kohortenstudie war sie mit einer Gesamtprävalenz von 7.4% die zweithäufigst anzutreffende EIM (4). Bei der aphtösen Stomatitis kann eine Behandlung der CED erfolgreich sein. Zur symptomatischen Therapie kann 2% Lidocain-Gel verwendet werden. Zusätzlich kann eine topische Steroidtherapie mit 0.1% Triamcinolon-Paste oder 0.5mg/5ml Dexamethason-Mundspülung oder auch eine topische anti-entzündliche Therapie mit 5% Amlexanox-Paste zu einer verbesserten Heilung führen (28).
Sweet Syndrom: Das Sweet-Syndrom wird in einigen Arbeiten ebenfalls als EIM bei CED beschrieben (29, 30). Es gehört zu den akuten neutrophilen Dermatosen zu welchen auch das PG zählt, es kann jedoch durch das Aussehen, die Verteilung und die histologischen Merkmale unterschieden werden. Es besteht eine Prädilektion für Patienten mit einer Kolonbeteiligung (100%), Patienten mit anderen EIM (77%) und Frauen (87%). Die Hautveränderungen gehen meist (67-80%) mit aktiver Krankheitsaktivität ein her, jedoch können diese auch in 21% den intestinalen Symptomen vorausgehen (22). Beim Sweet-Syndrom sind in der Literatur diverse Therapieoptionen beschrieben (u.a. Prednisone p.o., Methylprednisolone i.V., Dapson, Colchizin, Indemethacin, Cyclosporin, TNF-Hemmer, topische Steroide). Als primäre Therapie gelten die topische und systemische Therapie mit Steroiden (0.5-1 mg/kg/d) (31).
Ophtalmologische extraintestinale Manifestationen
Bei Patienten mit CED kann es im Verlauf der Erkrankung in 4-12% zu einer Augenbeteiligung kommen (32). Am häufigsten sind dabei die Episkleritis und die Uveitis anzutreffen. Die Häufigkeit wird in verschiedenen Kohortenstudien bei MC, als auch bei CU, mit 3-6% angegeben (14, 33). In einer kürzlich durchgeführten Schweizer Kohortenstudie zeigte sich eine Prävalenz der Uveitis von 4% bei CU und 6% bei MC Patienten (4). Die Uveitis tritt in Verbindung mit einer CED häufig beidseitig auf und kann sehr langdauernd sein und ist durch verschwommene Sicht, Photophobie, Augen- und Kopfschmerzen gekennzeichnet. Die Episkleritis äußert sich meist durch hyperämische Skleren und ist meist schmerzlos. Die Diagnose kann erst nach Ausschluss einer Uveitis gestellt werden. Als Komplikation eines chronischen Steroidgebrauchs kann es bei bis zu 25% der Patienten die eine Steroiddosis von ≥15mg Prednison über einen Zeitraum von einem Jahr erhalten zu einem posterioren subkapsulärem Katarakt kommen, weshalb bei Patienten mit einer Langzeit-Steroidtherapie regelmäßige ophthalmologische Kontrollen stattfinden sollten (11).
Die Episkleritis ist meist selbstlimitierend und muss für gewöhnlich nicht spezifisch behandelt werden. Im Vordergrund stehen eine Behandlung der zugrundeliegenden CED zusammen mit einer Analgesie und topische Steroide (32). Bei der Gabe von topischen Steroiden muss streng auf die mögliche Entwicklung von Infektionen, Ulzerationen und Uveitiden geachtet werden.
Bei der Uveitis handelt es sich im Vergleich zur Episkleritis aufgrund des potentiellen Risikos eines Sehverlustes um einen ophthalmologischen Notfall. Die Therapie umfasst üblicherweise eine Kombination aus topischen und systemischen Steroiden. Azathioprin, Methotrexat und TNF-Hemmer sind therapierefraktären Fällen vorbehalten (11).
Hepatobiliäre extraintestinale Manifestationen
Die primär sklerosierende Cholangitis (PSC) ist eine seltene, chronische cholestatische Erkrankung des hepato-biliären Systems bei der es zu einer Destruktion der intra- und extrahepatischen Gallenwege durch chronische Entzündung und Fibrose kommt. Sie kann unbehandelt zu Leberversagen und Tod führen. Die PSC ist mit einem 10-20% Lebenszeitrisiko verbunden ein cholangiozelluläres Karzinom zu entwickeln (34). Ein erster Zusammenhang zwischen PSC und IBD wurde erstmals 1965 beschrieben (35). In einer schwedischen Kohorte von 1500 Patienten mit Colitis ulcerosa liess sich eine PSC-Prävalenz von 3.7%, in einer ungarischen Kohorte eine Prävalenz von 1.6% der CU Patienten nachweisen. 70% der Patienten mit PSC leiden an einer CU. Für Morbus Crohn sind niedrigere Prävalenzen von 1-2% beschrieben (4, 14, 18, 36).
In der Vergangenheit wurden verschiedenste Therapieoptionen für die PSC evaluiert. Obwohl der Nutzen nicht gesichert ist, ist aktuell die Therapie der Wahl eine Behandlung mit Ursodeoxycholsäure (UDCA). Es wird in einer üblichen Dosierung von 10-15mg/kg angewendet.
In einer kürzlich durchgeführten Meta-Analyse zeigten sich jedoch keine Hinweise für eine Reduktion des Adenom- oder Kolonkarzinomrisikos durch Anwendung von UDCA (37). Ob eine Hochdosis-UDCA Therapie einen Vorteil gegenüber einer niedrigen Dosierung hat, wird kontrovers diskutiert (34). Es konnte sogar ein erhöhtes Risiko für die Entwicklung einer kolorektalen Neoplasie bei Patienten mit CU und PSC mit hochdosierter UDCA-Therapie nachgewiesen werden (38). Aktuell gibt es keinen sicheren Hinweis für den Nutzen einer TNF-hemmenden Therapie mit Infliximab oder Adalimumab auf den Krankheitsverlauf einer PSC (39). Auch für die Anwendung von weiteren Therapioptionen (z.B. Steroide, Cyclosporin, Tacrolimus, Methotrexat) gibt es nur limitierte klinische Erfahrung mit Verbesserung der Leberwerte, aber ohne sichere Hinweise für eine histologische Verbesserung (6). Eine endoskopische Therapie von dominanten Strikturen kann den langfristigen Verlauf positiv beeinflussen, zusätzlich kann eine orthotrope Lebertransplantation ein gutes outcome bei Patienten mit einer PSC im Endstadium ermöglichen (40).
Zusammenfassung
Morbus Crohn und Colitis ulcerosa, sind chronisch entzündliche Erkrankungen, welche nicht auf den Gastrointestinaltrakt beschränkt sind. Zusätzlich können diverse Organsysteme mitbetroffen sein, was die CED zu einer Systemerkrankung macht. Ein frühes Erkennen von EIM ermöglicht eine gezielte Therapie und verringert die Gesamtmorbidität der betroffenen Patienten. Insbesondere kann eine effektive Erhaltungstherapie das Auftreten von EIM welche eng mit der Krankheitsaktivität der zugrundliegenden CED verknüpft sind vermeiden. Bei den Behandlungsstrategien kann vermehrt auf eine Vielzahl von randomisiert-kontrollierten Studien zurückgegriffen werden. Des Weiteren existieren Erfahrungen in der Behandlung von Patienten, die nicht an einer CED leiden. Neben spezifischen Interventionen bei EIM welche nicht mit der Krankheitsaktivität der CED verknüpft sind spielt eine anti-inflammatorische oder immunmodulatorische Therapie eine entscheidende Rolle. Zudem gewinnt die Verwendung einer TNF-Hemmer Therapie in der Behandlung von verschiedenen EIM zunehmend an Bedeutung. Extraintestinale Manifestationen sind häufig und bei bis zu 50% der Patienten mit chronisch entzündlichen Darmkrankheiten anzutreffen. Bis zu einem Viertel dieser extraintestinalen Manifestationen treten vor der Diagnose der chronisch entzündlichen Darmkrankheit auf. Unter der Berücksichtigung der langen diagnostischen Verzögerung der chronisch entzündlichen Darmkrankheiten ist es wichtig, dass behandelnde Ärzte sich dieser Assoziation und dieser Chronologie bewusst werden.
Facharzt für Innere Medizin und Gastroenterologie FMH
Zentrum für Gastroenterologie und Hepatologie
Vulkanplatz 8
8048 Zürich
stephan.vavricka@hin.ch
Der Autor hat keine Interessenkonflikte.
1. Abraham C, Cho JH. Inflammatory bowel disease. N Engl J Med. 2009; 361: 2066–78.
2. Torres J, Bonovas S, Doherty G, Kucharzik T, Gisbert JP, Raine T, Adamina M, Armuzzi A, Bachmann O, Bager P, Biancone L, Bokemeyer B, Bossuyt P, Burisch J, Collins P, El-Hussuna A, Ellul P, Frei-Lanter C, Furfaro F, Gingert C, Gionchetti P, Gomollon F, González-Lorenzo M, Gordon H, Hlavaty T, Juillerat P, Katsanos K, Kopylov U, Krustins E, Lytras T, Maaser C, Magro F, Marshall JK, Myrelid P, Pellino G, Rosa I, Sabino J, Savarino E, Spinelli A, Stassen L, Uzzan M, Vavricka S, Verstockt B, Warusavitarne J, Zmora O, Fiorino G. ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment. J Crohns Colitis. 2020 Jan 1;14(1):4-22. doi: 10.1093/ecco-jcc/jjz180.
3. Raine T, Bonovas S, Burisch J, Kucharzik T, Adamina M, Annese V, Bachmann O, Bettenworth D, Chaparro M, Czuber-Dochan W, Eder P, Ellul P, Fidalgo C, Fiorino G, Gionchetti P, Gisbert JP, Gordon H, Hedin C, Holubar S, Iacucci M, Karmiris K, Katsanos K, Kopylov U, Lakatos PL, Lytras T, Lyutakov I, Noor N, Pellino G, Piovani D, Savarino E, Selvaggi F, Verstockt B, Spinelli A, Panis Y, Doherty G. ECCO Guidelines on Therapeutics in Ulcerative Colitis: Medical Treatment. J Crohns Colitis. 2022 Jan 28;16(1):2-17. doi: 10.1093/ecco-jcc/jjab178.
4. Vavricka SR, Schoepfer A, Scharl M, Lakatos PL, Navarini A, Rogler G. Extraintestinal Manifestations of Inflammatory Bowel Disease.Inflamm Bowel Dis. 2015;21:1982-92.
5. Vavricka SR, Scharl M, Gubler M, Rogler G. Biologics for extraintestinal manifestations of IBD. Curr Drug Targets. 2014; 15:1064-73.
6. Lakatos PL, Lakatos L, Kiss LS, Peyrin-Biroulet L, Schoepfer A, Vavricka S. Treatment of extraintestinal manifestations in inflammatory bowel disease. Digestion. 2012;86 Suppl 1:28-35.
7. Vavricka SR, Brun L, Ballabeni P, Pittet V, Prinz Vavricka BM, Zeitz J, Rogler G, Schoepfer AM. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. Am J Gastroenterol. 2011; 106:110-9.
8. Vavricka SR, Spigaglia SM, Rogler G, Pittet V, Michetti P, Felley C, et al. Systematic evaluation of risk factors for diagnostic delay in inflammatory bowel disease. Inflamm Bowel Dis. 2012; 18:496–505.
9. Schoepfer AM, Dehlavi MA, Fournier N, Safroneeva E, Straumann A, Pittet V, et al. Diagnostic delay in Crohn’s disease is associated with a complicated disease course and increased operation rate. Am J Gastroenterol. 2013; 108:1744–53.
10. Vavricka SR, Rogler G, Gantenbein C, Spoerri M, Prinz Vavricka M, Navarini AA, et al. Chronological order of appearance of extraintestinal manifestations relative to the time of IBD diagnosis in the Swiss Inflammatory Bowel Disease Cohort. Inflamm Bowel Dis. 2015, May 27th, epub.
11. Gordon H, Burisch J, Ellul P, Karmiris K, Katsanos K, Allocca M, Bamias G, Barreiro-de Acosta M, Braithwaite T, Greuter T, Harwood C, Juillerat P, Lobaton T, Müller-Ladner U, Noor N, Pellino G, Savarino E, Schramm C, Soriano A, Stein JM, Uzzan M, van Rheenen PF, Vavricka SR, Vecchi M, Zuily S, Kucharzik T. ECCO Guidelines on Extraintestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis. 2023 Jun 23: jjad108. doi: 10.1093/ecco-jcc/jjad108. Online ahead of print.
12. Orchard, T.R., B.P. Wordsworth, and D.P. Jewell, Peripheral arthropathies in inflammatory bowel disease: their articular distribution and natural history. Gut, 1998. 42(3): p. 387-91.
13. Russell, A.S., Arthritis, inflammatory bowel disease, and histocompatibility antigens. Annals of internal medicine, 1977. 86(6): p. 820-1.
14. Lakatos, L., et al., Association of extraintestinal manifestations of inflammatory bowel disease in a province of western Hungary with disease phenotype: results of a 25-year follow-up study. World journal of Gastroenterology: WJG, 2003. 9(10): p. 2300-7.
15. V Hedin CRH, Vavricka SR, Stagg A, Schoepfer A, Raine T, Puig L, Pleyer U, Navarini A, van der Meulen A, Maul J, Katsanos K, Kagramanova A, Greuter T, Gonzalez Lama Y, van Gaalen F, Ellul P, Burisch J, Bettenworth D, Becker MD, Bamias G, Rieder F. The Pathogenesis of Extraintestinal Manifestations: Implications for IBD research, diagnosis and therapy. J Crohns Colitis. 2018 Nov 15. doi: 10.1093/ecco-jcc/jjy191.
16. Guillo L, Abreu M, Panaccione R, Sandborn WJ, Azevedo VF, Gensler L, Moghaddam B, Ahuja V, Ali SA, Allez M, Ananthakrishnan AN, Bhattacharya A, Dubinsky M, Griffiths A, Hart A, Korelitz B, Kotze PG, Koutroubakis IE, Lakatos PL, Lindsay JO, Magro F, Mantzaris GJ, Ng SC, O’Morain C, Panés J, Parigi T, Ran Z, Rogler G, Rubin DT, Sachar DB, Siegmund B, Steinwurz F, Tysk C, Vavricka S, Verstraete SG, Brezin AP, Haemel AK, Dignass A, Sands BE, Danese S, Peyrin-Biroulet L. Endpoints for extraintestinal manifestations in inflammatory bowel disease trials: the EXTRA consensus from the International Organization for the Study of Inflammatory Bowel Diseases. Lancet Gastroenterol Hepatol. 2022 Mar;7(3):254-261. doi: 10.1016/S2468-1253(21)00297-1. Epub 2022 Jan 17. PMID: 35051383 Singh, S., L.A. Graff, and C.N. Bernstein, Do NSAIDs, antibiotics, infections, or stress trigger flares in IBD? The American journal of gastroenterology, 2009. 104(5): p. 1298-313; quiz 1314.
17. Lakatos, P.L., et al., Treatment of extraintestinal manifestations in inflammatory bowel disease. Digestion, 2012. 86 Suppl 1: p. 28-35.
18. 12 Herfarth, H., et al., Improvement of arthritis and arthralgia after treatment with infliximab (Remicade) in a German prospective, open-label, multicenter trial in refractory Crohn’s disease. The American journal of gastroenterology, 2002. 97(10): p. 2688-90.
19. Kaufman, I., et al., The effect of infliximab on extraintestinal manifestations of Crohn’s disease. Rheumatology international, 2005. 25(6): p. 406-10.
20. Zochling, J., et al., Current evidence for the management of ankylosing spondylitis: a systematic literature review for the ASAS/EULAR management recommendations in ankylosing spondylitis. Annals of the rheumatic diseases, 2006. 65(4): p. 423-32.
21. Ardizzone, S., et al., Extraintestinal manifestations of inflammatory bowel disease. Digestive and liver disease : official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver, 2008. 40 Suppl 2: p. S253-9.
22. Orchard, T.R., et al., Uveitis and erythema nodosum in inflammatory bowel disease: clinical features and the role of HLA genes. Gastroenterology, 2002. 123(3): p. 714-8.
23. Farhi, D., et al., Significance of erythema nodosum and pyoderma gangrenosum in inflammatory bowel diseases: a cohort study of 2402 patients. Medicine, 2008. 87(5): p. 281-93.
24. Juillerat, P., et al., Extraintestinal manifestations of Crohn’s disease. Digestion, 2007. 76(2): p. 141-8.
25. Bennett, M.L., et al., Pyoderma gangrenosum. A comparison of typical and atypical forms with an emphasis on time to remission. Case review of 86 patients from 2 institutions. Medicine, 2000. 79(1): p. 37-46.
26. Brooklyn, T.N., et al., Infliximab for the treatment of pyoderma gangrenosum: a randomised, double blind, placebo-controlled trial. Gut, 2006. 55(4): p. 505-9.
27. Trost, L.B. and J.K. McDonnell, Important cutaneous manifestations of inflammatory bowel disease. Postgrad Med J, 2005. 81(959): p. 580-5.
28. Travis, S., et al., Sweet’s syndrome: an unusual cutaneous feature of Crohn’s disease or ulcerative colitis. The South West Gastroenterology Group. European journal of gastroenterology & hepatology, 1997. 9(7): p. 715-20.
29. Orchard, T., Extraintestinal complications of inflammatory bowel disease. Current gastroenterology reports, 2003. 5(6): p. 512-7.
30. Dabade, T.S. and M.D. Davis, Diagnosis and treatment of the neutrophilic dermatoses (pyoderma gangrenosum, Sweet’s syndrome). Dermatologic therapy, 2011. 24(2): p. 273-84.
31. Manganelli, C., S. Turco, and E. Balestrazzi, Ophthalmological aspects of IBD. European review for medical and pharmacological sciences, 2009. 13 Suppl 1: p. 11-3.
32. Bernstein, C.N., et al., The prevalence of extraintestinal diseases in inflammatory bowel disease: a population-based study. The American journal of gastroenterology, 2001. 96(4): p. 1116-22.
33. Michaels, A. and C. Levy, The medical management of primary sclerosing cholangitis. Medscape journal of medicine, 2008. 10(3): p. 61.
34. Smith, M.P. and R.H. Loe, Sclerosing Cholangitis; Review of Recent Case Reports and Associated Diseases and Four New Cases. American journal of surgery, 1965. 110: p. 239-46.
35. Olsson, R., et al., Prevalence of primary sclerosing cholangitis in patients with ulcerative colitis. Gastroenterology, 1991. 100(5 Pt 1): p. 1319-23.
36. Ashraf, I., et al., Ursodeoxycholic acid in patients with ulcerative colitis and primary sclerosing cholangitis for prevention of colon cancer: a meta-analysis. Indian journal of gastroenterology: official journal of the Indian Society of Gastroenterology, 2012. 31(2): p. 69-74.
37. Eaton, J.E., et al., High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. The American journal of gastroenterology, 2011. 106(9): p. 1638-45.
38. Barrie, A. and M. Regueiro, Biologic therapy in the management of extraintestinal manifestations of inflammatory bowel disease. Inflammatory bowel diseases, 2007. 13(11): p. 1424-9.
39. Barnabas, A. and R.W. Chapman, Primary sclerosing cholangitis: is any treatment worthwhile? Current gastroenterology reports, 2012. 14(1): p. 17-24.
Therapeutische Umschau
- Vol. 80
- Ausgabe 9
- Dezember 2023