- Moderne Chirurgie bei chronisch entzündlichen Darmerkrankungen
Durch die Zunahme der medikamentösen Therapiemöglichkeiten, insbesondere durch die Biologika, ist die chirurgische Behandlung von chronisch entzündlichen Darmerkrankungen (CED) in den letzten Jahrzehnten immer mehr in den Hintergrund getreten. Trotzdem stellen chirurgische Interventionen weiterhin eine wichtige Säule im Gesamtkonzept der Behandlungen dar. Beim Morbus Crohn ist die chirurgische Therapie vor allem für die Behandlung der Komplikationen von grosser Bedeutung. In den letzten Jahren hat sich jedoch ein Wandel in der Behandlungsphilosophie von Patienten mit isoliertem Befall des Ileozoekalübergangs vollzogen, und für selektionierte Patienten scheint die primäre chirurgische Resektion eine gleichwertige Therapiealternative zur medikamentösen antikörperbasierten Therapie zu sein. Bei der Colitis ulcerosa hingegen bietet die Chirurgie die einzige kurative Option an. Beim schweren akuten Schub ist eine Operation indiziert, wenn die konservative Behandlung nicht anschlägt und/oder wenn eine Kolonperforation droht. Indikationen für elektive Eingriffe sind Versagen einer konservativen Therapie sowie maligne Transformation. Der ileoanale J-Pouch ist heutzutage die Standardrekonstruktion nach restaurativer Koloproktektomie mit einem exzellenten funktionellen Langzeitergebnis.
Die zunehmende Komplexität der Indikationsstellung und der minimalinvasiven chirurgischen Techniken, sowie die anspruchsvolle perioperative Behandlung gehen mit einer zunehmenden Spezialisierung in der Behandlung von CED-Patienten auch in der Viszeralchirurgie einher, die immer in einem interdisziplinären Kontext mit der Gastroenterologie steht.
Indikationen für eine chirurgische Intervention
Morbus Crohn und Colitis ulcerosa sind lebenslange, chronische entzündliche Darmerkrankungen. Das primäre Therapieziel bei beiden Erkrankungen ist die Kontrolle aktiver Schübe durch medikamentöse Induktion einer Remission, welche dann steroidfrei erhalten werden sollte (1-3). Trotz signifikanter Verbesserungen seit der Einführung der Antikörper-basierten Therapien, den sogenannten Biologika wie z.B. TNF-α Inhibitoren, besteht noch immer ein erhöhtes lebenslanges Risiko, einen chirurgischen Eingriff zu benötigen. In den ersten 10 Jahren nach Diagnosestellung beträgt das Operationsrisiko für den Morbus Crohn annährend 50 % und für die Colitis ulcerosa ca. 20 % (4). Den richtigen Moment und das notwendige Ausmass einer chirurgischen Intervention zu bestimmen ist im klinischen Alltag herausfordernd und sollte in einer interdisziplinären Gruppe diskutiert werden. Das folgende Kapitel soll einen Einblick in die aktuelle leitliniengerechte chirurgische Therapie der chronisch entzündlichen Darmerkrankungen geben.
Morbus Crohn
Der Morbus Crohn zeichnet sich durch seine mögliche Lokalisation im gesamten gastrointestinalen Trakt von der Speiseröhre bis zum Enddarm und durch den Befall aller Darmwandschichten aus. Durch die transmurale Inflammation von Darmabschnitten kann es zu Durchwanderungsprozessen und Ausbildung von Abszessen und Fisteln kommen. (5-7). Durch die anhaltende Entzündung des Darmes kommt es zur Fibrosierung der Darmwand und Bildung von Strikturen, welche ein Passagehindernis darstellen können. Am häufigsten betroffen sind das terminale Ileum und der ileozoekale Übergang (7). Das klinische Korrelat stellen hier rezidivierende krampfartige Bauchschmerzen aufgrund einer Subileussymptomatik dar. Dieses Bild kann auch in Zusammenhang mit einer akuten Stenose auftreten, welche durch eine ausgeprägte Entzündung mit einhergehendem Darmwandödem verursacht wird. Sie ist einer medikamentösen Therapie zugänglicher als die fibrostenotische Variante (8).
Erstes Ziel ist gemäss den „Leitlinien zur medikamentösen Therapie des Morbus Crohn“ der European Crohn’s and Colitis Organisation (ECCO) die medikamentöse Kontrolle der inflammatorischen Komponente der Erkrankung. Vor einer immunsuppressiven Therapie ist der Ausschluss komplizierender Faktoren wie Abszesse und Fisteln sowie einer freien Perforation essentiell. Falls solche vorliegen, muss die Durchführung einer chirurgischen Intervention geprüft werden. Ebenfalls sind fibrostenotische Passagehindernisse ggf. primär operativ zu behandeln (3), da eine Rückbildung der Fibrose unter Therapie mit Steroiden oder Biologika nicht zu erwarten ist (8, 9). Im Fall eines intraabdominalen Abszesses wird die sonographisch oder CT gestützte Einlage einer Drainage empfohlen. Ist der Abszess suffizient kontrolliert, kann die immunsuppressive Therapie begonnen werden (1). Ebenfalls sollten perianale Fisteln durch Einlage eines Setons adäquat drainiert sein (3).
Die inflammatorische Krankheitsaktivität und deren Dynamik können anhand der Entzündungsparameter (Leukozyten, CRP) in Verbindung mit dem Crohn’s Disease Activity Index (CDAI) eingeschätzt und beurteilt werden. Eine Remission ist zwischen 0 bis 150 Punkten definiert (10). Die ECCO-Leitlinien sehen eine solche suffizient belegt durch ein Abfallen des Index um 100 Punkte oder unter die Gesamtpunktzahl von 150 (11). Mit dem CDAI kann daher die Frage nach einem therapierefraktären Krankheitsverlauf, der eine chirurgische Therapie erfordern könnte, orientierend beantwortet werden.
Zur Beurteilung der obstruktiven Krankheitskomponente ist eine Erhebung des klinischen Befundes in Zusammenschau mit bildgebender Diagnostik notwendig (8, 9, 12).
Für Letztere ist die MR-Enterographie als Goldstandard anzusehen. Schulberg et al. haben in einer retrospektiven Studie den Krankheitsverlauf von 136 Patienten, welche insgesamt 235 Strikturen aufwiesen, mit dem Befund der initialen MR Enterographie korreliert. Positiv prädiktive Faktoren für die Notwendigkeit einer operativen Therapie waren eine langstreckige Striktur > 5 cm, eine Dilatation der prästenotischen Dünndarmschlinge auf über 3 cm sowie eine Verbreiterung der Darmwand im Bereich der Striktur auf mehr als 1 cm. 81% der Patienten, welche alle drei Faktoren aufwiesen, benötigten in dem Beobachtungszeitraum von fünf Jahren eine operative Therapie. Hingegen musste bei nur 17% der Patienten, die keines der drei Merkmale hatten, eine Operationsindikation gestellt werden (13).
Bei einem akuten Ileusbild aufgrund einer Obstruktion und fehlenden Anzeichen einer Peritonitis oder Darmischämie sollte eine Operation, wenn möglich, erst verzögert erfolgen. An erster Stelle steht die konservative Therapie mit Dekompression über eine nasogastrale Sonde, intravenöser Rehydrierung, ggf. nutritiver Optimierung und bei akuter Obstruktion die Entzündungskontrolle mit immunsuppressiver Therapie. Nach den genannten Optimierungen erfolgt die Reevaluation und die allfällige operative Therapie nach Möglichkeit elektiv bzw. semi-elektiv. Ganz im Gegensatz dazu steht bei Anzeichen einer freien Perforation oder Ischämie die Notfalloperation im Vordergrund (1).
Eine aktuelle Auswertung der deutschen DRG-Statistik zwischen 2010 und 2017 schloss mehr als 200‘000 Crohn-Fälle ein und bestätigte die Ileozoekalresektion und die rechtsseitige Hemikolektomie als häufigste Eingriffe bei Patienten mit Morbus Crohn. Dabei fiel auf, dass sich auch in der Ära der immunmodulatorischen Therapie die relativen Operationszahlen nicht signifikant änderten, wohl aber sich die absoluten Behandlungszahlen erhöhten (14). Hinsichtlich der Indikationsstellung zur Ileozoekalresektion vollzog sich in den letzten Jahren ein Paradigmenwechsel, welcher auch in die aktuelle deutsche S3-Leitlinie zur Behandlung des Morbus Crohn Einzug nahm: Bei nicht stenosierender terminaler Ileitis mit steroidrefraktärem Verlauf ist eine laparoskopische Ileozoekalresektion einer Infliximab Monotherapie mindestens gleichwertig und kann daher als Option erwogen werden (3). Hintergrund ist der 2017 hochrangig publizierte LIR!C Trial. Dieser stellte als randomisierte Multicenterstudie die Monotherapie mit Infliximab der laparoskopischen Ileozoekalresektion bei Patienten mit über mindestens drei Monate therapierefraktärer, nicht stenosierender Ileitis terminalis gegenüber. Das mediane Follow-up betrug 48 Monate. Es konnte gezeigt werden, dass 37% der Patienten mit alleiniger Infliximab-Therapie im Beobachtungszeitraum noch eine Ileozoekalresektion benötigten, während von den bereits initial operierten Patienten nur etwa 26% eine Infliximab-Therapie erhalten mussten. Die Lebensqualität war in beiden Studienarmen vergleichbar (15). Mittlerweile wurden auch die Langzeitdaten mit einem medianen Follow- up von fünf Jahren veröffentlicht, welche diese Ergebnisse
bestätigten (16).
Zusammengefasst bestehen Operationsindikationen bei freien Perforationen, Anzeichen einer Darmischämie und bei therapierefraktärem Verlauf. Bei gedeckten Perforationen sollte die Operation möglichst erst nach Abszesskontrolle erfolgen. Strikturen können zunächst endoskopisch therapiert werden, falls sie erreichbar sind, einzeln auftreten, nicht anguliert sind und eine Länge von 5 cm nicht überschreiten.
Die übrigen Strikturen sollten operativ saniert werden (8, 9). Die Entscheidung sollte stets im interdisziplinären Team getroffen werden (1, 3, 11).
Colitis ulcerosa
Die Colitis ulcerosa breitet sich in der Regel kontinuierlich, beginnend im Rektum, nach proximal aus. Sie ist limitiert auf den Dickdarm, wobei auch ein Übergang auf die letzten Zentimeter des terminalen Ileums als sogenannte Backwash Ileitis vorkommen kann. Dies kann die Differenzialdiagnose zum Morbus Crohn erschweren. Von der Entzündung betroffen ist bei der Colitis ulcerosa nur die Mukosa (2, 17). Notfällige Operationsindikationen bestehen bei fulminanter Krankheitsaktivität, die auf eine medikamentöse
Therapie nicht ausreichend ansprechen oder bei komplizierenden Faktoren wie unkontrollierbare, kreislaufrelevante untere GI-Blutungen, freie und gedeckte Perforation und Entwicklung eines toxischen Megakolons. Dann wird im Regelfall eine Kolektomie durchgeführt (18). Weiterhin besteht eine absolute Operationsindikation bei endoskopisch nicht resektablen Dysplasien oder kolorektalen Karzinomen sowie eine relative Operationsindikation bei rezidivierend therapierefraktärer Colitis und Stenosen (17, 19).
Die Abgrenzung einer akuten schweren Colitis ulcerosa ist mit den Kriterien nach Truelove und Witts möglich. Sie liegt demnach vor, wenn eines der folgenden Symptome auftritt: Mehr als fünf blutige Diarrhöen täglich gepaart mit schweren Bauchkrämpfen, an zwei von vier Tagen Fieber > 37.8°C, eine Tachykardie von mehr als 90/min, eine Blutsenkungsgeschwindigkeit von mehr als 30 mm/h oder eine Anämie mit einem Hämoglobin < 10.5 g/dL (2, 17, 18). Diese Patienten sind schwer krank und sollten gemäss der ECCO Leitlinien für die chirurgische Therapie der Colitis ulcerosa für die Durchführung einer intensiven intravenösen Behandlung mit Corticosteroiden, Volumen- und Elektrolytensubstitution hospitalisiert werden. Ab der Erstvorstellung ist eine interdisziplinäre Behandlung unter Einbezug des gastroenterologischen und kolorektalchirurgischen Teams zu empfehlen (20). Eine Sigmoidoskopie mit Biopsie zum Ausschluss eines Cytomegalievirus oder einer anderen Infektion (häufig ist die Clostridiencolitis) sollte durchgeführt und bei positivem Befund die entsprechende Behandlung initiiert werden (2). Erweist sich die fulminante Colitis innerhalb von 3 Tagen als steroidrefraktär und ergibt sich auch durch eine Salvagetherapie mit Ciclosporin oder Infliximab bis zum 7. Behandlungstag keine Besserung, sollte eine Kolektomie durchgeführt werden, da sich die Morbidität und Mortalität bei weiterer Verzögerung signifikant erhöht (17, 21).
Das toxische Megakolon stellt eine gefürchtete Komplikation der fulminanten Colitis dar und hat eine hohe Assoziation zur Colitis ulcerosa und dem M. Crohn. Es zeichnet sich histologisch durch ein Fortschreiten der Entzündung auf alle Wandschichten und radiologisch durch eine Überdehnung des Kolons > 6 cm aus ohne Nachweis einer Stenose. Früh erkannt und behandelt, kann seine Mortalität bei chronisch entzündlichen Erkrankungen lediglich 2% betragen. Bei Perforation steigt die Mortalität auf bis zu 35 – 80% an. Die Behandlung erfolgt analog der fulminanten Colitis medikamentös unter engmaschiger interdisziplinärer Reevaluation einer Kolektomie bei fehlender Besserung nach 24-72 Stunden (22).
Die Colitis ulcerosa geht mit einem 2,4 fach erhöhten Risiko der Karzinogenese einher (23). Beginnend im 6. bis 8. Jahr nach Erstdiagnose sollte daher gemäss der aktualisierten deutschen S3-Leitlinie Colitis ulcerosa die endoskopische Vorsorge mit strukturierten, jährlich wiederholten, vollständigen High Resolution oder chromoendoskopischen Kolonoskopien beginnen (2). Da sich das Karzinomrisiko bei gleichzeitigem Vorliegen einer primär sklerosierenden Cholangitis (PSC) nochmals 5-fach erhöht (24), sollte die Surveillance in diesem Fall bereits ab dem ersten Krankheitsjahr jährlich erfolgen. Zudem wird eine medikamentöse Therapie der PSC mit Ursodesoxycholsäure zur Reduktion des Krebsrisikos empfohlen (2). Sollten sich hochgradige intraepitheliale Neoplasien (IEN) ergeben, so wird eine Proktokolektomie empfohlen. Entzündliche Veränderungen des Kolons können makroskopisch flachen, niedriggradigen IEN ähneln. Sollte eine intensivierte antiinflammatorische Therapie keine Besserung in der kurzfristigen endoskopischen Kontrolle nach 3 – 6 Monaten zeigen und sich die IEN bestätigen, so ist die Proktokolektomie zu empfehlen. Ebenfalls sollte diese bei flachen, hochgradigen IEN indiziert werden, da das Risiko eines anderweitig lokalisierten simultanen Karzinoms signifikant erhöht ist. (2).
Kolonstenosen sind bei der Colitis ulcerosa immer bis zum Beweis des Gegenteils malignitätsverdächtig. Bis zu 9% der wegen Kolonstenosen operierten und präoperativ endoskopisch dysplasiefreien Patienten weisen im definitiven histologischen Befund Low- und High-Grade Dysplasien sowie Colitis assoziierte Karzinome auf (25). Daher sollten Kolonstenosen immer umfassend bildgebend und bioptisch abgeklärt werden. Falls die Histologie uneindeutig bleibt, sollte die Kolektomie erwogen werden (2).
Patienten mit einer therapierefraktären oder steroidabhängigen Erkrankung können von einer restaurativen Proktokolektomie mit ileopouchanaler Anastomose (IPAA) profitieren. Dieser Goldstandard in der Behandlung der Colitis ulcerosa kann auch nach langjähriger medikamentöser Behandlung und zunehmend schwierigerer endoskopischer Surveillance sowie aufgrund der Sorge vor der Entwicklung eines Malignoms angeboten werden. Die Lebensqualität verbessert sich durch die Operation für die meisten Patienten. (2, 20). Eine Alternative kann für einige Patienten die Proktokolektomie mit definitiver terminaler Ileostomie darstellen, die eine vergleichbare Lebensqualität ermöglichen kann (26).
Perioperative Optimierung
Die European Society for Clinical Nutrition and Metabolism (ESPEN) hat eine spezifische Leitlinie für Patienten mit chronisch entzündlichen Darmerkrankungen herausgegeben. Diese sind generell dem Risiko einer Mangelernährung ausgesetzt und sollten daher regelmässig gescreent werden.
Operationseingriffe bei mangelernährten Patienten sollten möglichst 7 – 14 Tage verschoben werden, um eine Optimierung herbeiführen zu können (27). Die ECCO schlägt im elektiven Setting die routinemässige Beteiligung einer spezialisierten Ernährungsberatung vor (20).
Patienten, die Prednisolonäquivalenzdosen von ≥ 20 mg/d über mehr als 6 Wochen erhalten haben, sind einem deutlich erhöhten Risiko von postoperativen Komplikationen ausgesetzt.
Die hohen Steroiddosen sollten präoperativ möglichst reduziert oder ausgeschlichen werden. Ist eine signifikante Reduktion unter diese Grenze nicht möglich, wie z. B. in einer Notfallsituation, sollte eine protektive Stomaanlage oder die Durchführung eines mehrzeitigen Eingriffes erwogen werden. Die Gabe von Thiopurinen (Azathioprin, 6-Mercaptopurin) muss nicht pausiert werden (1, 20).
Ciclosporin kann perioperativ weiterhin verabreicht werden. Die Fortsetzung der Therapie mit Biologika wird bei Colitis ulcerosa nicht empfohlen (2, 20). Es gibt Hinweise darauf, dass sie mit Komplikationen der ileopouchanalen Anastomose, welche frühzeitig oder nach Verschluss der Ileostomie auftreten können, in Zusammenhang stehen.
Hingegen kann bei M. Crohn der TNF-α Antikörper Infliximab gemäss der ECCO Guidelines perioperativ fortgesetzt werden. Eine Meta-Analyse aus dem Jahr 2019, die 18 Studien mit insgesamt 1407 Patienten mit und 4589 Patienten ohne präoperative Infliximab-Therapie einschloss, fand keine Unterschiede hinsichtlich postoperativer Major- und Minorkomplikationen, oberflächlichen bis tiefen Wundinfektionen, Reoperation und Mortalität (1).
Für Vedolizumab liegen kontroverse Daten vor. Mehrere Meta-Analysen legen nahe, dass es keine erhöhte postoperative Komplikationsrate bei präoperativer Applikation von Vedolizumab sowohl im Vergleich zu Crohn Patienten mit Infliximab und solchen ohne Biologikatherapie gibt (28, 29). Eine weitere, neuere Meta-Analyse von 12 Studien mit 1925 eingeschlossenen Patienten, von denen 709 Vedolizumab erhielten, ergab eine erhöhte Rate an oberflächlichen und tiefen chirurgischen Wundinfektionen, ein vermehrtes Auftreten eines postoperativen Ileus sowie ein höheres Risiko für peristomale Wunddehiszenzen (30). Daher sollte die perioperative Gabe von Vedolizumab kritisch hinterfragt werden.
Bei präoperativer Anwendung von Ustekinumab bestehen nach derzeitiger Datenlage keine Hinweise auf eine erhöhte postoperative Komplikationsrate (1, 31).
Operative Therapie
Morbus Crohn
Die Ileozoekalresektion ist der häufigste durchgeführte chirurgische Eingriff beim Morbus Crohn (14). Die ECCO empfiehlt in ihrer Leitlinie zur chirurgischen Therapie bei M. Crohn in erster Linie ein minimalinvasives Vorgehen unter der Massgabe, dass eine ausreichende Expertise vorhanden ist (1). Die laparoskopische oder robotische hat sich in den letzten Jahren zunehmend gegen die offene Operation durchgesetzt (14). Die so behandelten Patienten hatten gegenüber den offen operierten Patienten eine reduzierte Rate an chirurgischen Wundinfektionen, Wunddehiszenzen sowie eine verringerte Spitalverweildauer (14, 32). Der Eingriff kann heutzutage vollständig laparoskopisch mit intrakorporaler Stapleranastomose und Bergung des Präparates über einen Bergeschnitt durchgeführt werden. Er kann mit entsprechender Expertise auch wiederholt laparoskopisch bei Rezidiven durchgeführt werden (1). Jedoch bestehen auch Limitationen für die laparoskopische CED Chirurgie. So kann die adäquate Beurteilung des restlichen Dünndarms z. B. bei multiplen Strikturen erschwert sein. In Notfallsituationen konnte für die Laparoskopie bei diesem Patientengut eine erhöhte Konversionsrate sowie die Resektion längerer Darmabschnitte im Vergleich zum primär offenen Vorgehen gezeigt werden (33).
Die Single Port Chirurgie, hat sich für die CED Chirurgie aufgrund einer sehr langen Lernkurve, höherer Kosten und nur marginalen kosmetischen Vorteilen nicht breit durchsetzen können (32). Für die robotische Chirurgie wurde die sichere Anwendung in der CED Chirurgie demonstriert. Allerdings konnte noch keine Überlegenheit des Verfahrens gegenüber der laparoskopischen Chirurgie gezeigt werden. Ausserdem könnte die eingeschränkte Haptik bei den meisten aktuell marktüblichen Systemen eine erschwerende Variable bei der Operation von Crohn Patienten mit sehr entzündetem, brüchigen Gewebe darstellen (34).
Unterschiede der Anastomosentechnik
Der technische Anspruch an die Anastomose besteht darin, dass sie weit durchgängig und gut durchblutet sein soll sowie keine Insuffizienz entwickelt. Beim Morbus Crohn kommt hinzu, dass im Anastomosenbereich möglichst kein inflammatorisches Rezidiv entstehen sollte, da dieses konsekutiv zu Strikturen und damit Anastomosenstenosen führen würde. Dies ist bei bis zu 60% der Crohn Patienten innerhalb des ersten Jahres der Fall. Davon sind mehr Patienten mit ileokolischer Erkrankung betroffen als solche, bei denen lediglich der Dünndarm befallen ist (35).
Im Sinne der innovativen Weiterentwicklung und evidenzbasierten Überprüfung der chirurgischen Techniken, wird die Wahl der Anastomosentechnik kontrovers diskutiert. Mehrere Meta-Analysen verglichen das Outcome einer End zu End konfigurierten Hand- mit einer anisoperistaltisch Seit zu Seit konfigurierten Stapleranastomose. Dabei wurden für die Stapleranastomose eine verringerte Rate an Gesamtkomplikationen, weniger Anastomoseninsuffizienzen und eine verringerte Spitalverweildauer gesehen (36-38). Die eingeschlossenen Studien sind jedoch von geringer Qualität, da es sich überwiegend um prospektive und retrospektive Single Center Studien handelte. Nichtsdestotrotz empfiehlt die ECCO die Durchführung einer Seit-zu-Seit Stapleranastomose (1).
Dem steht eine innovative Anastomosentechnik entgegen, die sich in den letzten Jahren vermehrt verbreitet hat. Die sogenannte Kono-S Anastomose ist eine handgenähte Darmnahtverbindung, die 2011 von Kono publiziert wurde und ihre Anwendung bei der Ileozoekalresektion sowie bei Dünndarmsegmentresektionen findet (39). Sie soll mit weniger Entzündungsrezidiven einhergehen (39, 40).
Die Strikturoplastik als Alternative zur Segmentresektion
Bei rezidivierenden und insbesondere multilokulären Strikturen und auch nach wiederholten darmresezierenden Verfahren stellt sich die Frage nach einem darmsparenden Verfahren zur Vermeidung eines Kurzdarmsyndroms. Dies ist mit der Strikturoplastik möglich und wird auch in den ECCO Guidelines aus den genannten Gründen empfohlen (1). Die populärste Art zur Versorgung kurzer Stenosen bis 10 cm Länge ist die von der Pyloroplastik adaptierte Strikturoplastik nach Heinecke-Mikulicz. Dabei wird über dem stenotischen Dünndarm eine antimesenterielle Längsinzision vorgenommen, die danach quer vernäht wird, sodass eine Weitung des Dünndarmlumens resultiert. Für längere Stenosen eignen sich z. B. die komplexeren Verfahren nach Finney (10 – 25 cm) und Michelassi (> 25 cm). Die Strikturoplastik weist eine geringe Morbidität bei wenig höheren Rezidivraten als die Resektion auf (30 vs 22 %) (41).
Colitis ulcerosa
Ca. 20–30% der Patienten mit Colitis ulcerosa benötigen im Verlauf aufgrund von therapierefraktärem Verlauf oder Dysplasie/Neoplasie eine Kolektomie (42). Gemäss den ECCO Guidelines ist die restaurative Proktokolektomie stets einer Kolonsegmentresektion (Sigmoidektomie, Hemikolektomie, Rektumresektion) vorzuziehen. Dies wird mit der möglichen Heilung der Krankheit und zum anderen aus onkologischer Sichtweise hinsichtlich der Colitis-assoziierten Karzinome begründet (18, 25). Die segmentale Kolektomie birgt jedoch im Gegensatz eine verringerte Morbidität und besitzt insbesondere bei älteren Patienten ihren Stellenwert. Für diese Patientengruppe konnte gezeigt werden, dass keiner dieser Personen einen metachronen endoluminalen Tumor im Beobachtungszeitraum von 7 – 10 Jahren entwickelte, wenn die OP-Indikation eine andere als eine aktive Colitis war (Polypen, maligne Tumore, Stenosen) (43). Eine multizentrische retrospektive Studie mit 72 Patienten konnte zeigen, dass ein frühzeitiger postoperativer Colitisschub bei nur 7% der mit segmentaler Kolektomie operierten Patienten auftrat. Allerdings sollte bemerkt werden, dass sich 35% der Patienten nach median 19 Monaten reoperieren liessen und die meisten von ihnen eine restaurative Proktokolektomie oder eine totale Kolektomie in ileorektaler Anastomose erhielten (44).
Die restaurative Proktokolektomie mit ileopouchanaler Anastomose
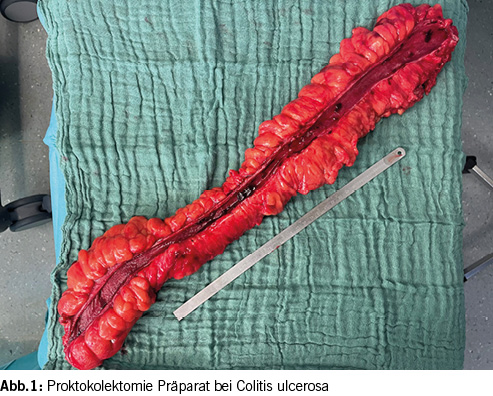
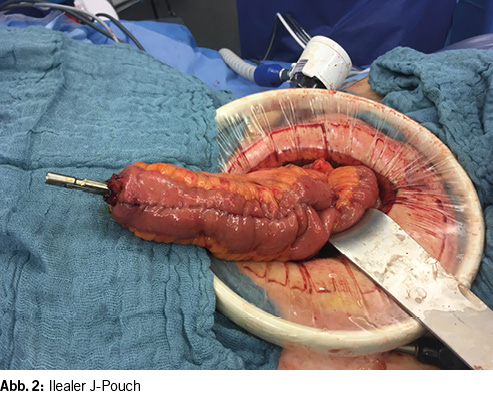
Der Goldstandard der chirurgischen Therapie ist die restaurative Proktokolektomie mit ileopouchanaler Anastomose (IPAA) (2, 17-21) (Abb. 1). Es sind verschiedene Konfigurationen des Pouches möglich – der Form nach J-, S-, H- oder W Pouch benannt – von denen der J-Pouch durch die S3-Leitlinie zur Therapie der Colitis ulcerosa empfohlen wird, da er die geringste technische Komplexizität besitzt und im langfristigen Verlauf die Funktion mit den anderen Poucharten vergleichbar gut ist (2) (Abb. 2).
Vorteil des Verfahrens ist die Kontinenzerhaltung zum einen durch den Erhalt des analen Sphinkterapparates, zum anderen durch die Bildung eines Stuhlreservoirs. Besteht ein allgemein erhöhtes perioperatives Risiko oder beispielsweise eine schwere steroidrefraktäre akute Colitis, wird die Durchführung als dreizeitiger Eingriff empfohlen. Das zweizeitige wird regelmässig, das einzeitige Vorgehen nur in ausgewählten Einzelfällen angewandt (17).
Beim dreizeitigen Vorgehen erfolgt im ersten Schritt eine subtotale Kolektomie und Anlage eines endständigen Ileostomas. Die zweite Operation folgt einige Wochen bis Monate später, wodurch eine Rekonvaleszenz vom Ersteingriff mit nutritiver Optimierung ermöglicht werden soll. In Fällen der steroidrefraktären Colitis werden in dieser Phase die Steroide ausgeschlichen. Bei dem Eingriff erfolgt eine Proktektomie, also die vollständige Resektion des Rektumstumpfes, die Formierung eines Pouches und die ileopouchanale Anastomosierung sowie die Anlage eines doppelläufigen, protektiven Ileostomas. Die dritte Operation umfasst die Rückverlagerung des protektiven Ileostomas. Die dreizeitige Operation hat unter anderem ihren Stellenwert darin, dass sie auch auf eine Notfalloperation aufbauen kann und kein rein elektives Verfahren ist.
Die zweizeitige Prozedur folgt dem einzeitigen Vorgehen mit dem Unterschied der Anlage eines protektiven Ileostomas beim ersten Eingriff, welches in einer zweiten Operation rückverlagert wird. Die einzeitige Operation umfasst eine totale Proktokolektomie, Formierung eines Pouches im terminalen Ileum sowie dessen Anastomosierung mit dem verbleibenden Analkanal, ohne Anlage einer Schutzileostomie.
Mit der IPAA wird eine Kontinenz ermöglicht, die mit ca. fünf Stuhlentleerungen täglich und 1 – 2 Entleerungen in der Nacht einhergeht. 30 Jahre nach Pouchanlage konnte ein adäquat funktionierender Pouch bei 94% der Patienten mit Colitis ulcerosa festgestellt werden (45). Hinsichtlich der Sexualfunktion und Fertilität ist bei Frauen mit ausstehendem Kinderwunsch ggf. zunächst eine Kolektomie mit einer ileorektalen Anastomose vorzuziehen, da die relevanten pelvinen Nervenbahnen und Strukturen bei diesem Eingriff im Vergleich zur IPAA mit höherer Sicherheit geschont werden. Dabei sollte berücksichtigt werden, dass der Rektumstumpf weiterhin regelmässig endoskopisch auf Präkanzerosen gescreent wird (17).
Als kurzfristige postoperative Komplikationen der IPAA können Pouch Insuffizienzen mit lokalen Abszessen in 13 bis 22% der Fälle auftreten (46).
Eine langfristige Komplikation der IPAA ist die Pouchitis. Dabei handelt es sich um eine unspezifische Entzündung des Pouches, die mit abdominalen Krämpfen, Fieber, erhöhter Stuhlfrequenz und schleimigen, teils blutigen Stühlen einhergeht (17). Die Therapie besteht in der Regel durch einen zwei- bis vierwöchigen Antibiotikakurs mit Ciprofloxacin oder Metronidazol, wobei sich auch antibiotikarefraktäre chronische Verläufe entwickeln können (19, 20).
Eine veritable Alternative zur IPAA stellt die Proktokolektomie mit endständigem Stoma dar. Diese wird in den ECCO-Leitlinien für ausgewählte Patienten empfohlen, da sie mit einer geringeren Morbidität bei vergleichbarer Lebensqualität verbunden ist (20).
Die Eingriffe können laparoskopisch assistiert oder robotisch durchgeführt werden, allerdings darf beim schwer kranken, immunsupprimierten Patienten die Indikation zur offenen Chirurgie grosszügiger gestellt werden, da die Gewebequalität in der akuten Entzündung sehr fragil ist und eine kotige Peritonitis nach einer Perforation einen foudroyanten Verlauf nehmen kann (32).
Klinik für Chirurgie und Viszeralchirurgie
Kantonsspital Baselland
Rheinstrasse 26
4410 Liestal
Klinik für Chirurgie und Viszeralchirurgie
Kantonsspital Baselland
Rheinstrasse 26
4410 Liestal
robert.rosenberg@ksbl.ch
Die Autoren haben keine Interessenkonflikte.
Fazit für die Praxis
• Die Zusammenarbeit in multidisziplinären Teams, um die beste Lösung für den einzelnen Patienten zu finden, ist der Schlüssel zur Optimierung der Versorgung von CED-Patienten.
• Bei der Vorbereitung zu einem operativen Eingriff sollte die Ernährungssituation optimiert und die immunsuppressive Therapie angepasst werden.
• Die Operation beim Morbus Crohn wird nach Erschöpfung aller medikamentösen Maßnahmen oder zur Behandlung von Komplikationen durchgeführt. Goldstandard bei der chirurgischen Behandlung der Colitis ulcerosa ist die Proktokolektomie mit ileoanaler Pouchanlage, welche durch eine Verbesserung der Lebensqualität und ein gutes funktionelles Langzeitergebnis gekennzeichnet ist.
• Die meisten Operationen bei CED können sicher minimalinvasiv durchgeführt werden was zu einer schnellen Erholung und exzellenten kosmetischen Ergebnis führt.
1. Adamina M, Bonovas S, Raine T, Spinelli A, Warusavitarne J, Armuzzi A, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Surgical Treatment. J Crohns Colitis. 2020; 14(2): 155-68.
2. Kucharzik T, Dignass A, Atreya R, Bokemeyer B, Esters P, Herrlinger K, et al. Aktualisierte S3-Leitlinie Colitis ulcerosa (Version 6.1) – Februar 2023. Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselerkrankungen (DGVS) – AWMF Registriernummer 021-009). 2023.
3. Sturm A, Atreya R, Bettenworth D, Bokemeyer B, Dignass A, Ehehalt R, et al. Aktualisierte S3-Leitlinie „Diagnostik und Therapie des Morbus Crohn“ der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – August 2021 – AWMF-Registernummer: 021-004. Z Gastroenterol. 2022; 60(3): 332-418.
4. Frolkis AD, Dykeman J, Negron ME, Debruyn J, Jette N, Fiest KM, et al. Risk of surgery for inflammatory bowel diseases has decreased over time: a systematic review and meta-analysis of population-based studies. Gastroenterology. 2013; 145(5): 996-1006.
5. Cheifetz AS. Management of active Crohn disease. JAMA. 2013; 309(20): 2150-8.
6. Richards RJ. Management of abdominal and pelvic abscess in Crohn’s disease. World J Gastrointest Endosc. 2011; 3(11): 209-12.
7. Rieder F, Zimmermann EM, Remzi FH, Sandborn WJ. Crohn’s disease complicated by strictures: a systematic review. Gut. 2013; 62(7): 1072-84.
8. Ford MM. Crohn’s Disease Obstructions. Clin Colon Rectal Surg. 2021; 34(4): 227-32.
9. Rieder F, Fiocchi C, Rogler G. Mechanisms, Management, and Treatment of Fibrosis in Patients With Inflammatory Bowel Diseases. Gastroenterology. 2017; 152(2): 340-50 e6.
10. Liu JK, Lichtenstein GR. Chapter 21 – Inflammatory Bowel Disease. In: Ginsberg GG, Gostout CJ, Kochman ML, Norton ID, (eds.). Clinical Gastrointestinal Endoscopy. Second Edition ed. Philadelphia: W.B. Saunders; 2012. 243-64.
11. Torres J, Bonovas S, Doherty G, Kucharzik T, Gisbert JP, Raine T, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment. J Crohns Colitis. 2020; 14(1): 4-22.
12. Bouhnik Y, Carbonnel F, Laharie D, Stefanescu C, Hebuterne X, Abitbol V, et al. Efficacy of adalimumab in patients with Crohn’s disease and symptomatic small bowel stricture: a multicentre, prospective, observational cohort (CREOLE) study. Gut. 2018; 67(1): 53-60.
13. Schulberg JD, Wright EK, Holt BA, Sutherland TR, Hume SJ, Hamilton AL, et al. Magnetic resonance enterography for predicting the clinical course of Crohn’s disease strictures. J Gastroenterol Hepatol. 2020; 35(6): 980-7.
14. Stoss C, Berlet M, Reischl S, Nitsche U, Weber MC, Friess H, et al. Crohn’s disease: a population-based study of surgery in the age of biological therapy. Int J Colorectal Dis. 2021; 36(11): 2419-26.
15. Ponsioen CY, de Groof EJ, Eshuis EJ, Gardenbroek TJ, Bossuyt PMM, Hart A, et al. Laparoscopic ileocaecal resection versus infliximab for terminal ileitis in Crohn’s disease: a randomised controlled, open-label, multicentre trial. Lancet Gastroenterol Hepatol. 2017; 2(11): 785-92.
16. Stevens TW, Haasnoot ML, D’Haens GR, Buskens CJ, de Groof EJ, Eshuis EJ, et al. Laparoscopic ileocaecal resection versus infliximab for terminal ileitis in Crohn’s disease: retrospective long-term follow-up of the LIR!C trial. Lancet Gastroenterol Hepatol. 2020; 5(10): 900-7.
17. Gajendran M, Loganathan P, Jimenez G, Catinella AP, Ng N, Umapathy C, et al. A comprehensive review and update on ulcerative colitis(). Dis Mon. 2019; 65(12): 100851.
18. Oresland T, Bemelman WA, Sampietro GM, Spinelli A, Windsor A, Ferrante M, et al. European evidence based consensus on surgery for ulcerative colitis. J Crohns Colitis. 2015; 9(1): 4-25.
19. Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis. Lancet. 2017; 389(10080): 1756-70.
20. Spinelli A, Bonovas S, Burisch J, Kucharzik T, Adamina M, Annese V, et al. ECCO Guidelines on Therapeutics in Ulcerative Colitis: Surgical Treatment. J Crohns Colitis. 2022; 16(2): 179-89.
21. Randall J, Singh B, Warren BF, Travis SP, Mortensen NJ, George BD. Delayed surgery for acute severe colitis is associated with increased risk of postoperative complications. Br J Surg. 2010; 97(3): 404-9.
22. Desai J, Elnaggar M, Hanfy AA, Doshi R. Toxic Megacolon: Background, Pathophysiology, Management Challenges and Solutions. Clin Exp Gastroenterol. 2020; 13: 203-10.
23. Scarpa M, Castagliuolo I, Castoro C, Pozza A, Scarpa M, Kotsafti A, et al. Inflammatory colonic carcinogenesis: a review on pathogenesis and immunosurveillance mechanisms in ulcerative colitis. World J Gastroenterol. 2014; 20(22): 6774-85.
24. Soetikno RM, Lin OS, Heidenreich PA, Young HS, Blackstone MO. Increased risk of colorectal neoplasia in patients with primary sclerosing cholangitis and ulcerative colitis: a meta-analysis. Gastrointest Endosc. 2002; 56(1): 48-54.
25. Fumery M, Pineton de Chambrun G, Stefanescu C, Buisson A, Bressenot A, Beaugerie L, et al. Detection of Dysplasia or Cancer in 3.5% of Patients With Inflammatory Bowel Disease and Colonic Strictures. Clin Gastroenterol Hepatol. 2015; 13(10): 1770-5.
26. Murphy PB, Khot Z, Vogt KN, Ott M, Dubois L. Quality of Life After Total Proctocolectomy With Ileostomy or IPAA: A Systematic Review. Dis Colon Rectum. 2015; 58(9): 899-908.
27. Bischoff SC, Escher J, Hebuterne X, Klek S, Krznaric Z, Schneider S, et al. ESPEN practical guideline: Clinical Nutrition in inflammatory bowel disease. Clin Nutr. 2020; 39(3): 632-53.
28. Law CCY, Narula A, Lightner AL, McKenna NP, Colombel JF, Narula N. Systematic Review and Meta-Analysis: Preoperative Vedolizumab Treatment and Postoperative Complications in Patients with Inflammatory Bowel Disease. J Crohns Colitis. 2018; 12(5): 538-45.
29. Moosvi Z, Duong JT, Bechtold ML, Nguyen DL. Systematic Review and Meta-Analysis: Preoperative Vedolizumab and Postoperative Complications in Patients with IBD. South Med J. 2021; 114(2): 98-105.
30. Guo D, Jiang K, Hong J, Zhang M, Shi Y, Zhou B. Association between vedolizumab and postoperative complications in IBD: a systematic review and meta-analysis. Int J Colorectal Dis. 2021; 36(10): 2081-92.
31. Garg R, Mohan BP, Ponnada S, Regueiro M, Lightner AL, Click B. Postoperative outcomes after preoperative ustekinumab exposure in patients with Crohn’s disease: a systematic review and meta-analysis. Ann Gastroenterol. 2021; 34(5): 691-8.
32. Kienle P, Magdeburg R. (Minimally invasive and robot-assisted surgery for chronic inflammatory bowel disease : Current status and evidence situation). Chirurg. 2021; 92(1): 21-9.
33. Celentano V, O’Leary DP, Caiazzo A, Flashman KG, Sagias F, Conti J, et al. Longer small bowel segments are resected in emergency surgery for ileocaecal Crohn’s disease with a higher ileostomy and complication rate. Tech Coloproctol. 2019; 23(11): 1085-91.
34. Crippa J, Carvello M, Kotze PG, Spinelli A. Robotic Surgery in Inflammatory Bowel Disease. Curr Drug Targets. 2021; 22(1): 112-6.
35. Pascua M, Su C, Lewis JD, Brensinger C, Lichtenstein GR. Meta-analysis: factors predicting post-operative recurrence with placebo therapy in patients with Crohn’s disease. Aliment Pharmacol Ther. 2008; 28(5): 545-56.
36. Feng JS, Li JY, Yang Z, Chen XY, Mo JJ, Li SH. Stapled side-to-side anastomosis might be benefit in intestinal resection for Crohn’s disease: A systematic review and network meta-analysis. Medicine (Baltimore). 2018; 97(15): e0315.
37. He X, Chen Z, Huang J, Lian L, Rouniyar S, Wu X, et al. Stapled side-to-side anastomosis might be better than handsewn end-to-end anastomosis in ileocolic resection for Crohn’s disease: a meta-analysis. Dig Dis Sci. 2014; 59(7): 1544-51.
38. Simillis C, Purkayastha S, Yamamoto T, Strong SA, Darzi AW, Tekkis PP. A meta-analysis comparing conventional end-to-end anastomosis vs. other anastomotic configurations after resection in Crohn’s disease. Dis Colon Rectum. 2007; 50(10): 1674-87.
39. Kono T, Ashida T, Ebisawa Y, Chisato N, Okamoto K, Katsuno H, et al. A new antimesenteric functional end-to-end handsewn anastomosis: surgical prevention of anastomotic recurrence in Crohn’s disease. Dis Colon Rectum. 2011; 54(5): 586-92.
40. Shimada N, Ohge H, Kono T, Sugitani A, Yano R, Watadani Y, et al. Surgical Recurrence at Anastomotic Site After Bowel Resection in Crohn’s Disease: Comparison of Kono-S and End-to-end Anastomosis. J Gastrointest Surg. 2019; 23(2): 312-9.
41. Landerholm K, Reali C, Mortensen NJ, Travis SPL, Guy RJ, George BD. Short- and long-term outcomes of strictureplasty for obstructive Crohn’s disease. Colorectal Dis. 2020; 22(9): 1159-68.
42. Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology. 2011; 140(6): 1785-94.
43. Khan N, Cole E, Shah Y, Paulson EC. Segmental resection is a safe oncological alternative to total proctocolectomy in elderly patients with ulcerative colitis and malignancy. Colorectal Dis. 2017; 19(12): 1108-16.
44. Frontali A, Cohen L, Bridoux V, Myrelid P, Sica G, Poggioli G, et al. Segmental Colectomy for Ulcerative Colitis: Is There a Place in Selected Patients Without Active Colitis? An International Multicentric Retrospective Study in 72 Patients. J Crohns Colitis. 2020; 14(12): 1687-92.
45. Lightner AL, Mathis KL, Dozois EJ, Hahnsloser D, Loftus EV, Jr., Raffals LE, et al. Results at Up to 30 Years After Ileal Pouch-Anal Anastomosis for Chronic Ulcerative Colitis. Inflamm Bowel Dis. 2017; 23(5): 781-90.
46. Widmar M, Munger JA, Mui A, Gorfine SR, Chessin DB, Popowich DA, et al. Diverted versus undiverted restorative proctocolectomy for chronic ulcerative colitis: an analysis of long-term outcomes after pouch leak short title: outcomes after pouch leak. Int J Colorectal Dis. 2019; 34(4): 691-7.
Therapeutische Umschau
- Vol. 80
- Ausgabe 9
- Dezember 2023