- Mise à jour sur l’ostéoporose – dépistage, diagnostic et traitement

En Suisse, l’ostéoporose touche une femme sur deux et un homme sur cinq. Les fractures se situent au niveau de la colonne vertébrale, de la hanche, de l’avant-bras, de l’humérus et du bassin, selon le PD Dr Christof Iking-Konert, de l’hôpital de ville Triemli à Zürich. Les fractures vertébrales ne sont pas rares. Elles sont cliniquement inapparentes.
Le conférencier a présenté une histoire typique d’ostéoporose : Patiente de 66 ans, IMC 23,3, fumeuse, FRAX® 23% pour MOF (Major Osteoporotic Fracture), calculé sans DXA (Dual-Energy X-ray absorptiometry).
Une grande partie des femmes à haut risque de fracture ne reçoivent pas de traitement en Suisse, selon l’orateur.
Diagnostic de l’ostéoporose
Un diagnostic précoce serait important, mais une indication remboursée pour une ostéodensitométrie comprend les points suivants:
– Ostéoporose cliniquement manifeste, y compris les fractures liées à l’ostéoporose
– Traitement à long terme à la cortisone (>5mg/d)
– Hypogonadisme (y compris ménopause précoce)
– Hyperparathyroïdie primaire
– Maladies gastro-intestinales avec malabsorption (incl. maladie de Crohn, maladie cœliaque)
– Ostéogenèse imparfaite
– Maladie du VIH
– Traitement par inhibiteur de l’aromatase (après la ménopause) ou par l’association GnRH
– Paramètres de laboratoire de base : Diagnostic différentiel, indication d’un analogue + inhibiteur de l’aromatase (avant la ménopause) ou d’un traitement anti-androgénique
– Mesure de l’évolution en cas d’ostéoporose connue tous les 2 ans, y compris mesure de l’évolution sous traitement.
Calculateur de risque FRAX® pour déterminer le risque de fracture
Le calculateur de risque FRAX permet d’estimer le risque à 10 ans de fracture de la hanche ou d’ostéoporose en tenant compte des facteurs de risque cliniques. En présence d’une ostéodensitométrie au col du fémur, le risque de fracture peut être évalué de manière encore plus précise.
Paramètres de laboratoire de base Diagnostic différentiel/indice
de la clairance de la créatine (DFG)
Abaissée en cas d’ostéopathie rénale, insuffisance rénale de degré supérieur comme contre-indica tion à divers médicaments
Protéine C-réactive
élevée en cas de maladie inflammatoire et d’indice de malignité, élevée en cas de maladie rhumatismale, de maladie auto-immune, en cas de valeur anormale en raison d’une possible indication de paraprotéinémie : électrophorèse.
Numération sanguine
TSH
GL/HbA1c
Calcium sérique
(élevé)
(abaissée)
Hyperparathyroïdie primaire syndrome paranéoplasique ou autres causes d’hypercalcémie par ex. hyperparathyroïdie secondaire, malabsorption des médicaments. Hypocalcémie comme contre-indication à plusieurs ostéoporoses.
Phosphate sérique
(augmenté)
Insuffisance rénale, stade 4 hyperparathyroïdie secondaire rénale
(abaissé)
Malabsorption, hypophosphatémie, par exemple dans le cadre d’un hypophosphatémie liée à l’X
Sérum sodique (abaissé)
Facteur de risque de fracture de la hanche, risque accru de chute, p.ex. ostéomalacie
Phosphatase alcaline (abaissé)
Indication possible d’hypophosphatasie, sous traitement antirésorptif de longue durée
(élevée)
DD augmentation de la PA d’origine hépatique
Gamma-GT (élevée)
Maladie cœliaque ou abus d’alcool (risque de chute)
(abaissé)
Lésion du foie
Paramètres différents Diagnostic différentiel recommandé
Calcium sérique (abaissé)
AP Iso-enzymes
Calculer le calcium corrigé par l’albumine, p. ex. en cas de MGUS
Calcium sérique (augmenté)
Parathormone, excrétion 24h calcium et phosphate
Vitamine D (sarcoidose) Vitamine D Hypervitaminose ?
(élevée)
Isoenzymes AP, scintigraphie du squelette si nécessaire
(abaissé)
Isoenzymes AP, pyridoxal-5-phosphate (vit B6), éventuellement génétique humaine
TSH
fT3, fT4, substitution de la thyroxine ou de la triiodothyronine ?
Gammapathie monoclonale
Immunofixation, chaînes légères
Créatinine, DFG (abaissé)
PTHm 1,25(OH)2Vitamine D
selon la clinique,
AC cœliaque, etc.
inspiré de Directives DVO sur l’ostéoporose – DVO e.V.
Retour à la vignette de la patiente – comme on pourrait s’y attendre
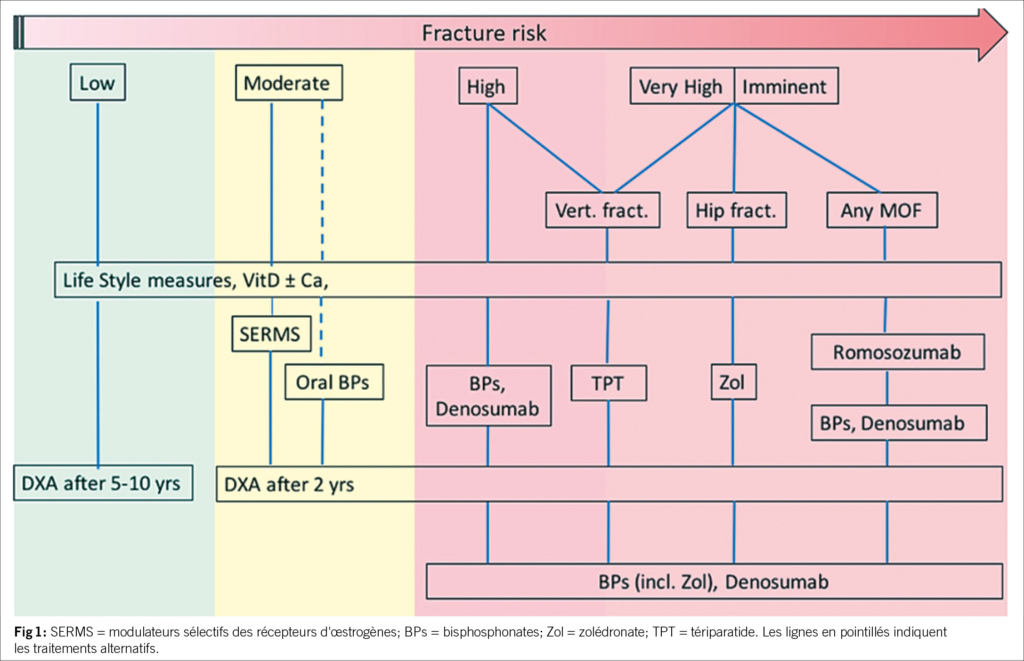
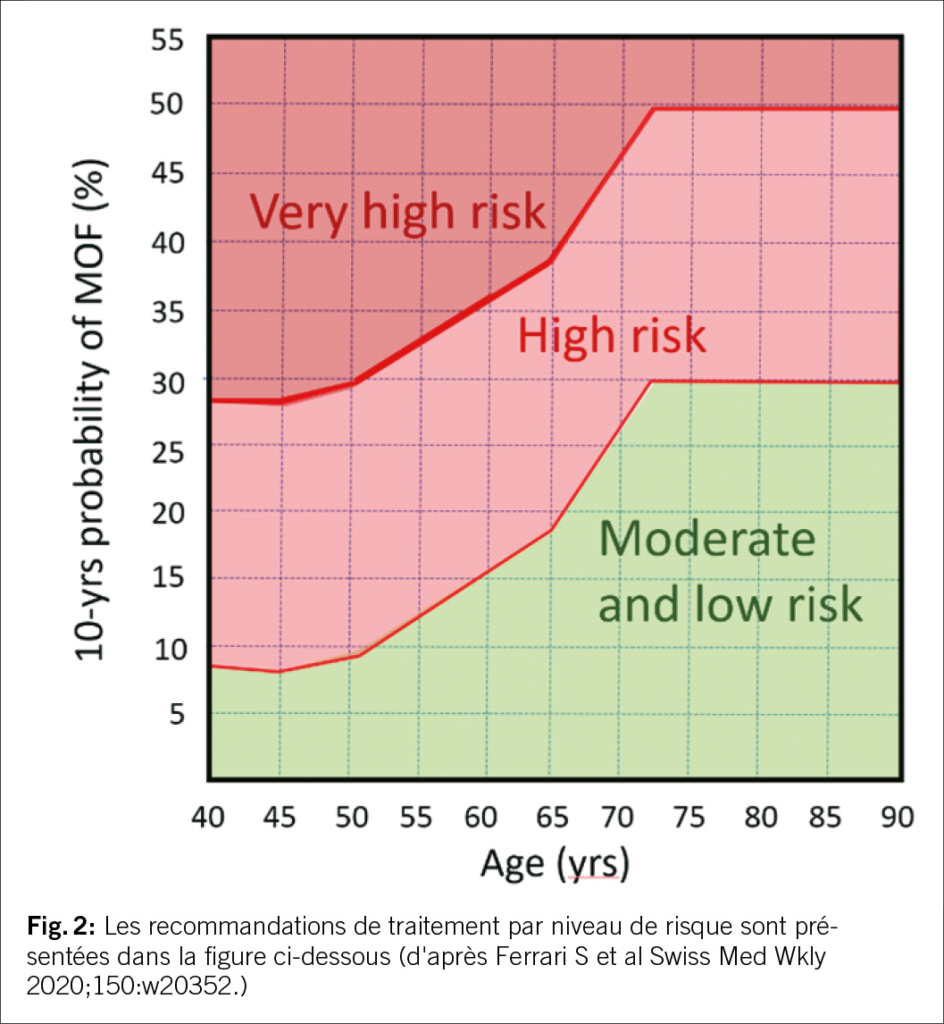
La patiente IMC 23,3, fumeuse, âgée de 68 ans, se présente pour des douleurs dorsales. Mise en évidence d’une fracture récente de la colonne lombaire 4. FRAX pour MOF 30% (T-score (col du fémur) : -2,8 SD. Les fractures de fragilité sont le principal facteur de risque d’une nouvelle fracture, d’où l’importance de la prévention des fractures après une fracture déjà subie. Le conférencier fait référence à un article dans le Swiss Medical Weekly de 2020 (Lippuner K et al. 2020 recommendations for osteoporosis treatment according to fracture risk from the Swiss Association against Osteoporosis (SVG). Swiss Med. Weekly 2020, 150:w20352).
Traitement de l’ostéoporose
Prévention des chutes par le mouvement. Physiothérapie : cours ambulatoire de sécurité de la marche. Une personne sur trois de plus de 65 ans est victime d’une chute. Il existe un équilibre entre les ostéoclastes (dégradation osseuse) et les ostéoblastes (formation osseuse). À partir de la ménopause, la résorption osseuse prédomine.
Le premier mécanisme thérapeutique est le mécanisme antirésorptif:
les bisphosphonates, le denosumab et le SERM (modulateur sélectif des récepteurs aux premiers œstrogènes) inhibent les ostéoclastes.
Traitement médicamenteux de l’ostéoporose chez les adultes âgés
L’objectif du traitement de l’ostéoporose est de prévenir les fractures. Plusieurs agents pharmacologiques sont disponibles pour réduire le risque de fracture, soit en diminuant la résorption osseuse, soit en stimulant la formation osseuse. Les bisphosphonates sont les antirésorptifs les plus répandus ; ils abaissent les marqueurs du turnover osseux à de faibles concentrations préménopausiques et réduisent les taux de fracture (corps vertébral de 50 à 70 %, corps non vertébral de 20 à 30 % et hanche de ~40 %). Les bisphosphonates atteignent un plateau après 3-5 ans.
Le dénosumab est un anticorps monoclonal anti-RANKL qui inhibe efficacement le développement et l’activité des ostéoclastes. Le dénosumab est administré tous les 6 mois par injection sous-cutanée. L’efficacité du dénosumab peut être démontrée jusqu’à 10 ans. Pour stimuler la formation osseuse, deux classes d’anabolisants sont aujourd’hui disponibles.
Le tériparatide et l’abaloparatide ciblent tous deux le récepteur de la parathormone 1. Le romosozumab est un anticorps monoclonal anti-sclérostine qui stimule la formation osseuse et inhibe la résorption. Le romosozumab est administré sous forme d’injection sous-cutanée mensuelle pendant un an. Des études comparatives directes indiquent que les anabolisants ont une plus grande efficacité contre les fractures et entraînent une plus grande augmentation de la densité osseuse que les médicaments antirésorptifs. L’effet des anabolisants est temporaire, ce qui nécessite une transition vers des médicaments antirésorptifs.
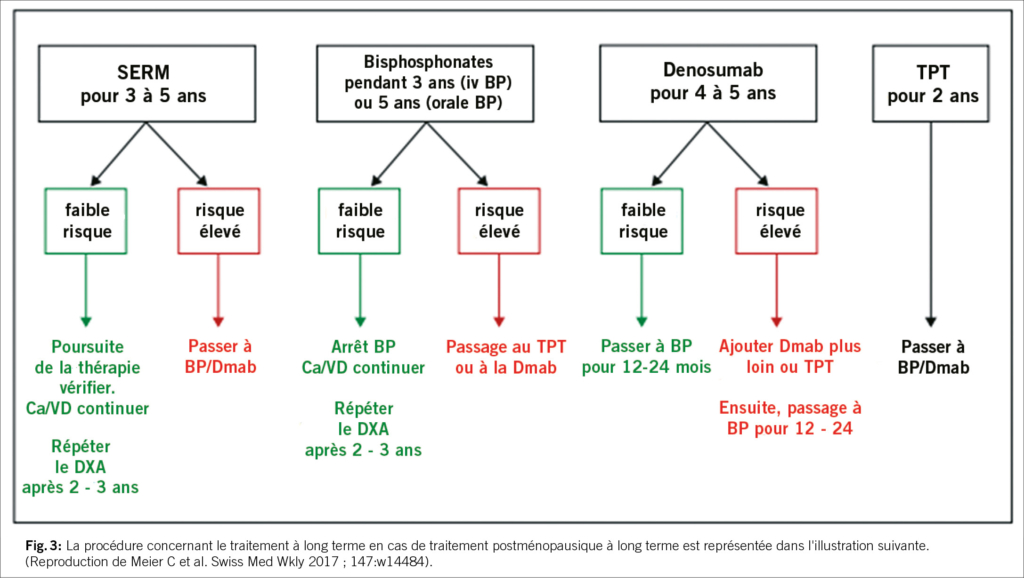
Traitement à long terme de l’ostéoporose postménopausique
L’étude BMD DATA Switch Study sur la hanche a montré que chez les femmes ménopausées ostéoporotiques passées du tériparatide au dénosumab, la densité minérale osseuse continuait d’augmenter, tandis que le passage du dénosumab au tériparatide entraînait une perte osseuse progressive ou transitoire. Ces résultats devraient être pris en compte dans le choix du traitement initial et ultérieur des patientes postménopausées atteintes d’ostéoporose.
Le traitement ostéoanabolique par romosozumab s’est avéré meilleur que le traitement antirésorptif par alendronate (Saa g KG et al N Engl J Med 2017;377:1417-1427).
Options après dénosumab pour l’ostéoporose postménopausique – Recommandations ECTS
Patient / Durée du traitement
Jeunes patients sous faible risque de fracture
Dénosumab à court terme (<2,5 ans) ou faible risque de fracture
faible risque de fracture
Dénosumab longue durée (>2.5 ans) et/ou risque de fracture élevé
Traitement/ Recommandation d’arrêt
dénosumab non recommandé
Bisphosphonates ou zolendronate oraux pour 1-2 ans
denosumab jusqu’à 10 ans
Switch sur zolendronate (début 6 mois après la dernière injection de denosumab) + mesure des DMO à 3 et 6 mois
riesen@medinfo-verlag.ch