- Patientenzentrierte Forschung zur Dosisoptimierung von Onkologika
Pharmazeutika treiben die Kosten der Krebsbehandlung erheblich an und beschränken den Zugang zu lebensrettenden Medikamenten, insbesondere in Ländern mit geringem Einkommen. Viele neue Krebsmedikamente sind teuer, was ihre Verfügbarkeit in diesen Ländern und für unversicherte Patienten stark einschränkt. Die Herstellungs- und Entwicklungskosten solcher Medikamente sind oft gering im Vergleich zu ihren Verkaufspreisen.
Pharmaceuticals significantly drive up the cost of cancer treatment and limit access to life-saving drugs, especially in low-income countries. Many new cancer drugs are expensive, which severely limits their availability in these countries and to uninsured patients. The manufacturing and development costs of such drugs are often low compared to their retail prices.
Key Words: cost of cancer treatment, cancer drugs
Orginalartikel: Annals of Oncology 2023 Aug;34(8):638-644. doi: 10.1016/j.annonc.2023.05.006.
Die Art und Weise, wie Medikamente entwickelt und dosiert werden, hat sich in den letzten Jahrzehnten kaum verändert.
Die herkömmliche Annahme war, dass höhere Dosen zu mehr Wirksamkeit führen, aber dies kann auch zu mehr Toxizität ohne zusätzlichen Nutzen führen. Die optimale Dosis für viele Medikamente ist oft erheblich niedriger als die maximale verträgliche Dosis. Die FDA hat das Optimus-Projekt ins Leben gerufen, um Dosisoptimierungsstudien für neu zugelassene Krebsmedikamente zu fordern. Dieser Ansatz könnte dazu beitragen, die Kosten zu senken und den Zugang zu lebensrettenden Medikamenten zu verbessern. Es wurden Leitlinien für die Pharmaindustrie verfasst. Durch die Testung bezgl. minimal wirksamer Dosen vor der Zulassung können unnötige Toxizitäten für den individuellen Patienten reduziert werden. Gleichzeitig können direkte Kosten durch Medikamente aber auch sekundäre Kosten der Behandlung von Nebenwirkungen reduziert werden. Selbst wenn Programme wie Optimus erfolgreich sein sollten, können vermutlich dennoch nicht in allen Fällen optimale Dosierungen gefunden werden. Weitere Studien nach Markteinführung werden somit weiterhin notwendig sein.
Die meisten klinischen Studien zur Bewertung von Krebsmedikamenten werden üblicherweise von pharmazeutischen Unternehmen durchgeführt und finanziert mit dem Ziel einer Zulassung und Vergütung. Anreize zur Durchführung von Studien, welche eine Nichtunterlegenheit zeigen sind aber kaum vorhanden. So wurden bis dato kaum Studien mit bereits patentabgelaufenen Medikamenten in neuen Indikationen durchgeführt, da dies kommerziell nicht interessant ist. Genau so wenig wurde in der Vergangenheit getestet ob Medikamente in geringerer Dosis oder weniger häufig gegeben werden könnten. Dies mutet seltsam an, in einer Welt der permanent steigenden Gesundheitskosten.
Ein neues Finanzierungsmodell, bei dem solche Studien von den Kostenträgern finanziert werden, bietet das Potenzial, diese Kosten zu reduzieren. Wenn eine Dosisoptimierungsstudie zeigt, dass das Dosierungsschema mit geringeren Kosten äquivalente Vorteile bietet, wie etwa ähnliche Überlebensraten bei geringerer Toxizität, könnten die langfristigen finanziellen Einsparungen erheblich sein.
Darüber hinaus sind die Nettokostenbelastungen für die Zahler, die solche Studien finanzieren, in der Regel null oder können sogar Geld sparen. Die Einsparungen bei den Arzneimittelkosten während der Studie können dazu verwendet werden, die Kosten der Studie zu decken. Dies macht die Finanzierung solcher Studien für die Kostenträger und Patienten bereits während der Studie attraktiv.
Die hohen Kosten für Pharmazeutika haben die Forschungsdisziplin der interventionellen Pharmakoökonomie voran gebracht. Diese Disziplin bewertet die Evidenz zur effektiven Dosierung aus klinischen und pharmakologischen Studien und strebt an, Toxizität und Kosten durch Reduzierung der Medikamentendosierung zu verringern. Frühere Veröffentlichungen haben gezeigt, dass die Verschreibungskosten für bestimmte Medikamente um mehr als 50% gesenkt werden können. Dies bedeutet, dass durch die Optimierung der Dosierung von Medikamenten erhebliche Kosteneinsparungen möglich sind.
Eine weniger einschneidende Strategie ist die Anpassung von Medikamentendosen an die Körpergrösse und das Körpergewicht der Patienten, um Toxizität und Kosten zu reduzieren. Die Anpassung der Dosen entsprechend dem Körpergewicht der Patienten kann weltweit zu erheblichen Einsparungen führen. In den USA könnte die gewichtsbasierte Dosierung von Pembrolizumab bei Lungenkrebspatienten die Kostenträger um über 800 Millionen US-Dollar pro Jahr entlasten. Kosten können auch durch Dosierungsanpassungen, z.B. durch die Einnahme mit Nahrung zur Erhöhung der Bioverfügbarkeit, oder durch den Einsatz kostengünstigerer Alternativen gesenkt werden. Das Ziel ist, die klinische Wirksamkeit beizubehalten, die Toxizität zu reduzieren und die finanzielle Belastung für Patienten und Kostenträger zu verringern.
Bei neuen Medikamenten führt die Suche nach niedrigeren, optimalen Dosierungen wahrscheinlich nicht zu niedrigeren Einführungspreisen, aber die Dosierungsoptimierung wird die Toxizität reduzieren und somit die Gesamtkosten für die Kostenträger senken. Bei bereits zugelassenen Krebsmedikamenten mit hohen Dosierungen gibt es erhebliches Potenzial zur Reduzierung von Toxizität und Kosten. Einige Pharmaunternehmen haben Preiserhöhungen vorgenommen, um ihre Einnahmen zu steigern, vor allem in den USA aber es ist schwierig, den Preis einer zugelassenen Dosis erheblich zu erhöhen, ohne öffentliche Empörung auszulösen. Das Teilen von Ampullen bei parenteralen Medikamenten wie monoklonalen Antikörpern bietet erhebliche Möglichkeiten zur Kosteneinsparung. Weniger häufige Dosierung oder kürzere Behandlungsverläufe können sowohl bei neuen als auch bei zuvor zugelassenen Medikamenten erhebliche Einsparungen bewirken.
Die Akzeptanz von abgesenkten Dosierungen von Krebstherapien in Industrieländern ist begrenzt, obwohl solche Ansätze das Potenzial haben, den Zugang zu wirksamen Behandlungen in ärmeren Ländern zu verbessern. Ein Beispiel hierfür ist die Tatsache, dass viele medizinische Leitlinien nach wie vor längere Behandlungszeiträume empfehlen (vergleiche hierzu Trastuzumab adjuvant über ein Jahr bei Brustkrebs versus kürzere Behandlung), obwohl kürzere Therapien, wie sie im Indian National Cancer Grid empfohlen werden, ebenfalls positive Ergebnisse zeigen. Ein weiteres Beispiel ist Abirateron, bei dem niedrigere Dosierungen, die zusammen mit Nahrung eingenommen werden, von der National Comprehensive Cancer Network (NCCN) als Alternative zu höheren, nüchternen Dosierungen aufgeführt sind.
Eine der Hauptursachen für die Zurückhaltung gegenüber abgesenkten Therapien liegt in der Befürchtung, dass dadurch die Wirksamkeit der Behandlung beeinträchtigt wird. Da in den Systemen der westlichen Welt keine Anreize bestehen kostengünstigere Alternativen zu wählen (Kosten werden ja von der Allgemeinheit über Prämien oder Steuergelder bezahlt) werden solche Optmierungen bis heute nicht nachgefragt. Kommt hinzu, dass höhere Dosen häufig auch mehr Nebenwirkungen bedeuten. Anstatt diese aber mit Dosisoptimierungen zu reduzieren liegt der Hauptfokus bei den behandelnden Onkologen darin, die Toxizitäten mit zusätzlichen Interventionen optimal zu managen.
Einen Lösungsansatz, Ärzte, Patienten und Zulassungsbehörden zu überzeugen, stellen Dosierungs-Optimierungsstudien dar. Diese Studien konzentrieren sich auf Medikamente, bei denen es Evidenz für die Wirksamkeit von Dosierungsanpassungen gibt. Die Evidenz kann aus verschiedenen Quellen stammen, wie beispielsweise Anträgen zur Marktzulassung durch Zulassungsbehörden, die gelegentlich Empfehlungen zur Untersuchung niedrigerer Dosen enthalten. Sie kann auch aus präklinischen Studien, Phase-1-Studien oder realen Daten kommen, wenn Ärzte vorbeugende Dosisreduktionen durchführen.
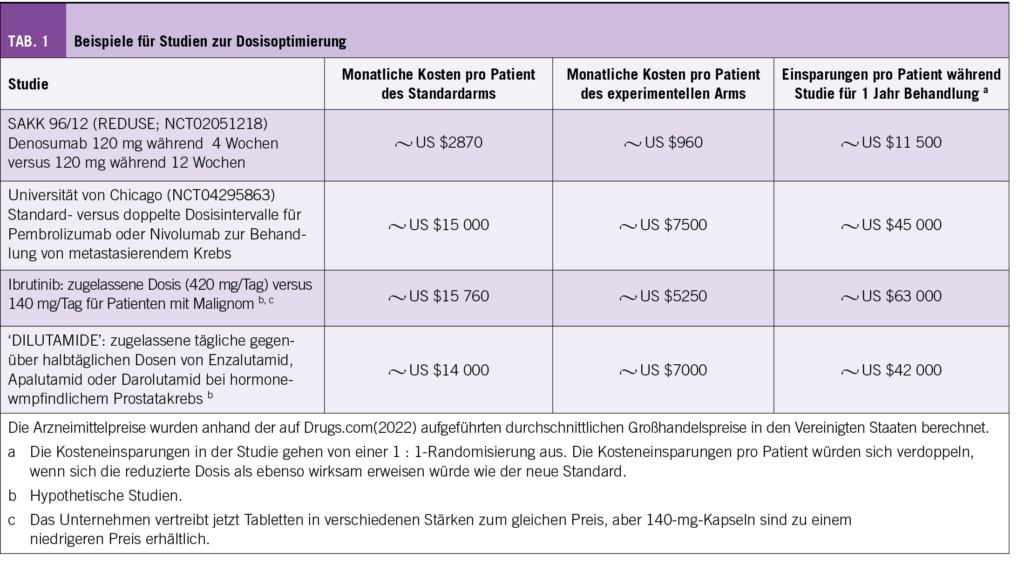
In diesem Kontext möchten wir das Interesse auf drei wichtige Antitumortherapien lenken: Immun-Checkpoint-Inhibitoren, Ibrutinib für lymphoide Malignome und Anti-Androgene der zweiten Generation für die Behandlung von Prostatakrebs. Diese Medikamente sind weit verbreitet und generieren hohe Umsätze weltweit. Es gibt Hinweise darauf, dass die in den großen Zulassungsstudien verwendeten Dosierungen bei diesen Medikamenten über den minimal wirksamen Dosen liegen, um ihre Ziele zu erreichen. Einige klinische Studien, die in Ländern mit begrenztem Medikamentenzugang durchgeführt wurden oder während der Anpassung an die COVID-19-Pandemie, haben aufgezeigt, dass niedrigere Dosierungen genauso wirksam sein könnten, und die Toxizität evtl. sogar reduzieren (Tab. 1).
Eigenfinanzierte Dosis-Optimierungsstudien: Chancen und Herausforderungen
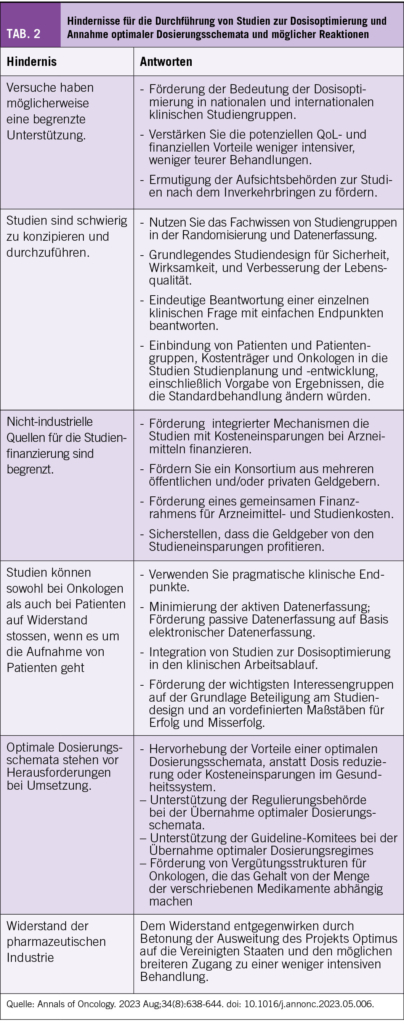
Dosis-Optimierungsstudien bieten klare Vorteile, aber sie stehen vor zahlreichen Herausforderungen bei ihrem Design, ihrer Finanzierung, der Akzeptanz von Onkologen und Patienten, der Modifizierung von Medikamentenlabels und Leitlinien sowie der Umsetzung der Ergebnisse in die Praxis. Diese Herausforderungen und mögliche Lösungen sind in Tabelle 2 aufgeführt, basierend auf begrenzten veröffentlichten Erkenntnissen und persönlichen Erfahrungen der Autoren.
Die Einbeziehung von Patienten und Onkologen in die Planung von Dosis-Optimierungsstudien ist entscheidend, um Endpunkte zu definieren, die später in der Expertenwelt akzeptiert sind und zu einer Praxisänderung führen. Der Fokus sollte auf einer besseren Verträglichkeit der Therapie liegen und damit einer besseren Lebensqualität bei keinen oder möglichst geringen Einbussen von Effektivitätsendpunkten. Nur wenn solche Studienresultate die Chance haben Leitlinien zu verändern sollten sie durchgeführt werden.
Die erforderlichen Beweise zur Veränderung der Praxis variieren wahrscheinlich je nach geografischem Kontext. In Industrieländern können große Nichtunterlegenheitsstudien erforderlich sein, insbesondere wenn die pharmazeutische Industrie die Reduzierung der Dosierung ablehnt. Solche Studien setzen strenge statistische Grenzen für den Nachweis, dass die reduzierte Behandlung im Hinblick auf den primären Nutzen (z. B. das Gesamtüberleben) nicht unter
legen ist gegenüber der Standarddosierung und dem Zeitplan. In Ländern mit niedrigem und mittlerem Einkommen (LMICs) könnten randomisierte Äquivalenzstudien mittlerer Größe mit Fokus auf Toxizitätsreduzierung und Kosten die Praxis beeinflussen.
In der Schweiz wurden bereits mehrere solcher Studien durchgeführt. Dabei konnte gezeigt werden, dass beim metastasierten Kolonkarzinom eine alleinige Erhaltungstherapie mit Bevacizumab gegenüber einer Therapiepause keinen Vorteil bietet. Eine sehr grosse Studie (Reduse, SAKK 96/12) untersucht die Gabe von Denosumab alle 3 Monate versus monatlich mit 1380 Patienten und steht kurz vor dem Ende der Rekrutierung. Die Finanzierung erfolgt über die Versicherer von Santesuisse. Der andere Krankenkassenverband Curafutura konnte sich nicht zu einer Finanzierung durchringen. Jedoch haben sowohl Helsana als auch die CSS als Einzelversicherer die Studie ebenfalls unterstützt. Einzig die Versicherungen KPT und Sanitas haben die Teilnahme verweigert und werden so, sollte die Studie positiv ausfallen als Trittbrettfahrer von ihren Konkurrenten profitieren.
Leider wurde vom BAG bei der aktuell durchgeführten KVV-Revision trotz Intervention der schweizerischen Gesellschaft für medizinische Onkologie die Aufnahme eines entsprechenden Artikels in die Verordnung abgelehnt.
Gerade in der aktuellen Zeit mit stark steigenden Kassenprämien, wären solche Optimierungen von medikamentösen Therapien ein Lösungsansatz innovative und wirksamere Therapien auch in Zukunft allen Patienten zukommen zu lassen. Ich fordere darum alle Steakholders auf mit der SGMO und der SAKK an einen Tisch zu sitzen um hier nach über 10 Jahren ohne allgemein verbindliche Regeln endlich eine Lösung zu finden.
Dieser Artikel enthält wesentliche Textpassagen von Annals of Oncology Volume 34, Issue 8, 2023, bei der R von Moos als Coautor mitgewirkt hat. Wir empfehlen an dieser Stelle diesen Artikel im Original zu lesen.
Copyright bei Aerzteverlag medinfo AG
Direktor Tumor- und Forschungszentrum
Kantonsspital Graubünden
7000 Chur
tumorzentrum@ksgr.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. World Health Organization Model List of Essential Medicines e 22nd List, 2021. Geneva: World Health Organization; 2021 (WHO/MHP/HPS/ EML/2021.02).
2. Patil V, Abraham G, Ravikrishna M, et al. Retrospective analysis: checkpoint inhibitor accessibility for thoracic and head and neck cancers and factors influencing it in a tertiary centre in India. Ecancer medicalscience. 2022;16:1464.
3. Ghosh J, Gupta S, Desai S, et al. Estrogen, progesterone and HER2 receptor expression in breast tumors of patients, and their usage of HER2-targeted therapy, in a tertiary care centre in India. Indian J Cancer. 2011;48:391-396.
4. Prasad V, Mailankody S. Research and development spending to bring a single cancer drug to market and revenues after approval. JAMA Intern Med. 2017;177:1569-1575.
5. Shah M, Rahman A, Theoret MR, Pazdur R. The drug-dosing conundrum in oncology – when less is more. N Engl J Med. 2021;385: 1445-1447.
6. US FDA. Project Optimus. Available at https://www.fda.gov/about-fda/ oncology-center-excellence/project-optimus. Accessed May 29, 2023.
7. Ratain MJ, Tannock IF, Lichter AS. Dose optimization of sotorasib: is the US Food and Drug Administration sending a message? J Clin Oncol. 2021;39:3423-3426.
8. US FDA. Available at https://www.fda.gov/media/164555/download. Accessed May 29, 2023.
9. Goldstein DA, Lichter AS, Ratain MJ. Payer funding of interventional pharmacoeconomic studies: a new paradigm. Health Affairs Blog. November 25, 2019. Available at https://www.healthaffairs.org/do/10.1377/forefront.20191119.302743/full/. Accessed May 29, 2023.
10. van Ommen-Nijhof A, Retèl VP, van den Heuvel M, Jager A, van Harten WH, Sonke GS. A revolving research fund to study efficient use of expensive drugs: big wheels keep on turning. Ann Oncol. 2021;32: 1212-1215.
11. Ratain MJ, Goldstein DA, Lichter AS. Interventional pharmacoeconomicsda new discipline for a cost-constrained environment. JAMA Oncol. 2019;5:1097-1098.
12. Serritella AV, Strohbehn GW, Goldstein DA, Lichter AS, Ratain MJ. Interventional pharmacoeconomics: a novel mechanism for unlocking value. Clin Pharmacol Ther. 2020;108:487-493.
13. Strohbehn GW, Lichter AS, Ratain MJ. US government payer-funded trials to address oncology’s drug-dosing conundrum e a congressional call to action? J Clin Oncol. 2023;41:2488-2492.
14. Tannock IF, Ratain MJ, Goldstein DA, Lichter AS, Rosner GL, Saltz LB. Near-equivalence: generating evidence to support alternative costeffective treatments. J Clin Oncol. 2021;39:950-955.
15. Goldstein DA, Ratain MJ, Saltz LB. Weight-based dosing of pembrolizumab every 6 weeks in the time of COVID-19. JAMA Oncol. 2020;6:1694-1695.
16. Goldstein DA, Harvey RD, Chan KKW. Enabling the sharing of singledose vials through risk mitigation to decrease financial toxicity. JAMA Oncol. 2022;8:821-822.
17. Gupta A, Eisenhauer EA, Booth CM. The time toxicity of cancer treatment. J Clin Oncol. 2022;40:1611-1615.
18. Gillessen S, Von Moos RAF, Hayoz S, et al. Incidence of hypocalcemia in patients with castration-resistant prostate cancer treated with denosumab: data from a non-inferiority phase III trial assessing prevention of symptomatic skeletal events (SSE) with denosumab administered every four weeks (q4w) versus every 12 weeks (q12w)dSAKK 96/12 (REDUSE). J Clin Oncol. 2019;37(suppl 7):139.
19. Koeberle D, Betticher DC, von Moos R, et al. Bevacizumab continuation versus no continuation after first-line chemotherapy plus bevacizumab in patients with metastatic colorectal cancer: a randomized phase III non-inferiority trial (SAKK 41/06). Ann Oncol. 2015;26:709-714.
20. Zander T, Pabst T, Schär S, et al. Alternate-day dosing of pomalidomide in relapsed/refractory multiple myeloma: a multicenter, single-arm phase 2 trial. Leukemia. 2023;37:699-701.
21. Amadori D, Aglietta M, Alessi B, et al. Efficacy and safety of 12-weekly versus 4-weekly zoledronic acid for prolonged treatment of patients with bone metastases from breast cancer (ZOOM): a phase 3, openlabel, randomised, non-inferiority trial. Lancet Oncol. 2013;14:663-670.
22. Himelstein AL, Foster JC, Khatcheressian JL, et al. Effect of longerinterval vs standard dosing of zoledronic acid on skeletal events in patients with bone metastases: a randomized clinical trial. JAMA. 2017;317:48-58.
23. Hortobagyi GN, Van Poznak C, Harker WG, et al. Continued treatment effect of zoledronic acid dosing every 12 vs 4 weeks in women with breast cancer metastatic to bone: the OPTIMIZE-2 randomized clinical trial. JAMA Oncol. 2017;3:906-912.
24. Clemons M, Ong M, Stober C, et al. A randomised trial of 4- versus 12- weekly administration of bone-targeted agents in patients with bone metastases from breast or castration-resistant prostate cancer. Eur J Cancer. 2021;142:132-140.
25. Piccart MJ, Hilbers FS, Bliss JM, et al. Road map to safe and welldesigned de-escalation trials of systemic adjuvant therapy for solid tumors. J Clin Oncol. 2020;38:4120-4129.
26. Pivot X, Romieu G, Debled M, et al. 6 months versus 12 months of adjuvant trastuzumab in early breast cancer (PHARE): final analysis of a multicentre, open-label, phase 3 randomised trial. Lancet. 2019;393: 2591-2598.
27. Earl HM, Hiller L, Vallier AL. 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet. 2019;393:2599-2612.
28. Gulia S, Kannan S, Badwe R, Gupta S. Evaluation of 1-year vs shorter durations of adjuvant trastuzumab among patients with early breast cancer: an individual participant data and trial-level meta-analysis. JAMA Netw Open. 2020;3:e2011777.
29. Grothey A, Sobrero AF, Shields AF, et al. Duration of adjuvant chemotherapy for stage III colon cancer. N Engl J Med. 2018;378:1177-1188.
30. Iveson TJ, Kerr RS, Saunders MP, et al. 3 versus 6 months of adjuvant oxaliplatin-fluoropyrimidine combination therapy for colorectal cancer (SCOT): an international, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2018;19:562-578.
31. Attard G, Reid AH, Yap TA, et al. Phase I clinical trial of a selective inhibitor of CYP17, abiraterone acetate, confirms that castrationresistant prostate cancer commonly remains hormone driven. J Clin Oncol. 2008;26:4563-4571.
32. Chi KN, Spratlin J, Kollmannsberger C, et al. Food effects on abiraterone pharmacokinetics in healthy subjects and patients with metastatic castration-resistant prostate cancer. J Clin Pharmacol. 2015;55:1406-1414.
33. Szmulewitz RZ, Peer CJ, Ibraheem A, et al. Prospective international randomized phase II study of low-dose abiraterone with food versus standard dose abiraterone in castration-resistant prostate cancer. J Clin Oncol. 2018;36:1389-1395.
34. Cho BC, Obermannova R, Bearz A, et al. Efficacy and safety of ceritinib (450 mg/d or 600 mg/d)with food versus 750-mg/d fasted in patients with ALK receptor tyrosine kinase (ALK)-positive NSCLC: primary efficacy results from the ASCEND-8 Study. J Thorac Oncol. 2019;14:1255-1265.
35. Earl HM, Hiller L, Dunn J, et al. Optimising the duration of adjuvant trastuzumab in early breast cancer in the UK. Clin Oncol (R Coll Radiol). 2021;33:15-19.
36. Patel A, Tannock IF, Srivastava P, et al. Low-dose abiraterone in metastatic prostate cancer: is it practice changing? Facts and facets. JCO Glob Oncol. 2020;6:382-386.
37. Rocque GB, Williams CP, Andrews C, et al. Patient perspectives on chemotherapy de-escalation in breast cancer. Cancer Med. 2021;10: 3288-3298.
38. US Food and Drug Administration Center for Drug Evaluation and Research. Clinical pharmacology and biopharmaceutics review(s): application number: 205552Orig1s000, 2013. Available at https://www.accessdata.fda.gov/drugsatfda_docs/nda/2013/205552Orig1s000 ClinPharmR.pdf. Accessed May 29, 2023.
39. Patnaik A, Kang SP, Rasco D, et al. Phase I study of pembrolizumab (MK-3475; anti-PD-1 monoclonal antibody) in patients with advanced solid tumors. Clin Cancer Res. 2015;21:4286-4293.
40. Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med. 2012;366: 2443-2454.
41. Brahmer JR, Drake CG, Wollner I, et al. Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates. J Clin Oncol. 2010;28:3167-3175.
42. Malmberg R, Zietse M, Dumoulin DW, et al. Alternative dosing strategies for immune checkpoint inhibitors to improve cost-effectiveness: a special focus on nivolumab and pembrolizumab. Lancet Oncol. 2022;23:e552-e561.
43. Motzer RJ, Rini BI, McDermott DF, et al. Nivolumab for metastatic renal cell carcinoma: results of a randomized phase II trial. J Clin Oncol. 2015;33:1430-1437.
44. Peer CJ, Heiss BL, Goldstein DA, Goodell JC, Figg WD, Ratain MJ. Pharmacokinetic simulation analysis of less frequent nivolumab and pembrolizumab dosing: pharmacoeconomic rationale for dose deescalation. J Clin Pharmacol. 2022;62:532-540.
45. Goldstein DA, Ratain MJ. Alternative dosing regimens for atezolizumab: right dose, wrong frequency. Cancer Chemother Pharmacol. 2019;84: 1153-1155.
46. Patil VM, Noronha V, Menon N, et al. Low-dose immunotherapy in head and neck cancer: a randomized study. J Clin Oncol. 2023;41: 222-232.
47. Patel A, Goldstein DA, Tannock IF. Improving access to immunotherapy in low- and middle-income countries. Ann Oncol. 2022;33:360-361.
48. Hirsch I, Goldstein DA, Tannock IF, Butler MA, Gilbert DC. Optimising the dose and schedule of immune checkpoint inhibitors for global access. Nat Med. 2022;28:2236-2237.
49. Chen LS, Bose P, Cruz ND, et al. A pilot study of lower doses of ibrutinib in patients with chronic lymphocytic leukemia. Blood. 2018;132: 2249-2259.
50. Ratain MJ, Moslehi JJ, Lichter AS. Ibrutinib’s cardiotoxicity-an opportunity for postmarketing regulation. JAMA Oncol. 2021;7:177-178.
51. Ratain MJ, Tannock IF, Lichter AS. The dosing of ibrutinib and related Bruton’s tyrosine kinase inhibitors: eliminating the use of brute force. Blood Adv. 2022;6:5041-5044.
52. Scher HI, Beer TM, Higano CS, et al. Antitumour activity of MDV3100 in castration-resistant prostate cancer: a phase 1-2 study. Lancet. 2010;375:1437-1446.
53. Rathkopf DE, Morris MJ, Fox JJ, et al. Phase I study of ARN-509, a novel antiandrogen, in the treatment of castration-resistant prostate cancer. J Clin Oncol. 2013;31:3525-3530.
54. Fizazi K, Massard C, Bono P, et al. Activity and safety of ODM-201 in patients with progressive metastatic castration-resistant prostate cancer (ARADES): an open-label phase 1 dose-escalation and randomised phase 2 dose expansion trial. Lancet Oncol. 2014;15: 975-985.
55. Rocque GB, Andrews C, Lawhon VM, et al. Oncologist-reported barriers and facilitators to enrolling patients in optimization trials that test less intense cancer treatment. JCO Oncol Pract. 2023;19:e263-e273.
56. Bouche G, Meheus L. Ensuring completeness and timeliness of cancer treatment guidelines. Nat Rev Clin Oncol. 2022;19:563-564.
57. Quartagno M, Walker AS, Babiker AG, et al. Handling an uncertain control group event risk in non-inferiority trials: non-inferiority frontiers and the power-stabilizing transformation. Trials. 2020; 21:145.
58. Garattini S, Bertele V. “Non-inferiority trials are unethical because they disregard patients’ interests.” Lancet. 2007;370:1875-1877.
59. Jatoi I, Gail MH. The need for combined assessment of multiple outcomes in noninferiority trials in oncology. JAMA Oncol. 2020;6:420-424.
60. United States Senate Appropriations Bill. Available at https://www. appropriations.senate.gov/imo/media/doc/AGFY23RPT.PDF. Accessed May 29, 2023.
info@onco-suisse
- Vol. 13
- Ausgabe 8
- Dezember 2023