- Oligometastasiertes Prostatakarzinom
Das Konzept der Oligometastasierung als fortgeschrittenes Tumorstadium, welches dennoch in kurativer Intention behandelt werden könne, wurde 1995 von Hellman und Weichselbaum formuliert (1). Beispiele für eine kurative Metastasen-gerichtete Therapie (MDT) sind die Resektion von Lebermetastasen von kolorektalen Tumoren (2–5), von adrenalen Metastasen von nicht-kleinzelligen Bronchialkarzinomen (6) oder von Lungenmetastasen verschiedener Tumoren (7). Ziel dieser Arbeit ist es, die Evidenz zur MDT beim oligometastasierten Prostatakarzinom zusammenzufassen und ein paar konkrete Empfehlungen zu geben.
The concept of oligometastasis as an advanced tumour stage that can nevertheless be treated with curative intent was formulated by Hellman and Weichselbaum in 1995 (1).Examples of curative metastasis-directed therapy (MDT) include resection of liver metastases from colorectal tumours (2-5), adrenal metastases from non-small cell lung cancer (6) or lung metastases from various tumours (7). The aim of this paper is to summarise the evidence on MDT for oligometastatic prostate cancer and to make some specific recommendations.
Key Words: oligometastasis, curative metastasis-directed therapy (MDT), radiotherapy, stereotactic ablative radiotherapy, oligometastatic prostate cancer
Das oligometastasierte Prostatakarzinom (omPC) wird meist charakterisiert als das Vorliegen von maximal drei Fernmetastasen (M1), typischerweise Lymphknoten- und/oder Knochenmetastasen (8). Die beste Evidenz für Behandlungsempfehlungen beim metastasierten Hormon-sensitive Prostatakarzinom (mHSPC), welches auch das oligometastasierte Hormon-sensitiven Prostatakarzinom (omHSPC) umfasst, gibt es für palliative medikamentöse Therapien. Die Grundlage der Systemtherapie stellt dabei eine Androgendeprivation (ADT) dar, wobei die Intensivierung der Therapie durch die Ergänzung von Androgen Receptor Pathway Inhibitors (ARPI) und in ausgewählten Fällen von Docetaxel die Prognose deutlich verbessert werden kann (9–17).
Im Falle einer bei Erstdiagnose vorliegenden Oligometastasierung (d.h. synchrone Metastasierung) ist häufig auch die Definition einer low volume Erkrankung gemäss CHAARTED-Kriterien erfüllt (16), bei der nach den Ergebnissen aus der STAMPEDE-Studie eine hypofraktionierte Bestrahlung des Primärtumors neben der Standard ADT zu einer absoluten Verbesserung des Gesamtüberlebens von 8% nach 3 Jahren führt (18). In kürzlich präsentierten Ergebnissen der PEACE-1-Studie, zeigte sich in dieser Situation jedoch mit ADT plus Abiraterone (+/- Docetaxel) behandelten Männern durch eine Bestrahlung der Prostata zwar eine Verbesserung des radiographisch Progressions-freien Überlebens (rPFS), jedoch keine Verbesserung des Gesamtüberlebens (19). Daten aus randomisierten Studien für eine MDT bei synchron omHSPC liegen bisher kaum vor. Eine Radiotherapie z. B. einer singulären Knochenmetastase im Bereich der Symphyse kommt allenfalls pragmatisch in Betracht, wenn der Primärtumor bestrahlt wird und dies nicht zu einem relevant höheren Toxizitätsrisiko führt.
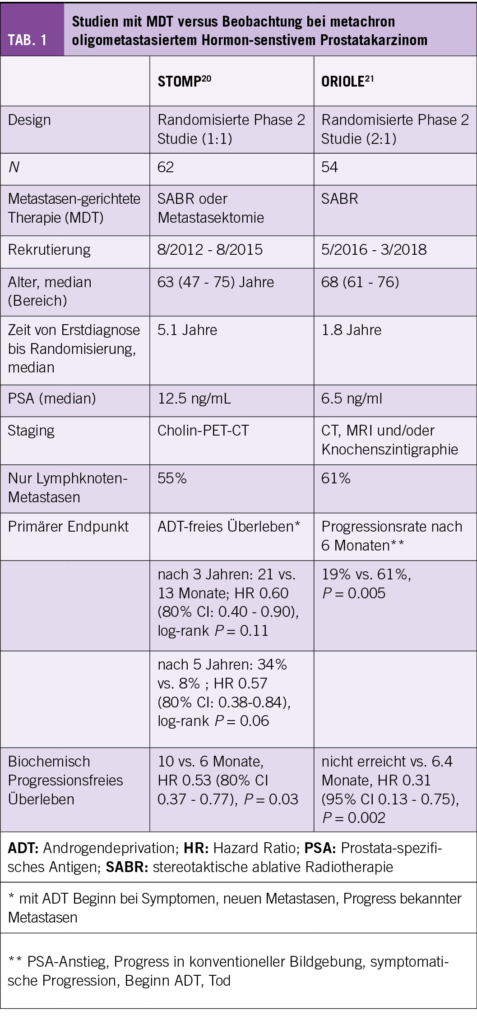
Die besten Daten für eine MDT beim omHSPC nach vorgängiger kurativ intendierter Behandlung mittels Prostatektomie oder Radiotherapie (d.h. metachrone Metastasierung) stammen von den randomisierten Phase 2 Studien STOMP und ORIOLE (20, 21). In beiden Studien wurden asymptomatische Patienten mit maximal drei Metastasen eingeschlossen, festgestellt mittels Cholin-PET/CT in der STOMP-Studie (20) bzw. Computertomographie, Magnetresonanztomographie und/oder Knochenszintigraphie in der ORIOLE-Studie (21). Die Patienten wurden anschliessend randomisiert zu einer lokalen Therapie (stereotaktische ablative Radiotherapie, SABR) oder Beobachtung; in der STOMP-Studie war auch eine Resektion pelviner Lymphknotenmetastasen (cN1) möglich (20). In beiden Studien zeigte sich ein signifikanter Unterschied im primären Endpunkt: In der STOMP-Studie fand sich eine Verlängerung der ADT-freien Zeit von median 8 Monaten (20) und in der ORIOLE-Studie eine absolute Reduktion der Progressionswahrscheinlichkeit nach 6 Monaten um 42% (21). Beeindruckend ist die ADT-freie Rate von 34% nach 5 Jahren bei der STOMP-Studie. Die Charakteristika und Ergebnisse beider Studien sind in der Tabelle 1 zusammengefasst.
Bei der Interpretation dieser Daten ist zunächst zu konstatieren, dass eine reine Verlaufsbeobachtung – anders als bei der Planung der Studien – heute kein übliches Vorgehen mehr darstellt und lediglich bei geringer Krankheitsdynamik eine Option darstellt. Weiters handelt es sich um kleinere Phase 2 Studien mit einer beträchtlichen Wahrscheinlichkeit für ein falsch-positives Ergebnis (alpha Fehler). Auch die Bildgebung für den Studieneinschluss dürfte heutzutage an vielen Orten vom sensitiveren PSMA-PET/CT-Untersuchungen abgelöst worden sein. Die Bedeutung hiervon illustriert eine Substudie der ORIOLE-Studie, in der bei allen Männern vor SABR auch ein PSMA-PET gemacht wurde, wobei die Investigatoren bei der Therapieplanung keine Kenntnis der entsprechenden Befunde hatten (21). Es zeigte sich dann, dass bei fast der Hälfte der mit SABR behandelten Männer, viele PET-positive Befunde nicht von den Bestrahlungsvolumina erfasst worden waren. Bemerkenswerterweise zeigte sich nach 6 Monaten dann nur bei 1/19 Männern (5%) mit Behandlung aller Metastasen eine Progression im Vergleich zu 6/16 (38%) bei denen nicht alle PET-positiven Befunde bestrahlt worden waren. Ein ähnliches Bild zeigte sich für den sekundären Endpunkt Progressions-freies Überleben (PFS) mit einer Hazard Ratio (HR) von 0.26 (P = 0.006) zu Gunsten von Patienten ohne nicht-behandelte Metastasen (21).
Gibt es andere Faktoren, welche mit einem Benefit einer Metastasen-gerichteten Therapie korrelieren? Interessanterweise war der Unterschied im ADT-freien Überleben in der STOMP-Studie bei Männern mit einer PSA-Verdoppelungszeit ≤ 3 Monaten deutlich grösser als bei Männern mit einer PSA-Verdoppelungszeit >3 Monaten (20). In einer kürzlich publizierten kombinierten Analyse der beiden Studien mit einem median Follow-up von 53 Monaten konnte bei 70 Patienten ein next generation sequencing (NGS) durchgeführt werden, wobei der relative Benefit einer Metastasen-gerichteten Therapie (MDT) bei Vorliegen einer Hochrisiko-Signatur (definiert als Mutation in ATM, BRCA1/2, Rb1 oder TP53) tendenziell grösser war als wenn eine solche Signatur nicht vorlag: Hazard Ratio für Progression-freies Überleben (HRPFS) 0.05 vs. HRPFS 0.42 (P für Interaktion 0.12) (22). Oder in absoluten Zahlen: Medianes PFS mit Hochrisiko-Signatur 7.5 Monate (MDT) vs. 2.8 Monate (Beobachtung) bzw. ohne Vorliegen einer Hochrisiko-Signatur 13.4 Monate (MDT) vs. 7.0 Monate (Beobachtung) (22). Falls in weiteren Studien bestätigt, dürfte diese Unterscheidung hilfreich sein, da insgesamt Männer mit einem metachron oligometastasierten Prostatakarzinom eine ausgezeichnete Prognose haben (mittleres Überleben in der Grössenordnung von acht Jahren mit alleiniger ADT) (23).
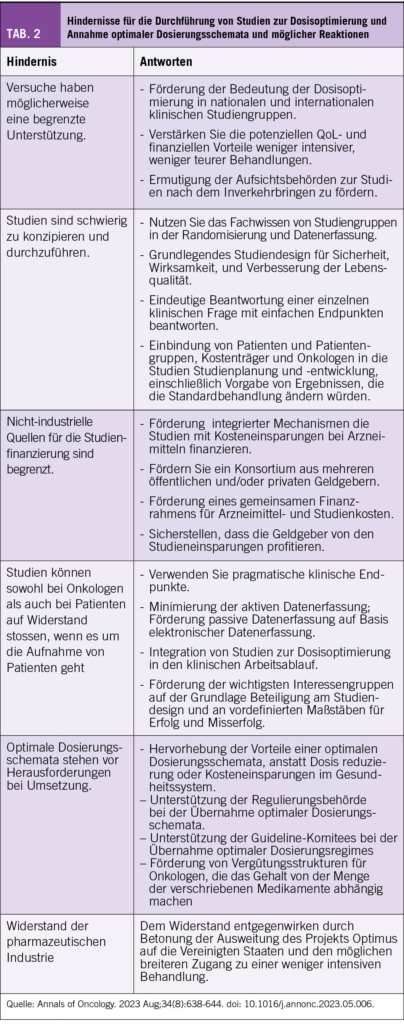
Eine synergistische Wirkung zwischen Radiotherapie und endokriner Therapie ist in der lokalisierten Situation klar belegt (24). Eine kurzzeitige systemische Therapie bestehend aus ADT + ARPI in Kombination mit MDT kann, basierend auf der EXTEND-Studie, erwogen werden (25). In dieser randomisierten Phase 2 Studie wurden Männer mit oligometastasiertem Prostatakarzinom (definiert als maximal 5 Metastasen, diagnostiziert mittels Computertomographie und Knochenszintigraphie oder Fluciclovine F18 PET/CT) nach mindestens zweimonatiger ADT randomisiert zu einer zusätzlichen ablativen Strahlentherapie aller Metastasen unter Fortführung der ADT mit oder ohne ARPI oder einer alleinigen Fortführung der ADT mit oder ohne ARPI. Die endokrine Therapie wurde nach 6 Monaten pausiert und erst bei biochemischer/radiographischer Progression wieder begonnen (intermittierende Gabe). Der primäre Endpunkt war PFS. Mehr als 60% der Patienten in der Gruppe mit der zusätzlichen Strahlentherapie und lediglich 30% der Patienten in der Gruppe ohne Strahlentherapie benötigten 2 Jahre nach Studieneinschluss keinen Wiederbeginn der systemischen Therapie (25). Weitere Details zu Studien sind in Tabelle 2 zusammengefasst.
In der erwähnten EXTEND-Studie mit recht heterogenem Patientenkollektiv wurden insgesamt auch 7 Patienten mit oligometastasiertem Kastrations-resistentem Prostatakarzinom (omCRPC) eingeschlossen, aber auf Grund der Subgruppengrösse nicht separat ausgewertet (25). Randomisierte Daten für eine MDT bei omCRPC liegen ansonsten nicht vor und das Vorgehen in dieser Situation bedarf wie auch das Management einer Oligoprogression (z.B. Progress einer singulären Metastase bei ansonsten ansprechenden oder stabilen Metastasen) einer Einzelfallentscheidung.
Zusammenfassend kann zum oligometastasierten Prostatakarzinom festgehalten werden, dass drei randomisierte Phase 2 Studien eine Verlängerung der Progressions-freien Zeit durch eine Metastasen-gerichtete Therapie – typischerweise eine stereotaktische Radiotherapie – bei metachroner Metastasierung zeigen konnten, eine Systemtherapie jedoch auch bei Oligometastasierung die Standardbehandlung darstellt. Eine Metastasen-gerichtete Therapie (MDT) ohne begleitende Systemtherapie kommt im Einzelfall bei gut informierten Patienten nach PSMA-PET/CT und sorgfältiger interdisziplinärer Evaluation in Betracht, insbesondere um Nebenwirkungen der endokrinen Therapie zu vermeiden (26). Die Kombination MDT mit einer zeitlich unbegrenzten endokrinen Therapie sollte aus unserer Sicht jedoch kritisch hinterfragt werden, da in den erwähnten Studien STOMP und ORIOLE eine solche Kombination nicht vorgesehen war bzw. eine Verlängerung der ADT-freien Zeit gerade das primäre Studienziel darstellte (STOMP-Studie). Eine zeitlich begrenzte endokrine Therapie in Kombination mit einer MDT kann hingegen, wie durch die EXTEND-Studie illustriert, ebenfalls bei gut informierten Patienten, auch ein sinnvolles Vorgehen darstellen.
Copyright bei Aerzteverlag medinfo AG
Medizinische Onkologie, St. Claraspital, Basel, Schweiz;
St. Clara Forschung, Basel, Schweiz;
Medizinische Fakultät, Universität Basel, Basel, Schweiz
Arnoud.Templeton@claraspital.ch
Radioonkologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
Arnoud J. Templeton hat Honorare erhalten von Astellas (persönlich [P], an die eigene Institution [I]), Bayer (I), Janssen (P, I), MSD (I), Roche (I), SAKK (P); er hat an Advisory Boards mit Vergütung teilgenommen von MSD (P, I), Sanofi (I), Roche (I), Janssen (I), Bayer (I), Pfizer (I), Ipsen (I), Sandoz (I), BMS (I); er hat Kongressunterstützung erhalten von Orion Pharma (P), Roche (P).
Alexandros Papachristofilou hat Honorare erhalten von Debiopharm, Janssen, Merck und Sanofi sowie Kongressunterstützung von Bayer, Astellas, AstraZeneca.
◆ Bei synchron metastasiertem, oligometastasiertem ProstataCa besteht in der Regel keine Indikation für die Radiotherapie von asymptomatischen Fernmetastasen.
◆ Eine hypofraktionierte Strahlentherapie des Primärtumors kann gemäss STAMPEDE-Studie weiterhin empfohlen werden, der absolute Benefit dürfte jedoch im Zeitalter der eskalierten systemischen Therapie geringer sein.
◆ Eine Radiotherapie von einzelnen Metastasen kann die ADT-freie Zeit verlängern.
1. Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol Off J Am Soc Clin Oncol 1995;13(1):8–10.
2. Pawlik TM, Scoggins CR, Zorzi D, et al. Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases. Ann Surg 2005;241(5):715–22, discussion 722-724.
3. Fong Y, Fortner J, Sun RL, Brennan MF, Blumgart LH. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 1999;230(3):309–18; discussion 318-321.
4. Nordlinger B, Guiguet M, Vaillant JC, et al. Surgical resection of colorectal carcinoma metastases to the liver. A prognostic scoring system to improve case selection, based on 1568 patients. Association Française de Chirurgie. Cancer 1996;77(7):1254–62.
5. Hughes KS, Simon R, Songhorabodi S, et al. Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery 1986;100(2):278–84.
6. Strong VE, D’Angelica M, Tang L, et al. Laparoscopic adrenalectomy for isolated adrenal metastasis. Ann Surg Oncol 2007;14(12):3392–400.
7. Pastorino U, Buyse M, Friedel G, et al. Long-term results of lung metastasectomy: prognostic analyses based on 5206 cases. J Thorac Cardiovasc Surg 1997;113(1):37–49.
8. Gillessen S, Attard G, Beer TM, et al. Management of Patients with Advanced Prostate Cancer: The Report of the Advanced Prostate Cancer Consensus Conference APCCC 2017. Eur Urol 2018;73(2):178–211.
9. Smith MR, Hussain M, Saad F, et al. Darolutamide and Survival in Metastatic, Hormone-Sensitive Prostate Cancer. N Engl J Med 2022;386(12):1132–42.
10. Fizazi K, Foulon S, Carles J, et al. Abiraterone plus prednisone added to androgen deprivation therapy and docetaxel in de novo metastatic castration-sensitive prostate cancer (PEACE-1): a multicentre, open-label, randomised, phase 3 study with a 2 × 2 factorial design. The Lancet 2022;399(10336):1695–707.
11. Chi KN, Agarwal N, Bjartell A, et al. Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2019;381(1):13–24.
12. Davis ID, Martin AJ, Stockler MR, et al. Enzalutamide with Standard First-Line Therapy in Metastatic Prostate Cancer. N Engl J Med 2019;381(2):121–31.
13. Armstrong AJ, Szmulewitz RZ, Petrylak DP, et al. ARCHES: A Randomized, Phase III Study of Androgen Deprivation Therapy With Enzalutamide or Placebo in Men With Metastatic Hormone-Sensitive Prostate Cancer. J Clin Oncol 2019;37(32):2974–86.
14. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2017;377(4):352–60.
15. James ND, de Bono JS, Spears MR, et al. Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 2017;377(4):338–51.
16. Sweeney CJ, Chen Y-H, Carducci M, et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. N Engl J Med 2015;373(8):737–46.
17. James ND, Sydes MR, Clarke NW, et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. The Lancet 2016;387(10024):1163–77.
18. Parker CC, James ND, Brawley CD, et al. Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet Lond Engl 2018;392(10162):2353–66.
19. Bossi A, Foulon S, Maldonado X, et al. Prostate irradiation in men with de novo, low-volume, metastatic, castration-sensitive prostate cancer (mCSPC): Results of PEACE-1, a phase 3 randomized trial with a 2×2 design. J Clin Oncol 2023;41(17_suppl):LBA5000–LBA5000.
20. Ost P, Reynders D, Decaestecker K, et al. Surveillance or Metastasis-Directed Therapy for Oligometastatic Prostate Cancer Recurrence: A Prospective, Randomized, Multicenter Phase II Trial. J Clin Oncol Off J Am Soc Clin Oncol 2018;36(5):446–53.
21. Phillips R, Shi WY, Deek M, et al. Outcomes of Observation vs Stereotactic Ablative Radiation for Oligometastatic Prostate Cancer: The ORIOLE Phase 2 Randomized Clinical Trial. JAMA Oncol 2020;6(5):650–9.
22. Deek MP, Van der Eecken K, Sutera P, et al. Long-Term Outcomes and Genetic Predictors of Response to Metastasis-Directed Therapy Versus Observation in Oligometastatic Prostate Cancer: Analysis of STOMP and ORIOLE Trials. J Clin Oncol Off J Am Soc Clin Oncol 2022;40(29):3377–82.
23. Francini E, Gray KP, Xie W, et al. Time of metastatic disease presentation and volume of disease are prognostic for metastatic hormone sensitive prostate cancer (mHSPC). The Prostate 2018;78(12):889–95.
24. Bolla M, de Reijke TM, Van Tienhoven G, et al. Duration of Androgen Suppression in the Treatment of Prostate Cancer. N Engl J Med 2009;360(24):2516–27.
25. Tang C, Sherry AD, Haymaker C, et al. Addition of Metastasis-Directed Therapy to Intermittent Hormone Therapy for Oligometastatic Prostate Cancer: The EXTEND Phase 2 Randomized Clinical Trial. JAMA Oncol 2023;9(6):825–34.
26. Templeton AJ, Omlin A, Berthold D, et al. Interdisciplinary Swiss consensus recommendations on staging and treatment of advanced prostate cancer. Swiss Med Wkly 2023;153:40108.
info@onco-suisse
- Vol. 13
- Ausgabe 8
- Dezember 2023