- Wann welche Thrombocyten-Aggregationshemmer, wann orale Antikoagulation in der Kardiologie?
Die antithrombotische Therapie bei kardialen Erkrankungen hat sich in den letzten 30 Jahren durch die Etablierung neuer Thrombocytenaggregationshemmer und neuer oraler Antikoagulantien stark verändert. Die Wahl der einzelnen Substanzen und die Festlegung der Behandlungsdauer stellen im klinischen Alltag eine grosse Herausforderung dar. Die heutigen in vielen 100 Seiten dargestellten Richtlinien basieren auf zahlreichen grossen randomisierten Studien, welche sich in erster Linie am Nutzen, nämlich der Verhinderung von atherothrombotischen und thromboembolischen Ereignissen und am Risiko der durch die Gerinnungshemmung in Kauf genommenen Blutungen orientiert. Die Übersicht orientiert sich an den in diesem Zusammenhang kardiologisch wichtigsten Krankheitsbildern Koronare Herzkrankheit, Klappenerkrankungen, Vorhofflimmern/Vorhofflattern und Thrombose/Lungenembolie.
Antithrombotic therapy for cardiac diseases has changed considerably over the last 30 years due to the establishment of new platelet inhibitors and new oral anticoagulants. The choice of individual substances and the determination of the duration of treatment represent a major challenge in everyday clinical practice. The current guidelines, presented in many hundreds of pages, are based on numerous large randomized studies, which are primarily oriented towards the benefit, namely the prevention of atherothrombotic and thromboembolic events and the risk of bleeding associated with anticoagulation. The overview is based on the most important cardiac disease entities in this context: coronary heart disease, valve disease, atrial fibrillation/atrial flutter and thrombosis/pulmonary embolism.
Key words: Thrombocytenaggregationshemmung, Orale Antikoagulation, Akutes und chronisches Coronarsyndrom, Vorhofflimmern/Vorhofflattern
Einleitung
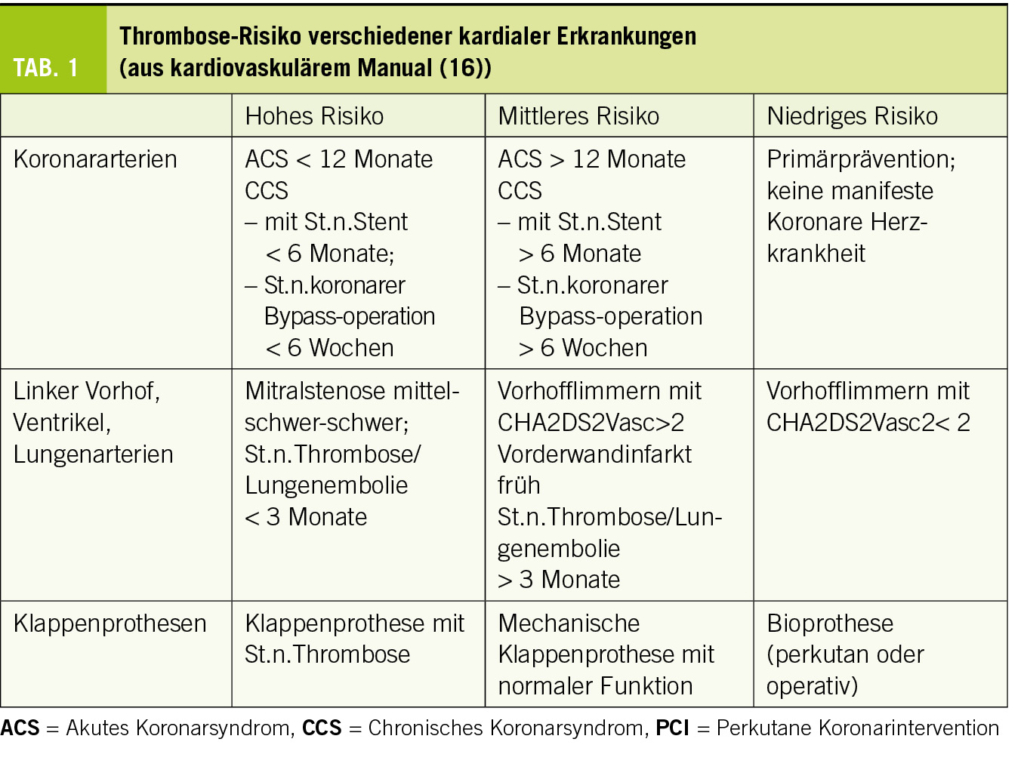
Arterielle und venöse thrombotische und thromboembolische Ereignisse sind für einen wesentlichen Teil der kardiovaskulären Erkrankungen verantwortlich, beispielsweise im Rahmen der koronaren Herzkrankheit, von Vorhofflimmern und –flattern oder von venösen Thrombosen und Lungenembolien. Die Thrombocytenaggregationshemmung sowie die Hemmung der plasmatischen Gerinnung beeinflussen entscheidend den Verlauf dieser kardiovaskulären Erkrankungen durch Reduktion von thrombotischen Ereignissen im arteriellen und venösen System. Generell aber ist eine effiziente Gerinnungshemmung immer auch mit einem erhöhten Blutungsrisiko verbunden. Der Erfolg einer antithrombotischen Behandlung misst sich am Netto-Benefit zwischen Verhinderung von thrombotischen Ereignissen und der Inkaufnahme von (mehr) Blutung. Für verschiedene Krankheitsentitäten lässt sich das Thromboserisiko in drei Risikogruppen einteilen (Tab. 1).
Zur Abschätzung des Blutungsrisikos existieren je nach Krankheitsbild unterschiedliche Scores, welche zurzeit noch validiert werden. Die Darstellung der diversen Scores bei der Koronaren Herzkrankheit sprengt den Rahmen dieser Übersicht. Hier sei auf weiterführende Literatur verwiesen (1).
Im Laufe der vergangenen Jahrzehnte sind für die Thrombocyten-Aggregationshemmung neben niedrig dosierter Acetylsalicysäure verschiedene andere orale Substanzen dazugekommen; heute am wichtigsten sind die P2Y12-Inhibitoren Clopidogrel (Plavix®), Prasugrel (Efient®) und Ticagrelor (Brillique®). Zur plasmatischen Gerinnungshemmung werden neben dem Vitamin-K-Antagonisten (VKA) Phenprocoumon (Marcourmar®) und Acenocoumarol (Sintrom®) die NOAKs (Nicht-Vitamin-K-abhängige orale Antikoagulation) in Form der Faktor-Xa-Antagonisten Rivaroxaban (Xarelto®), Apixaban (Eliquis®) und Edoxaban (Lixiana®) und des direkten Thrombin-Inhibitor Dabigatran (Pradaxa®) eingesetzt. Die Wahl der einzelnen Substanzen bzw. allfällige Kombinationen stellt im klinischen Alltag eine grosse Herausforderung dar. In der folgenden Übersicht soll mittels klinischer Standardsituation das Prinzip des rationalen Einsatzes der verschiedenen Substanzen aufgezeigt werden.
Koronare Herzkrankheit
Heutiger Stellenwert der Thrombocytenaggregationshemmung in der Primärprävention
Der Stellenwert von Acetyl-Salicyl-Säure (ASS) in der Dosierung von 75-100mg pro Tag in der Primärprävention einer Koronaren Herzkrankheit ist in den letzten Jahren aufgrund eines ungünstigen Nutzen-Risikos immer mehr in Frage gestellt worden. Mehrere grosse randomisierte Studien haben gezeigt, dass das leicht erhöhte Blutungsrisiko die Verhinderung von kardiovaskulären Ereignissen überwiegt. Eine in diesem Zusammenhang durchgeführte Meta-Analyse anhand von 11 Studien mit insgesamt über 150’000 Probanden zeigte zwar eine 20%ige relative Risikoreduktion von Myokardinfarkten, jedoch keine Reduktion der kardiovaskulären Mortalität, und dies um den Preis von signifikant mehr Blutungen, insbesondere 50% mehr Hirnblutungen (2). Die aktuellen europäischen und amerikanischen Richtlinien raten deshalb in der kardiovaskulären Primärprävention vom Einsatz von niedrig-dosiertem Aspirin (75-100mg täglich) ab (3, 4). Zudem ist unklar, ob die Einnahme von Aspirin das Risiko der Inzidenz oder Mortalität von Darmkrebs verringert (3).
Wo die Grenze zwischen Primär- und Sekundärprävention ist, bleibt arbiträr. Durch verschiedene Risikorechner wie den in der Schweiz hauptsächlich verwendeten AGLA-Score, den ESC-SCORE-2 und ESC-SCORE2-OP lassen sich Risikokategorien für die Wahrscheinlichkeit des Auftretens eines zukünftigen kardiovaskulären Ereignisses berechnen: Ein sehr hohes Risiko entspricht im AGLA-Score einer berechneten 10-Jahreseintrittswahrscheinlichkeit von mehr als 30 Prozent für ein tödliches oder nicht-tödliches kardiovaskuläres Ereignis, vergleichbar mit einer im ESC-Score-2 berechneten Wahrscheinlichkeit von mehr als 10 Prozent eines tödlichen vaskulären Ereignisses in 10 Jahren. Die Ziel-Werte für die LDL-Senkung sind hier genau definiert. Wann hingegen mit einer Thrombocytenaggregationshemmung begonnen werden soll, ist nicht ebenso klar geregelt und soll individuell festgelegt werden (4).
Thrombocytenaggregationshemmung bei Chronischem Koronarsyndrom (CCS) und akutem Koronarsyndrom (ACS)
Der Begriff des Chronischen Koronarsyndroms ist 2019 eingeführt worden und soll auf die potentiell dynamische Komponente der chronischen koronaren Herzkrankheit hinweisen (5).
Auch heute ist bei etablierter kardiovaskulärer Erkrankung die tägliche Einnahme von 75-100mg ASS erste Wahl zur antithrombotischen Sekundärprävention (5). Die irreversible Tc-Aggregations-Hemmung ist assoziiert mit einer signifikanten Reduktion zukünftiger kardiovaskulärer Ereignisse inkl. einer 10%igen Reduktion der kardiovaskulären Mortalität (6). Höhere ASS-Dosierungen erhöhen nicht den Effekt der Tc-Aggregationshemmung, jedoch das Risiko von gastrointestinalen Nebenwirkungen. Anstelle von ASS kann unter bestimmten Umständen auch eine Monotherapie mit einem P2Y12-Inhibitor durchgeführt werden: Insbesondere Patienten mit PAVK und KHK könnten von gemäss einer schon im Jahre 1996 publizierten Studie von Clopidogrel profitieren (5).
In erster Linie wird bei ASS-Intoleranz Clopidogrel in einer Dosierung von 75mg empfohlen. Bzgl. einer differenzierten Darstellung sei auf die ausführlichen europäischen Richtlinien verwiesen (5). Die über Jahrzehnte gültige Empfehlung, bei CCS bzw. 1 Jahr nach ACS in der Langzeitsekundärprävention eine Plättchenhemmermonotherapie bzw. bei Patienten mit Antikoagulationsindikation eine Antikoagulationsmonotherapie durchzuführen, wurde mit der Richtlinie von 2019 im Sinne einer Individualisierung leicht modifiziert (5). Insbesondere bei in der COMPASS-Studie untersuchten schwer polyvaskulär kranken CCS-Patienten mit begleitendem Diabetes, peripher arterieller Verschlusskrankheit und Sinusrhythmus kann unter Berücksichtigung des Blutungsrisikos zeitlich unlimitiert eine niedrig dosierte Antikoagulationstherapie mit 2×2.5 mg Rivaroxaban täglich zusätzlich zu ASS 100 mg in Betracht gezogen werden (7).
Antithrombotische Therapie nach elektiv durchgeführter Koronarintervention bei CCS sowie nach ACS: Die Definition der Dauer und die Wahl der antithrombotischen Therapie nach perkutaner Koronarintervention und Stentimplantation bleibt ebenfalls eine Herausforderung (8). Unter dem Gesichtspunkt des Ischämierisikos hängen Art und Dauer der dualen antithrombotischen Therapie von der klinischen Situation (ACS vs. CCS) und der Komplexität des Koronareingriffs ab. Eine Verlängerung der intensivierten antithrombotischen Therapie kann zwar das Ischämierisiko verringern, ist aber mit einer erhöhten Blutungsgefahr und damit potenziell einer erhöhten Sterblichkeit verbunden (8). Die Richtlinien empfehlen deshalb, die Dauer der dualen antithrombotischen Therapie zu individualisieren (9). Die Anpassung an die individuelle klinische Situation bleibt auch deshalb eine Herausforderung, weil erstens Blutungen und Ischämie gemeinsame Prädiktoren haben, und zweitens Thrombozytenfunktionstests nachweislich im klinischen Alltag nicht hilfeich für die Entscheidungsfindung sind. Tabelle 2 fasst die für den Alltag wichtigsten Empfehlungen zusammen.

Die wichtigsten Aspekte der prä-/periinterventionellen antithrombotischen ACS-Therapie (10) :
NSTEMI
– Ticagrelor und Prasugrel werden bevorzugt eingesetzt anstelle von Clopidogrel.
– eine routinemässige Vorbehandlung mit einem P2Y12Inhibitor ist kontraindiziert, falls eine frühe invasive Abklärung (<24Stunden) gewählt wird.
STEMI
– Initial unfraktioniertes Heparin als erste Wahl zusätzlich zu 250 mg ASS i.v. oder p.o.
– Prasugrel und Ticagrelor haben Clopidogrel als erste Wahl ersetzt.
Duale Antithrombotische Therapie nach koronarer Bypassoperation: Neben einer zeitlich unlimitierten Gabe von ASS 100 mg wird im Rahmen eines CCS eine 6-monatige, nach ACS eine 12-monatige zusätzliche Gabe von Clopidogrel empfohlen (5, 10).
Antithrombotische Therapie nach Klappeninterventionen
Nach mechanischer Klappenimplantation ist eine zeitlich unlimitierte orale Antikoagulation mit einem VKA, d.h. in erster Linie Phenprocoumon (Marcourmar®) indiziert. Anstelle einer Bandbreite von einem INR z.B. zwischen 2.0 und 3.0 wird heute ein Ziel-INR bevorzugt angegeben, bei modernen Klappen ohne zusätzliche Risikofaktoren (wie z.B. Klappe in Mitral- oder Tricuspidalposition, frühere Thromboembolie, gleichzeitiges Vorliegen eines Vorhofflimmerns oder eingeschränkte linksventrikuläre Auswurffraktion <35%) beträgt der Ziel-INR 2,5 (4). Das INR-Selbstmonitoring ist assoziiert mit einem erniedrigten Risiko einer VKA-assoziierten Komplikation und sollte bei geeigneten Patienten jeden Alters angestrebt werden (11). Eine zusätzliche Gabe von 75-100mg ASS pro Tag kann bei Patienten mit sehr hohem Thrombose-Embolie-Risiko eingesetzt werden, ist aber begleitet von einem erhöhten Blutungsrisiko (12). Das periinterventionelle antithrombotische Management erfordert bei allen Patienten, welche unter einer gerinnungshemmenden Therapie sind, ein strukturiertes Vorgehen unter Berücksichtigung des Blutungsrisikos des Eingriffes bei Weiterführen der Gerinnungshemmung und des Thrombo-Embolie-Risikos bei Unterbrechung und allfälliger Überbrückung (13).
Die optimale antithrombotische Strategie nach chirurgisch implantierter Bioprothese ist aufgrund unklarer Datenlage nach wie vor kontrovers. In den aktuellen europäischen Richtlinien wird eine 3-monatige OAK mit VKA empfohlen für Bioprothesen in mitraler und tricuspidaler Position, bei Bioprothesen in aortaler Position wird ASS oder VKA empfohlen für 3 Monate (13)
– Nach perkutanem Aortenklappenersatz ist eine zeitlich unlimitierte Gabe von ASS 100 mg empfohlen, ohne zusätzliche Notwendigkeit einer initialen OAK (13).
Vorhofflimmern und Vorhofflattern
Die Indikation für eine Antikoagulation, d.h. Hemmung der plasmatischen Gerinnung zur Risikoreduktion eines thromboembolischen Ereignisses bei chronischem Vorhofflimmern und Vorhofflattern (VHF) ist gegeben bei einem CHA2DS2Vasc-Score >2 beim Mann und >3 bei der Frau (14).
Für den Einsatz von NOAKs besteht eine mindestens gleich gute Effizienz im Vergleich zu VKA d.h. Phenprocoumon (Marcoumar®) bzw. Acenocoumarol (Sintrom®), aber eine insgesamt verbesserte Sicherheit, in erster Linie weniger Hirnblutungen und weniger schwere und lebensbedrohliche Blutungen im Vergleich zu VKA.
In den aktuellen europäischen Richtlinien besteht zwar für die Thromboembolieprophylaxe bei VHF eine gleichwertige Klasse-I-Indikation für VKA und NOAKs. Grundsätzlich wird den NOAKs unter Beachtung der Kontraindikationen (schwere Niereninsuffienz, mechanische Herzklappe, mittel- oder hochgradige Mitralstenose) aber der Vorzug gegeben (14).
Spezial-Situationen: Nach einer Kardioversion ist aufgrund einer vorübergehend eingeschränkten Vorhofskontraktion (sogenanntes «atrial Stunning») eine Thromboembolieprophylaxe vorzugsweise mit einem NOAK unabhängig vom CHA2DS2-VASc Score für mindestens 4 Wochen notwendig. Etwas länger und zwar für 3 Monate, d.h. bis zur erwarteten Abheilung der entstandenen Endothelläsionen im linken Vorhof sollte die OAK nach Pulmonalvenenisolation erfolgen. Aspirin hat in dieser Indikation keinen Stellenwert mehr.
Einige weitere wichtige Aspekte zum Einsatz von NOAKS:
– Eine ungenügende Compliance kann die Wirksamkeit von NOAKs erheblich beeinträchtigen (kurze Halbwertszeit, kein Monitorring).
– Kombination mit Thrombozytenaggregationshemmern bei Patienten mit Vorhofflimmern und KHK kommen in Frage (Tab. 2)
– Das Risiko für gastrointestinale Blutungen ist möglicherweise etwas erhöht unter Rivaroxaban 20 mg und Dabigatran 150 mg 2x/Tag (im Vergleich zu den anderen NOAKs)
– Niereninsuffizienz:
o regelmässige Kreatininkontrolle nötig (Dabigatran höchste Kumulationsgefahr, da 80% renal eleminiert). Die Dosis gemäss Zulassung richtet sich nach der Kreatininclearence und nicht nach der eGFR.
o Schwere Niereninsuffizienz: kaum Daten (weder für NOAK noch für VKA); Apixaban und Edoxaban whs. die besten Optionen
o Quantifizierung der antikoagulatorischen Effekte (Anti-Faktor-Xa Aktivität) im Notfall (Blutung, Operation) möglich, aber nicht generell zur Therapiekontrolle
o Nach bariatrischer Chirurgie wenig Daten hinsichtlich Resorption von NOAK. Primär Verwendung von VKA oder von Apixaban unter Kontrolle der Anti-Faktor-Xa Aktivität
Antithrombotische Therapie bei Thrombose/Lungenembolie
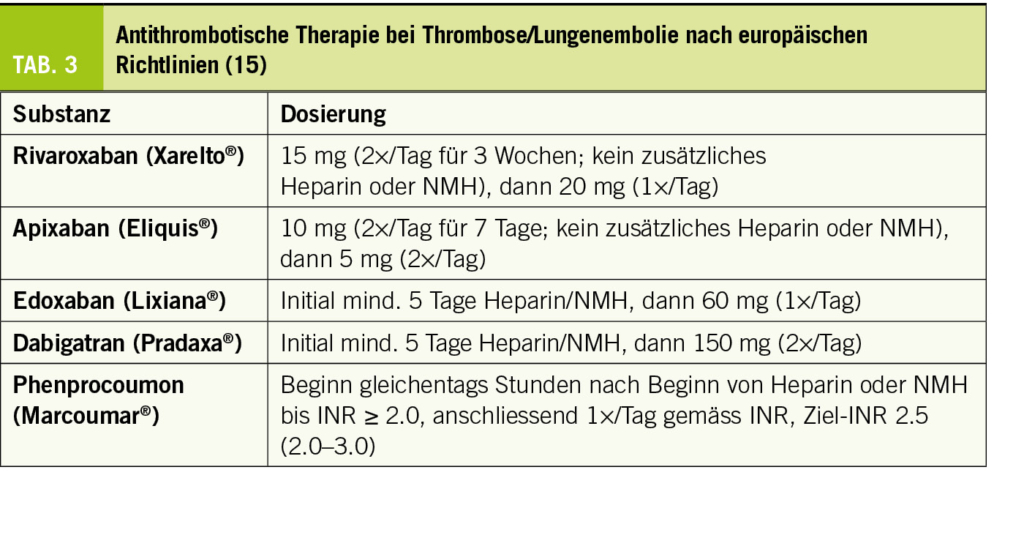
Bezüglich Diagnostik und Risikostratfizierung von Thrombose und Lungenembolie sei auf die neuesten europäischen Richtlinien verwiesen (15). Die NOAKS haben sich gegenüber der antithrombotischen Behandlung mit VKA weitgehend durchgesetzt. Wie in Tabelle 3 ersichtlich, ist die initiale Behandlung entsprechend den in diesem Setting durchgeführten randomisierten Studien bei den verschiedenen NOAKS unterschiedlich.
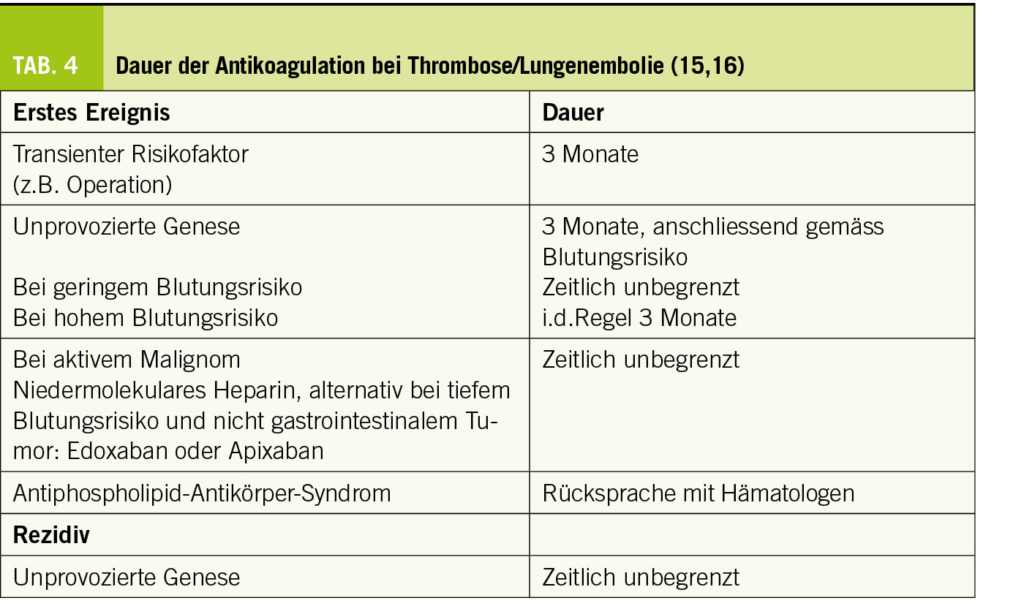
Wie lange soll die OAK nach Thrombose/Lungenembolie durchgeführt werden?
Neben der Behandlung des akuten thromboembolischen Ereignisses soll die OAK auch ein erneutes Ereignis verhindern. Grundsätzlich soll die OAK mindestens 3 Monate weitergeführt werden. Anschliessend wird ein individualisiertes Vorgehen empfohlen, je nach Risikosituation und Abschätzung des zukünftigen Thrombose- und Blutungsrisikos interdisziplinär mit Hämatologen (Tab. 4).
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Die Autoren haben keine Interessenskonflikte in Zusammenhang mit diesem Artikel deklariert.
Literatur :
1. Colleran R, Urban P. Defining the HBR patient – another step in the right direction. EuroIntervention J Eur Collab Work Group Interv Cardiol Eur Soc Cardiol. 2020;16:357–360.
2. Mahmoud AN, Gad MM, Elgendy AY, Elgendy IY, Bavry AA. Efficacy and safety of aspirin for primary prevention of cardiovascular events: a meta-analysis and trial sequential analysis of randomized controlled trials. Eur Heart J. 2019;40:607–617.
3. US Preventive Services Task Force, Davidson KW, Barry MJ, Mangione CM, Cabana M, Chelmow D, Coker TR, Davis EM, Donahue KE, Jaén CR, Krist AH, Kubik M, Li L, Ogedegbe G, Pbert L, Ruiz JM, Stevermer J, Tseng C-W, Wong JB. Aspirin Use to Prevent Cardiovascular Disease: US Preventive Services Task Force Recommendation Statement. JAMA. 2022;327:1577–1584. et al.
4. Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida J-M, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B, ESC National Cardiac Societies, ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42:3227–3337.
5. Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, Prescott E, Storey RF, Deaton C, Cuisset T, Agewall S, Dickstein K, Edvardsen T, Escaned J, Gersh BJ, Svitil P, Gilard M, Hasdai D, Hatala R, Mahfoud F, Masip J, Muneretto C, Valgimigli M, Achenbach S, Bax JJ, Neumann F-J, Sechtem U, Banning AP, Bonaros N, Bueno H, Bugiardini R, Chieffo A, Crea F, Czerny M, Delgado V, Dendale P, Flachskampf FA, Gohlke H, Grove EL, James S, Katritsis D, Landmesser U, Lettino M, Matter CM, Nathoe H, Niessner A, Patrono C, Petronio AS, Pettersen SE, Piccolo R, Piepoli MF, Popescu BA, Räber L, Richter DJ, Roffi M, Roithinger FX, Shlyakhto E, Sibbing D, Silber S, Simpson IA, Sousa-Uva M, Vardas P, Witkowski A, Zamorano JL, Achenbach S, Agewall S, Barbato E, Bax JJ, Capodanno D, Cuisset T, Deaton C, Dickstein K, Edvardsen T, Escaned J, Funck-Brentano C, Gersh BJ, Gilard M, Hasdai D, Hatala R, Mahfoud F, Masip J, Muneretto C, Prescott E, Saraste A, Storey RF, Svitil P, Valgimigli M, Windecker S, Aboyans V, Baigent C, Collet J-P, Dean V, Delgado V, Fitzsimons D, Gale CP, Grobbee D, Halvorsen S, Hindricks G, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromesThe Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J [Internet]. [cited 2019 Nov 7];Available from: https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehz425/5556137
6. Antithrombotic Trialists’ (ATT) Collaboration, Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, Buring J, Hennekens C, Kearney P, Meade T, Patrono C, Roncaglioni MC, Zanchetti A. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet Lond Engl. 2009;373:1849–1860.
7. Eikelboom JW, Connolly SJ, Bosch J, Dagenais GR, Hart RG, Shestakovska O, Diaz R, Alings M, Lonn EM, Anand SS, Widimsky P, Hori M, Avezum A, Piegas LS, Branch KRH, Probstfield J, Bhatt DL, Zhu J, Liang Y, Maggioni AP, Lopez-Jaramillo P, O’Donnell M, Kakkar AK, Fox KAA, Parkhomenko AN, Ertl G, Störk S, Keltai M, Ryden L, Pogosova N, Dans AL, Lanas F, Commerford PJ, Torp-Pedersen C, Guzik TJ, Verhamme PB, Vinereanu D, Kim J-H, Tonkin AM, Lewis BS, Felix C, Yusoff K, Steg PG, Metsarinne KP, Cook Bruns N, Misselwitz F, Chen E, Leong D, Yusuf S. Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med. 2017;377:1319–1330.
8. Khan SU, Singh M, Valavoor S, Khan MU, Lone AN, Khan MZ, Khan MS, Mani P, Kapadia SR, Michos ED, Stone GW, Kalra A, Bhatt DL. Dual Antiplatelet Therapy After Percutaneous Coronary Intervention and Drug-Eluting Stents: A Systematic Review and Network Meta-Analysis. Circulation. 2020;142:1425–1436.
9. Neumann F-J, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, Byrne RA, Collet J-P, Falk V, Head SJ, Jüni P, Kastrati A, Koller A, Kristensen SD, Niebauer J, Richter DJ, Seferović PM, Sibbing D, Stefanini GG, Windecker S, Yadav R, Zembala MO. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87–165.
10. Byrne RA, Rossello X, Coughlan JJ, Barbato E, Berry C, Chieffo A, Claeys MJ, Dan G-A, Dweck MR, Galbraith M, Gilard M, Hinterbuchner L, Jankowska EA, Jüni P, Kimura T, Kunadian V, Leosdottir M, Lorusso R, Pedretti RFE, Rigopoulos AG, Rubini Gimenez M, Thiele H, Vranckx P, Wassmann S, Wenger NK, Ibanez B, ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes: Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J. 2023;ehad191.
11. Heneghan C, Ward A, Perera R, Bankhead C, Fuller A, Stevens R, Bradford K, Tyndel S, Alonso-Coello P, Ansell J, Beyth R, Bernardo A, Christensen TD, Cromheecke M, Edson RG, Fitzmaurice D, Gadisseur AP, Garcia-Alamino JM, Gardiner C, Hasenkam M, Jacobson A, Kaatz S, Kamali F, Khan TI, Knight E, Körtke H, Levi M, Matchar DB, Menéndez-Jándula B, Rakovac I, Schaefer C, Siebenhofer A, Souto JC, Sunderji R, Gin K, Shalansky K, Völler H, Wagner O, Zittermann A. Self-monitoring of oral anticoagulation: systematic review and meta-analysis of individual patient data. The Lancet. 2012;379:322–334.
12. Massel DR, Little SH. Antiplatelet and anticoagulation for patients with prosthetic heart valves. Cochrane Database Syst Rev. 2013;2013:CD003464.
13. Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, Capodanno D, Conradi L, De Bonis M, De Paulis R, Delgado V, Freemantle N, Gilard M, Haugaa KH, Jeppsson A, Jüni P, Pierard L, Prendergast BD, Sádaba JR, Tribouilloy C, Wojakowski W, ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561–632.
14. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, Boriani G, Castella M, Dan G-A, Dilaveris PE, Fauchier L, Filippatos G, Kalman JM, La Meir M, Lane DA, Lebeau J-P, Lettino M, Lip GYH, Pinto FJ, Thomas GN, Valgimigli M, Van Gelder IC, Van Putte BP, Watkins CL, Group ESD, Kirchhof P, Kühne M, Aboyans V, Ahlsson A, Balsam P, Bauersachs J, Benussi S, Brandes A, Braunschweig F, Camm AJ, Capodanno D, Casadei B, Conen D, Crijns HJGM, Delgado V, Dobrev D, Drexel H, Eckardt L, Fitzsimons D, Folliguet T, Gale CP, Gorenek B, Haeusler KG, Heidbuchel H, Iung B, Katus HA, Kotecha D, Landmesser U, Leclercq C, Lewis BS, Mascherbauer J, Merino JL, Merkely B, Mont L, Mueller C, Nagy KV, Oldgren J, Pavlović N, Pedretti RFE, Petersen SE, Piccini JP, Popescu BA, Pürerfellner H, Richter DJ, Roffi M, Rubboli A, Scherr D, Schnabel RB, Simpson IA, Shlyakhto E, Sinner MF, Steffel J, Sousa-Uva M, Suwalski P, Svetlosak M, Touyz RM, Windecker S, Aboyans V, Baigent C, Collet J-P, Dean V, Delgado V, Fitzsimons D, Gale CP, Grobbee DE, Halvorsen S, Hindricks G, Iung B, Jüni P, Katus HA, Landmesser U, Leclercq C, Lettino M, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS)The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J [Internet]. 2020 [cited 2020 Aug 31];Available from: https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehaa612/5899003
15. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing G-J, Harjola V-P, Huisman MV, Humbert M, Jennings CS, Jiménez D, Kucher N, Lang IM, Lankeit M, Lorusso R, Mazzolai L, Meneveau N, Ní Áinle F, Prandoni P, Pruszczyk P, Righini M, Torbicki A, Van Belle E, Zamorano JL, Galié N, Gibbs JSR, Aboyans V, Ageno W, Agewall S, Almeida AG, Andreotti F, Barbato E, Bauersachs J, Baumbach A, Beygui F, Carlsen J, De Carlo M, Delcroix M, Delgado V, Subias PE, Fitzsimons D, Gaine S, Goldhaber SZ, Gopalan D, Habib G, Halvorsen S, Jenkins D, Katus HA, Kjellström B, Lainscak M, Lancellotti P, Lee G, Gal GL, Messas E, Morais J, Petersen SE, Petronio AS, Piepoli MF, Price S, Roffi M, Salvi A, Sanchez O, Shlyakhto E, Simpson IA, Stortecky S, Thielmann M, Noordegraaf AV, Becattini C, Bueno H, Geersing G-J, Harjola V-P, Huisman MV, Humbert M, Jennings CS, Jiménez D, Kucher N, Lang IM, Lankeit M, Lorusso R, Mazzolai L, Meneveau N, Ní Áinle F, Prandoni P, Pruszczyk P, Righini M, Torbicki A, VanBelle E, LuisZamorano J, Windecker S, Aboyans V, Baigent C, Collet J-P, Dean V, Delgado V, Fitzsimons D, Gale CP, Grobbee D, Halvorsen S, Hindricks G, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS)The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Heart J [Internet]. [cited 2019 Nov 13];Available from: https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehz405/5556136
16. www.kardiovaskuläres Manual KSSG, editor. Kardiovaskuläres Manual KSSG.
17. Costa F, van Klaveren D, James S, Heg D, Räber L, Feres F, Pilgrim T, Hong M-K, Kim H-S, Colombo A, Steg PG, Zanchin T, Palmerini T, Wallentin L, Bhatt DL, Stone GW, Windecker S, Steyerberg EW, Valgimigli M, PRECISE-DAPT Study Investigators. Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual antiplatelet therapy (PRECISE-DAPT) score: a pooled analysis of individual-patient datasets from clinical trials. Lancet Lond Engl. 2017;389:1025–1034.
der informierte @rzt
- Vol. 14
- Ausgabe 1
- Januar 2024