- Cancers invasifs du sein chez les femmes âgées de ≥ 80 ans
Key words: oncogériatrie, patiente âgée et cancer du sein, cancer sein localisé, cancer du sein métastatique
Introduction
L’âge médian au diagnostic de cancer du sein est de 64 ans en Suisse; 36% des patientes ont 70 ans et plus, 15% 80 ans et plus. Le taux de survie spécifique à 5 ans augmente depuis des années et atteint 88% (1) tous stades confondus. En 2022, l’espérance de vie d’une femme de 80 ans est de 10,4 ans (2). Ces patientes très âgées ne sont pas représentées dans les études qui incluent sauf exception des patientes en bon état générale, sans dysfonction d’organe avec un status performance selon OMS 0 ou 1 soit activité normale ou restreinte pour des activités physiques importantes, mais patient ambulant et capable de fournir un travail léger. Il existe donc une incertitude quant à l’efficacité et à la toxicité des traitements oncologiques pour cette population qui, par ailleurs présente une forte prévalence de comorbidités et de polymédication. La Société internationale d’oncologie gériatrique (SIOG) a émis des recommandations pour la population âgée (3).
Évaluation gériatrique
Les bonnes pratiques recommandent une évaluation gériatrique pour tous les patients âgés ≥70 ans atteints de cancer (3). En routine le score de dépistage G8 permet d’identifier les patients nécessitant une évaluation gériatrique plus complète (4). Plusieurs essais randomisés ont montré que l’adaptation des prises en charge suite à cette évaluation réduisait la toxicité des traitements, diminuait les hospitalisations et améliorait la qualité de vie, tout en préservant la survie (5,6). Une évaluation de l’espérance de vie à l’aide d’outils validés et répertoriés sur ePrognosis (4) devrait être effectuée.
Cancer du sein localisé
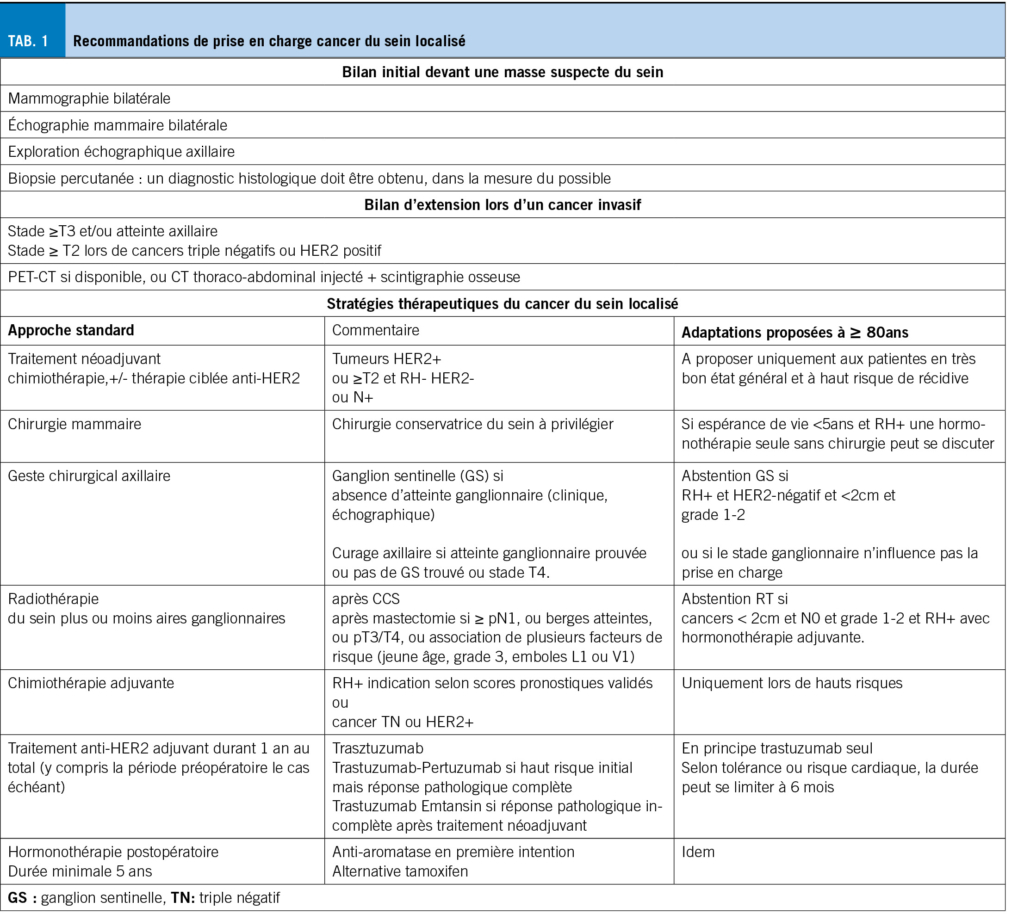
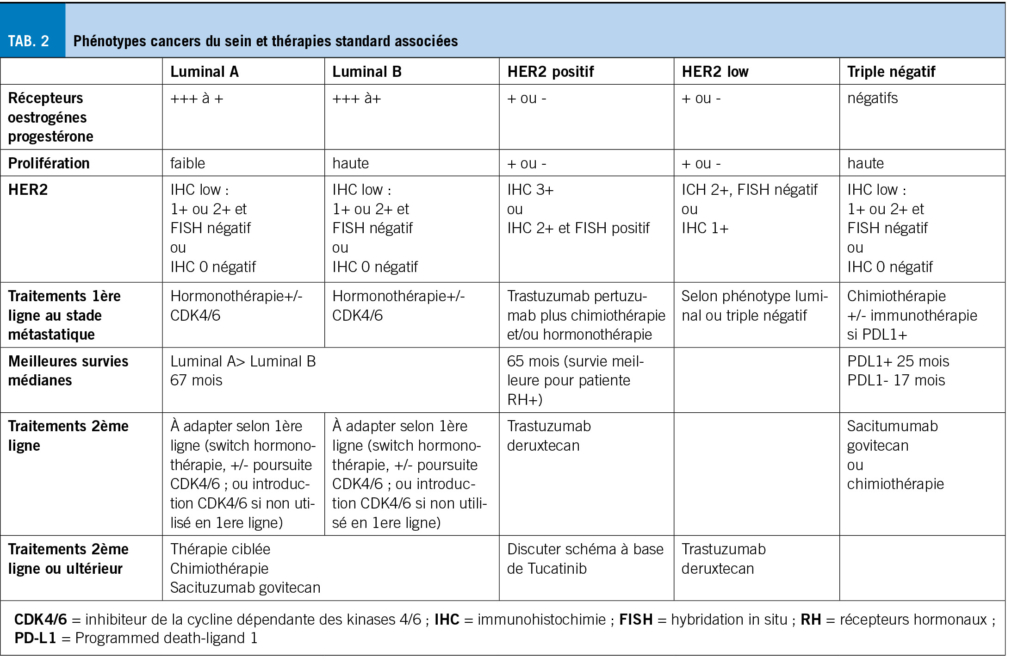
Lorsque l’espérance de vie est <10 ans, le dépistage mammographique est futile car une réduction de la mortalité par cancer du sein est peu probable (7). La prise en charge standard est résumée dans le tableau 1. Le choix thérapeutique dépend essentiellement du stade TNM et du phénotype histologique tableau 2. Environ 90 % des patientes âgées de ≥ 80 ans présentent des tumeurs RH+ HER2- (8).
Traitement chirurgical du sein
Vu l’absence de différence de survie globale (SG) par rapport à la mastectomie, la chirurgie conservatrice du sein (CCS) avec radiothérapie adjuvante est devenue la référence (9). Une hormonothérapie première sans chirurgie devrait rester l’exception étant donné un moins bon contrôle local rendant parfois nécessaire une chirurgie de rattrapage (10) et le fait qu’une moins bonne SG après 5 ans est observée dans une étude récente chez des femmes de 80 ans et plus avec un cancer RH+(11).
Traitement chirurgical axillaire
L’essai de phase III NSABP-32, n’a pas trouvé de différence de survie ou de contrôle locorégional pour les patientes avec cancer du sein RH+ sans atteinte axillaire clinique, traitées par la technique du ganglion sentinelle (GS) versus un curage axillaire, faisant du GS la référence pour ces patientes (12). Cette pratique diminue les complications classiques du curage (douleur, engourdissement, gonflement et limitation des mouvements du bras).
Dès 2016, certaines guidelines recommandent de ne pas utiliser en routine la biopsie du GS chez les femmes de ≥70 ans avec un cancer RH+, HER2-, <2cm, grade 1 ou 2 (13). Récemment, l’essai SOUND (N=1405, 36% ≥ 65 ans) n’a pas montré de différence de survie sans maladie à distance, chez les femmes atteintes d’un cancer du sein <2cm, RH+, HER-(14).
Radiothérapie postopératoire
La radiothérapie (RT) postopératoire réduit la récidive locorégionale et, chez les patientes N+, diminue la mortalité par cancer du sein (15). Son indication chez les patientes âgées, doit être évaluée selon une stratification du risque (16). Deux essais randomisés, ont montré que la RT après une CCS n’améliorait pas la survie globale ou spécifique au cancer du sein chez les patientes âgées ≥ 70ans atteintes d’un cancer du sein RH+ (17,18) et recevant une hormonothérapie par tamoxifene (Tam). Dans ces 2 études, le taux de récidive locorégionale était plus élevé sans radiothérapie (10% Tam vs 2% Tam+RT à 10 ans (17) et 4,1% Tam vs 1,3% Tam+RT à 5 ans (18)). Cependant, l’étude prospective de cohorte LUMINA (âge médian 67,1 ans) a montré que la récidive locale à 5 ans était faible (2.3 %), malgré l’absence de RT chez les femmes ménopausées (8% ≥ 75 et 3% ≥ 80) avec cancer bas risque (luminal A, grade 1 ou 2, T1N0), traitées par CCS et hormonothérapie (19).
La radiothérapie du sein entier reste donc toujours recommandée après CCS, mais l’abstention est raisonnable lors de cancer à faible risque pour les patientes ayant une espérance de vie limitée.
Chimiothérapie néoadjuvante/adjuvante
En situation préopératoire, seul 6,3% des 8949 patientes incluses dans 8 études randomisées avaient 65 ans ou plus et aucune plus de 80 ans (20). L’expérience d’un centre de référence montre que des toxicités plus importantes conduisent à la réduction ou à l’arrêt prématuré du traitement dans 78% versus 57% (p < 0.001) chez les 74 patientes âgées de 71 à 76 ans (21). L’indication à un tel traitement ne devrait être envisagée que pour des patientes hautement sélectionnées, lors de risques accrus de récidives, sur la base de scores pronostiques (22), ou lors de cancers RH- pour lesquels la plupart des rechutes surviennent dans les 5 ans. Comme pour la chimiothérapie néoadjuvante, les schémas standard pouvant être proposés dans cette classe d’âge sont les suivants : 4 cycles de docétaxel et cyclophosphamide (TC), 4 cycles de doxorubicine – cyclophosphamide, ou 6 cycles de cyclophosphamide, méthotrexate et fluorouracile (CMF). Le paclitaxel hebdomadaire en particulier, peut être combiné au traitement antiHER2, et être administré également chez des patientes plus fragiles (22).
Traitements anti-HER2
Lors de cancers HER2+, un traitement anti-HER2 par trastuzumab devrait être introduit quel que soit l’âge, bien que les patientes âgées ≥60ans soient sous-représentées, 16% dans l’étude HERA (23), et présentent une augmentation de la toxicité cardiaque, nécessitant des interruptions du traitement dans près de 40 % des cas (24). La SIOG recommande une chimio adjuvante (docetaxel ou paclitaxel hebdomadaire) associée à 1 an de trastuzumab. Vu le risque accru de toxicité, notamment digestive, l’association avec le pertuzumab doit être réservée aux patientes en bonne santé (22). Un traitement plus court (6 mois) peut être envisagé pour les patientes plus fragiles ou présentant un risque cardiologique (25,26). L’essai de phase III Short-HER montre une survie sans maladie et une SG comparables avec 9 semaines de trastuzumab versus 1 an pour les risques faibles (N0) et intermédiaires (moins de 4 ganglions atteints) (27). L’utilisation du trastuzumab seul, sans chimio, peut également être discutée chez les patientes les plus fragiles (28).
Dans l’essai KATHRINE (âge médian 49 ans, moins d’1% ≥75 ans), le trastuzumab emtansine (T-DM1) adjuvant lors d’une maladie résiduelle après un traitement néoadjuvant à base de trastuzumab, réduit le risque de récidive et de décès par rapport au trastuzumab adjuvant. Des toxicités telles que la neuropathie et la pneumopathie questionnent le rapport bénéfice/risque chez les patientes âgées (29).
Hormonothérapie
L’efficacité du traitement endocrinien est indépendante de l’âge et le choix du traitement dépend du risque estimé de récidive, des comorbidités de la patiente et des effets secondaires attendus du traitement endocrinien dont l’ostéoporose et les douleurs musculo-squelettiques (inhibiteurs de l’aromatase (IA)) ou le risque thrombo-embolique et de cancer de l’endomètre (Tam) (30). Les IA sont légèrement supérieurs au Tam en termes de risque de récidive du cancer du sein et de mortalité, et devraient être privilégiés.
La non observance du traitement endocrinien est un problème majeur à tout âge et semble augmenter chez les 80 ans et plus 52% (n=100) contre 24,2% pour la population totale (n=1192). (31). Dans une étude portant sur 437 patientes de ≥ 60 ans, les patientes de ≥ 80 ans (n=79) ont plus souvent refusé de débuter l’hormonothérapie (13,0 % contre 4,5 %, P = 0,01) (32). Ce problème devrait être abordé avant de décider de ne pas opérer une maladie localisée.
Traitement des cancers métastatiques
Le traitement de toute patiente atteinte d’un cancer du sein métastatique, quel que soit son âge, est non curatif et vise à contrôler le cancer et à maintenir la qualité de vie. Nous nous limiterons aux premières lignes de traitements (tableau 2).
Tumeurs hormonosensibles RH+ HER2-
Plus l’expression des RH est importante, plus le cancer est susceptible de répondre à un traitement hormonal, qui constitue alors le premier choix. Si une menace de la fonction d’organes nécessite une réponse tumorale rapide, une chimio peut être discutée. Les inhibiteurs de la kinase 4/6 dépendante de la cycline (CDK4/6) (ribociclib, abemaciclib, palbociclib) associés à un IA ou au fulvestrant (anti oestrogénique), améliorent le taux de réponse et la survie sans progression (SSP) (33). Une meilleure survie globale est obtenue en 2ème ligne, mais à ce jour en première ligne, seul ribociclib plus létrozole a démontré un avantage de SG (médiane 63,9 mois contre 51,4 mois avec létrozole plus placebo) y compris chez les ≥ 75 ans (34). L’efficacité des inhibiteurs de CDK4/6 parait indépendante de l’âge (198 patientes ≥75 ans soit 10,8% de la population incluse), au prix de toxicités plus élevées (88.8% grades 3-4 si ≥ 75 ans versus 73,4 % si <75 ans), nécessitant des modifications de dose, voire l’arrêt du traitement (33). Au moment de la progression, un changement de thérapie endocrinienne (de IA à fulvestrant, de fulvestrant à IA) est proposé. La poursuite de l’inhibiteur CDK4/6 reste discutée (35), mais celui-ci devrait être débuté s’il n’a pas été introduit auparavant, étant donné le bénéfice de SG attendu (36). En cas de résistance à l’hormonothérapie, d’autres thérapies peuvent se discuter (chimio, thérapies ciblées (37)).
Cancers HER2+
Chez les patientes avec cancer HER2+, le traitement anti-HER2 par trastuzumab associé au pertuzumab et au paclitaxel hebdomadaire est recommandé comme traitement de première intention (38).
Pour les patients non éligibles aux taxanes, ou qui désirent des schémas moins toxiques (peu ou pas d’alopécie ou de complications digestives, infectieuses, et neurologiques), la vinorelbine ou la capécitabine peuvent être des alternatives (22,39,40). Chez les patientes très fragiles, le trastuzumab +/- pertuzumab seul ou associé à une hormonothérapie si RH+ peut être envisagé (41,42). Après traitement de première ligne par trastuzumab, l’anticorps conjugué trastuzumab-deruxtecan (T-dxd) est associé à une meilleure SG par rapport au T-DM1 (SG à 24 mois 77.4% vs 69.9%) (43). Chez les patientes de ≥ 65 ans on observe une augmentation des toxicités (digestives et hématologiques) amenant à un arrêt du traitement dans 25,4% des cas contre 18,7% chez les plus jeunes. Le risque de pneumopathie est également supérieur (17,5% contre 11,8%) (44). L’utilisation de ce traitement doit donc être très prudente chez les patientes âgées. Le T-DM1 pourrait être utilisé en cas d’intolérance (45).
Cancers triples négatifs (TN) ou hormonorésistants
Une chimio peut être proposée aux patientes avec cancer du sein métastatique TN-, ou lors de cancer RH+ résistant à la thérapie endocrinienne ou dont la maladie progresse rapidement ou menace la fonction d’organes. Une mono-chimiothérapie est préférable, étant donné le risque plus élevé d’effets secondaires (22). Le choix est basé sur le profil des effets secondaires, les comorbidités et les souhaits de la patiente.
L’ajout d’un inhibiteur des checkpoints (ICP) à la chimio de première ligne, lors de tumeurs TN exprimant PDL1, améliore la SG d’environ 7 mois (âge médian 55 ans, 23% ≥ 65ans (46) ; âge médian 53 ans, 21% > 65 ans (47)). L’utilisation de ces ICP est déjà bien établie dans la population âgée et/ou fragile. Le mauvais pronostic des tumeurs TN avec l’utilisation de la chimio seule, est également amélioré en 2ème ligne par l’anticorps sacituzumab ciblant le récepteur Trop2 conjugué au govitecan (un inhibiteur topoisomérase), avec une survie médiane 12,1 versus 6,7 mois (âge médian 54 ans, (29–82) (48)). Ces nouvelles thérapies doivent être utilisées avec la plus grande prudence chez les patientes âgées.
Conclusion
Les patientes atteintes d’un cancer du sein, âgées de ≥ 80 ans, représentent une proportion croissante de la population. Les décisions thérapeutiques doivent être basées sur l’espérance de vie, les bénéfices potentiels du traitement, les souhaits de la patiente et les effets secondaires potentiels du traitement.
Une collaboration étroite entre les oncologues et les gériatres est essentielle pour parvenir à un équilibre entre les objectifs du traitement oncologique et le maintien de la qualité de vie des patientes.
Copyright Aerzteverlag medinfo AG
Service d’oncologie
Hôpital du Valais – CHVR
Av. Grand-Champsec 86
1951 Sion
marie-gabrielle.courtes@hopitalvs.ch
Service d’oncologie
Hôpital du Valais – CHVR
Av. Grand-Champsec 86
1951 Sion
sandro.anchisi@hopitalvs.ch
Les auteurs n’ ont pas déclaré de conflits d’ intérêts en rapport avec cet article.
◆ Les femmes âgées avec cancer du sein représentent une population croissante
◆ La mortalité par cancer du sein diminue, grâce à l’évolution des traitements oncologiques
◆ Les patientes ≥80 ans sont peu représentées dans les études cliniques, rendant l’élaboration de standards difficile dans cette population
◆ Une adaptation des traitements est nécessaire après une évaluation gériatrique en tenant compte de l’espérance de vie, des comorbidités et des souhaits des patientes
1. https://www.bfs.admin.ch/bfs/fr/home/statistiques/sante/etatsante/maladies/cancer/specifiques.hml. Consulté le 12.11.2023
2. https://www.bfs.admin.ch/bfs/fr/home/statistiques/population/naissances-deces/esperance-vie.html. Consulté le 12.11.2023
3. Dale W, Klepin HD, Williams GR, et al. Practical assessment and management of vulnerabilities in older patients receiving systemic cancer therapy: ASCO guideline update. J Clin Oncol 2023; 41:4293-312
4. Soubeyran P, Bellera C, Goyard J, et al. Screening for vulnerability in older cancer patients: the ONCODAGE Prospective Multicenter Cohort Study. PLoS One 2014 Dec 11;9:e115060
5. management on the toxic effects of cancer treatment (GAP70+): a cluster-randomised study. Lancet 2021; 398:1894-1904.
6. Li D, Sun C-L, Kim H, et al. Geriatric assessment–driven intervention (GAIN) on chemotherapy-related toxic effects in older adults with cancer: A randomized clinical trial. JAMA Oncol 2021; 7:e214158
7. Badgwell BD, Giordano SH, Duan ZZ, et al. Mammography before diagnosis among women age 80 years and older with breast cancer. J Clin Oncol 2008; 26:2482–8.
8. Jenkins EO, Deal AM, Anders CK, et al. Age-specific changes in intrinsic breast cancer subtypes: A focus on older women. Oncologist 2014; 19:1076-83
9. Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002; 347:1233-41.
10. Hind D, Wyld L, Reed MW. Surgery, with or without tamoxifen, vs tamoxifen alone for older women with operable breast cancer: cochrane review. Br J Cancer 2007; 96:1025-9.
11. De Boer AZ, de Glas NA, Marang-van de Mheen PJ, et al. Effect of omission of surgery on survival in patients aged 80years and older with early-stage hormone receptor-positive breast cancer. Br J Surg 2020; 107:1145–53
12. Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010; 11:927-33
13. Grossi S, Le J, Armani A. Omitting axillary staging in selected patients: Rationale of Choosing Wisely in breast cancer treatment. Surgery 2023; 174:413-5.
14. Gentilini OD, Botteri E, Sangalli C, et al. SOUND Trial Group. Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: The SOUND randomized clinical trial. JAMA Oncol 2023; 9:1557-64.
15. McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10 years recurrence and 20 years breast cancer mortality: metaanalysis of individual patient data for 8135 women in 22 randomised trials. Lancet 2014; 383: 2127-35.
16. Stueber TN, Diessner J, Bartmann C, et al. Effect of adjuvant radiotherapy in elderly patients with breast cancer. PLoS One 2020; 15: e0229518.
17. Hughes Hughes KS, Schnaper LA, Bellon JR, et al. Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer: long-term follow-up of CALGB 9343.J Clin Oncol 2013; 31: 2382-7.
18. Kunkler IH, Williams LJ, Jack WJ, et al; PRIME II investigators. Breast-conserving surgery with or without irradiation in women aged 65 years or older with early breast cancer (PRIME II): a randomised controlled trial. Lancet Oncol 2015; 16:266-73.
19. Whelan TJ, Smith S, Parpia S, et al; LUMINA study investigators. Omitting radiotherapy after breast-conserving surgery in luminal A breast cancer. N Engl J Med. 2023; 389:612-9.
20. Von Waldenfels G, Loibl S, Furlanetto J, et al. Outcome after neoadjuvant chemotherapy in elderly breast cancer patients – a pooled analysis of individual patient data from eight prospectively randomized controlled trials. Oncotarget 2018; 9: 15168-79
21. Williams AD, Dang CT, Sevilimedu V, et al. Neoadjuvant chemotherapy for breast cancer in the elderly: Are we accomplishing our treatment goals? Ann Surg Oncol 2022; 29:8002-11.
22. Biganzoli L, Battisti NML, Wildiers H, et al. Updated recommendations regarding the management of older patients with breast cancer: a joint paper from the European Society of Breast Cancer Specialists (EUSOMA) and the International Society of Geriatric Oncology (SIOG). Lancet Oncol 2021; 22:e327-e340.
23. Meron D, Piccart-Gebhart MJ, Gelber RD, et al. 11 years’ followup of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet 2017; 389: 1195–205
Références complètes: sur notre site internet www.medinfo-verlag.ch
24. Reeder-Hayes KE, Meyer AM, Hinton SP, et al. Comparative toxicity and effectiveness of trastuzumab-based chemotherapy regimens in older women with early-stage breast cancer. J Clin Oncol 2017; 35: 3298–305
25. Pivot X, Romieu G, Debled M, et al. 6 months versus 12 months of adjuvant trastuzumab for patients with HER2-positive early breast cancer (PHARE): a randomised phase 3 trial. Lancet Oncol 2013; 14:741-8.
26. Earl HM, Hiller L, Vallier AL, et al. 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet 2019; 393:2599-2612.
27. Conte P, Bisagni G, Piacentini F, et al. Nine-week versus one-year trastuzumab for early human epidermal growth factor receptor 2-positive breast cancer: 10-year update of the ShortHER phase III randomized trial. J Clin Oncol. 2023; 41:4976-81.
28. Sawaki M, Taira N, Uemura Y, et al. Randomized controlled trial of trastuzumab with or without chemotherapy for HER2-positive early breast cancer in older patients. J Clin Oncol 2020; 38:3743–52.
29. Loibl S, Mano M, Untch M, et al. Phase III study of adjuvant ado-trastuzumab emtansine vs trastuzumab for residual invasive HER2-positive early breast cancer after neoadjuvant chemotherapy and HER2-targeted therapy: KATHERINE final IDFS and updated OS analysis. Presented at: 2023 San Antonio Breast Cancer Symposium; December 5-9, 2023; San Antonio, TX. Abstract GS03-12
30. Crystal JS, Rand J, Johnson J, et al. Adjuvant endocrine therapy is associated with improved overall survival in elderly hormone receptor-positive breast cancer patients. Breast Cancer Res Treat 2020;184:63–74.
31. Dragvoll I, Bofin AM, Søiland H, et al. Predictors of adherence and the role of primary non-adherence in antihormonal treatment of breast cancer. BMC Cancer 2022; 22:1247.
32. Guth U, Myrick ME, Kandler C, et al. The use of adjuvant endocrine breast cancer therapy in the oldest old. Breast 2013; 22:863-68.
33. Howie LJ, Singh H, Bloomquist E, et al. Outcomes of older women with hormone receptor-positive, human epidermal growth factor receptor-negative metastatic breast cancer treated with a CDK4/6 inhibitor and an aromatase inhibitor: an FDA pooled analysis. J Clin Oncol 2019; 37:3475-83.
34. Hart L, Im S, Tolaney SM, et al. Efficacy, safety, and quality of life with ribociclib + endocrine therapy in elderly patients with HR+/HER2– advanced breast cancer across the MONALEESA-2, -3, and -7 trials. Presented at the 2023 San Antonio Breast Cancer Symposium; December 5-9, 2023; San Antonio, TX; abstract PS02-01.
35. Kalinsky K, Accordino MK, Chiuzan C, et al. Randomized phase II trial of endocrine therapy with or without ribociclib after progression on cyclin-dependent kinase 4/6 inhibition in hormone receptor-positive, human epidermal growth factor receptor 2-negative metastatic breast cancer: MAINTAIN trial. J Clin Oncol 2023; 41:4004-13.
36. Sonke G, van Ommen-Nijhof, Wortelboer N, et al. Primary outcome of the phase 3 SONIA trial (BOOG 2017-03). J Clin Oncol 2023; 41: 17_suppl, LBA1000.
37. André F, Ciruelos EM, Juric D, et al. Alpelisib plus fulvestrant for PIK3CA-mutated, hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: final overall survival results from SOLAR-1. Ann Oncol 2021; 32:208-17.
38. Miles D, Ciruelos E, Schneeweiss A, et al; PERUSE investigators. Final results from the PERUSE study of first-line pertuzumab plus trastuzumab plus a taxane for HER2-positive locally recurrent or metastatic breast cancer, with a multivariable approach to guide prognostication. Ann Oncol 2021; 32:1245-55.
39. Perez EA, López-Vega JM, Petit T, et al. Safety and efficacy of vinorelbine in combination with pertuzumab and trastuzumab for first-line treatment of patients with HER2-positive locally advanced or metastatic breast cancer: VELVET Cohort 1 final results. Breast Cancer Res 2016; 18:126.
40. Andersson M, López-Vega JM, Petit T, et al. Efficacy and safety of pertuzumab and trastuzumab administered in a single infusion bag, followed by vinorelbine: VELVET cohort 2 final results. Oncologist 2017; 22:1160-8.
41. Vogel CL, Cobleigh MA, Tripathy D, et al: Efficacy and safety of trastuzumab as a single agent in first-line treatmentof HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002; 20:719-26
42. Huober J, Weder P, Ribi K, et al. Pertuzumab plus trastuzumab with or without chemotherapy followed by emtansine in ERBB2-positive metastatic breast cancer: A secondary analysis of a randomized clinical trial. JAMA Oncol 2023; 9:1381–89.
43. Hurvitz SA, Hegg R, Chung WP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet 2023; 401:105-17.
44. Krop IE, Wildiers H, Hurvitz SA, et al. An age-specific pooled analysis of trastuzumab deruxtecan (T DXd) in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) from DESTINY-Breast01, -02, and -03.J Clin Oncol 2023; 41:16_suppl, 1006
45. Krop IE, Kim SB, Gonzalez-Martin A, et al. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial. Lancet Oncol 2014; 15(7):689-69
46. Schmid P, Rugo HS, Adams S, et al; IMpassion130 Investigators. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2020; 21(1):44-59
47. Cortes J, Rugo HS, Cescon DW, et al; KEYNOTE-355 Investigators. Pembrolizumab plus chemotherapy in advanced triple-negative breast cancer. N Engl J Med 2022; 387:217-26.
48. Bardia A, Hurvitz SA, Tolaney SM, et al; ASCENT clinical trial Investigators. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med 2021; 384:1529-41.
la gazette médicale
- Vol. 13
- Ausgabe 1
- Januar 2024