- Perioperative Therapie beim Nierenzellkarzinom
2020 wurden weltweit 431 288 Nierenzellkarzinome (RCC) diagnostiziert. Der Grossteil der Patienten wird durch eine Lokaltherapie geheilt. Je nach Risikofaktoren rezidivieren allerdings bis zu 70% der Tumore, was eine Einschränkung der Lebenserwartung zur Folge hat. Um eine Verbesserung der Prognose zu erreichen, wurden verschiedene Tyrosinkinase (TKI)-, mTOR- und Checkpointinhibitoren (IO) im perioperativen Setting getestet. Nur in zwei Studien S-TRAC und Keynote 564 konnte eine Verbesserung des krankheitsfreien Überlebens (DFS) gezeigt werden. Für Sunitinib im S-TRAC Trial führte dies allerdings nicht zu einer Verbesserung des Gesamtüberlebens (OS). In Zusammenschau mit der Toxizität des Sunitinib wird der Einsatz von EAU und ESMO nicht empfohlen. Die Keynote 564 Studie wies für Pembrolizumab bei Patienten mit RCC und Risikokonstellation für ein Rezidiv eine Verbesserung des DFS nach und beim diesjährigen ASCO GU wurde eine robuster OS Benefit gezeigt. Es besteht allerdings die Gefahr einer Übertherapie mit dem Risiko von unnötiger Toxizität für den Patienten und einer finanziellen Belastung für das Gesundheitssystem. Die Identifikation von klinischen und molekularen Biomarkern ist entscheidend für eine optimale Patientenselektion.
431,288 renal cell carcinomas (RCC) were diagnosed worldwide in 2020. The majority of patients are cured through local therapy. However, depending on the risk factors, up to 70% of tumors recur, which results in a reduction in life expectancy. To achieve improvement, various tyrosine kinase (TKI), mTOR and checkpoint inhibitors (IO) have been tested in the perioperative setting. Only two trials S- TRAC and Keynote 564 showed an DFS benefit. However, for sunitinib in the S-TRAC trial, this did not lead to an improvement in overall survival (OS). Together with the remarkable toxicity of sunitinib, EAU and ESMO do not recommended the use. Keynote 564 demonstrated an improvement in DFS for pembrolizumab in patients with RCC and a high-risk constellation for recurrence. The presentation at this years ASCO GU showed an OS benefit. However, there is a risk of overtreatment with the risk of unnecessary toxicity for the patient and a financial burden on the healthcare system. The identification of clinical and molecular biomarkers is crucial for optimal patient selection.
Key Words: adjuvant, clear cell carcinoma, immunotherapy, tyrosine kinase inhibitors
2020 wurden weltweit 431 288 Nierenzellkarzinome (RCC) diagnostiziert und 179 368 Todesfälle dokumentiert (1). Der Grossteil der Patienten mit Nierenzellkarzinomen wird durch Lokaltherapien geheilt. Je nach Tumorgrösse, Lymphknotenstatus, Fuhrmangrad rezidivieren allerdings bis zu 70 % der Tumore, was eine Einschränkung der Lebenserwartung zur Folge hat (2). Die Frage der adjuvanten Therapie von Nierenzellkarzinomen hat somit einen grossen Stellenwert zur Verbesserung der Prognose dieser Patientengruppe. In der metastasierten Situation wurden in den letzten Jahren viele Fortschritte mit signifikanter Verbesserung der Überlebenszeit gemacht. Viele von den verwendeten Substanzen wurden als logische Konsequenz auch in der adjuvanten Situation getestet.
Tyrosinkinase- und mTOR Inhibitoren
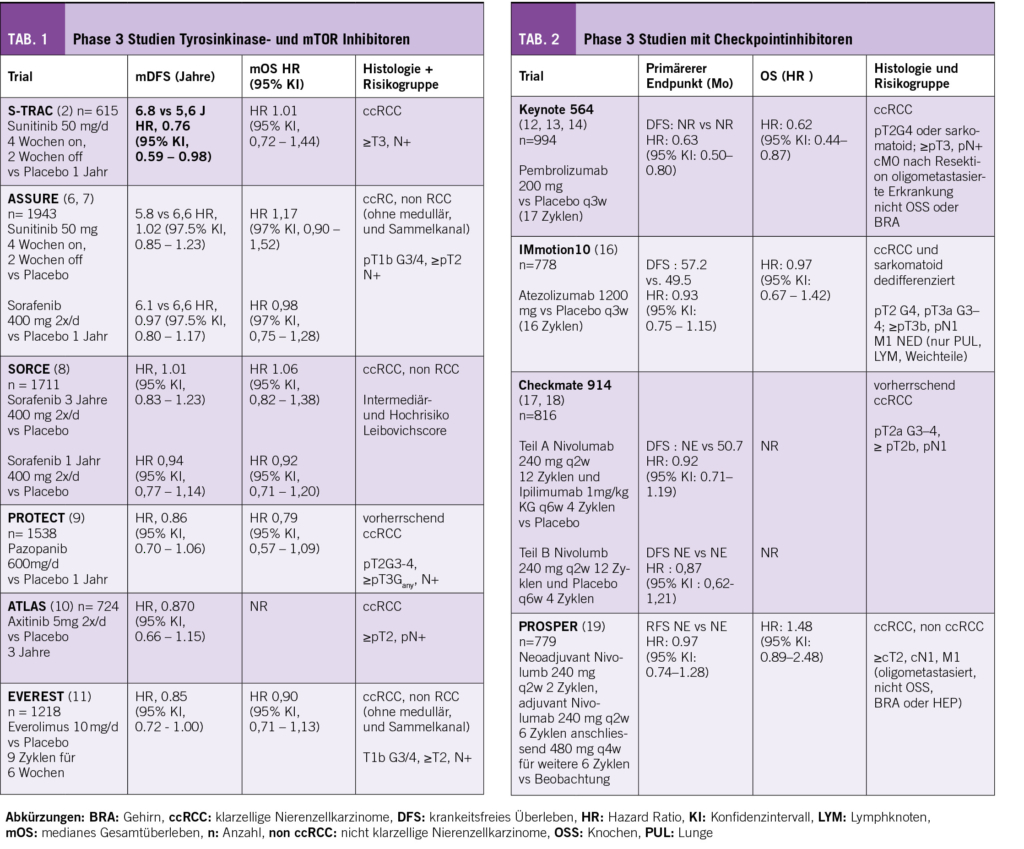
Die sechs Phase 3 Studien, die Tyrosinkinase- und mTOR Inhibitoren im adjuvanten Setting nutzten, unterscheiden sich hinsichtlich Histologien und Risikogruppen zum Teil erheblich (Tab. 1).
Der S-TRAC Trial konnte eine Verbesserung des DFS für Sunitinib mit einer HR 0,76 (95% KI 0,59 – 0,98) zeigen, was zur Zulassung durch die «US Food and Drug Administration» (FDA) in den USA führte. Eine Verbesserung des OS konnte allerdings nicht gezeigt werden. 27 % der Patienten in der Sunitinibgruppe brachen die Therapie aufgrund von Nebenwirkungen (AE) ab (3). Eine Zulassung in der Indikation erfolgte daher in Europa nicht und die Therapie wird von ESMO und EAU nicht empfohlen (4, 5). Keiner der anderen Trials mit TKI oder mTOR Inhibitoren konnte einen DFS oder OS Benefit zeigen (6-11).
Checkpointinhibitoren
Für den Einsatz von Checkpointinhibitoren im adjuvanten Setting gibt es vier vorgestellte Phase 3 Studien, die eine Hochrisikopopulation gemäss Histologie, TNM und Fuhrmangrad einschliessen (Tab. 2).
Die Keynote 564 konnte für Pembrolizumab eine Verbesserung des DFS mit einer HR 0,68 (KI 0,53 – 0,87) zeigen (12). Der Benefit blieb auch im 30 Monate follow up erhalten (13). Dieser DFS Benefit führte zur Zulassung durch die FDA und European Medcine Administration (EMA). Beim aktuellen ASCO GU wurden nun die OS-Daten präsentiert, mit einer statistisch signifikanten Verbesserung HR 0,62 (KI 0,44 – 0,87) (14).
Die aktuellen NCCN Guidelines empfehlen eine adjuvante Therapie mit Pembrolizumab gemäss den Einschlusskriterien der Keynote 564 (15). Die aktuellen ESMO und EAU Guidelines schliessen sich dem mit einer optionalen respektive schwachen Empfehlung an. Allerdings berücksichtigen diese noch nicht den OS Benefit. (4, 5). Der IMmotion 010 Trial untersuchte Atezolizumab bei Patienten mit klarzelligem und sarkomatoid dedifferenziertem RCC ohne DFS-Benefit (16).
Die Checkmate 914 Studie testete die im metastasierten Stadium sehr effektive Kombination aus Ipiliumumab und Nivolumab. Etwas überraschend konnte kein DFS Benefit gezeigt werden (17). Der Prosper Trial verabreichte Nivolumab 2 x präoperativ zusätzlich zur adjuvanten Therapie, aber auch ohne DFS Benefit und wurde vorzeitig beendet (19).
Der RAMPART Trial rekrutiert aktuell Patienten für eine Durvalumabmonotherapie oder die Kombination aus Durvalumab und Tremelimumab. Die erste Datenauswertung ist für 2024 vorgesehen (20).
Die Frage, warum nur eine von vier IO basierten Studien einen DFS und OS Benefit zeigen konnte, kann bisher nicht abschliessend beantwortet werden. Es gibt keinen direkten Vergleich der verschiedenen PD-1 und PD-L1 Inhibitoren in der adjuvanten Situation. Das Studiendesign und die Einschlusskriterien der verschiedenen Studien sind heterogen. Prosper schloss nicht klarzellige Histologien ein, welche ein geringeres Ansprechen auf eine IO-Therapie im metastasierten Stadium zeigen (21). Die Subgruppenanalyse sowohl von der Keynote 564 als auch der CheckMate 914 lassen für Tumore mit sarkomatoider Differenzierung einen Benefit vermuten (13, 17).
Patienten mit vollständiger Metastasenresektion (M1 NED) wurden in der Keynote 564 und in der IMmotion 010, nicht aber in der CheckMate 914 eingeschlossen. Auch der PROSPER Trial schloss Patienten mit M1 NED ein, allerdings nur 3%. In der Subgruppenanalyse der Keynote 564 profitieren insbesondere Patienten mit M1 NED.
Die Therapiestrategie für den Rezidivfall nach adjuvanter Therapie ist aktuell noch unklar. Ist von einer IO/IO oder IO/TKI Therapie noch ein Benefit zu erwarten?
Spielt die Therapiedauer und kumulative Dosis eine Rolle? CheckMate 914 hatte eine geplante Therapiedauer von nur 6 Monaten. Trotzdem brachen 32% der Patienten die Therapie vorzeitig ab. Es gibt einen dritten Studienarm mit einer Nivolumabmonotherapie, auch für diesen konnte keine DFS-Benefit gezeigt werden (17,18). Ausserdem wurde mit der 6 wöchentlichen Gabe ein anderes Ipilimumabschema als im metastasierten Stadium üblich gewählt. Vergrösserte Therapieintervalle für Ipiliumumab gehen nicht mit einer reduzierten Effektivität in der metastasierten Situation einher (22).
Der nun nachgewiesene solide OS Benefit für Pembrolizumab ändert die Situation. Es ist davon auszugehen, dass die Guidelines der Fachgesellschaften angepasst werden.
Im präsentierten Zeitraum von 48 Monaten waren 64,9% in der Pembrolizumabgruppe vs 56,6% in der Placebogruppe ohne Rezidiv (14). Dies bedeutet aber auch, dass für 56,6% der Patienten Pembrolizumab eine Übertherapie darstellen würde. Eine optimale Patientenselektion ist also von entscheidender Bedeutung, und die Identifikation von klinischen und molekularen Biomarkern ist Gegenstand laufender und zukünftiger Forschung.
Stadtspital Zürich Triemli
Klinik für Medizinische Onkologie und Hämatologie
Birmensdorferstrasse 497
8063 Zürich
Onkologie/Hämatologie
Kantonsspital Graubünden
Loëstrasse 170
7000 Chur
richard.cathomas@ksgr.ch
K. Hoppe hat folgende COI: Bayer, BMS, MSD,
Novartis, Pfizer. R.Cathomas hat folgende COI: Consulting für BMS, MSD, Roche, Pfizer, Bayer, Honoraria von BMS
◆ Die Frage der adjuvanten Therapie von Nierenzellkarzinomen ist weiterhin nicht beantwortet. Adjuvant Pembrolizumab zeigt zwar einen DFS Benefit aber bisher nur einen Trend für ein OS Benefit. Eine Therapie kann nach ausreichender Kosten- und Nutzenabwägung gemeinsam mit dem Patienten insbesondere bei Hochrisikokonstellation wie zum Beispiel sarkomatoider Differenzierung evaluiert werden. Um eine Übertherapie mit der Gefahr unnötiger Toxizität zu verhindern ist die Identifikation von klinischen und molekularen Biomarkern entscheidend für die optimale Patientenselektion.
1. Bukavina L, Bensalah K, Bray F, Carlo M, Challacombe B, Karam JA, et al. Epidemiology of Renal Cell Carcinoma: 2022 Update. Eur Urol. 2022;82(5):529-42.
2. Chin AI, Lam JS, Figlin RA, Belldegrun AS. Surveillance strategies for renal cell carcinoma patients following nephrectomy. Rev Urol. 2006;8(1):1-7.
3. Ravaud A, Motzer RJ, Pandha HS, George DJ, Pantuck AJ, Patel A, et al. Adjuvant Sunitinib in High-Risk Renal-Cell Carcinoma after Nephrectomy. N Engl J Med. 2016;375(23):2246-54.
4. eUpdate – Renal Cell Carcinoma Treatment Recommendations: https://www.esmo.org/guidelines/guidelines-by-topic/esmo-clinical-practice-guidelines-genitourinary-cancers/renal-cell-carcinoma/eupdate-renal-cell-carcinoma-treatment-recommendations-4; [
5. EAU Guidelines on Renal Cell Carcinoma [Available from: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Renal-Cell-Carcinoma-2023.pdf.
6. Haas NB, Manola J, Dutcher JP, Flaherty KT, Uzzo RG, Atkins MB, et al. Adjuvant Treatment for High-Risk Clear Cell Renal Cancer: Updated Results of a High-Risk Subset of the ASSURE Randomized Trial. JAMA Oncol. 2017;3(9):1249-52.
7. Haas NB, Manola J, Uzzo RG, Flaherty KT, Wood CG, Kane C, et al. Adjuvant sunitinib or sorafenib for high-risk, non-metastatic renal-cell carcinoma (ECOG-ACRIN E2805): a double-blind, placebo-controlled, randomised, phase 3 trial. Lancet. 2016;387(10032):2008-16.
8. Eisen T, Frangou E, Oza B, Ritchie AWS, Smith B, Kaplan R, et al. Adjuvant Sorafenib for Renal Cell Carcinoma at Intermediate or High Risk of Relapse: Results From the SORCE Randomized Phase III Intergroup Trial. J Clin Oncol. 2020;38(34):4064-75.
9. Motzer RJ, Haas NB, Donskov F, Gross-Goupil M, Varlamov S, Kopyltsov E, et al. Randomized Phase III Trial of Adjuvant Pazopanib Versus Placebo After Nephrectomy in Patients With Localized or Locally Advanced Renal Cell Carcinoma. J Clin Oncol. 2017;35(35):3916-23.
10. Gross-Goupil M, Kwon TG, Eto M, Ye D, Miyake H, Seo SI, et al. Axitinib versus placebo as an adjuvant treatment of renal cell carcinoma: results from the phase III, randomized ATLAS trial. Ann Oncol. 2018;29(12):2371-8.
11. Ryan CW, Tangen CM, Heath EI, Stein MN, Meng MV, Alva AS, et al. Adjuvant everolimus after surgery for renal cell carcinoma (EVEREST): a double-blind, placebo-controlled, randomised, phase 3 trial. Lancet. 2023;402(10407):1043-51.
12. Choueiri TK, Tomczak P, Park SH, Venugopal B, Ferguson T, Chang YH, et al. Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med. 2021;385(8):683-94.
13. Powles T, Tomczak P, Park SH, Venugopal B, Ferguson T, Symeonides SN, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022;23(9):1133-44.
14. Choueiri et al. J Clin Oncol 42, 2024 (suppl 4; abstr LBA359)
15. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)
Kidney Cancer [
16. Pal SK, Uzzo R, Karam JA, Master VA, Donskov F, Suarez C, et al. Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2022;400(10358):1103-16.
17. Motzer RJ, Russo P, Grunwald V, Tomita Y, Zurawski B, Parikh O, et al. Adjuvant nivolumab plus ipilimumab versus placebo for localised renal cell carcinoma after nephrectomy (CheckMate 914): a double-blind, randomised, phase 3 trial. Lancet. 2023;401(10379):821-32.
18 Motzer et al. J Clin Oncol 42, 2024 (suppl 4; abstr LBA358)
19. Allaf M, Kim SE, Harshman LC, McDermott DF, Master VA, Signoretti S, et al. LBA67 Phase III randomized study comparing perioperative nivolumab (nivo) versus observation in patients (Pts) with renal cell carcinoma (RCC) undergoing nephrectomy (PROSPER, ECOG-ACRIN EA8143), a National Clinical Trials Network trial. Annals of Oncology. 2022;33:S1432-S3.
20. Oza B, Frangou E, Smith B, Bryant H, Kaplan R, Choodari-Oskooei B, et al. RAMPART: A phase III multi-arm multi-stage trial of adjuvant checkpoint inhibitors in patients with resected primary renal cell carcinoma (RCC) at high or intermediate risk of relapse. Contemp Clin Trials. 2021;108:106482.
21. Zoumpourlis P, Genovese G, Tannir NM, Msaouel P. Systemic Therapies for the Management of Non-Clear Cell Renal Cell Carcinoma: What Works, What Doesn’t, and What the Future Holds. Clin Genitourin Cancer. 2021;19(2):103-16.
22. Vasudev NS, Ainsworth G, Brown S, Pickering L, Waddell TS, Fife K, et al. LBA29 Nivolumab in combination with alternatively scheduled ipilimumab in first-line treatment of patients with advanced renal cell carcinoma: A randomized phase II trial (PRISM). Annals of Oncology. 2021;32:S1304-S5.
11. Ryan CW, Tangen CM, Heath EI, Stein MN, Meng MV, Alva AS, et al. Adjuvant everolimus after surgery for renal cell carcinoma (EVEREST): a double-blind, placebo-controlled, randomised, phase 3 trial. Lancet. 2023;402(10407):1043-51.
12. Choueiri TK, Tomczak P, Park SH, Venugopal B, Ferguson T, Chang YH, et al. Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med. 2021;385(8):683-94.
13. Powles T, Tomczak P, Park SH, Venugopal B, Ferguson T, Symeonides SN, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022;23(9):1133-44.
14. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)
Kidney Cancer [
15. Pal SK, Uzzo R, Karam JA, Master VA, Donskov F, Suarez C, et al. Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2022;400(10358):1103-16.
16. Motzer RJ, Russo P, Grunwald V, Tomita Y, Zurawski B, Parikh O, et al. Adjuvant nivolumab plus ipilimumab versus placebo for localised renal cell carcinoma after nephrectomy (CheckMate 914): a double-blind, randomised, phase 3 trial. Lancet. 2023;401(10379):821-32.
17. Allaf M, Kim SE, Harshman LC, McDermott DF, Master VA, Signoretti S, et al. LBA67 Phase III randomized study comparing perioperative nivolumab (nivo) versus observation in patients (Pts) with renal cell carcinoma (RCC) undergoing nephrectomy (PROSPER, ECOG-ACRIN EA8143), a National Clinical Trials Network trial. Annals of Oncology. 2022;33:S1432-S3.
18. Oza B, Frangou E, Smith B, Bryant H, Kaplan R, Choodari-Oskooei B, et al. RAMPART: A phase III multi-arm multi-stage trial of adjuvant checkpoint inhibitors in patients with resected primary renal cell carcinoma (RCC) at high or intermediate risk of relapse. Contemp Clin Trials. 2021;108:106482.
19. Zoumpourlis P, Genovese G, Tannir NM, Msaouel P. Systemic Therapies for the Management of Non-Clear Cell Renal Cell Carcinoma: What Works, What Doesn’t, and What the Future Holds. Clin Genitourin Cancer. 2021;19(2):103-16.
20. Vasudev NS, Ainsworth G, Brown S, Pickering L, Waddell TS, Fife K, et al. LBA29 Nivolumab in combination with alternatively scheduled ipilimumab in first-line treatment of patients with advanced renal cell carcinoma: A randomized phase II trial (PRISM). Annals of Oncology. 2021;32:S1304-S5.
info@onco-suisse
- Vol. 14
- Ausgabe 1
- Februar 2024