- Update CAR-T-Zellen – welches CAR-Produkt für wen?
In diesem Artikel wird der aktuelle Stand der CAR-T-Zelltherapie im klinischen Alltag erörtert, wobei neben dem Einsatz bei hämatologischen Malignomen auch das Potenzial für breitere Anwendungen betrachtet werden soll. Hintergrund ist der zunehmende Einsatz von modifizierten Immunzelltherapien (ICT) in der klinischen Praxis und der Bedarf an weiterer Forschung zur Optimierung und Ausweitung ihres Einsatzes.
This article discusses the current status of CAR-T cell therapy in clinical practice, looking at its potential for broader applications in addition to its use in hematologic malignancies. The background is the increasing use of modified immune cell therapies (ICT) in clinical practice and the need for further research to optimize and expand their use.
Key Words: CAR-T-cells, maamtological nmalignancies, genetically modified immune cells.
CAR-T-Zellen im klinischen Alltag
Zelluläre Immuntherapien haben mittlerweile Eingang in die klinische Routine gefunden (1-3). Als «lebende genetisch veränderte Therapieform» können modifizierte Immunzelltherapien (ICT) in unterschiedlichen Krankheitsentitäten eingesetzt werden (4,5). Derzeit laufen zahlreiche präklinische und klinische Studien mit dem Ziel, verschiedene Strategien zur Veränderung von Immunzellen nicht nur für onkologische Indikationen, sondern auch für entzündliche und Infektionskrankheiten zu entwickeln (6-9).
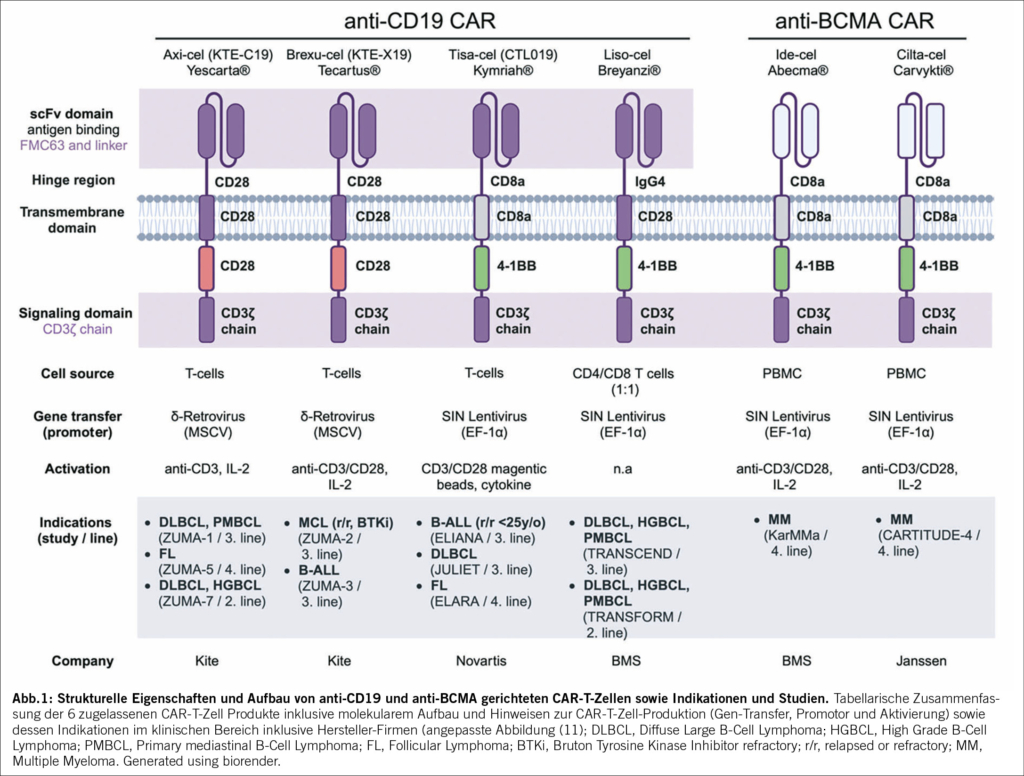
T-Zellen, die gentechnisch so verändert wurden, dass sie mit Hilfe eines Chimären Antigenrezeptors (CAR) gegen Tumoroberflächenstrukturen gerichtet werden können, haben sich als ein grosser Erfolg in der Behandlung von hämatologischen Malignomen erwiesen (10). In den letzten vier Jahren hat Swissmedic sechs verschiedene CAR-T-Zell Konstrukte in der Schweiz zugelassen (Abb. 1).
Hierbei handelt es sich um eine CAR-T-Zell Therapie für hämatologische Malignome wie refraktäre oder rezidivierende (r/r) akute lymphatische Leukämien der B-Zell Reihe (r/r B-ALL), diffuses grosszelliges B-Zell-Lymphom (DLBCL), follikuläres Lymphom (FL), Mantelzell-Lymphom (MCL) und seit Kürzerem auch das Multiple Myelom (MM). Derzeit laufen zahlreiche klinische Studien, in welchen verschiedene Strategien mit dem Ziel untersucht werden, diese zellulären therapeutischen Anwendungen zu verbessern. Es werden grosse Anstrengungen unternommen, um Abläufe und CAR-T-Zell Konstrukte zu optimieren, welche bereits aus der erfolgreichen CAR-T-Zell-Behandlung von hämatologischen Tumorerkrankungen implementiert wurden. Das Ziel besteht darin, CAR-T-Zellen so anzupassen und zu nutzen, um die Anwendung auf solide Tumorarten und nicht-bösartige Erkrankungen, insbesondere lebensbedrohliche systemische Autoimmunerkrankungen, auszuweiten (12).
Das übergeordnete Ziel, eine grössere Anzahl von Patienten von diesen neuartigen zellulären Therapieformen profitieren zu lassen, indem der Zugang zu dieser Behandlungsoption verbessert wird, bleibt bestehen. Im Januar 2019, nur kurz nach erfolgter Zulassung von Swissmedic, fand am Inselspital als erstem Standort in der Schweiz die erste Infusion von CAR-T- Zellen statt. Dies bei einer jungen erwachsenen Patientin mit (r/r) B-ALL. Seither wurden in der Schweiz mehr als 332 Patient/-innen mit verschiedenen Indikationen wie Non-Hodgkin-Lymphom (NHL), ALL und MM behandelt. 2023 erhielten in der Schweiz 174 Patient/-innen in total 10 Zentren eine CAR-T-Zelltherapie, mit 54 am meisten im Inselspital.
Update anti-CD19 gerichtete CAR-T-Zellen
Die erste Zulassung von Swissmedic für CAR-T-Zellen erhielt Tisa-cel (Kymriah®) für B-ALL bei Kindern und jüngeren Erwachsenen (vor dem vollendeten 25. Altersjahr). Die hierfür zugrunde liegende Phase II Studie (ELIANA-trial) bestätigte vor kurzem in einem 3-Jahres-Update, dass Tisa-cel weiterhin eine kurative Behandlungsoption darstellt. Dies mit einem Gesamtüberleben von 63% nach 3 Jahren bei dieser stark vorbehandelten Patienten-Population von pädiatrischen und jungen Erwachsenen mit r/r B-ALL (13, 14).
Kurz nach der Veröffentlichung des ELIANA-trials für B-ALL folgten weitere wegweisende Studien für CAR-T-Zellen (Tisa-cel – JULIET Studie und Axi-cel – ZUMA-1-Studie) zur Behandlung von grosszelligen B-Zell-Lymphomen (DLBCL) bei Erwachsenen nach mehr als 2 Therapie-Linien. Im Mai dieses Jahres wurde ein 5-Jahres-Follow-up der ZUMA-1 Studie veröffentlicht. Dabei konnte ein 5-Jahres-Gesamt-Überleben von 42.6% festgehalten werden. Das mediane Gesamtüberleben in der Patienten-Gruppe mit einer kompletten Remission (CR) wurde auch nach 5 Jahren noch nicht erreicht (3, 15). Diese Daten untermauern das Heilungspotential von Axi-cel bei Erwachsenen mit stark vorbehandelten grosszelligen B-Zell-Lymphomen (DLBCL).
Aufgrund des grossen Erfolges hat man weitere klinische Studien durchgeführt, mit dem Ziel CAR-T-Zellen gegen die Standardtherapie in der 2. Therapielinie (Hochdosis-Chemotherapie mit anschliessender autologer Stammzelltransplantation – HDCT/ASZT) zu vergleichen. Es wurden nur Patienten zugelassen, bei welchen ein Rezidiv des DLBCL innerhalb eines Jahres diagnostiziert wurde oder Patienten, die bereits primär refraktär auf die initiale Therapie waren. Zu der entsprechenden Phase 3 Studie für Axi-cel (ZUMA-7) wurden kürzlich Gesamtüberlebensdaten präsentiert. Dabei konnte eine 27.4% Reduktion des Risikos zu versterben in der CAR-T-Zellgruppe (Axi-cel) im Vergleich zur Kontrollgruppe (HD/ASZT) festgehalten werden (HR 0.73). Weiter wurde über einen Gesamtüberlebensvorteil von 8.6% berichtet (16, 17). In der kürzlich veröffentlichten ALYCANTE Studie (Phase II, multi-center, single-arm) wurden Patienten untersucht, welche zwar primär refraktär oder ein Rezidiv des DLBCL innerhalb eines Jahres hatten, jedoch nicht für eine HDCT/ASZT qualifizierten. Auch in dieser Patienten-Population wurde der primäre Endpunkt einer kompletten metabolischen Remission nach 3 Monaten erreicht. Das Progressionsfreie Überleben (PFS) belief sich auf 11,8 Monate und das mediane Gesamtüberleben wurde nicht erreicht (18). Diese Daten in dieser Patientenpopulation, welche eine sehr tiefe Heilungschance aufweisen, lassen doch aufhorchen. Auch wenn direkte Studienvergleiche nicht möglich sind, konnten Daten aus der TRANSFORM Studie, welche derselben Fragestellung nachging wie ZUMA-7 (2. Line bei r/r DLBCL) bis anhin ähnliche Resultate (ORR, Overall Response Rate und CR, Complete Response, Raten) mit dem CAR T Produkt Liso-cel liefern (19, 20). Ein Unterschied und Diskussionspunkt zwischen TRANSFORM und ZUMA-7 ist die Möglichkeit des Crossovers. Crossover von Patienten war nur in der TRANSFORM Studie möglich. Während die Studien ZUMA-7 (für Axi-cel) und TRANSFORM (für Liso-cel) ihre Endpunkte erreichten, konnte dies in der BELINDA Studie mit Tisa-cel (Kymriah®) nicht erreicht werden (21).
Zusammenfassend konnte damit gezeigt werden, dass fitte Patienten mit einer primär refraktären DLBCL Erkrankung oder einem Rezidiv eines DLBCL innerhalb eines Jahres nun primär mit den CAR-T-Zell Produkten Axi-cel und Liso-cel behandelt werden sollten. Falls es sich um weniger fitte Patienten handelt, muss Axi-cel oder eine alternative Behandlung beispielsweise mit einem bispezifischen Antikörper evaluiert werden (20).
Update anti-BCMA gerichtete CAR-T-Zellen
Seit Mai 2022 ist in der Schweiz Ide-cel (Abecma®) zur Behandlung des rezidivierten, refraktären Multiplen Myeloms nach mindestens 3 Vortherapien verfügbar. Auf Grund der initial limitierten Therapieslots wurden die Slots für alle Patienten im Rahmen eines nationalen Tumorboards vergeben (SBST-MM-CAR-T-Board) (22). Seit Juli 2023 stehen nun genügend Therapieslots zur Verfügung, sodass eine vorgängige Besprechung am nationalen Board nicht mehr notwendig ist. Die kürzlich am ASH gezeigten Daten zur Behandlung mit Ide-cel bestätigen einen PFS Vorteil gegenüber einer Standardbehandlung mit einem PFS von 13.8 Monaten im Vergleich zu 4.4 Monaten (HR 0.49), jedoch konnte bis anhin keine signifikante Verbesserung des overall survivals gezeigt werden (OS in beiden Gruppe noch nicht erreicht, HR 0.83) (23).
Die Therapie mit Cilta-cel (Carvikty®) ist von Swissmedic zwar zugelassen, aber in der Schweiz bis anhin noch nicht verfügbar. In der CARTITUDE-4 Studie konnte für Cilta-cel ein PFS Benefit gegenüber der Standardbehandlung (Pomalidomid, Bortezomib und Dexamethason oder Daratumumab, Pomalidomid und Dexamethason) gezeigt werden (noch nicht erreicht vs. 11,8 Monate, HR 0.26) (24). In der CARTITUDE-1 Studie wurde kürzlich ein eindrückliches PFS von 34,9 Monaten publiziert (25). Auch für Cilta-cel gibt es jedoch bis anhin keine Daten, die eine signifikante Verbesserung des overall survivals zeigen würden (25).
Beide CAR-T-Produkte konnten zudem – im Gegensatz zu den Erfahrungen mit CARs bei der Behandlung von Lymphomen – kein kuratives Potential zeigen. Die CAR-Produkte stehen daher sicherlich in grosser Konkurrenz zu den ebenso zwischenzeitlich verfügbaren bispezifischen Antikörpern. Für die Zukunft ist eine weitere Verbesserung der CARs für die Behandlung von Multiplen Myelomen sicherlich zu erhoffen.
Ausblick
Autologe CAR-T-Zellen haben ihre Berechtigung bei hämatologischen Erkrankungen bewiesen. Das Feld hat sich in den letzten 5 Jahren rasant entwickelt. Es stellt sich die Frage, ob in Zukunft noch weitere Indikationen auch bei soliden Tumoren oder bei inflammatorischen Systemerkrankungen aus dem rheumatischen Formenkreis dazukommen (26, 27). Zudem ist die Anwendung von allogen-generierten «allo-CAR T Zellen» noch nicht geklärt. Es macht den Anschein, dass noch weitere Optimierungsschritte auf diesem Weg benötigt werden.
Copyright bei Aerzteverlag medinfo
Inselspital, Universitätsspital Bern,
Universitätsklinik für Medizinische Onkologie,
Lory-Haus
Freiburgstrasse 41
3010 Bern
Inselspital
Universitätsspital Bern
Universitätsklinik für Medizinische Onkologie
Loryhaus
3010 Bern
Inselspital
Universitätsspital Bern
Universitätsklinik für Medizinische Onkologie
Loryhaus
3010 Bern
urban.novak@insel.ch
Die Autoren erklären, keine Interessenkonflikte zu haben.
1. Pasquini MC, Hu ZH, Curran K, et al. Real-world evidence of tisagenlecleucel for pediatric acute lymphoblastic leukemia and non-Hodgkin lymphoma. Blood Adv 2020;4(21):5414-24. doi: 10.1182/bloodadvances.2020003092
2. Jacobson CA, Hunter BD, Redd R, et al. Axicabtagene Ciloleucel in the Non-Trial Setting: Outcomes and Correlates of Response, Resistance, and Toxicity. J Clin Oncol 2020;38(27):3095-106. doi: 10.1200/JCO.19.02103 [published Online First: 20200715]
3. Neelapu SS, Jacobson CA, Ghobadi A, et al. Five-year follow-up of ZUMA-1 supports the curative potential of axicabtagene ciloleucel in refractory large B-cell lymphoma. Blood 2023;141(19):2307-15. doi: 10.1182/blood.2022018893
4. Irvine DJ, Maus MV, Mooney DJ, et al. The future of engineered immune cell therapies. Science 2022;378(6622):853-58. doi: 10.1126/science.abq6990 [published Online First: 20221124]
5. Korell F, Berger TR, Maus MV. Understanding CAR T cell-tumor interactions: Paving the way for successful clinical outcomes. Med 2022;3(8):538-64. doi: 10.1016/j.medj.2022.05.001
6. Oh S, Mao X, Manfredo-Vieira S, et al. Precision targeting of autoantigen-specific B cells in muscle-specific tyrosine kinase myasthenia gravis with chimeric autoantibody receptor T cells. Nat Biotechnol 2023;41(9):1229-38. doi: 10.1038/s41587-022-01637-z [published Online First: 20230119]
7. Maldini CR, Ellis GI, Riley JL. CAR T cells for infection, autoimmunity and allotransplantation. Nat Rev Immunol 2018;18(10):605-16. doi: 10.1038/s41577-018-0042-2
8. Finck AV, Blanchard T, Roselle CP, et al. Engineered cellular immunotherapies in cancer and beyond. Nat Med 2022;28(4):678-89. doi: 10.1038/s41591-022-01765-8 [published Online First: 20220419]
9. Mackensen A, Muller F, Mougiakakos D, et al. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus. Nat Med 2022;28(10):2124-32. doi: 10.1038/s41591-022-02017-5 [published Online First: 20220915]
10. Larson RC, Maus MV. Recent advances and discoveries in the mechanisms and functions of CAR T cells. Nat Rev Cancer 2021;21(3):145-61. doi: 10.1038/s41568-020-00323-z [published Online First: 2021/01/24]
11. Boettcher M, Joechner A, Li Z, et al. Development of CAR T Cell Therapy in Children-A Comprehensive Overview. J Clin Med 2022;11(8) doi: 10.3390/jcm11082158 [published Online First: 20220412]
12. Labanieh L, Mackall CL. CAR immune cells: design principles, resistance and the next generation. Nature 2023;614(7949):635-48. doi: 10.1038/s41586-023-05707-3 [published Online First: 20230222]
13. Laetsch TW, Maude SL, Rives S, et al. Three-Year Update of Tisagenlecleucel in Pediatric and Young Adult Patients With Relapsed/Refractory Acute Lymphoblastic Leukemia in the ELIANA Trial. J Clin Oncol 2023;41(9):1664-69. doi: 10.1200/JCO.22.00642 [published Online First: 20221118]
14. Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med 2018;378(5):439-48. doi: 10.1056/NEJMoa1709866 [published Online First: 2018/02/01]
15. Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. The New England journal of medicine 2017;377(26):2531-44. doi: 10.1056/NEJMoa1707447
16. Locke FL, Miklos DB, Jacobson CA, et al. Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. N Engl J Med 2022;386(7):640-54. doi: 10.1056/NEJMoa2116133 [published Online First: 20211211]
17. Westin JR, Oluwole OO, Kersten MJ, et al. Survival with Axicabtagene Ciloleucel in Large B-Cell Lymphoma. N Engl J Med 2023;389(2):148-57. doi: 10.1056/NEJMoa2301665 [published Online First: 20230605]
18. Houot R, Bachy E, Cartron G, et al. Axicabtagene ciloleucel as second-line therapy in large B cell lymphoma ineligible for autologous stem cell transplantation: a phase 2 trial. Nat Med 2023;29(10):2593-601. doi: 10.1038/s41591-023-02572-5 [published Online First: 20230914]
19. Abramson JS, Solomon SR, Arnason J, et al. Lisocabtagene maraleucel as second-line therapy for large B-cell lymphoma: primary analysis of the phase 3 TRANSFORM study. Blood 2023;141(14):1675-84. doi: 10.1182/blood.2022018730
20. Duarte C, Kamdar M. Management Considerations for Patients With Primary Refractory and Early Relapsed Diffuse Large B-Cell Lymphoma. Am Soc Clin Oncol Educ Book 2023;43:e390802. doi: 10.1200/EDBK_390802
21. Bishop MR, Dickinson M, Purtill D, et al. Second-Line Tisagenlecleucel or Standard Care in Aggressive B-Cell Lymphoma. N Engl J Med 2022;386(7):629-39. doi: 10.1056/NEJMoa2116596 [published Online First: 20211214]
22. Driessen C, Baur K, Heim D, et al. A National Platform and Scoring System Allocates CAR-T Treatment Slots for Multiple Myeloma to Patients with High Likelihood of Complete Remission. Blood 2023;142(Supplement 1):4701-01. doi: 10.1182/blood-2023-182628
23. Rodríguez Otero P, Ailawadhi S, Arnulf B, et al. Idecabtagene Vicleucel (ide-cel) Versus Standard (std) Regimens in Patients (pts) with Triple-Class-Exposed (TCE) Relapsed and Refractory Multiple Myeloma (RRMM): Updated Analysis from KarMMa-3. Blood 2023;142(Supplement 1):1028-28. doi: 10.1182/blood-2023-178933
24. San-Miguel J, Dhakal B, Yong K, et al. Cilta-cel or Standard Care in Lenalidomide-Refractory Multiple Myeloma. The New England journal of medicine 2023;389(4):335-47. doi: 10.1056/NEJMoa2303379 [published Online First: 2023/06/05]
25. Lin Y, Martin TG, Usmani SZ, et al. CARTITUDE-1 final results: Phase 1b/2 study of ciltacabtagene autoleucel in heavily pretreated patients with relapsed/refractory multiple myeloma. Journal of Clinical Oncology 2023;41(16_suppl):8009-09. doi: 10.1200/JCO.2023.41.16_suppl.8009
26. Kronig MN, Wehrli M, Salas-Benito D, et al. “Hurdles race for CAR T-cell therapy in digestive tract cancer”. Immunol Rev 2023;320(1):100-19. doi: 10.1111/imr.13273 [published Online First: 20230911]
27. Wehrli M, Maus MV. New CARs on and off the road: challenges and new developments in CAR-T cell therapy. Curr Opin Pharmacol 2021;59:116-26. doi: 10.1016/j.coph.2021.05.005 [published Online First: 20210628]
info@onco-suisse
- Vol. 14
- Ausgabe 2
- April 2024