- Rhythmusmanagement bei Patienten mit Herzinsuffizienz
Zusammenfassung: Arrhythmien treten häufig bei Patienten mit Herzinsuffizienz auf und sind mit einem signifikanten Risiko für Mortalität und Morbidität verbunden. Die Prävention des plötzlichen Herztods mittels ICD-Therapie ist entscheidend, aber die optimale Risikostratifizierung bleibt auch im Jahre 2024 herausfordernd. Für ventrikuläre Tachykardien unterstützen neue Daten den frühzeitigen Einsatz der Katheterablation. Die antiarrhythmische Medikamententherapie ist eine ergänzende Therapie bei symptomatischen Patienten, bietet aber keinen prognostischen Nutzen. Die antiarrhythmische Therapie bei Herzinsuffizienz erfordert einen systematischen, multimodalen Ansatz, der mit einer medikamentösen Therapie für Herzinsuffizienz beginnt und Device- und interventionelle Therapien integriert. Bei Patienten mit Herzinsuffizienz und Vorhofflimmern haben klinische Studien einen prognostischen Nutzen einer frühen Rhythmuskontrolle mittels Katheterablation gezeigt.
Rhythm management in patients with heart failure
Abstract: Arrhythmias manifest frequently in individuals with heart failure, posing a notable threat of mortality and morbidity. While the prevention of sudden cardiac death through ICD therapy remains pivotal, accurate risk stratification remains a challenging task even in 2024. Recent data underscore the early consideration of catheter ablation for ventricular tachycardias. Although antiarrhythmic drug therapy serves as an ancillary measure for symptomatic patients, it does not confer prognostic advantages. The holistic management of arrhythmias in heart failure necessitates a systematic, multidimensional approach that initiates with evidence-based medical therapy for heart failure and integrates device-based and interventional therapies. Noteworthy clinical studies have illustrated the positive prognostic impact of early rhythm control strategies, particularly catheter ablation, in individuals managing heart failure and atrial fibrillation.
Einführung
Ein beträchtlicher Anteil der Todesfälle bei Patienten mit Herzinsuffizienz ist auf ventrikuläre Arrhythmien, Bradykardie und Asystolie zurückzuführen, obwohl auch andere akute kardiovaskuläre Ereignisse eine Rolle spielen. Grundsätzlich kann die jährliche Rate plötzlicher Todesfälle schon durch die Behandlung der kardiovaskulären Grunderkrankung reduziert werden.
ICD-Therapie
Primärprävention
In einer Analyse von über 40.000 Patienten aus 12 Studien zur Herzinsuffizienz sanken die Raten der plötzlichen Herztode über 20 Jahre (von den mittleren 1990er-Jahren bis 2015) um 44% (1, 2). Dieser Rückgang ist wahrscheinlich auf Fortschritte in der Behandlung der Herzinsuffizienz zurückzuführen, da viele wichtige Therapien gemäss den Guidelines wie Betablocker, Mineralocorticoidrezeptorantagonisten, Sacubitril/Valsartan und biventrikuläre Pacemaker das Risiko eines plötzlichen Todes verringern (3). Obwohl einige Antiarrhythmika, insbesondere Amiodarone, die Häufigkeit von Tachyarrhythmien und plötzlichem Herzstillstand senken können, beeinflussen sie die Gesamtmortalität nicht (4). Zusätzlich hat sich die primär-prophylaktische ICD-Implantation bei ausgewählten Hochrisikopatienten mit Herzinsuffizienz etabliert. Der implantierbare Kardioverter-Defibrillator (ICD) wird eingesetzt zur Behandlung potenziell lebensbedrohlicher ventrikulärer Arrhythmien und kann auch Bradykardien verhindern, vorausgesetzt es handelt sich um ein transvenöses (nicht subkutanes) System.
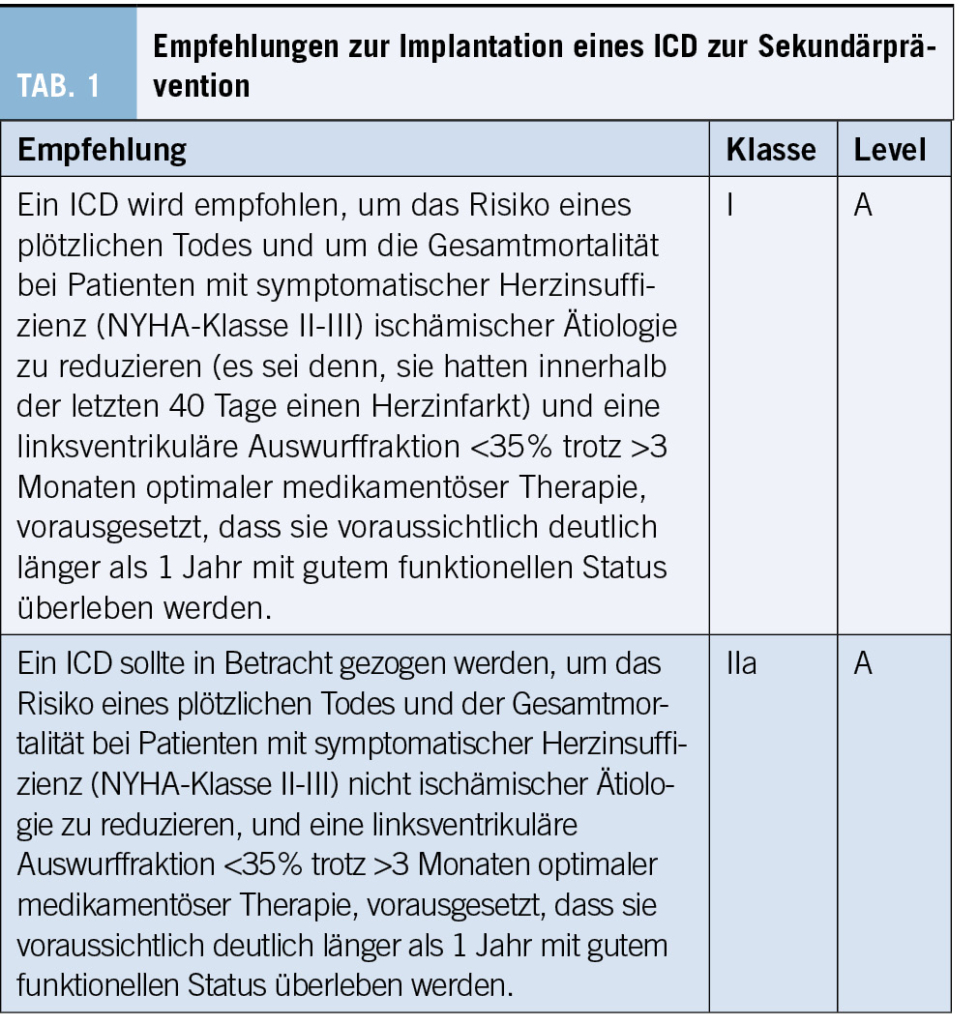
Obwohl ein ICD bei Patienten mit Herzinsuffizienz und reduzierter Auswurffraktion die Rate des plötzlichen arrhythmischen Todes reduziert, könnte der zusätzliche Nutzen bei gut kontrollierten Patienten begrenzt sein. In der DANISH-Studie mit Patienten mit nicht ischämischer Kardiomyopathie (NICM) war die Rate des plötzlichen Todes niedrig; nur 70 von 1116 Patienten hatten über 5 Jahre einen plötzlichen Tod (5). Während es einen leichten Rückgang des plötzlichen Todes mit einem ICD gab, zeigte sich keine signifikante Verbesserung der Gesamtmortalität. Subgruppenanalysen deuteten jedoch auf einen Nutzen für Patienten ≤70 Jahre hin. Eine Metaanalyse von Studien zu ICDs bei NICM bestätigte einen Überlebensvorteil, obwohl die Einbeziehung der DANISH-Studie den Effekt abschwächte (6). Die Empfehlungen zur Implantation eines ICD zur Sekundärprävention siehe Tabelle 1 (2).
Sekundärprävention
Hatte der Patient bereits anhaltende ventrikuläre Tachyarrhythmien erlitten oder sogar einen Herzstillstand überlebt, soll ein ICD das erneute Auftreten dieser lebensbedrohlichen Störungen verhindern. In diesem Fall sprechen wir von der Sekundärprävention des plötzlichen Herztodes.
Folgende Überlegungen sollten sich die behandelnden Ärzte unter Einbezug der Patienten vor der Implantation eines ICD bei Patienten mit Herzinsuffizienz machen (2):
1. Ein ICD wird bei Patienten mit Herzinsuffizienz empfohlen, um das Überleben zu erhöhen.
2. Die Entscheidung zur Implantation sollte die Ansicht des Patienten und dessen Lebensqualität berücksichtigen.
3. Patienten mit schweren Begleiterkrankungen, die voraussichtlich nicht wesentlich länger als 1 Jahr mit guter Lebensqualität überleben werden, haben wahrscheinlich keinen wesentlichen Nutzen von einem ICD.
Weitere wichtige Überlegungen zur Patientenauswahl für die Implantation eines implantierbaren Kardioverter-Defibrillators (2):
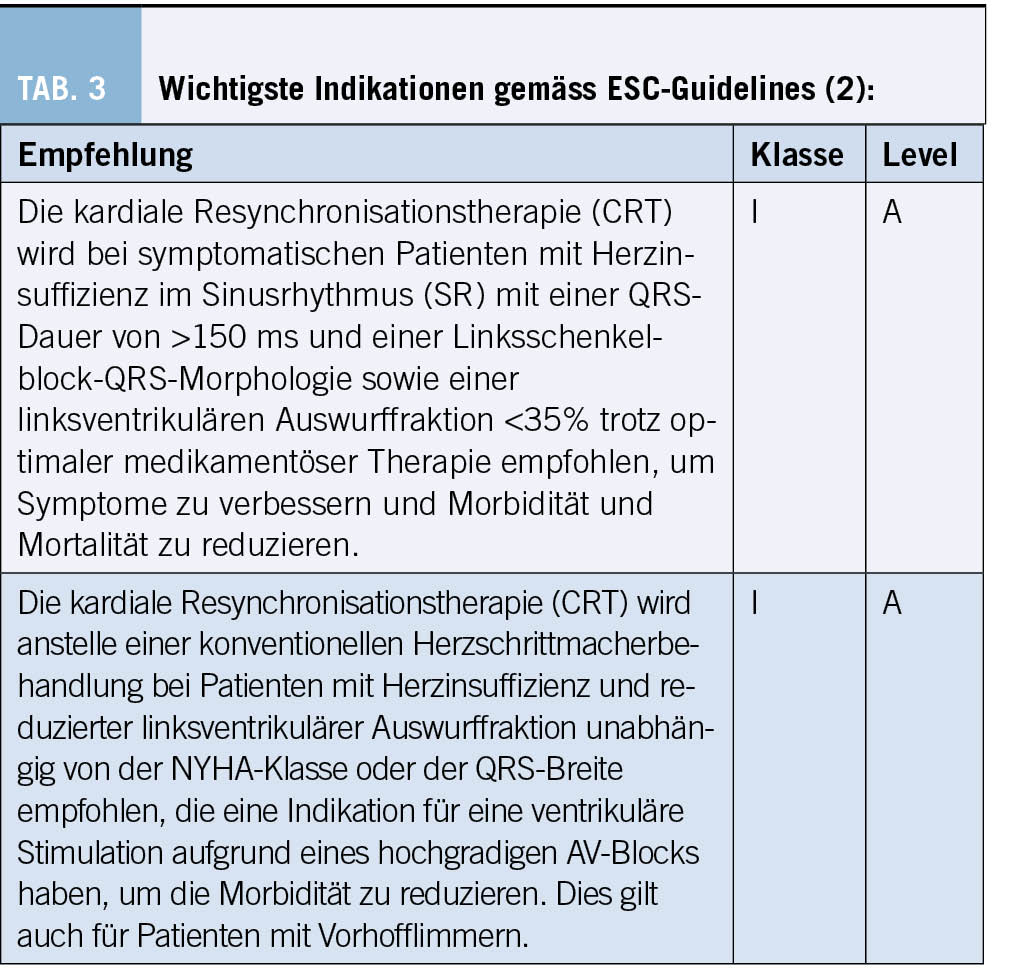
1. Bei Patienten mit HFrEF und einer QRS-Dauer ≥130 ms sollten wir einen biventrikulären ICD evaluieren.
2. Bei Patienten in der NYHA-Klasse IV wird ein ICD nicht empfohlen, sofern sie unter schweren, refraktären Symptomen leiden und keine Kandidaten für ein ventrikuläres Assistdevice oder eine Herztransplantation sind. Solche Patienten haben eine sehr begrenzte Lebenserwartung und sterben wahrscheinlich an Pumpenversagen.
3. Obwohl die DANISH-Studie keinen signifikanten Nutzen der ICD-Therapie bei Patienten mit NICM zeigte, sollte daran erinnert werden, dass NICM eine heterogene Erkrankung ist und bestimmte Subgruppen (z. B. Laminopathien, Sarkoidose) ein höheres Risiko für plötzlichen Tod haben und daher eine sorgfältige Abwägung der ICD-Indikation erfolgen sollte. In diesen Situationen kann das kardiale MRI zusätzliche Informationen zur Narbenlast liefern und so zur Entscheidungsfindung beitragen.
4. Patienten sollten über den Zweck eines ICD aufgeklärt und in den Entscheidungsprozess einbezogen werden. Sie sollten auch über mögliche Komplikationen im Zusammenhang mit der Implantation informiert werden. Sie sollten über Auswirkungen auf das Autofahren und das Risiko von unangemessenen Schocks aufgeklärt werden. Darüber hinaus sollten die Patienten über die Umstände informiert werden, unter denen der ICD deaktiviert werden kann, z. B. in terminalen Situationen (7).
Katheterablation von Kammertachykardien
Die ICD-Therapie reduziert den plötzlichen Herztod, verhindert jedoch keine ventrikulären Tachykardien. Daher können Patienten mit Herzinsuffizienz symptomatische ventrikuläre Arrhythmien und ICD-Schocks erfahren. Die Katheterablation von ventrikulären Tachykardien ist daher eine zentrale Komponente der ventrikulären Tachykardie-therapie bei Herzinsuffizienzpatienten. Daher wird die Katheterablation insbesondere bei Herzinsuffizienzpatienten mit ischämischer Kardiomyopathie und rezidivierender ventrikulärer Tachykardie nach ICD-Therapie empfohlen (2, 8, 9).
Überlegungen zur Indikationsstellung bei Batterieerschöpfung eines ICD
Wenn ein ICD-Generator das Ende seiner Lebensdauer erreicht oder explantiert werden muss, muss er nicht automatisch ersetzt werden. Vielmehr sollte eine gemeinsame Entscheidungsfindung stattfinden. Patienten sollten sorgfältig von einem erfahrenen Kardiologen evaluiert werden, da sich die Behandlungsziele seit der Implantation möglicherweise geändert haben (das Risiko für tödliche Arrhythmien kann niedriger sein oder das Risiko für nicht arrhythmischen Tod höher sein). Es ist umstritten, ob Patienten, deren LVEF sich stark verbessert hat und die während der Lebensdauer des ICD keine ICD-Therapie benötigt haben, ein weiteres Gerät implantiert werden sollte (2, 10).
Subkutane ICD-Systeme
Subkutane ICD (S-ICD) scheinen ebenso wirksam wie konventionelle transvenöse ICD mit einer ähnlichen Komplikationsrate zu sein. Obwohl das Risiko für inadäquate Schocks anfänglich höher zu sein schien, hat eine verbesserte Patientenauswahl gezeigt, dass S-ICD in dieser Hinsicht nicht unterlegen sind. Sie können die bevorzugte Option für Patienten mit schwierigem venösen Zugang oder solche sein, die aufgrund einer Infektion einen ICD entfernt bekommen müssen (12). Patienten müssen sorgfältig ausgewählt werden, da S-ICD keine Bradyarrhythmien behandeln können (ausser Post-Schock-Pacing) und weder Anti-Tachykardie-Pacing noch CRT liefern können (2, 11).
CRT-Therapie
Die kardiale Resynchronisationstherapie beruht auf der gleichzeitigen Stimulation von linkem und rechtem Ventrikel. Bei Patienten mit einer schweren Herzinsuffizienz liegt in etwa 30% der Fälle ein Linksschenkelblock vor, welcher zu einer ungünstigen Kontraktion des Herzens führt. Diesen Patienten kann unter Umständen mit einem Resynchronisationsgerät geholfen werden (12). Beim biventrikulären Pacing wird eine zusätzliche Elektrode, die über den Koronarsinus an die freie Wand des linken Ventrikels gelegt wurde, genutzt. Dadurch und dank der Elektrode im rechten Ventrikel kann das Herz wieder synchron stimuliert werden, und die ungünstigen Effekte des Linksschenkelblocks werden überbrückt. Bei Patienten, die auf diese Therapie ansprechen, tritt die Verbesserung der klinischen Symptomatik sofort nach Einschaltung des Gerätes ein.
Conduction-System-Pacing
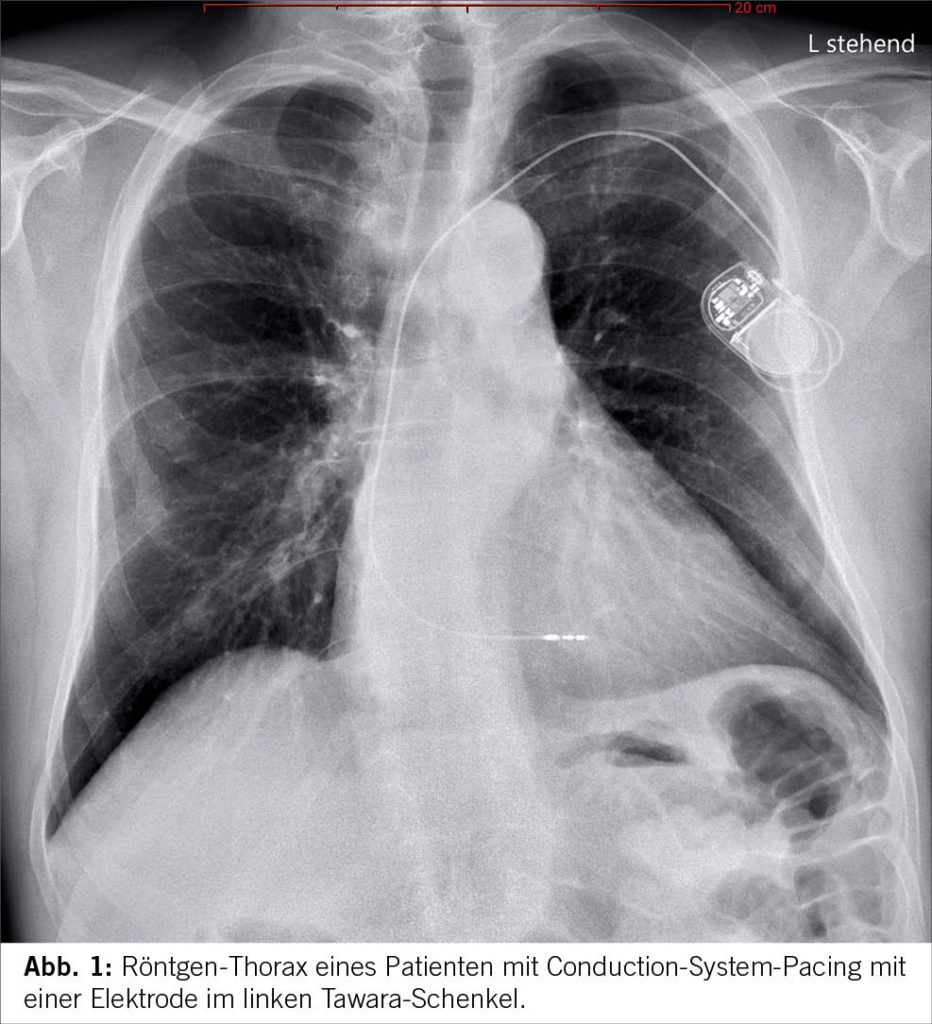
Biventrikuläres Pacing war bisher die etablierte Standardmethode für die kardiale Resynchronisationstherapie. Es weist jedoch eine nicht physiologische Aktivierung zwischen dem linken ventrikulären Epikardium und dem rechten ventrikulären Endokardium auf. Etwa ein Drittel der Herzinsuffizienzpatienten, die für die kardiale Resynchronisationstherapie infrage kommen, profitieren nicht von dieser Methode. Conduction-System-Pacing (CSP), einschliesslich His-Bündel-Pacing und Pacing im Bereich des linken Tawara-Schenkels, hat sich als vielversprechende Alternative zum biventrikulären Pacing für die kardiale Resynchronisation erwiesen (siehe Abbildung 1). Es gibt zunehmende Evidenz, dass CSP bei der Erzielung synchroner ventrikulärer Aktivierung und Repolarisation überlegen sein könnte (12-14). Jedoch stehen umfangreiche randomisierte Studien noch aus.
Ventrikuläre Extrasystolen bei Herzinsuffizienz
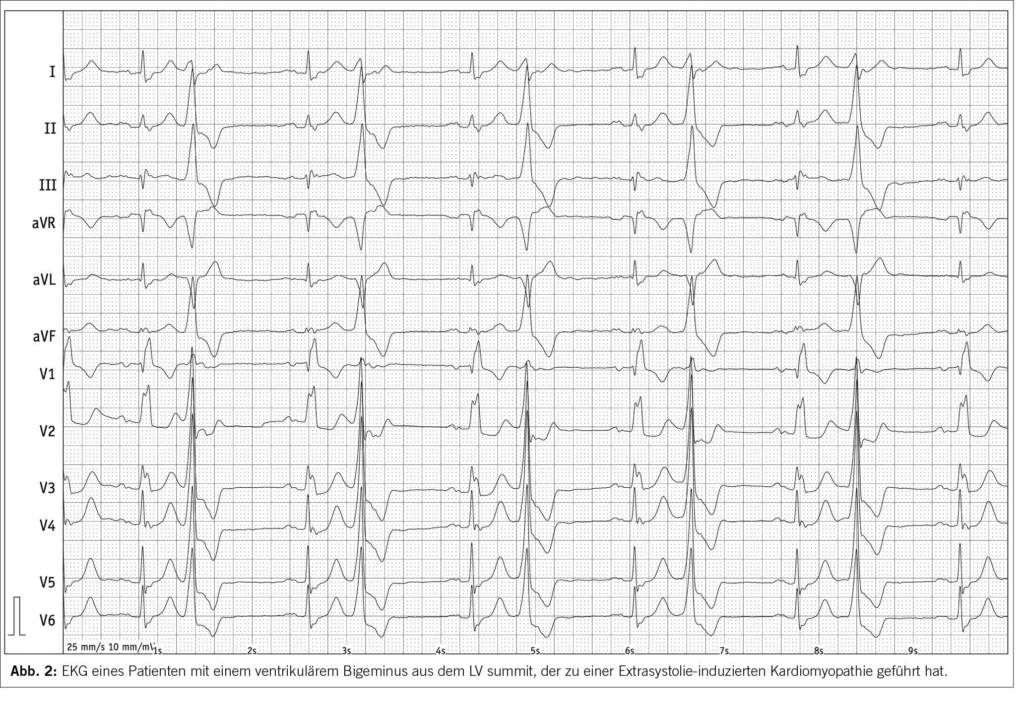
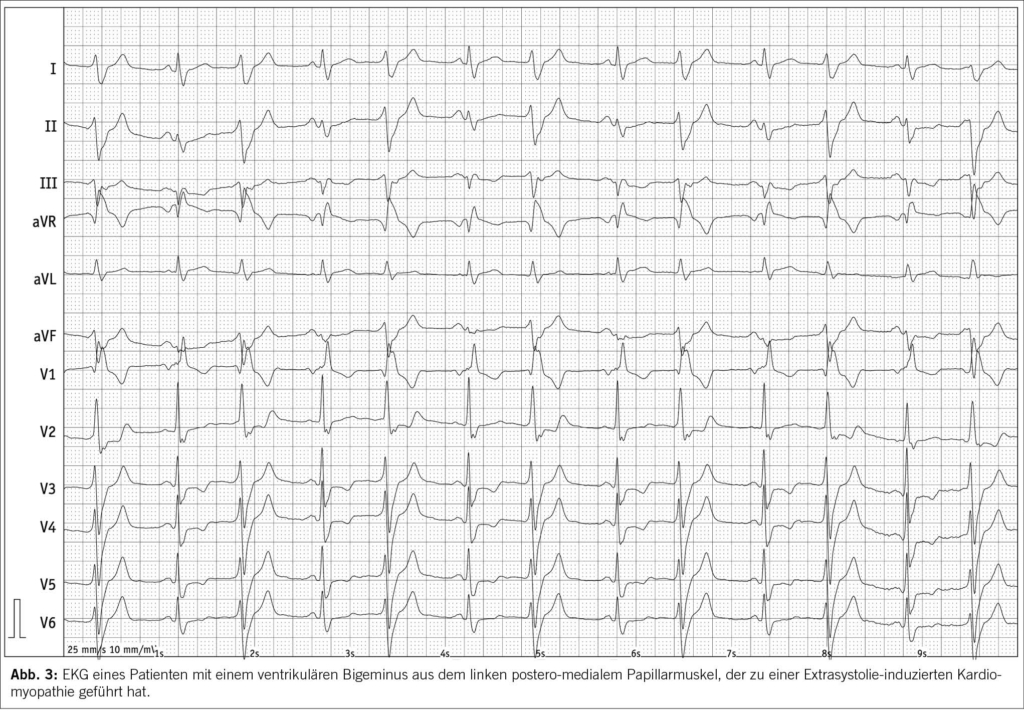
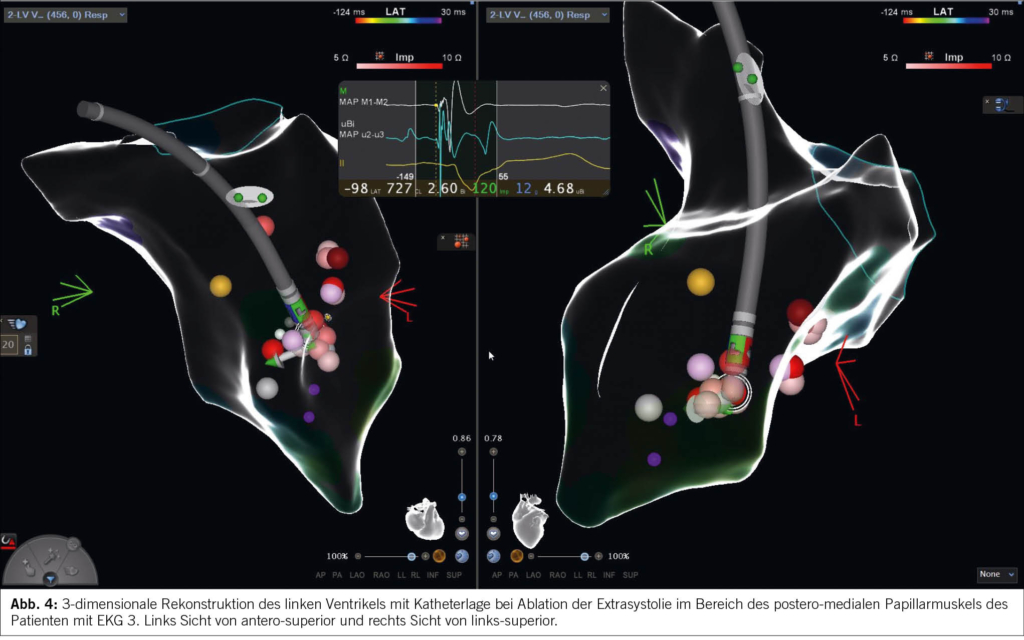
Ventrikuläre Extrasystolen sind die häufigsten ventrikulären Arrhythmien und treten häufig bei Patienten mit Herzinsuffizienz auf. Häufige ventrikuläre Extrasystolen können eine linksventrikuläre systolische Dysfunktion bei vorbestehender Herzinsuffizienz aggravieren (12). Wenn die Extrasystolen bei strukturell normalem Herzen eine Herzinsuffizienz verursachen, dann bezeichnen wir das als Extrasystolie-induzierte Kardiomyopathie (Abbildung 2 und 3). Es ist wichtig, diese Erkrankung zu erkennen, da die Kardiomyopathie durch die Beseitigung der ventrikulären Extrasystolie behandelt werden kann (Abbildung 4) (12, 15). Bei einigen Patienten normalisiert sich die linksventrikuläre Auswurffraktion jedoch trotz Beseitigung der ventrikulären Extrasystolie nicht. Dies weist dann eben auf eine vorbestehende linksventrikuläre Dysfunktion hin. Daher sollte die Diagnose einer Extrasystolie-induzierten Kardiomyopathie nur nach Verbesserung oder Normalisierung der LVEF nach Beseitigung der ventrikulären Extrasystolie gestellt werden. Eine ventrikuläre Extrasystoliebelastung von 10-20% scheint der Schwellenwert für die Entwicklung einer linksventrikulären Dysfunktion zu sein.
Die Katheterablation von ventrikulären Extrasystolen wird als Erstlinientherapie (Klasse-I-Empfehlung) für die Extrasystolie-induzierte Kardiomyopathie betrachtet. Antiarrhythmika sind eine Alternative, wenn die Katheterablation nicht gewünscht wird oder erfolglos war.
Vorhofflimmern
Vorhofflimmern und Herzinsuffizienz begünstigen gegenseitig ihr Auftreten und treten häufig gemeinsam auf. Der Anteil an Patienten mit Herzinsuffizienz, die Vorhofflimmern entwickeln, nimmt mit dem Alter und dem Schweregrad der Herzinsuffizienz zu. Wenn Vorhofflimmern Herzinsuffizienz im Sinne einer Tachykardiomyopathie verursacht, scheint der klinische Verlauf günstiger zu sein als bei anderen Ursachen von Herzinsuffizienz. Im Gegensatz dazu ist die Entwicklung von Vorhofflimmern bei Patienten mit chronischer Herzinsuffizienz mit einer schlechteren Prognose verbunden, einschliesslich Schlaganfall und erhöhter Sterblichkeit (12, 16).
Zudem stellt Herzinsuffizienz ein erhöhtes thromboembolisches Risiko bei Vorhofflimmern dar.
Beim Management von Patienten mit Herzinsuffizienz und gleichzeitigem Vorhofflimmern sollten folgende Punkte beachtet werden:
1. Identifikation und Behandlung möglicher Ursachen oder Auslöser von Vorhofflimmern: Potenzielle Ursachen oder auslösende Faktoren von Vorhofflimmern sollten identifiziert und korrigiert werden.
2. Management der Herzinsuffizienz
3. Prävention von embolischen Ereignissen
4. Frequenzkontrolle: Die Daten zur Frequenzkontrolle sind bei Patienten mit Vorhofflimmern und Herzinsuffizienz nicht eindeutig. Eine Strategie der grosszügigen (lenient) Frequenzkontrolle, definiert durch eine Ruheherzfrequenz <110 b.p.m., wurde mit einer strengen Frequenzkontrolle verglichen, wobei sich keine prognostischen Unterschiede zeigten. Daher stellt eine «lenient» Frequenzkontrolle einen akzeptablen ersten Ansatz dar: Jedoch sollte eine niedrigere Herzfrequenz angestrebt werden, falls anhaltende Symptome oder eine Tachykardie-induzierte Kardiomyopathie vorliegt.
5. Betablocker können für die Frequenzkontrolle bei HFrEF oder HFmrEF verwendet werden. Amiodaron i.v. kann die ventrikuläre Rate bei NYHA-Klasse IV und/oder hämodynamischer Instabilität reduzieren. Eine AV-Knoten-Ablation mit CRT-System-Implantation sollte bei unzureichender ventrikulärer Ratekontrolle erwogen werden (2).
6. Rhythmuskontrolle:
a. Die elektrische Kardioversion wird dringend empfohlen, wenn sich Patienten mit einer hämodynamischen Instabilität präsentieren, dabei muss natürlich das thromboembolische Risiko berücksichtigt werden. Bei Patienten ohne adäquate Antikoagulation und mit Vorhofflimmerndauer von mehr als 48 Stunden sind vor der Kardioversion mindestens 3 Wochen therapeutische Antikoagulation oder eine transösophageale Echokardiographie erforderlich.
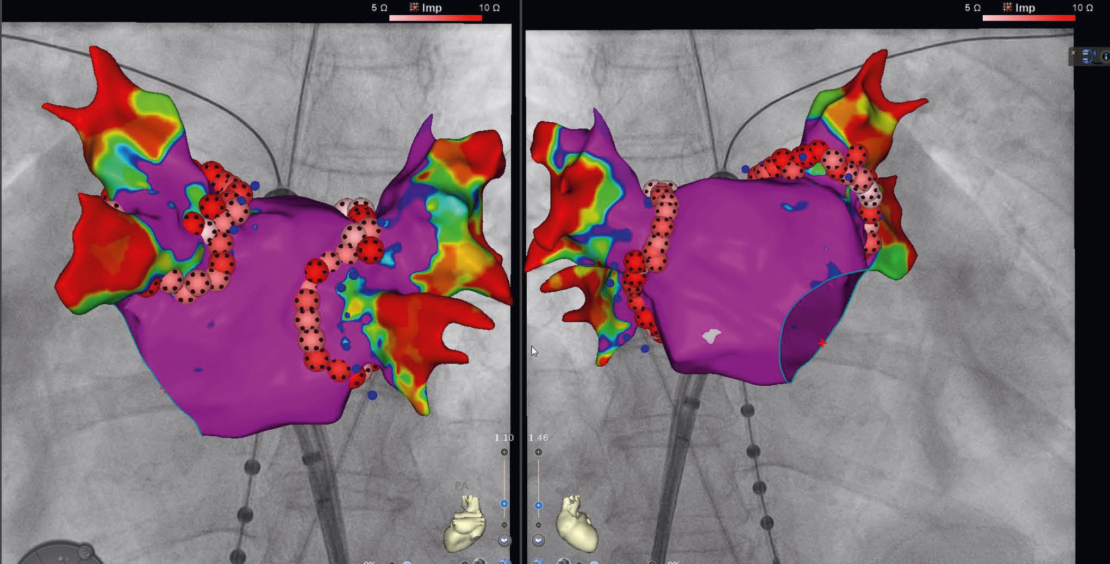
b. Für Patienten mit reduzierter linksventrikulärer Auswurffraktion (HFrEF) und Vorhofflimmern spielt die frühe Rhythmuskontrolle mittels Katheterablation eine entscheidende Rolle in der Behandlung, da neuere randomisierte kontrollierte Studien eine Verringerung der Vorhofflimmerlast und eine Verbesserung der Prognose zeigen (Abbildung 5). Somit kann gesagt werden, dass die Rhythmus-erhaltende Therapie bei Herzinsuffizienz-patienten nicht nur darauf abzielt, Symptome zu lindern, sondern sie kann das Fortschreiten von Herzinsuffizienz und Vorhofflimmern stoppen und so die Prognose verbessern (17, 18).
c. Bei der pharmakologischen Rhythmuskontrolle ist Amiodaron die bevorzugte Wahl für Patienten mit reduzierter linksventrikulärer Auswurffraktion. Eine langfristige Behandlung mit Antiarrhythmika beinhaltet die fortlaufende Überwachung bezüglich proarrhythmischer Effekte und Organtoxizität. Zudem sollte eine regelmässige Beurteilung der Vorhofflimmerlast unter Therapie erfolgen.
Kardiologie Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
Literatur:
1. Shen L, Jhund PS, Petrie MC, Claggett BL, Barlera S, Cleland JGF, Dargie HJ, Granger CB, Kjekshus J, Køber L, Latini R, Maggioni AP, Packer M, Pitt B, Solomon SD, Swedberg K, Tavazzi L, Wikstrand J, Zannad F, Zile MR, McMurray JJV. Declining Risk of Sudden Death in Heart Failure. N Engl J Med. 2017 Jul 6;377(1):41-51. doi: 10.1056/NEJMoa1609758. PMID: 28679089.
2. Authors/Task Force Members: McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022 Jan;24(1):4-131. doi: 10.1002/ejhf.2333. PMID: 35083827.
3. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Solomon SD, Swedberg K, Zile MR; PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014 Sep 11;371(11):993-1004. doi: 10.1056/NEJMoa1409077. Epub 2014 Aug 30. PMID: 25176015.
4. Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, Domanski M, Troutman C, Anderson J, Johnson G, McNulty SE, Clapp-Channing N, Davidson-Ray LD, Fraulo ES, Fishbein DP, Luceri RM, Ip JH; Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med. 2005 Jan 20;352(3):225-37. doi: 10.1056/NEJMoa043399. Erratum in: N Engl J Med. 2005 May 19;352(20):2146. PMID: 15659722.
5. Køber L, Thune JJ, Nielsen JC, Haarbo J, Videbæk L, Korup E, Jensen G, Hildebrandt P, Steffensen FH, Bruun NE, Eiskjær H, Brandes A, Thøgersen AM, Gustafsson F, Egstrup K, Videbæk R, Hassager C, Svendsen JH, Høfsten DE, Torp- Pedersen C, Pehrson S; DANISH Investigators. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med. 2016 Sep 29;375(13):1221-30. doi: 10.1056/NEJMoa1608029. Epub 2016 Aug 27. PMID: 27571011.
6. Di Marco A, Anguera I, Schmitt M, Klem I, Neilan TG, White JA, Sramko M, Masci PG, Barison A, Mckenna P, Mordi I, Haugaa KH, Leyva F, Rodriguez Capitán J, Satoh H, Nabeta T, Dallaglio PD, Campbell NG, Sabaté X, Cequier Á. Late Gadolinium Enhancement and the Risk for Ventricular Arrhythmias or Sudden Death in Dilated Cardiomyopathy: Systematic Review and Meta-Analysis. JACC Heart Fail. 2017 Jan;5(1):28-38. doi: 10.1016/j.jchf.2016.09.017. Epub 2016 Dec 21.
7. Kobza R, Erne P. End-of-life decisions in ICD patients with malignant tumors. Pacing Clin Electrophysiol. 2007 Jul;30(7):845-9. doi: 10.1111/j.1540-8159.2007.00771.x. PMID: 17584265.
8. Cronin EM, Bogun FM, Maury P, Peichl P, Chen M, Namboodiri N, Aguinaga L, Leite LR, Al-Khatib SM, Anter E, Berruezo A, Callans DJ, Chung MK, Cuculich P, d‘Avila A, Deal BJ, Bella PD, Deneke T, Dickfeld TM, Hadid C, Haqqani HM, Kay GN, Latchamsetty R, Marchlinski F, Miller JM, Nogami A, Patel AR, Pathak RK, Saenz Morales LC, Santangeli P, Sapp JL Jr, Sarkozy A, Soejima K, Stevenson WG, Tedrow UB, Tzou WS, Varma N, Zeppenfeld K. 2019 HRS/EHRA/APHRS/LAHRS expert consensus statement on catheter ablation of ventricular arrhythmias: Executive summary. J Arrhythm. 2020 Jan 3;36(1):1-58. doi: 10.1002/joa3.12264. PMID: 32071620; PMCID: PMC7011820.
9. Kobza R, Hilfiker G, Rissotto S, Mahida S, Grebmer C, Duru F, Pürerfellner H, Berte B. Performance and safety of temperature- and flow-controlled radiofrequency ablation for ventricular arrhythmia. Europace. 2023 Dec 28;26(1):euad372. doi: 10.1093/europace/euad372. PMID: 38193796; PMCID: PMC10775682.
10. Yap SC, Schaer BA, Bhagwandien RE, Kühne M, Dabiri Abkenari L, Osswald S, Szili-Torok T, Sticherling C, Theuns DA. Evaluation of the need of elective implantable cardioverter-defibrillator generator replacement in primary prevention patients without prior appropriate ICD therapy. Heart. 2014 Aug;100(15):1188-92. doi: 10.1136/heartjnl-2014-305535. Epub 2014 Jun 4. PMID: 24993502.
11. Knops RE, Olde Nordkamp LRA, Delnoy PHM, Boersma LVA, Kuschyk J, El-Chami MF, Bonnemeier H, Behr ER, Brouwer TF, Kääb S, Mittal S, Quast ABE, Smeding L, van der Stuijt W, de Weger A, de Wilde KC, Bijsterveld NR, Richter S, Brouwer MA, de Groot JR, Kooiman KM, Lambiase PD, Neuzil P, Vernooy K, Alings M, Betts TR, Bracke FALE, Burke MC, de Jong JSSG, Wright DJ, Tijssen JGP, Wilde AAM; PRAETORIAN Investigators. Subcutaneous or Transvenous Defibrillator Therapy. N Engl J Med. 2020 Aug 6;383(6):526-536. doi: 10.1056/NEJMoa1915932. PMID: 32757521.
12. Könemann H, Güler-Eren S, Ellermann C, Frommeyer G, Eckardt L.Antiarrhythmic Treatment in Heart Failure. Curr Heart Fail Rep. 2024Feb;21(1):22-32. doi: 10.1007/s11897-023-00642-w. Epub 2024 Jan 15. PMID: 38224446; PMCID: PMC10828006.
13. Ellenbogen KA, Auricchio A, Burri H, Gold MR, Leclercq C, Leyva F, Linde C, Jastrzebski M, Prinzen F, Vernooy K. The evolving state of cardiac resynchronization therapy and conduction system pacing: 25 years of research at EP Europace journal. Europace. 2023 Aug 25;25(8):euad168. doi: 10.1093/europace/euad168. PMID: 37622580; PMCID: PMC10450796.
14. Bressi E, Grieco D, Luermans J, Burri H, Vernooy K. Conduction system pacing for cardiac resynchronization therapy: State of the art, current controversies, and future perspectives. Front Physiol. 2023 Jan 13;14:1124195. doi: 10.3389/fphys.2023.1124195. PMID: 36711020; PMCID: PMC9880410.
15. Zeppenfeld K, Tfelt-Hansen J, de Riva M, Winkel BG, Behr ER, Blom NA, Charron P, Corrado D, Dagres N, de Chillou C, Eckardt L, Friede T, Haugaa KH, Hocini M, Lambiase PD, Marijon E, Merino JL, Peichl P, Priori SG, Reichlin T, Schulz-Menger J, Sticherling C, Tzeis S, Verstrael A, Volterrani M; ESC Scientific Document Group. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022 Oct 21;43(40):3997-4126. doi: 10.1093/eurheartj/ehac262. PMID: 36017572.
16. Santhanakrishnan R, Wang N, Larson MG, Magnani JW, McManus DD, Lubitz SA, Ellinor PT, Cheng S, Vasan RS, Lee DS, Wang TJ, Levy D, Benjamin EJ, Ho JE. Atrial Fibrillation Begets Heart Failure and Vice Versa: Temporal Associations and Differences in Preserved Versus Reduced Ejection Fraction. Circulation. 2016 Feb 2;133(5):484-92. doi: 10.1161/CIRCULATIONAHA.115.018614. Epub 2016 Jan 8. PMID: 26746177; PMCID: PMC4738087.
17. Schnabel RB, Marinelli EA, Arbelo E, Boriani G, Boveda S, Buckley CM, Camm AJ, Casadei B, Chua W, Dagres N, de Melis M, Desteghe L, Diederichsen SZ, Duncker D, Eckardt L, Eisert C, Engler D, Fabritz L, Freedman B, Gillet L, Goette A, Guasch E, Svendsen JH, Hatem SN, Haeusler KG, Healey JS, Heidbuchel H, Hindricks G, Hobbs FDR, Hübner T, Kotecha D, Krekler M, Leclercq C, Lewalter T, Lin H, Linz D, Lip GYH, Løchen ML, Lucassen W, Malaczynska-Rajpold K, Massberg S, Merino JL, Meyer R, Mont L, Myers MC, Neubeck L, Niiranen T, Oeff M, Oldgren J, Potpara TS, Psaroudakis G, Pürerfellner H, Ravens U, Rienstra M, Rivard L, Scherr D, Schotten U, Shah D, Sinner MF, Smolnik R, Steinbeck G, Steven D, Svennberg E, Thomas D, True Hills M, van Gelder IC, Vardar B, Palà E, Wakili R, Wegscheider K, Wieloch M, Willems S, Witt H, Ziegler A, Daniel Zink M, Kirchhof P. Early diagnosis and better rhythm management to improve outcomes in patients with atrial fibrillation: the 8th AFNET/EHRA consensus conference. Europace. 2023 Feb 8;25(1):6-27. doi: 10.1093/europace/euac062. PMID: 35894842; PMCID:PMC9907557.
18. Willems S, Borof K, Brandes A, Breithardt G, Camm AJ, Crijns HJGM, Eckardt L, Gessler N, Goette A, Haegeli LM, Heidbuchel H, Kautzner J, Ng GA, Schnabel RB, Suling A, Szumowski L, Themistoclakis S, Vardas P, van Gelder IC, Wegscheider K, Kirchhof P. Systematic, early rhythm control strategy for atrial fibrillation in patients with or without symptoms: the EAST-AFNET 4 trial. Eur Heart J. 2022 Mar 21;43(12):1219-1230. doi: 10.1093/eurheartj/ehab593. PMID: 34447995; PMCID: PMC8934687.
Therapeutische Umschau
- Vol. 81
- Ausgabe 2
- April 2024