- Management der Venenthrombose
1. Einführung zur Venenthrombose
Definitionen und Prävalenz (1)
Die venöse Thromboembolie (VTE) ist mit einer Inzidenz von 1–2 auf 1000 Patienten/Jahr eine häufige Erkrankung mit zwei Manifestationsformen, der Venenthrombose und der Lungenembolie (LE). Unter anatomischen und prognostischen Aspekten wird zwischen Thrombosen der tiefen Venen (TVT) und epifaszialer Venen (oberflächliche Venenthrombose, OVT, syn. Thrombophlebitis) unterschieden.
– Die meisten Thrombosen betreffen die Venen der unteren Extremitäten. Bei der tiefen Bein- oder Beckenvenenthrombose (TBVT) handelt es sich um eine partielle oder vollständige Verlegung der Leit- und/oder Muskelvenen durch Thromben. Die Lebenszeitprävalenz für eine TBVT liegt bei etwa 3–5 % und steigt mit zunehmendem Alter stark an. Mit Auswirkung auf die therapeutische Strategie werden die TBVT in proximale und distale Thrombosen unterteilt.
– Bei der isoliert distalen Thrombose (40 % der TVT) sind die tiefen Leit- (idTVT) und/oder Muskelvenen (iMVT) am Unterschenkel betroffen.
– Bei der proximalen Thrombose sind die Popliteal- (16 %), Femoral- (20 %) oder Beckenvenen (4 %) beteiligt.
– TVTs in anderen Lokalisationen sind deutlich seltener:
– Schulter-Armvenenthrombose (SAVT, 5–7 %)
– Cerebrale Venen- und Sinusthrombosen (CVST, ca. 1.3 pro 100 000 Personen/Jahr, 0.5–1 % aller Schlaganfälle)
– Viszeralvenenthrombose (ca. 2–3 pro 100 000 Personen/Jahr), umfasst Thrombosen der Pfortader (am häufigsten betroffen, meist infolge einer Leberzirrhose), Mesenterialvenen und Milzvene sowie das Budd-Chiari-Syndrom
Ursachen
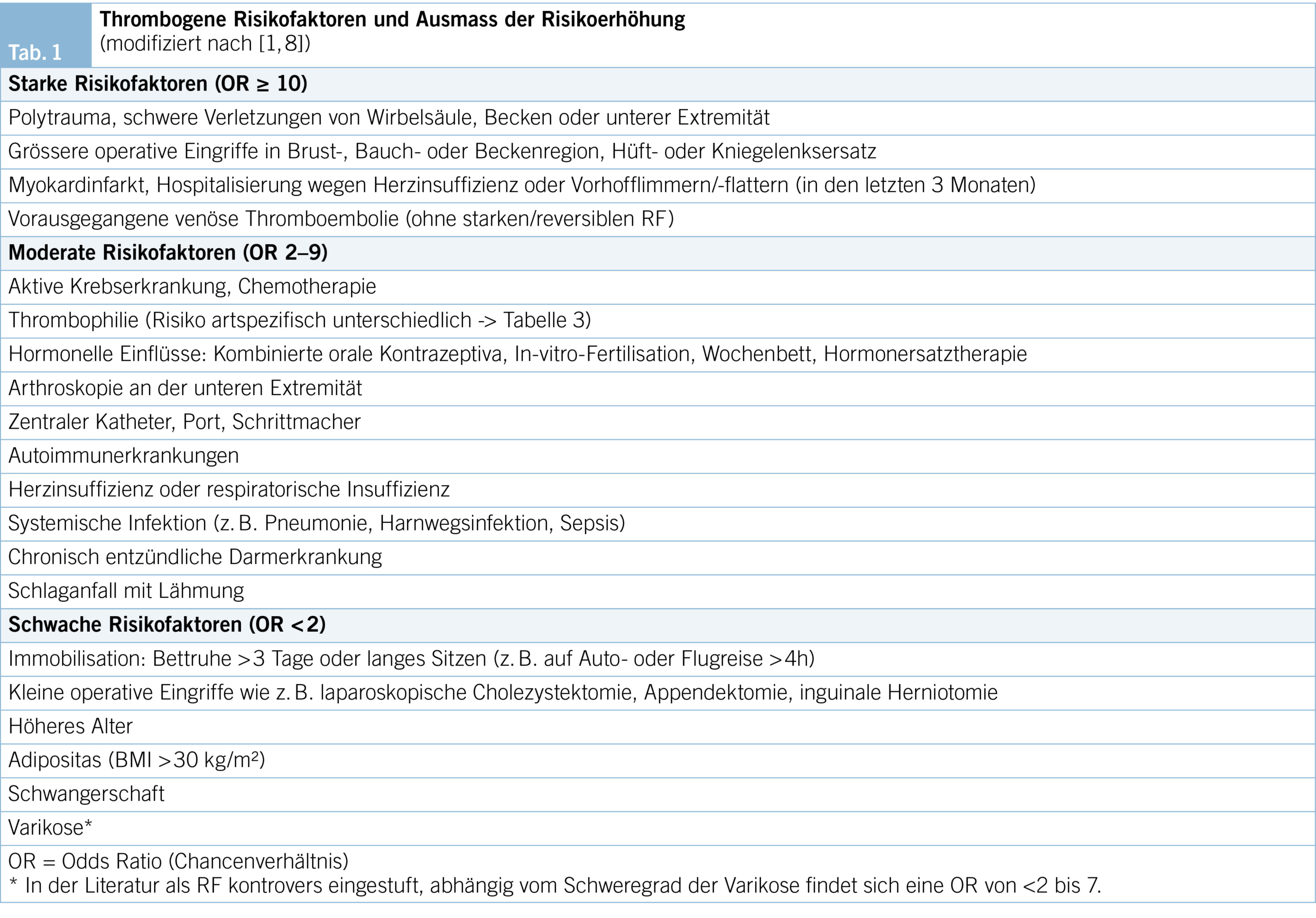
Thrombosen entstehen infolge Beeinträchtigung des Blutflusses mit venöser Stase, Veränderung der Blutzusammensetzung mit Hyperkoagulabilität sowie mechanisch oder inflammationsbedingter Endothelschädigung (Virchow-Trias). Bei jeder VTE soll nach Faktoren (Tab. 1) gesucht werden, die mutmasslich zum Thrombosegeschehen beigetragen haben (1–6), zur Abschätzung des Rezidivrisikos und mit Auswirkung auf die Behandlung und deren Dauer. Bei bis zu 30 % findet sich jedoch kein thrombogener Auslöser.
Prognose
Je proximaler eine TVT lokalisiert ist, desto höher ist das Embolie- und Rezidivrisiko und umso häufiger entwickeln sich gravierende Langzeitfolgen.
– LE-Risiko 10–30 %
– Postthrombotisches Syndrom (PTS) in ca. 30 %, davon entwickeln 2–3 % ein schweres PTS mit einem Ulcus cruris venosum
– Rezidive nach Beendigung der Antikoagulation: In unselektierten Thrombosekollektiven liegt das kumulative Rezidivrisiko nach einem VTE-Erstereignis bei 8 % nach 6 Monaten, 13 % nach 1 Jahr, 23 % nach 5 Jahren und 30 % nach 10 Jahren, fast 4 % der Rezidivereignisse verlaufen fatal (7).
2. Diagnostik bei tiefer Venenthrombose (TVT)
Klinische Symptomatik
Schmerz, Spannungsgefühl, Ödem, verstärkte Venenzeichen, Zyanose sind Hinweise auf eine TVT, sind jedoch – ebenso wie die klinischen Schmerz-Provokationsmanöver (Homann, Sigg, Payr etc.) – sehr unspezifisch und führen bei alleiniger Anwendung zu vielen falsch-positiven Befunden. Bei bettlägerigen Patienten verläuft die TVT oft asymptomatisch.
Diagnosealgorithmus bei TVT-Erstereignis
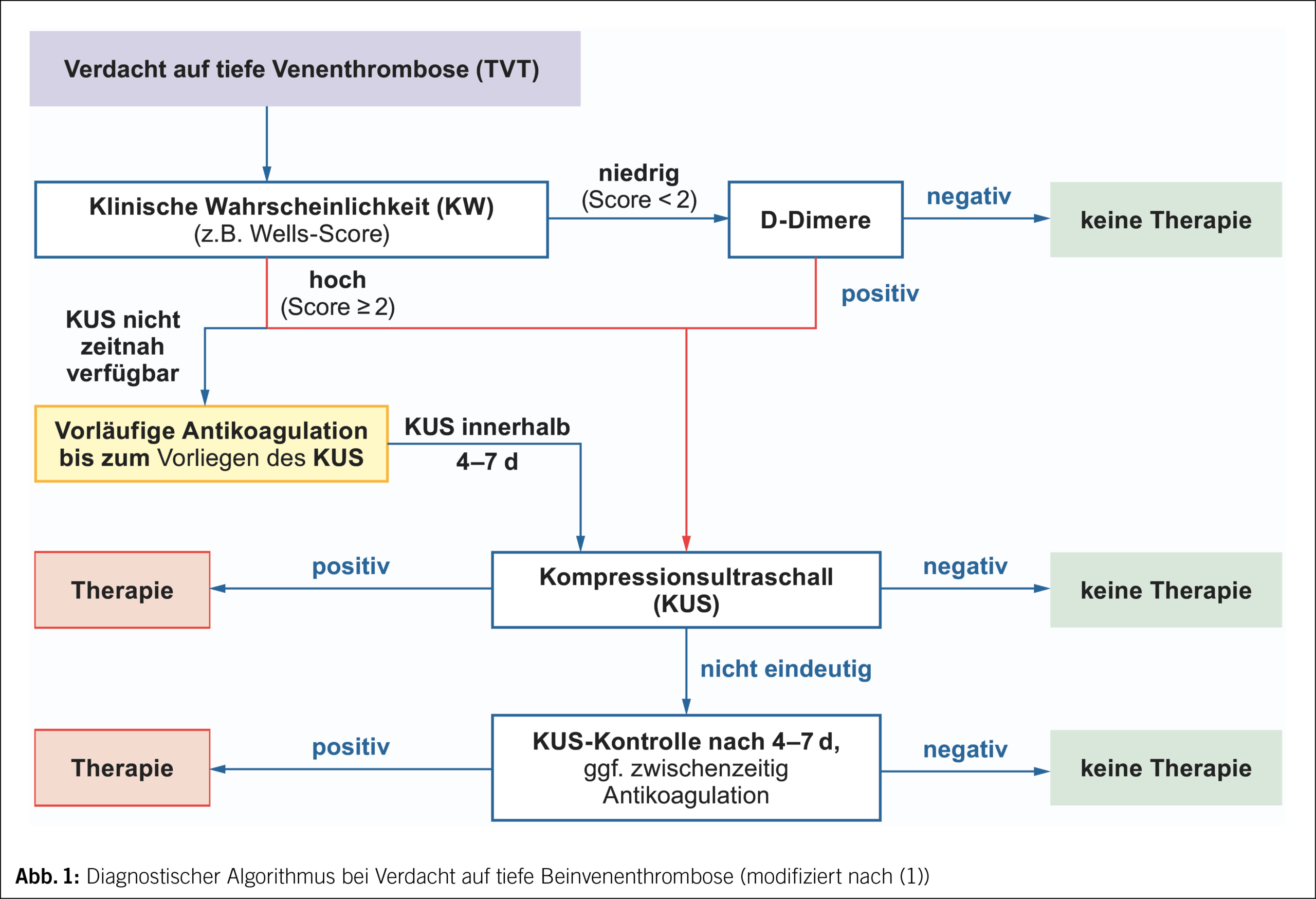
Die o.g. Symptome und die klinische Untersuchung haben nur eine geringe Sensitivität (60–90 % bei ambulanten, 0–20 % bei bettlägerigen Patienten) und Spezifität (9). Durch Integration in validierte Scores zur Vortestwahrscheinlichkeit einer TVT und Verwendung von Algorithmen (Abb. 1) erhöht sich jedoch deren Aussagekraft und wird grösstmögliche Kosteneffizienz in der Diagnostik erreicht.
Im Verdachtsfall auf eine TVT ist zur Bestimmung der klinischen Wahrscheinlichkeit (KW) der Wells-Score (10, 11) am gebräuchlichsten (Tab. 2). Entsprechend Validierungskohorten (beachte: nicht validiert für Schwangerschaft) liegt die Prävalenz der TVT bei hoher KW (Score ≥ 2) bei 30 %, bei geringer KW (Score < 2) bei 6 %. Bei niedriger KW wird die Diagnostik um einen D-Dimer-Test ergänzt und führt bei negativem Ergebnis zu einem sicheren Ausschluss. Bei hoher KW ist der Kompressionsultraschall (KUS) entscheidend.
D-Dimer-Bestimmung
D-Dimere sind Fibrinspaltprodukte, die eine erhöhte Fibrinolyseaktivität anzeigen, meist als Folge einer Aktivierung der Gerinnungskaskade. Ein Anstieg der D-Dimere kann auf ein Akutereignis einer VTE hindeuten, ist aber unspezifisch und findet sich auch bei entzündlichen Prozessen, Tumoren, Operationen, Blutung/Hämatomen und in der Schwangerschaft. Auch steigen die D-Dimere mit höherem Alter.
Für die D-Dimer-Diagnostik sollte ein hochsensitiver, quantitativer Test eingesetzt werden. Die in Gross- oder Gerinnungslabors verfügbaren Assays erreichen eine Sensitivität von > 96 % bei einer aus o.g. Gründen geringen Spezifität von 35 % (12). Wenn nicht zeitnah verfügbar, sind quantitative POCT-Tests (Point-of-Care-Tests) zur patientennahen Sofortdiagnostik in der Praxis eine annähernd gleichwertige Alternative (Sensitivität 85–96 %). Es gibt bislang keine international akzeptierte Standardisierung für die verschiedenen Tests, i.d.R. liegt der Grenzwert («Cut-off-value») für ein positives Ergebnis bei 500 μg/l bzw. 0.5mg/l.
Normwertige D-Dimere schliessen eine akute VTE mit hoher Wahrscheinlichkeit aus. Dennoch werden D-Dimere für die klinische Praxis nicht als «stand-alone»-Test empfohlen, da multizentrische, prospektiv durchgeführte Studien hierfür fehlen. Der D-Dimer-Test sollte mit Bezug auf die klinische Wahrscheinlichkeit im Diagnosealgorithmus eingesetzt (Abb. 1) und interpretiert werden (Abb. 2). Damit erreicht man zur Diagnose bzw. zum Ausschluss einer VTE eine hohe negativ prädiktive Wertigkeit von 99 % (13, 14) (NPV = Wahrscheinlichkeit, dass bei einem neg. Resultat die betreffende Krankheit nicht vorliegt). Durch Verwendung einer Altersadjustierung für Patienten ≥ 50 Jahre (= Lebensalter × 10 μg/l) kann man die Spezifität erhöhen, ohne Beeinträchtigung der Sensitivität (15).
Bildgebung
Bildgebende Methode der 1. Wahl ist der Kompressionsultraschall (KUS) mit Beurteilung des gesamten Beins, der eine TVT mit hoher Sicherheit (Sensitivität 94 %, Spezifität 97 %) (12) nachweist. Da im klinischen Alltag nicht überall 24/7 die fachliche Kenntnis hierfür verfügbar ist, wird in einigen Ländern und teils in Notaufnahmen alternativ der limitierte bzw. Point-of-Care-Ultraschall (POCUS) angewandt. Dabei wird der KUS nur an den proximalen Beinvenen oder, noch weiter vereinfacht, ein 2-Punkt-KUS der V. femoralis communis und V. poplitea durchgeführt. Das Verfahren ist auch für weniger routinierte Untersucher geeignet. Die limitierte Methode ist aber weniger sicher mit einer Post-Test-Inzidenz drei Monate nach initial unauffälligem Befund von 2.3 % gegenüber 0.57 % bei komplettem Beinvenenultraschall (16) und erfordert daher eine Zweituntersuchung mit vollständigem KUS innert 4 bis 7 Tagen zum sicheren Thromboseausschluss. Weiterhin ist der Ultraschall des kompletten Beins in der Detektion von Differenzialdiagnosen überlegen, wie z. B. Baker-Zysten, Hämatome, Aneurysmen.
Bei unklarem sonografischen Befund soll nach 4–7 Tagen eine vollständige KUS-Kontrolle erfolgen oder eine alternative Bildgebung mittels CT- oder MR-Phlebographie, welche zur Diagnostik der Beckenstrombahn und V. cava inferior überlegen ist. Die begrenzte Verfügbarkeit (MR) bzw. die relativ hohe Strahlenbelastung (beim CT) sowie hohe Kosten im Vergleich zur Sonografie sind Gründe, die beiden Verfahren nicht primär in diagnostische Algorithmen zur Abklärung einer TVT im Klinikalltag einzubinden.
Die konventionelle Phlebographie ist heute in der Thromboseabklärung ein nachgeordnetes Verfahren und nur noch ausnahmsweise indiziert, z. B. bei nicht eindeutiger Abklärung des Verdachts einer Rezidivthrombose, einer isolierten Beckenvenenthrombose oder im Rahmen eines rekanalisierenden Eingriffs.
Diagnostik bei V.a. Rezidivthrombose
Der unter Abbildung 1 dargestellte klassische Algorithmus zur Abklärung einer (Erst-)TVT ist bei Verdacht auf eine Rezidivthrombose unsicher, ein Diagnosealgorithmus wurde bisher für diese Situation nicht ausreichend gut validiert. Es ist anzunehmen, dass die klinische Wahrscheinlichkeit bei V.a. Rezidivthrombose nahezu immer hoch ist, da die erste Thrombose bereits mit 1 Punkt in den Wells-Score eingeht (Tab. 2) und Schmerz und/oder Schwellung als Anlass für den erneuten TVT-Verdacht mit weiteren 1–2 Punkten.
Der Sonografie kommt damit bei Diagnostik einer Rezidivthrombose eine noch grössere Bedeutung zu. Hilfreich ist dabei, wenn bei ipsilateralem Ereignis ein ausreichend gut dokumentierter Endzustand der abgelaufenen Thrombose zum Vergleich vorliegt, da nur ein Teil der Venen vollständig rekanalisieren und in 30–50 % der Fälle residuelle postthrombotische Veränderungen verbleiben. Als zusätzliche Sicherheit sollte bei V.a. ein Thromboserezidiv unabhängig der klinischen Wahrscheinlichkeit immer auch eine D-Dimer-Testung erfolgen (1).
– Normwertige D-Dimere und ein im Vergleich zur Voruntersuchung unveränderter Ultraschallbefund machen ein Thromboserezidiv unwahrscheinlich.
– Erhöhte D-Dimere beweisen keine Thrombose, können aber im Kontext mit Klinik und Ultraschall zur Einschätzung der Situation beitragen. Bei nicht eindeutigem Ultraschallbefund sollte eine Ultraschallkontrolle mit erneuter D-Dimer-Testung innerhalb 4–7 Tagen erfolgen, um aus der Dynamik der Befunde Rückschlüsse auf das Thrombosealter und die Aktualität des Geschehens zu ziehen.
Im Einzelfall kann bei V.a. Rezidivthrombose eine MR-Phlebographie erwogen werden. Spezielle Techniken (MR direct thrombus imaging, MRDTI) geben Hinweise auf das Thrombusalter und helfen zur Differenzierung einer akuten ipsilateralen Rezidivthrombose von postthrombotischen Veränderungen (17).
Abklärung einer Thrombophilie
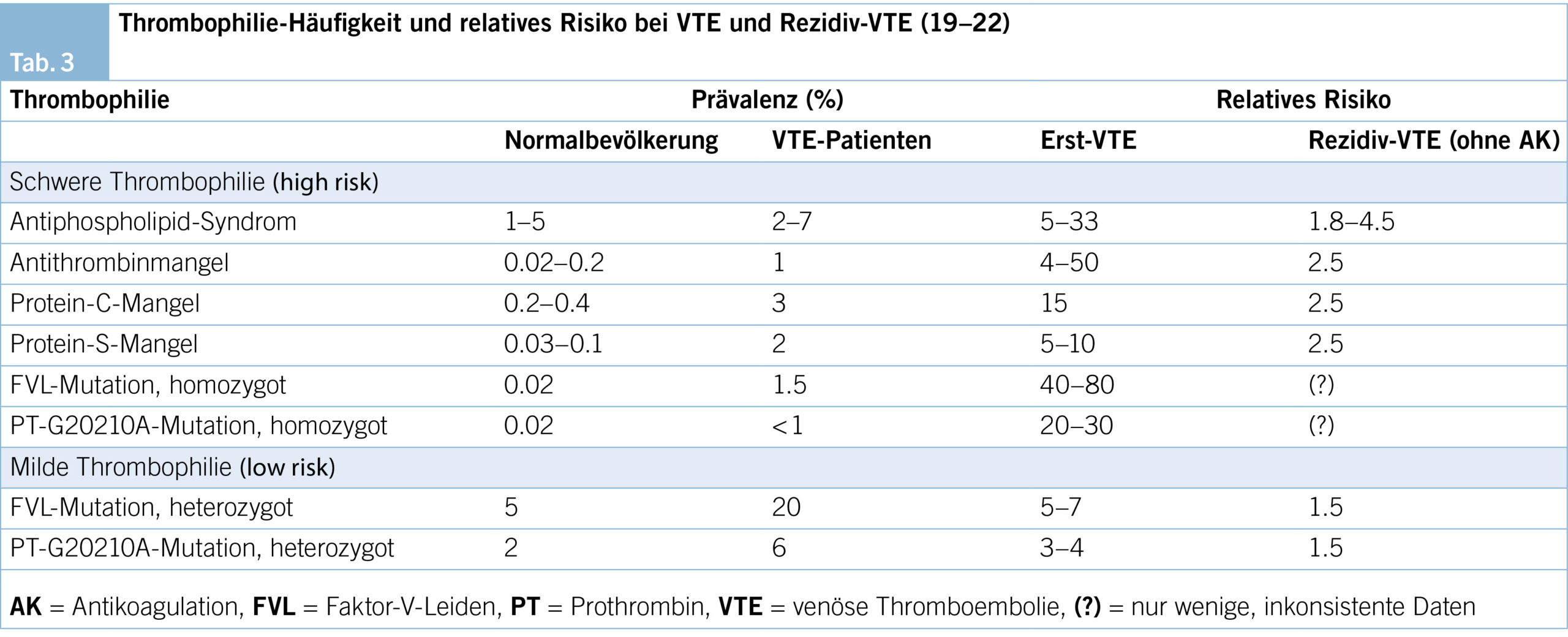
Der Begriff Thrombophilie bezeichnet angeborene oder erworbene Störungen der Blutgerinnung, die mit einem erhöhten Risiko für eine venöse Thromboembolie einhergehen. Die häufigen Thrombophilien (heterozygote Faktor-V-Leiden- und Prothrombin-Mutation) erhöhen das Thrombose- und Rezidivrisiko nur wenig (low-risk), hereditäre Thrombophilien mit hohem Thromboserisiko (high-risk) hingegen sind selten, ihr Einfluss auf das Rezidivrisiko unterschiedlich (Tab. 3). Insgesamt scheint die relative Risikoerhöhung für ein Erstereignis höher zu sein als für VTE-Rezidive (18).
Der Nachweis einer Gerinnungspathologie hat somit wenig Relevanz für das Management nach einem Indexereignis. Nach Leitlinien soll eine Abklärung nur dann durchgeführt werden, wenn sich aus dem Ergebnis therapeutische Konsequenzen ergeben. Sowohl die Schweizerische Gesellschaft für Angiologie als auch Hämatologie nehmen in ihrer 2024 resp. 2023 publizierten Top-5-Liste Smarter Medicine (https://www.smartermedicine.ch/de/top-5-listen) zum Thrombophilie-Screening Stellung und postulieren, keine Gerinnungsabklärung durchzuführen nach einem Erstereignis durch einen bekannten reversiblen oder irreversiblen Provokationsfaktor bzw. nach jeglicher VTE mit starkem transienten Risikofaktor. Begründung: Thrombophilietests sind kostspielig (nach eigener Recherche in 04/2024 Laborkosten ca. 630 CHF) und beeinflussen in o.g. Situation weder die Therapie noch die Prognose.
Eine Ausnahme stellt das Antiphospholipid-Syndrom (APS) dar, dessen Diagnose den Behandlungspfad einer VTE unmittelbar beeinflusst. Auf Basis der Daten der TRAPS-(Rivaroxaban) (23)- und ASTRO-APS-(Apixaban) (24)-Studie, die wegen erhöhter Rate arterieller Thrombosen im Vergleich zu Vitamin-K-Antagonisten (VKA) vorzeitig beendet wurde, werden sämtliche DOAKs für Patienten mit einer Thrombose und APS nicht empfohlen und sollten vorzugsweise NMH und VKA zur Antikoagulation eingesetzt werden.
Indikationen für eine Thrombophilie-Abklärung nach venöser Thromboembolie sind (1, 18, 25)
– spontanes VTE-Erstereignis bei unter 50-jährigen Patienten und/oder bei positiver Familienanamnese für gehäufte VTEs bei Verwandten 1. Grades
– rezidivierende VTEs ohne identifizierbaren Risikofaktor
– VTE-Progression trotz adäquater Antikoagulation
– atypische Thromboselokalisation (z. B. Viszeralvenen-, Sinusvenenthrombose)
– Hinweise auf APS: Schwangerschaftskomplikationen (rezidivierende Aborte, Plazentainsuffizienz/intrauterine Wachstumsverzögerung, Präeklampsie), spontane VTEs bei unter 50-Jährigen, Koinzidenz mit Autoimmunerkrankungen (z. B. Lupus erythematodes) oder arteriellen Thrombosen
– VTEs (v.a. kurz nach Start) unter östrogenhaltigen Medikamenten
Umfang der Thrombophilie-Abklärung
(in der Regel durch Gerinnungsspezialist)
– Gerinnungsstatus inklusive Quick/INR, aPTT, Fibrinogen, D-Dimere
– Protein C, Protein S, Antithrombin (funktionell)*
– APC-Resistenz, Genanalytik auf Faktor-V-Leiden-(R506Q)- und Prothrombin-G20210A-Mutation
– Lupus-Antikoagulans, Anti-Cardiolipin- und Anti-β-2-Glykoprotein-I-Antikörper (IgG + IgM). Die Tests bedürfen einer Kontrolle im Abstand von mindestens 12 Wochen, da nur bei Antikörperpersistenz die Diagnose eines APS gestellt werden darf.
– Bei Viszeralvenenthrombosen zudem Testung auf JAK2-Mutation für myelodysplastische Syndrome (Polycythaemia vera oder essenzielle Thrombozythämie), bei zusätzlicher Hämolyse Flowzytometrie (Nachweis für paroxysmale nächtliche Hämoglobinurie).
*Anmerkung: Während die Gendiagnostik als zuverlässig gilt, sollten pathologische Befunde für Antithrombin, Protein C oder S kritisch reflektiert und die einzelnen Tests kontrolliert werden, da sekundäre Mängel wesentlich häufiger vorkommen als hereditäre Defekte (DD physiologische Schwankungen, Lebererkrankung, Vitamin-K-Mangel, Antikoagulantien-, Östrogentherapie, Schwangerschaft u.a.).
Zeitpunkt der Testung
Wenn möglich soll die Thrombophilie-Abklärung nicht in der Akutphase einer VTE erfolgen (frühestens nach 2–3 Monaten), idealerweise einen Monat nach Absetzen der Antikoagulation, da einige Gerinnungstests bei ausgedehnten Thrombosen und durch den Einfluss von Antikoagulantien verfälscht werden können.
Soll eine Testung unter fortgeführter Antikoagulation erfolgen, sollte eine NMH- oder DOAK-Therapie zumindest für 48–72 h pausiert werden, um valide Testergebnisse zu gewährleisten. In den ersten 4 Wochen ist von einer solchen Therapiepause wegen des hohen Rezidiv- und LE-Risikos abzuraten. Eine Therapiepause gegen Ende der Erhaltungstherapie, wenn die Frage nach der Notwendigkeit einer Sekundärprophylaxe zu klären ist, ist dagegen in den meisten Fällen vertretbar. Alternativ kann eine relevante DOAK-Restwirkung in der Plasmaprobe durch Zusatz spezieller Kohle-Reagenzien (z. B. DOAC-Stop®, DOAC-Remove®) eliminiert werden – das Gerinnungslabor muss entsprechend auf die DOAK-Therapie hingewiesen werden (26).
Screening von Verwandten 1. Grades
Nach der Diagnose einer Thrombophilie beim Indexpatienten stellt sich die Frage der Notwendigkeit einer Testung der Angehörigen. Alle hereditären Thrombophilien werden autosomal dominant vererbt, somit besteht für sie eine Vortestwahrscheinlichkeit von 50 %. Eine primärpräventive Testung wird kontrovers diskutiert. Die Kenntnis einer Thrombophilie kann für eine Beratung zur Hormontherapie (Pille, HRT) oder Schwangerschaft und individualisierte Thromboseprophylaxe hilfreich sein, kann aber auch Ängste der Betroffenen provozieren. Bei den Verwandten soll wenn dann nur gezielt auf den nachgewiesenen Defekt getestet werden. Nicht alle Krankenkassen übernehmen die Kosten einer präventiven Testung, eine Kostengutsprache ist einzuholen.
Tumorsuche bei spontaner Thromboembolie
Tumorpatienten haben ein etwa 7-fach erhöhtes Risiko für eine VTE gegenüber Personen ohne Malignom infolge paraneoplastischer Gerinnungsaktivierung und/oder lokaler Gefässkompression oder -infiltration. Man nimmt an, dass ca. 20 % aller VTE-Ereignisse Tumor-assoziiert auftreten (27).
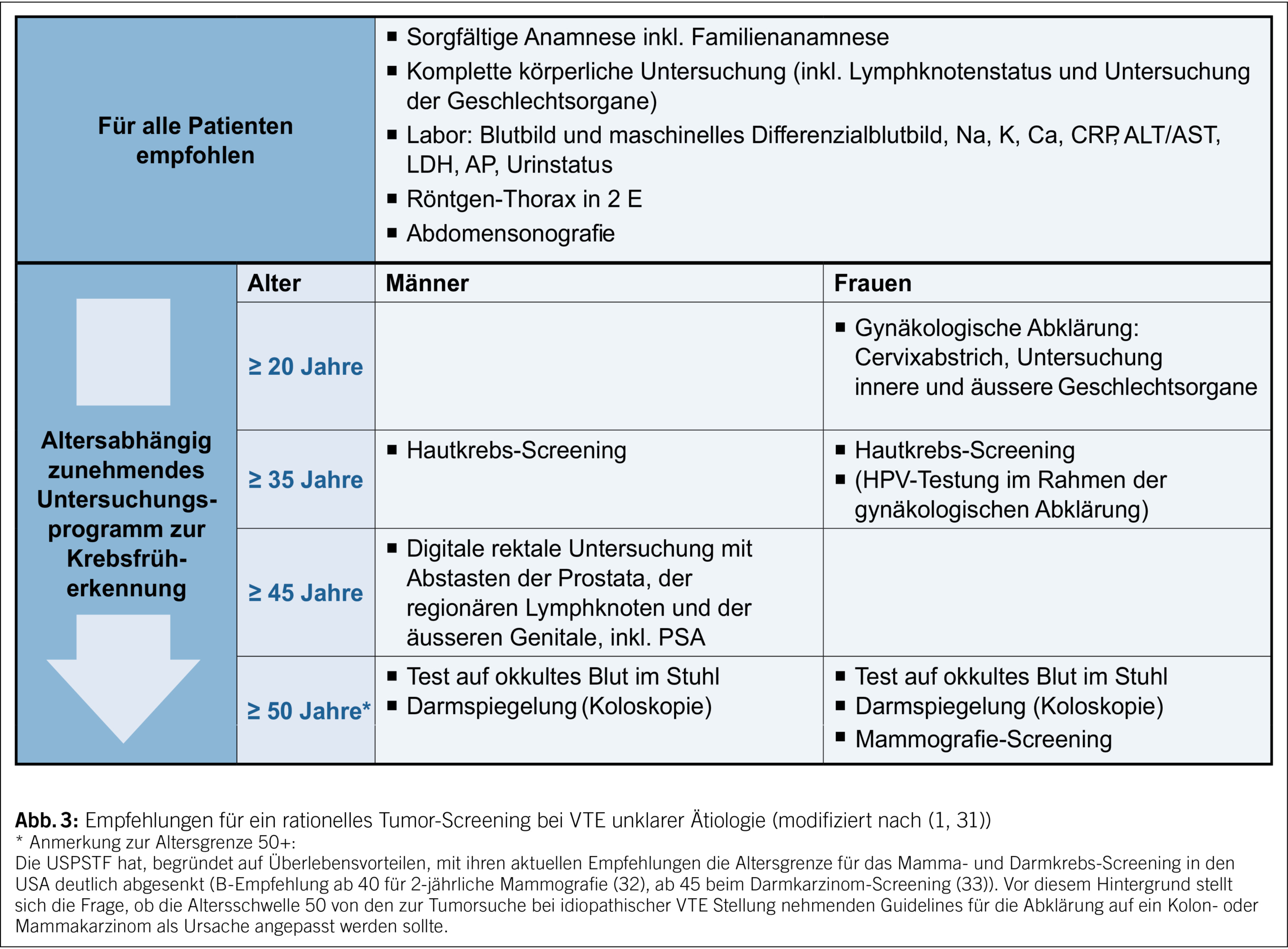
Einem idiopathischen Ereignis kann ein okkulter Tumor zugrunde liegen, das Risiko hierfür ist bei über 50-jährigen gegenüber jüngeren Patienten deutlich erhöht (6.8 % vs. 1 %) (28). Da der einer VTE zugrunde liegender Risikofaktor Einfluss auf die Therapie und Sekundärprophylaxe hat, wird bei unklarem Auslöser ein Tumor-Screening empfohlen.
– Etabliert hat sich die Empfehlung für eine «limitierte Tumorsuche» bei idiopathischer Thrombose mit den geschlechts- und altersspezifischen Krebsvorsorgeuntersuchungen (Abb. 3).
– Für eine «intensivierte Tumorsuche» ist kein klarer Vorteil belegt: Es können zwar etwas mehr Karzinome im Frühstadium detektiert werden, jedoch ergaben sich bisher im Vergleich einer intensiven Strategie mit zusätzlicher CT- oder PET-Untersuchung zur limitierten Routineabklärung keine signifikanten Unterschiede in der Anzahl zeitnah diagnostizierter Malignome und der Malignom-assoziierten Sterblichkeit (29, 30).
3. Therapie der TVT
3.0. Behandlungsstrategie
Mit Sicherung der Diagnose einer TVT soll ohne zeitlichen Verzug eine Antikoagulation (AK) eingeleitet werden. Falls zeitnah keine Bildgebung zur Verfügung steht, kann bei hoher TVT-Wahrscheinlichkeit eine Interims-Antikoagulation begonnen werden. In jedem Fall muss zu einem späteren Zeitpunkt der definitive Nachweis oder Ausschluss einer Thrombose mit Bildgebung geführt werden.
Die Behandlung hat folgende Ziele:
– Verhinderung eines appositionellen Thrombuswachstums und Risikoreduktion für eine Lungenembolie
– Die AK verschiebt das Gleichgewicht zwischen pro- und antikoagulatorischen Faktoren und unterstützt die Thrombusauflösung (und damit Rekanalisation) durch die körpereigene Fibrinolyse.
– Die AK reduziert das Risiko für Rezidivereignisse sowie das Auftreten und den Schweregrad eines postthrombotischen Syndroms (PTS).
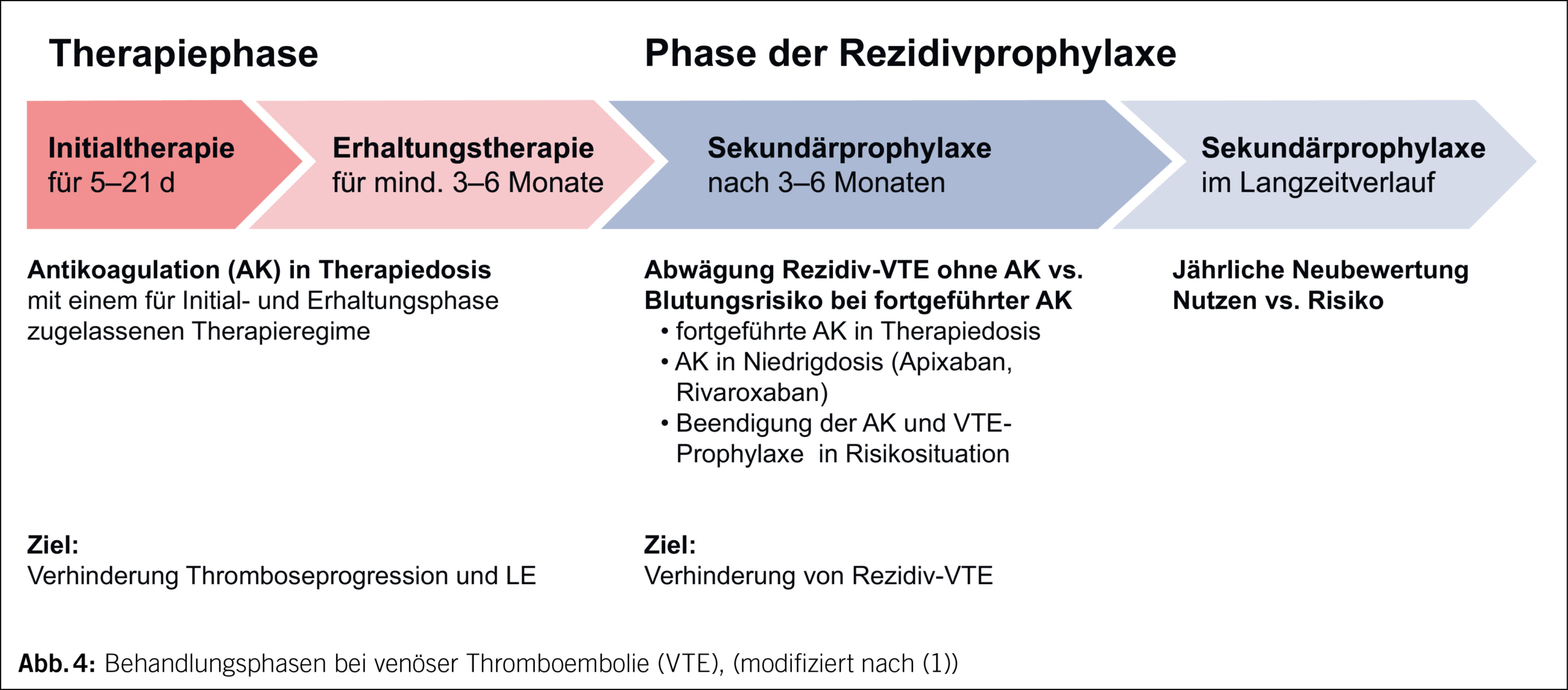
Die Therapie besteht aus 3 Behandlungsphasen (Abb. 4, Kapitel 3.1.–3.4.):
1. Phase der Initialtherapie (meist 5–21 Tage)
2. Phase der Erhaltungstherapie (mindestens 3–6 Monate)
3. Phase der Sekundärprophylaxe (ggf. zeitlich unbefristet)
Akut revaskularisierende Eingriffe wie systemische Thrombolyse mit oder ohne Thrombektomie haben nach jetzt verfügbarer Evidenz keinen Beleg für einen klaren Nutzen, eine vollständige Thrombusauflösung ist zwar häufiger als bei alleiniger Antikoagulation, die PTS-Inzidenz ist aber nur leicht reduziert (nach einem Cochrane-Review RR 0.89 [0,74–1,05]), Blutungskomplikationen sind vermehrt (34). Eine endovaskuläre Revaskularisation bleibt Sonderfällen vorbehalten, wie z. B. einer deszendierenden Beckenvenenthrombose oder schwerem PTS mit Claudicatio venosa, und kann im späteren Verlauf bei chronisch venöser Okklusion erwogen werden.
Mobilisierung
Patienten mit einer TVT jeglicher Lokalisation und Morphologie (auch «flottierender Thrombus») sollen nicht immobilisiert werden, nur bei ausgeprägter und schmerzhafter Beinschwellung (zur Hochlagerung des Beins). Die symptomadaptierte Mobilisierung fördert durch Einsatz der Muskelpumpen die venöse Entstauung.
Kompressionstherapie
Die Kompression fördert den venösen Rückstrom und begünstigt die Rekanalisation. Sie bewirkt damit in der Akutphase eine Linderung von Schmerzen und Schwellung, und hat langfristig das Ziel, die Häufigkeit und Schwere des PTS zu reduzieren. Voraussetzung hierfür sind der frühzeitige Beginn der Kompression (35, 36), eine konsequente Anwendung und ein ausreichender Anpressdruck, bei 20–40 mmHg ist eine um die Hälfte reduzierte Inzidenz des PTS belegt (35, 37, 38). Nach Guidelines wird empfohlen (1, 3, 4):
– Die Kompression soll frühzeitig (innerhalb 24 h nach Diagnosestellung) begonnen werden (IA-Empfehlung), bei massiver Beinschwellung initial als Kompressionsverband, nach Entstauung mit Strümpfen der KKL 2 (entspricht Kompressionsdruck 23–32 mmHg).
– Für die Strumpflänge ist nicht die Ausdehnung der TVT entscheidend, sondern die klinische Symptomatik. Bei Unterschenkelschwellung genügen Wadenstrümpfe A–D (IIaA), wodurch die Patientenadhärenz erhöht werden kann. Bei (zusätzlicher) Oberschenkelschwellung wird ein Schenkelstrumpf A–F empfohlen.
– Die Kompression ist ausschliesslich für das von der Thrombose betroffene Bein indiziert. Eine Kompression zur Sekundärprophylaxe nach einer LE ohne Nachweis einer TVT ist nicht sinnvoll.
– Nach 3–6 Monaten richtet sich die Entscheidung zu einer Fortführung der Kompression nach dem klinischen Befund und Ergebnis sonografischer Kontrollen (Zustand der Rekanalisation, Ausmass des postthrombotischen Klappenschadens) sowie der Patientenpräferenz.
3.1. Initialtherapie
Orale Antikoagulation (DOAK, VKA)
Die Therapie der VTE erfolgt in der Regel durch orale Antikoagulation, wobei DOAKs bei gleicher Effizienz und höherer Sicherheit (gegenüber VKA 40 % weniger schwere Blutungen) (39, 40) sowie einfacherer Anwendbarkeit im Regime gegenüber VKA mit einer IA-Empfehlung bevorzugt werden (1–4, 41), sofern keine Kontraindikationen (z. B. schwere Niereninsuffizienz, APS, Schwangerschaft) vorliegen.
Beim Antiphospholipid-Syndrom (APS) sind DOAKs bei der Hochrisikovariante (dreifach positiv für Lupus-Antikoagulans, Anti-Cardiolipin- und Anti-β-2-Glykoprotein-I-AK) wegen erhöhten Risikos für arterielle Thrombosen (Myokardinfarkte, Schlaganfälle) kontraindiziert. Bei Nichttripelpositiven wäre der Einsatz von DOAKs möglich, jedoch nur bei venöser, nicht bei stattgehabter arterieller Thrombose. Beim APS werden daher vorzugsweise NMH und VKA zur Antikoagulation empfohlen, nach arterieller Thrombose ggf. zusätzlich ASS.
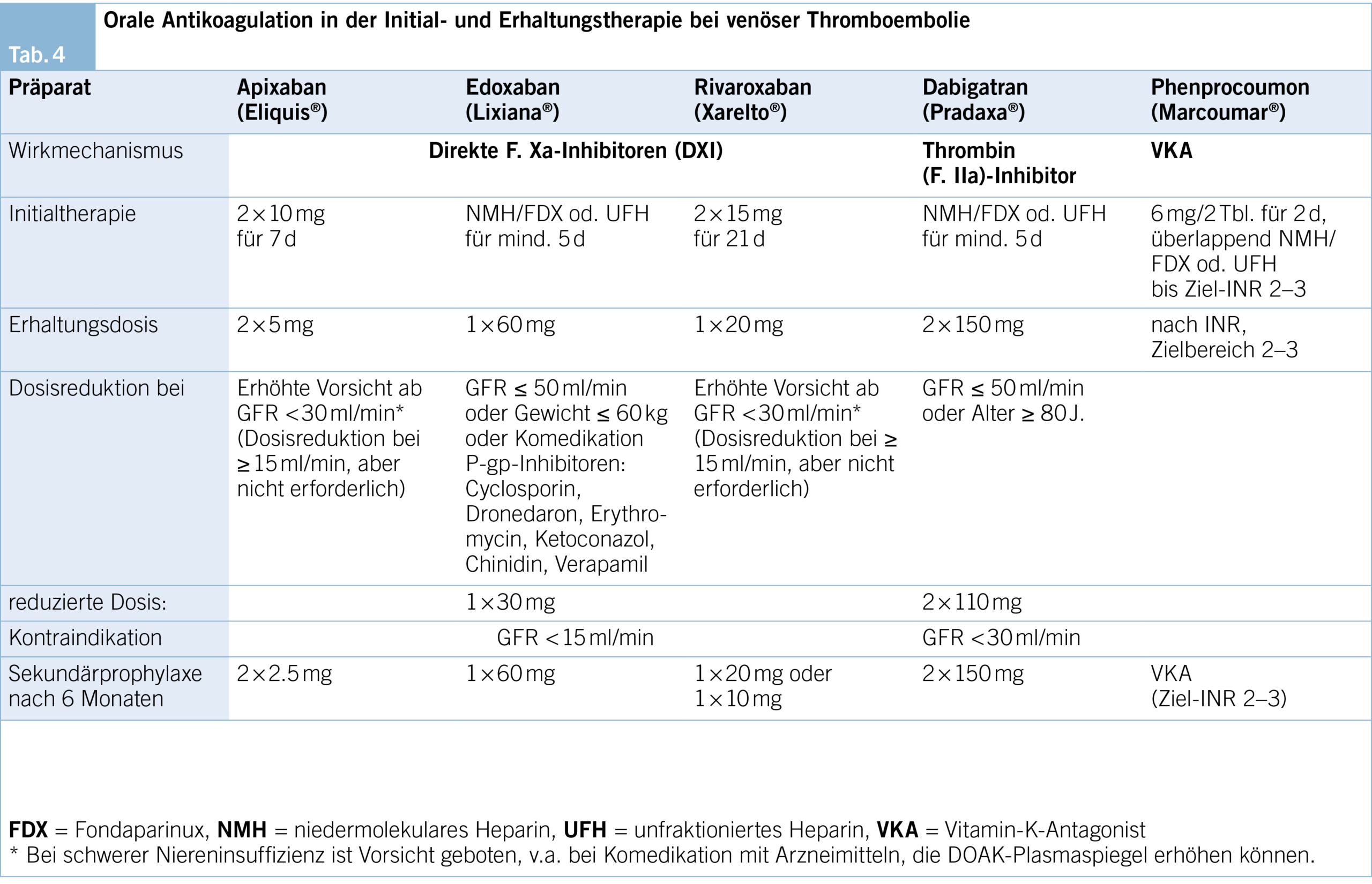
In der Initialphase gibt es folgende Besonderheiten der einzelnen Substanzen zu beachten (Tab. 4):
– Apixaban und Rivaroxaban können direkt oral gestartet werden, jedoch in höherer Dosierung als in der folgenden Phase der Erhaltungstherapie (Apixaban 2 × 10 mg/d für 7 d, Rivaroxaban 2 × 15 mg/d für 21 d).
– Sind Dabigatran, Edoxaban oder VKA für die Erhaltungsphase vorgesehen, ist vorausgehend eine Initial- therapie mit einem parenteralen Antikoagulans (Heparin oder Fondaparinux) in therapeutischer Dosierung erforderlich:
– Nach ≥ 5 d wird dann auf Edoxaban oder Dabigatran umgestellt.
– Bei VKA erfolgt die parenterale Antikoagulation überlappend und wird beendet, sobald der INR-Wert über mind. 48 h im Zielbereich von 2–3 liegt.
Parenterale Antikoagulation (Heparin, Heparinanaloga)
Erfolgt eine parenterale Antikoagulation, wird niedermolekulares Heparin (NMH) und Fondaparinux (alternativ bei Unverträglichkeit von NMH) aufgrund besserer Wirksamkeit, höherer Sicherheit und besserer Praktikabilität gegenüber unfraktioniertem Heparin (UFH) bevorzugt (42, 43).
– NMH: z. B. Dalteparin (Fragmin®) 1 × 200 IE/kg, Nadroparin (Fraxiforte®) 1 × 171 IE/kg, Enoxaparin (Clexane®) 2 × 1 mg/kg tgl. s.c.
– Fondaparinux (z. B. Arixtra®) 1 × 7.5 mg (5 mg bei < 50 kg; 10 mg bei > 100 kg) s.c.
– Bei Niereninsuffizienz gilt zu beachten:
– Bei einer GFR bis ≥ 30 ml/min bedarf es keiner Dosisanpassung.
– Bei GFR < 30 ml/min:
. Nadroparin und Fondaparinux sind bei < 30 ml/min kontraindiziert
. bei Enoxaparin Dosishalbierung von 2 × auf 1 × tgl. 1 mg/kg (44)
. übrige NMH dosisadjustiert nach Anti-Xa-Plasmaspiegel (gemessen 4–6 h nach letzter Injektion)
– UFH wird heute fast ausschliesslich bei Patienten mit schwerer Niereninsuffizienz (GFR < 30 ml/min) angewandt, wenn NMH, Fondaparinux oder orale Antikoagulantien kontraindiziert sind. UFH wird zudem eingesetzt, wenn bei Interventionen oder in der Schwangerschaft peripartal aufgrund eines erhöhten Blutungsrisikos ein Antikoagulans mit kurzer Halbwertszeit sicherer ist.
3.2. Erhaltungstherapie
Die Erhaltungstherapie schliesst sich als Bestandteil der Therapiephase an die Initialtherapie an und deckt den Zeitraum einer Thrombose ab, in der das Rezidivrisiko noch deutlich erhöht ist.
Für die proximale TVT hat sich in allen relevanten Leitlinien eine Antikoagulation von mind. 3 Monaten etabliert (1–3, 6). Ausgedehnte TVTs werden länger behandelt, insbesondere wenn nach 3 Monaten noch eine hohe Thrombuslast nachweisbar ist und damit einhergehend ein erhöhtes Risiko eines VTE-Rezidivs bzw. der Entwicklung eines PTS. Nach 3–6 Monaten gilt eine akute Thrombose als austherapiert.
Isoliert distale tiefe Bein- und Muskelvenenthrombose (idTVT, iMVT) ist beschränkt lokalisiert auf die tiefen Unterschenkelvenen und/oder Muskelvenen der Gastrocnemius- bzw. Soleusmuskulatur. Wegen des prognostisch günstigeren Verlaufs (< 1.5 % symptomatische Lungenembolien, wenig Rezidive, selten Entwicklung eines PTS) ist man in der Antikoagulation zurückhaltender.
– Für die idTVT ist eine Antikoagulation über 3 Monate ausreichend. Eine Cochrane-Metaanalyse (45) zeigte, dass damit das VTE-Rezidivrisiko um > 60 % gesenkt wird, kürzere Therapieprotokolle über 6 Wochen sind weniger effizient (13.5 % vs. 5.7 % Rezidivrate; RR 0.42).
– Für iMVT liegen die Komplikationsraten noch tiefer als für idTVT. Nach Leitlinien kann daher kürzer über 1–4 Wochen therapeutisch antikoaguliert oder aufgrund der schwachen und widersprüchlichen Datenlage auch auf eine Antikoagulation verzichtet werden (1). In diesem Fall soll die Thrombuslast sorgfältig dokumentiert und per Ultraschall nach 7 Tagen kontrolliert werden, um eine Progression zu detektieren (8–25 % Übertritt in die tiefen Leitvenen, Risiko bei Gastrocnemius- grösser als bei Soleus-iMVT).
3.3. Evaluation pro/kontra prolongierte Antikoagulation
Am Ende der Erhaltungstherapie stellt sich die Frage, ob die Antikoagulation beendet oder bei erhöhtem Rezidivrisiko – unter Abwägung zum Blutungsrisiko und unter Einbezug der Patientenpräferenz – prolongiert fortgeführt werden soll (i.e. Sekundärprophylaxe). Für die Gesamtbeurteilung sind zu berücksichtigen:
– Patienteneigene Risikofaktoren (Alter, Geschlecht, Thrombophilie)
– Charakteristika der vorausgegangenen VTE (Auslöser, Ausdehnung, klinischer Verlauf, Langzeitfolgen), insbesondere Residualzustand der TVT (sonografische Kontrolle nach Antikoagulation)
– Begleiterkrankungen (z. B. Malignom, Infektion, Autoimmunerkrankung)
– Komedikationen (z. B. Hormontherapie)
– Zusätzliche risikoerhöhende Begleitumstände (z. B. Adipositas, Varikosis, häufiges Reisen)
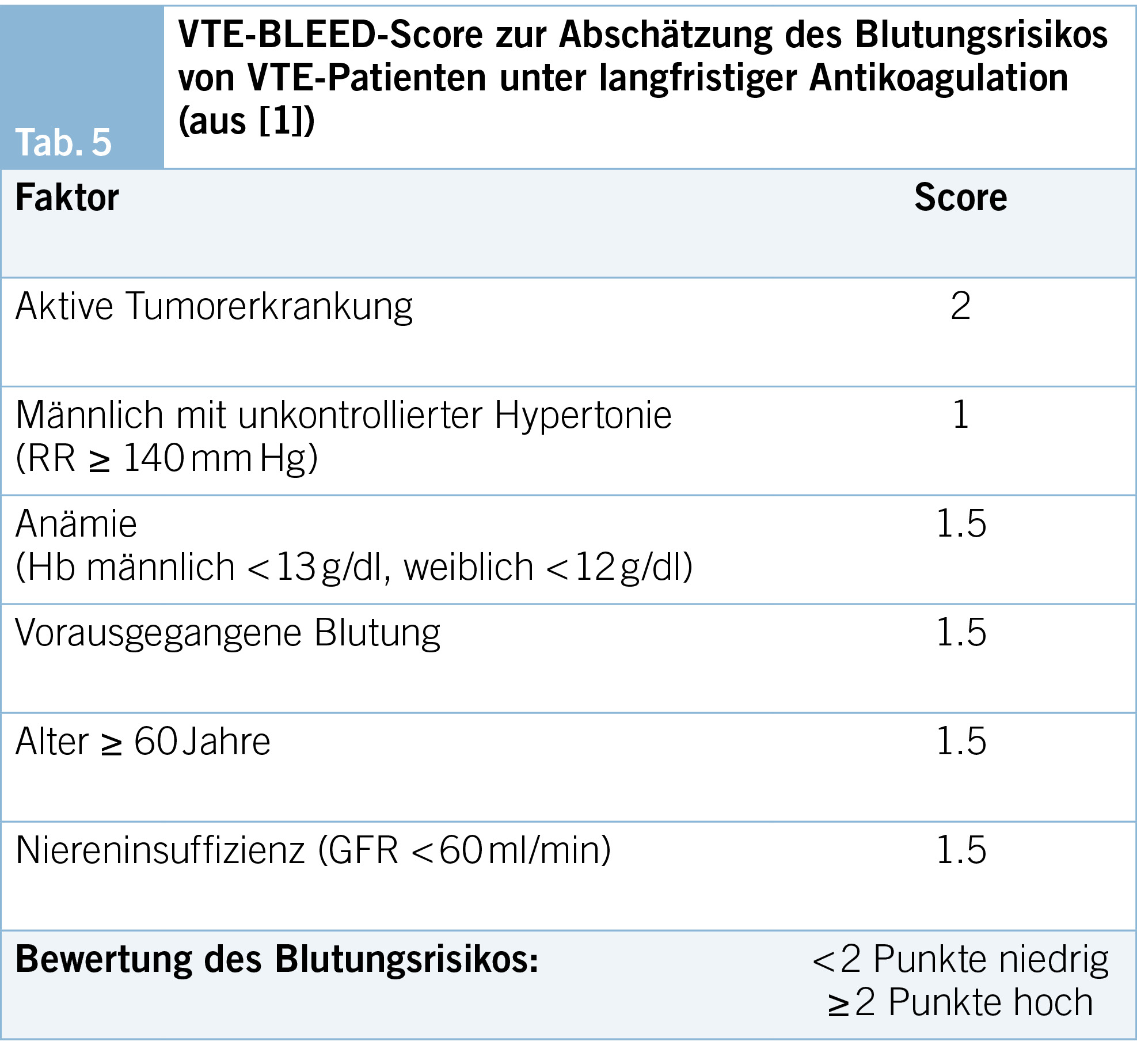
– Blutungsrisiko (VTE-BLEED-Score, Tab. 5)
Diese Entscheidung ist für Patienten mit proximaler TVT und/oder LE essenziell. Bei isoliert distaler TVT ist unter Berücksichtigung der niedrigen Komplikations- und Rezidivrate eine Antikoagulation über 3 Monate ausreichend, auch bei idiopathischem Trigger bzw. Rezidiv-idTVT. Lediglich bei persistierendem Risikofaktor (z. B. aktive Tumorerkrankung) sollte ebenfalls eine verlängerte Antikoagulation geprüft werden.
3.3.1. Sonografische Kontrolle
Nach 3–6 Monaten bzw. immer vor Absetzen der Antikoagulation ist eine sonografische Kontrolle erforderlich mit genauer Dokumentation der betroffenen Venenabschnitte und dem Ausmass eventueller Residualthromben. Die Statuserhebung dient als:
– Risikoindikator für Rezidivthrombosen
– Abschlussbefund und Referenz bei späterem V.a. einer ipsilateralen Rezidivthrombose
Eine Metaanalyse (46) zeigt, dass ohne Residualthrombus 3 Monate nach dem Indexereignis ein sehr niedriges Rezidivrisiko vorliegt, vice versa ein erhöhtes, wenn ein Restthrombus mit > 40 % Verlegung (47) des Venenlumens besteht.
3.3.2. Bedeutung einer D-Dimer-Bestimmung vor Beendigung der Antikoagulation
Die Dynamik der D-Dimere kann Hinweise auf das Rezidivrisiko geben. Hierfür wird bei normwertigen D-Dimeren die Antikoagulation pausiert und 4 bzw. 12 Wochen später die D-Dimere nochmals bestimmt (48, 49). Patienten, die bereits unter laufender Therapie erhöhte D-Dimere aufweisen sowie nach Beendigung der Antikoagulation einen Anstieg, weisen in Metaanalysen ein erhöhtes Rezidivrisiko auf (50, 51). Etwa 40–50 % aller Patienten haben nach einer ersten spontanen proximalen TVT oder LE erhöhte D-Dimere, was mit einem hohen Rezidivrisiko von 8.9 % im Vergleich zu 3.5 %/a bei normwertigen D-Dimeren assoziiert ist (48).
Zu bedenken ist allerdings der logistische Aufwand bei diesem Vorgehen und die geringe Spezifität der D-Dimere. Insofern kann das D-Dimer einen additiven Nutzen in der Entscheidungsfindung haben, insbesondere zur Einschätzung des VTE-Risikos bei spontanem Indexereignis. Es ist aber kein geeigneter Parameter, die Entscheidung zur VTE-Sekundärprophylaxe einzig an diesem Biomarker auszurichten.
3.3.3. Einschätzung des Rezidivrisikos
Das vom Aktionsbündnis Thrombose entworfene Ampelsystem (www.risiko-thrombose.de), das in modifizierter Form auch in aktuelle Leitlinien übernommen wurde (1, 41), gibt Orientierung zur Einschätzung des Rezidivrisikos bei proximaler TVT und/oder LE und zur Sekundärprophylaxe (Abb. 5).
Bei einer VTE, die durch einen transienten, starken Auslöser getriggert war, besteht ein niedriges Rezidivrisiko (< 3 %/a). Hier kann die Therapie mit Ablauf der Erhaltungsphase beendet werden, wenn der Risikofaktor nicht mehr vorliegt.
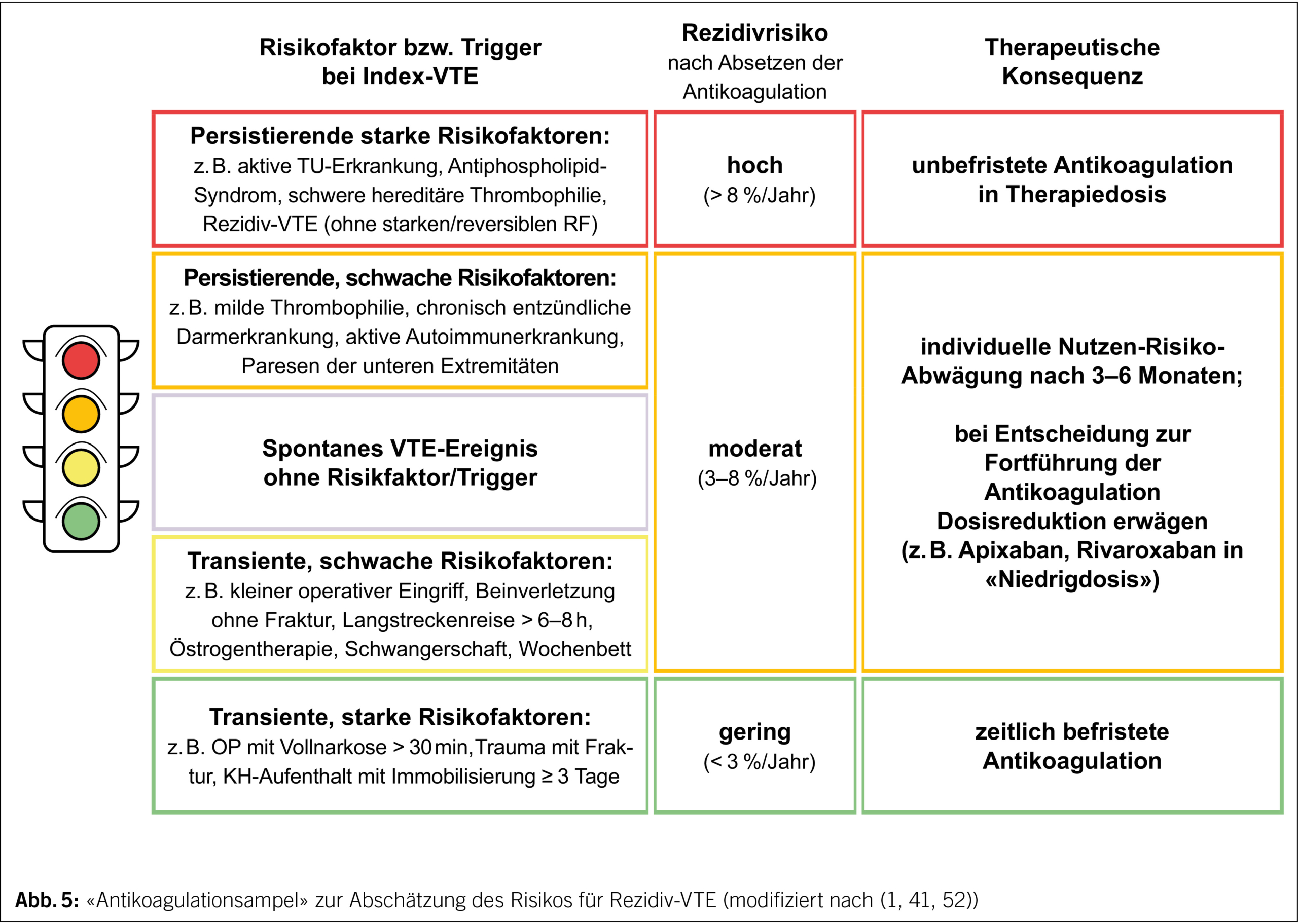
Bei hohem Rezidivrisiko (> 8 %/a) aufgrund persistierend starker Risikofaktoren oder St.n. VTE-Ereignissen (ohne starken, reversiblen RF) in der Vorgeschichte wird eine zeitlich unbefristete Antikoagulation empfohlen. Schwieriger ist die Beurteilung in der Situation, wenn kein oder nur ein schwacher, die VTE nur fraglich erklärender Risikofaktor vorliegt. Hier besteht ein moderates Rezidivrisiko (3–8 %/a), eine fortgesetzte Antikoagulation wird als sinnvoll erachtet, allerdings ist der klinische Nutzen geringer, und daher muss die Abwägung zum individuellen Blutungsrisiko kritischer erfolgen:
– Eine Fortsetzung der Antikoagulation sollte bei persistierend schwachem Risikofaktor erwogen werden, wenn das Blutungsrisiko gering ist.
– Ist das Blutungsrisiko erhöht oder lag ein spontanes VTE-Ereignis vor, werden weitere Risikoindikatoren einbezogen (RR= Relatives Risiko für VTE-Rezidiv):
– D-Dimer-Erhöhung bei Beendigung der Antikoagulation: RR 2.1–2.6 (51, 53)
– Hohe Restthrombuslast (> 40 % Verlegung des Venenlumens): RR 1.3–1.5 (16, 47)
– Männliches Geschlecht: RR 1.6–1.8, Männer haben gegenüber Frauen ein ca. 60 % höheres Rezidivrisiko von 7.5 %/a im Vergleich zu Frauen (ohne Östrogeneinfluss) von 3.8 %/a (54)
– Milde Thrombophilie: heterozygote F.V-Leiden- oder Prothrombin-G20210A-Mutation, RR 1.4–1.7 (55)
– Positive Familienanamnese ohne Nachweis einer konkreten Thrombophilie: RR 2.3, wenn ein Verwandter 1.° in jungen Jahren eine VTE hatte (56)
Es gibt prospektive Managementstudien für eine D-Dimer-Erhöhung bei Therapieende (57) und hohe Restthrombuslast (58), die bei verlängerter Antikoagulation eine signifikant niedrigere VTE-Rezidivrate zeigen. Für die weiteren o.g. Faktoren ist der Nutzen einer verlängerten Sekundärprophylaxe bislang nicht belegt.
3.3.4. Blutungsrisiko
Wichtige Prädiktoren für das Auftreten von Blutungen sind: Anämie, Alter, St.n. Blutung und Niereninsuffizienz. Der VTE-BLEED-Score (59, 60) ist für Patienten mit VTE und Indikation zur langfristigen Antikoagulation in Therapiedosis am besten validiert, um das Blutungsrisiko prospektiv abzuschätzen (Tab. 5). Ein hoher Score darf aber nicht dazu führen, Patienten mit klarer Indikation eine Antikoagulation vorzuenthalten, sondern modifizierbare Risiken zu optimieren (z. B. Hypertonie-einstellung, Überprüfen fortbestehender Notwendigkeit von Thrombozytenaggregationshemmern oder NSAR bei Komorbidität) und eine Antikoagulation mit möglichst niedrigem Blutungsrisiko zu wählen.
3.4. Sekundärprophylaxe
Bei hohem Rezidivrisiko wird eine zeitlich unbefristete Antikoagulation in volltherapeutischer Dosis empfohlen.
Bei moderatem Rezidivrisiko sollen zur prolongierten Sekundärprophylaxe bevorzugt Substanzen mit Zulassung in «Niedrigdosis» für diese Indikation eingesetzt werden:
– Gemäss Zulassungsstudien können Apixaban auf 2 × 2.5 mg bzw. Rivaroxaban auf 1 × 10 mg nach Abschluss einer 6-monatigen VTE-Behandlung reduziert werden, mit nachweislich im Vergleich ihrer Niedrig- zur Therapiedosis gleich effizienten Rezidivprophylaxe und niedrigerem Blutungsrisiko (61, 62).
– Für Edoxaban und Dabigatran liegen bislang keine Daten vor, die eine effiziente Sekundärprophylaxe in Niedrigdosis belegen.
– NMH können in intermediärer Dosierung fortgeführt werden (i.e. 50–75 % der volltherapeutischen Dosierung oder 2 × Prophylaxedosis).
– Bei VKA zeigten Studien mit einer Dosisreduktion auf einen INR von 1.5–2 eine deutliche Zunahme an VTE-Rezidiven, ohne das Blutungsrisiko erkennbar zu reduzieren (63, 64). Daher bleibt bei Einsatz von VKA zur Rezidivprophylaxe nur die Fortführung in der Therapiedosis mit einem Ziel-INR von 2–3.
Verlaufskontrollen unter Sekundärprophylaxe sollten in regelmässigen Abständen erfolgen mit routinemässigem Labor (Blutbild, Leber-/Nierenwerte unter DOAK bzw. Gerinnung unter VKA) sowie mind. alle 1–2 Jahre eine Neubewertung des Nutzens vs. Risiko.
Nach abgeschlossener Antikoagulation erfolgt bei thrombogener Risikosituation (wie Immobilisation, Langstreckenreisen > 4 h) bei Patienten mit stattgehabter VTE in der Regel eine Sekundärprophylaxe mit NMH in hochprophylaktischer Dosierung (z. B. 5000 IE Fragmin s. c.).
In dem Bewusstsein, dass der Einsatz von NMH zur Prophylaxe im nicht chirurgischen Setting nur die Zulassung für Patienten mit eingeschränkter Mobilität hat, können zur Reiseprophylaxe mit vergleichbarer «Datenlage» auch DOAK eingesetzt werden, z. B. Rivaroxaban 10 mg. Der Patient ist über den Off-label-use aufzuklären, die Kosten werden nicht von der Krankenkasse übernommen.
Institut für Hausarztmedizin Universitätsspital Zürich (IHAMZ)
Pestalozzistrasse 24
8091 Zürich
andrea.rosemann@usz.ch
Institut für Hausarztmedizin
Universitätsspital Zürich
Pestalozzistrasse 24
8091 Zürich
thomas.rosemann@usz.ch
Institut für Hausarztmedizin
Universität und UniversitätsSpital Zürich
Pestalozzistrasse 24
8091 Zürich
oliver.senn@usz.ch
Die Autorinnen und Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Linnemann B, Blank W, Doenst T, al e. Diagnostik und Therapie der Venenthrombose und Lungenembolie – AWMF-S2k-Leitlinie. 2023;https:/register.awmf.org/de/leitlinien/detail/065-002.
2. Stevens SM, Woller SC, Kreuziger LB, Bounameaux H, Doerschug K, Geersing GJ, et al. Antithrombotic Therapy for VTE Disease: Second Update of the CHEST Guideline and Expert Panel Report. Chest. 2021;160(6):e545-e608.
3. Kakkos SK, Gohel M, Baekgaard N, Bauersachs R, Bellmunt-Montoya S, Black SA, et al. Editor‘s Choice – European Society for Vascular Surgery (ESVS) 2021 Clinical Practice Guidelines on the Management of Venous Thrombosis. Eur J Vasc Endovasc Surg. 2021;61(1):9-82.
4. Mazzolai L, Ageno W, Alatri A, Bauersachs R, Becattini C, Brodmann M, et al. Second consensus document on diagnosis and management of acute deep vein thrombosis: updated document elaborated by the ESC Working Group on aorta and peripheral vascular diseases and the ESC Working Group on pulmonary circulation and right ventricular function. Eur J Prev Cardiol. 2022;29(8):1248-63.
5. Lim W, Le Gal G, Bates SM, Righini M, Haramati LB, Lang E, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: diagnosis of venous thromboembolism. Blood Adv. 2018;2(22):3226-56.
6. Ortel TL, Neumann I, Ageno W, Beyth R, Clark NP, Cuker A, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv. 2020;4(19):4693-738.
7. White RH. Identifying risk factors for venous thromboembolism. Circulation. 2012;125(17):2051-3.
8. Encke A, Haas S, Kopp I, Abholz H-H, Bode C, Bootz F, et al. S3-Leitlinie: Prophylaxe der venösen Thromboembolie (VTE). Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. (AWMF); 2015. Report No.: AWMF Leitlinien-Register Nr. 003/001.
9. Goodacre S, Sutton AJ, Sampson FC. Meta-analysis: The value of clinical assessment in the diagnosis of deep venous thrombosis. Ann Intern Med. 2005;143(2):129-39.
10. Wells PS, Owen C, Doucette S, Fergusson D, Tran H. Does this patient have deep vein thrombosis? JAMA. 2006;295(2):199-207.
11. Wells PS, Anderson DR, Rodger M, Forgie M, Kearon C, Dreyer J, et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis. N Engl J Med. 2003;349(13):1227-35.
12. Bhatt M, Braun C, Patel P, Patel P, Begum H, Wiercioch W, et al. Diagnosis of deep vein thrombosis of the lower extremity: a systematic review and meta-analysis of test accuracy. Blood Adv. 2020;4(7):1250-64.
13. Büller HR, Ten Cate-Hoek AJ, Hoes AW, Joore MA, Moons KG, Oudega R, et al. Safely ruling out deep venous thrombosis in primary care. Ann Intern Med. 2009;150(4):229-35.
14. El Tabei L, Holtz G, Schürer-Maly C, Abholz HH. Accuracy in diagnosing deep and pelvic vein thrombosis in primary care: an analysis of 395 cases seen by 58 primary care physicians. Dtsch Arztebl Int. 2012;109(45):761-6.
15. Parry BA, Chang AM, Schellong SM, House SL, Fermann GJ, Deadmon EK, et al. International, multicenter evaluation of a new D-dimer assay for the exclusion of venous thromboembolism using standard and age-adjusted cut-offs. Thromb Res. 2018;166:63-70.
16. Johnson SA, Stevens SM, Woller SC, Lake E, Donadini M, Cheng J, et al. Risk of deep vein thrombosis following a single negative whole-leg compression ultrasound: a systematic review and meta-analysis. JAMA. 2010;303(5):438-45.
17. van Dam LF, Dronkers CEA, Gautam G, Eckerbom A, Ghanima W, Gleditsch J, et al. Magnetic resonance imaging for diagnosis of recurrent ipsilateral deep vein thrombosis. Blood. 2020;135(16):1377-85.
18. Lindhoff-Last E, Luxembourg B. Evidence-based indications for thrombophilia screening. Vasa. 2008;37(1):19-30.
19. Mannucci PM, Franchini M. Classic thrombophilic gene variants. Thromb Haemost. 2015;114(5):885-9.
20. Weingarz L, Schwonberg J, Schindewolf M, Hecking C, Wolf Z, Erbe M, et al. Prevalence of thrombophilia according to age at the first manifestation of venous thromboembolism: results from the MAISTHRO registry. Br J Haematol. 2013;163(5):655-65.
21. Kearon C, Parpia S, Spencer FA, Baglin T, Stevens SM, Bauer KA, et al. Antiphospholipid antibodies and recurrent thrombosis after a first unprovoked venous thromboembolism. Blood. 2018;131(19):2151-60.
22. Pengo V, Ruffatti A, Legnani C, Testa S, Fierro T, Marongiu F, et al. Incidence of a first thromboembolic event in asymptomatic carriers of high-risk antiphospholipid antibody profile: a multicenter prospective study. Blood. 2011;118(17):4714-8.
23. Pengo V, Denas G, Zoppellaro G, Jose SP, Hoxha A, Ruffatti A, et al. Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome. Blood. 2018;132(13):1365-71.
24. Woller SC, Stevens SM, Kaplan D, Wang TF, Branch DW, Groat D, et al. Apixaban compared with warfarin to prevent thrombosis in thrombotic antiphospholipid syndrome: a randomized trial. Blood Adv. 2022;6(6):1661-70.
25. Linnemann B, Hart C. Laboratory Diagnostics in Thrombophilia. Hamostaseologie. 2019;39(1):49-61.
26. Siriez R, Dogne JM, Gosselin R, Laloy J, Mullier F, Douxfils J. Comprehensive review of the impact of direct oral anticoagulants on thrombophilia diagnostic tests: Practical recommendations for the laboratory. Int J Lab Hematol. 2021;43(1):7-20.
27. Timp JF, Braekkan SK, Versteeg HH, Cannegieter SC. Epidemiology of cancer-associated venous thrombosis. Blood. 2013;122(10):1712-23.
28. van Es N, Ay C, Jara-Palomares L. Screening for Occult Cancer in Patients with Venous Thromboembolism: Past, Present, and Future. Hamostaseologie. 2020;40(3):270-9.
29. Carrier M, Lazo-Langner A, Shivakumar S, Tagalakis V, Zarychanski R, Solymoss S, et al. Screening for Occult Cancer in Unprovoked Venous Thromboembolism. N Engl J Med. 2015;373(8):697-704.
30. Robin P, Otten HM, Delluc A, van Es N, Carrier M, Salaun PY, Le Gal G. Effect of occult cancer screening on mortality in patients with unprovoked venous thromboembolism. Thromb Res. 2018;171:92-6.
31. Delluc A, Antic D, Lecumberri R, Ay C, Meyer G, Carrier M. Occult cancer screening in patients with venous thromboembolism: guidance from the SSC of the ISTH. J Thromb Haemost. 2017;15(10):2076-9.
32. Force USPST, Nicholson WK, Silverstein M, Wong JB, Barry MJ, Chelmow D, et al. Screening for Breast Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2024.
33. Force USPST, Davidson KW, Barry MJ, Mangione CM, Cabana M, Caughey AB, et al. Screening for Colorectal Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2021;325(19):1965-77.
34. Broderick C, Watson L, Armon MP. Thrombolytic strategies versus standard anticoagulation for acute deep vein thrombosis of the lower limb. Cochrane Database Syst Rev. 2021;1(1):CD002783.
35. Amin EE, Bistervels IM, Meijer K, Tick LW, Middeldorp S, Mostard G, et al. Reduced incidence of vein occlusion and postthrombotic syndrome after immediate compression for deep vein thrombosis. Blood. 2018;132(21):2298-304.
36. Arpaia G, Cimminiello C, Mastrogiacomo O, de Gaudenzi E. Efficacy of elastic compression stockings used early or after resolution of the edema on recanalization after deep venous thrombosis: the COM.PRE Trial. Blood Coagul Fibrinolysis. 2007;18(2):131-7.
37. Brandjes DP, Buller HR, Heijboer H, Huisman MV, de Rijk M, Jagt H, ten Cate JW. Randomised trial of effect of compression stockings in patients with symptomatic proximal-vein thrombosis. Lancet. 1997;349(9054):759-62.
38. Prandoni P, Lensing AW, Prins MH, Frulla M, Marchiori A, Bernardi E, et al. Below-knee elastic compression stockings to prevent the post-thrombotic syndrome: a randomized, controlled trial. Ann Intern Med. 2004;141(4):249-56.
39. van der Hulle T, Kooiman J, den Exter PL, Dekkers OM, Klok FA, Huisman MV. Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the treatment of acute symptomatic venous thromboembolism: a systematic review and meta-analysis. J Thromb Haemost. 2014;12(3):320-8.
40. van Es N, Coppens M, Schulman S, Middeldorp S, Buller HR. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood. 2014;124(12):1968-75.
41. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Respir J. 2019;54(3).
42. Erkens PM, Prins MH. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism. Cochrane Database Syst Rev. 2010(9):CD001100.
43. Garcia DA, Baglin TP, Weitz JI, Samama MM. Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e24S-e43S.
44. arznei-telegramm. Fraktionierte Heparine zur Akuttherapie venöser Thromboembolien. a-t. 2009;01(40):1-4.
45. Kirkilesis G, Kakkos S, Bicknell C, Salim S, Kakavia K. Treatment of distal deep vein thrombosis. Cochrane Database Syst Rev. 2020;4:CD013422.
46. Donadini M, Ageno W, Antonucci E, Cosmi B, Kovacs M, Le Gal G. Prognostic significance of residual venous obstruction in patients with treated unprovoked deep vein thrombosis: a patient-level meta-analysis. Thromb Haemost. 2014;111(1):172–9.
47. Prandoni P, Lensing AW, Prins MH, Bernardi E, Marchiori A, Bagatella P, et al. Residual venous thrombosis as a predictive factor of recurrent venous thromboembolism. Ann Intern Med. 2002;137(12):955-60.
48. Palareti G, Legnani C, Cosmi B, Valdre L, Lunghi B, Bernardi F, Coccheri S. Predictive value of D-dimer test for recurrent venous thromboembolism after anticoagulation withdrawal in subjects with a previous idiopathic event and in carriers of congenital thrombophilia. Circulation. 2003;108(3):313-8.
49. Cosmi B, Legnani C, Tosetto A, Pengo V, Ghirarduzzi A, Testa S, et al. Usefulness of repeated D-dimer testing after stopping anticoagulation for a first episode of unprovoked venous thromboembolism: the PROLONG II prospective study. Blood. 2010;115(3):481-8.
50. Verhovsek M, Douketis JD, Yi Q, Shrivastava S, Tait RC, Baglin T, et al. Systematic review: D-dimer to predict recurrent disease after stopping anticoagulant therapy for unprovoked venous thromboembolism. Ann Intern Med. 2008;149(7):481-90, W94.
51. Douketis J, Tosetto A, Marcucci M, Baglin T, Cushman M, Eichinger S, et al. Patient-level meta-analysis: effect of measurement timing, threshold, and patient age on ability of D-dimer testing to assess recurrence risk after unprovoked venous thromboembolism. Ann Intern Med. 2010;153(8):523-31.
52. Kearon C, Ageno W, Cannegieter SC, Cosmi B, Geersing GJ, Kyrle PA, et al. Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH. J Thromb Haemost. 2016;14(7):1480-3.
53. Kearon C, Parpia S, Spencer FA, Schulman S, Stevens SM, Shah V, et al. Long-term risk of recurrence in patients with a first unprovoked venous thromboembolism managed according to d-dimer results; A cohort study. J Thromb Haemost. 2019;17(7):1144-52.
54. Douketis J, Tosetto A, Marcucci M, Baglin T, Cosmi B, Cushman M, et al. Risk of recurrence after venous thromboembolism in men and women: patient level meta-analysis. BMJ. 2011;342:d813.
55. Segal JB, Brotman DJ, Necochea AJ, Emadi A, Samal L, Wilson LM, et al. Predictive value of factor V Leiden and prothrombin G20210A in adults with venous thromboembolism and in family members of those with a mutation: a systematic review. JAMA. 2009;301(23):2472-85.
56. Weingarz L, Schindewolf M, Schwonberg J, Hecking C, Wolf Z, Erbe M, et al. Thrombophilia and risk of VTE recurrence according to the age at the time of first VTE manifestation. Vasa. 2015;44(4):313-23.
57. Palareti G, Cosmi B, Legnani C, Tosetto A, Brusi C, Iorio A, et al. D-dimer testing to determine the duration of anticoagulation therapy. N Engl J Med. 2006;355(17):1780-9.
58. Prandoni P, Prins MH, Lensing AW, Ghirarduzzi A, Ageno W, Imberti D, et al. Residual thrombosis on ultrasonography to guide the duration of anticoagulation in patients with deep venous thrombosis: a randomized trial. Ann Intern Med. 2009;150(9):577-85.
59. Klok FA, Huisman MV. How I assess and manage the risk of bleeding in patients treated for venous thromboembolism. Blood. 2020;135(10):724-34.
60. Badescu MC, Ciocoiu M, Badulescu OV, Vladeanu MC, Bojan IB, Vlad CE, Rezus C. Prediction of bleeding events using the VTE-BLEED risk score in patients with venous thromboembolism receiving anticoagulant therapy (Review). Exp Ther Med. 2021;22(5):1344.
61. Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med. 2013;368(8):699-708.
62. Weitz JI, Lensing AWA, Prins MH, Bauersachs R, Beyer-Westendorf J, Bounameaux H, et al. Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism. N Engl J Med. 2017;376(13):1211-22.
63. Ridker P, Goldhaber S, Danielson E, Rosenberg Y, Eby C, Deitcher S. Long-term, low-intensity warfarin therapy for the prevention of recurrent venous thromboembolism. N Engl J Med. 2003;348(15):1425-34.
64. Kearon C, Ginsberg J, Kovacs M, Anderson D, Wells P, Julian J. Comparison of low-intensity warfarin therapy with conventional-intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism. N Engl J Med. 2003;349(7):631–9.
PRAXIS
- Vol. 113
- Ausgabe 6-7
- Juli 2024