- Update 2023 ESC Guidelines Endocarditis
Die infektiöse Endokarditis ist eine seltene Erkrankung, die jedoch aufgrund ihrer hohen Morbidität und Mortalität für die globale Gesundheit von grosser Bedeutung ist. Die Europäische Gesellschaft für Kardiologie hat im Jahr 2023 die Leitlinien zur infektiösen Endokarditis aktualisiert. Was die Prävention betrifft, so wurde die Risikogruppe für die Entwicklung einer Endokarditis auch aufgrund des zunehmenden Einsatzes von Transkatheterverfahren zur Klappenreparatur aktualisiert und die Indikation für eine Antibiotikaprophylaxe verstärkt. Die zentrale Rolle des Endokarditis-Teams bei der Behandlung des Patienten in allen Phasen von der Erstvorstellung bis zur Entlassung wird stigmatisiert. Die Diagnose der Endokarditis wird zunehmend mit multimodaler Bildgebung gestellt. Die Indikationen und der Zeitpunkt für herzchirurgische Eingriffe wurden überarbeitet, wobei auch das Vorhandensein möglicher neurologischer Komplikationen berücksichtigt wurde. Bei stabilen Patienten nach der kritischen Anfangsphase wird nun ein ambulantes Management eingeführt. Dieses Papier fasst die wichtigsten Änderungen und Neuerungen des Dokuments zusammen, die für Spezialisten verschiedener medizinischer Disziplinen bei der Behandlung von Patienten mit Endokarditis von Nutzen sein können.
Infective endocarditis is a rare disease, but due to its high morbidity and mortality it is of great importance for global health. In 2023, the European Society of Cardiology updated the guidelines on infective endocarditis. In terms of prevention, the population at risk for endocarditis has been updated also in consideration to the increasing use of transcatheter procedures for valve repair and the indication for antibiotic prophylaxis has been strengthened. The central role of the endocarditis team in the management of the patient at all stages from the initial presentation to discharge is stigmatized. The use of multimodality imaging for the diagnosis of endocarditis is introduced with specific diagnosis pathways. The indications and timing for cardiac surgery have been revised, also taking into account the presence of possible neurological complications. Outpatient management is now introduced for stable patients after the critical initial phase. This paper summarizes the main changes and innovations of the document that may be useful for specialists from different medical disciplines in the management of patients with endocarditis.
Keywords: Endocarditis; antibiotic prophylaxis; cardiac surgery; cardiac imaging.
Einleitung
Endokarditis ist eine schwere Erkrankung, die mit einer hohen Morbidität und Mortalität verbunden ist und weltweit eine grosse Herausforderung für die Gesundheitsversorgung darstellt. Trotz zahlreicher Fortschritte in der Medizin steht die Endokarditis immer noch vor grossen Herausforderungen in Bezug auf die Prävention, die rechtzeitige Diagnose, die angemessene Behandlung und den Outcome für die Patienten. Neueren Daten aus Europa und Amerika entsprechend nimmt die Gesamtinzidenz der Endokarditis zu, und die «Global Burden of Disease» meldet 13.8 Fälle pro 100 000 Personen pro Jahr im Jahr 2019 (1).
Ein im Jahr 2019 veröffentlichtes prospektives internationales europäisches Register über Endokarditis berichtet über eine Spital-Mortalität von 17 % und eine hohe Prävalenz von Komplikationen, einschliesslich embolischer Ereignisse in 20 %, akutem Nierenversagen in fast 18 % und Herzinsuffizienz in 14 % der Betroffenen; ein grosser Teil der Patienten musste zudem einer Herzoperation unterzogen werden (51 %). In Europa sind die häufigsten Erreger Staphylokokken (44 %), Enterokokken (16 %), orale Streptokokken (12 %) und Streptococcus gallolyticus (7 %); andererseits sind bei etwa 21 % der Patienten die Blutkulturen negativ (2).
Im Jahr 2023 hat die Europäische Gesellschaft für Kardiologie neue Leitlinien für die Behandlung von Endokarditis herausgegeben, acht Jahre nach dem vorhergehenden Dokument, im Lichte mehrerer neuer Daten in Bezug auf die Risikopopulation für Endokarditis, diagnostische Kriterien und Bildgebungsmodalitäten, medikamentöse Therapie und chirurgische Behandlung (3). Das aktuelle Dokument fasst die wichtigsten Neuerungen zusammen und konzentriert sich auf praktische Informationen für die spezialisten verschiedener medizinischer Disziplinen.
Prävention
Das Rationale der Antibiotikaprophylaxe ist, dass durch die Reduzierung der Bakteriämie, die mit verschiedenen (vor allem oralen) Eingriffen verbunden ist, das Risiko einer bakteriellen Kolonisierung von Herzstrukturen minimiert wird. Tatsächlich befindet sich in der Mundhöhle eine reichhaltige kommensale Flora, und obwohl selbst alltägliche Tätigkeiten wie Zähneputzen, Kauen und die Verwendung von Zahnseide für eine Bakteriämie verantwortlich sein können, gibt es Hinweise darauf, dass eine Reihe von zahnärztlichen Eingriffen mit einem erhöhten Endokarditis-Risiko verbunden sein können. Dazu gehören: Zahnextraktionen, oralchirurgische Eingriffe (einschliesslich Parodontal-Chirurgie, Implantat-Chirurgie und orale Biopsien) und zahnärztliche Eingriffe, bei denen das Zahnfleisch oder der periapikale Bereich der Zähne manipuliert wird (einschliesslich Zahnsteinentfernung und Wurzelbehandlung) (4, 5).
Tatsächlich können Zahnärztliche Eingriffe etwa 30–40 % aller Fälle von Streptokokken-Endokarditis erklären. (4, 5) Thornhill et al. haben 2022 in einer sehr grossen Cross-over-Studie, die fast 8 Millionen Patienten in den USA umfasste, berichtet, dass der Einsatz einer Antibiotikaprophylaxe bei Hochrisikopatienten mit einer signifikanten Reduzierung der Inzidenz von infektiöser Endokarditis verbunden war (4). Die Verwendung einer Antibiotikaprophylaxe in der klinischen Praxis wurde daher unterstützt.
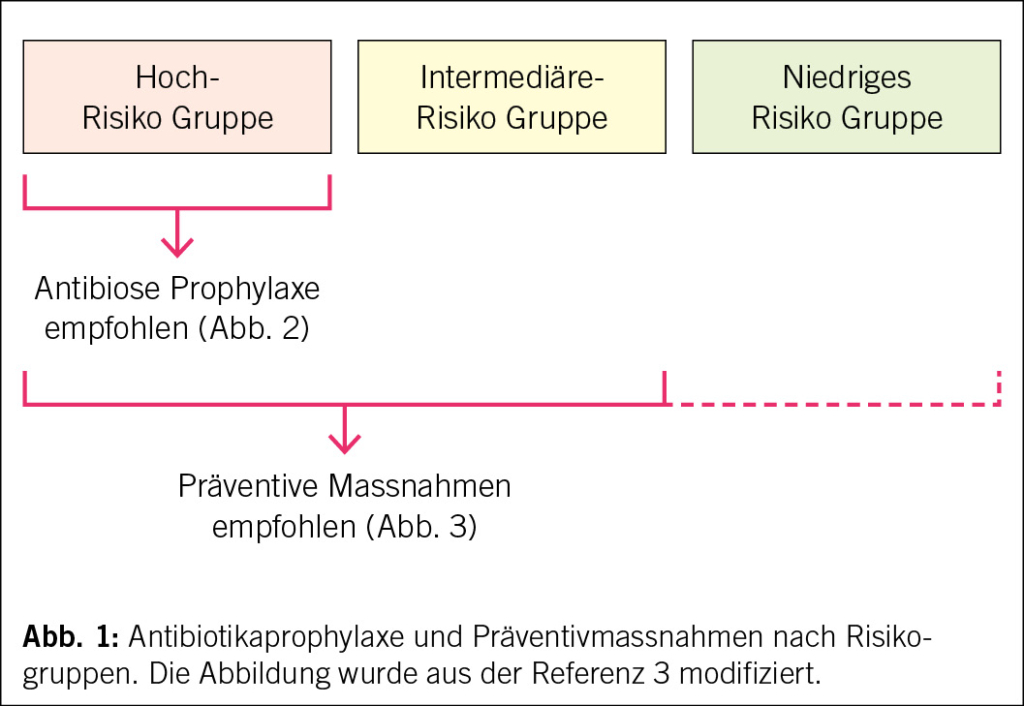
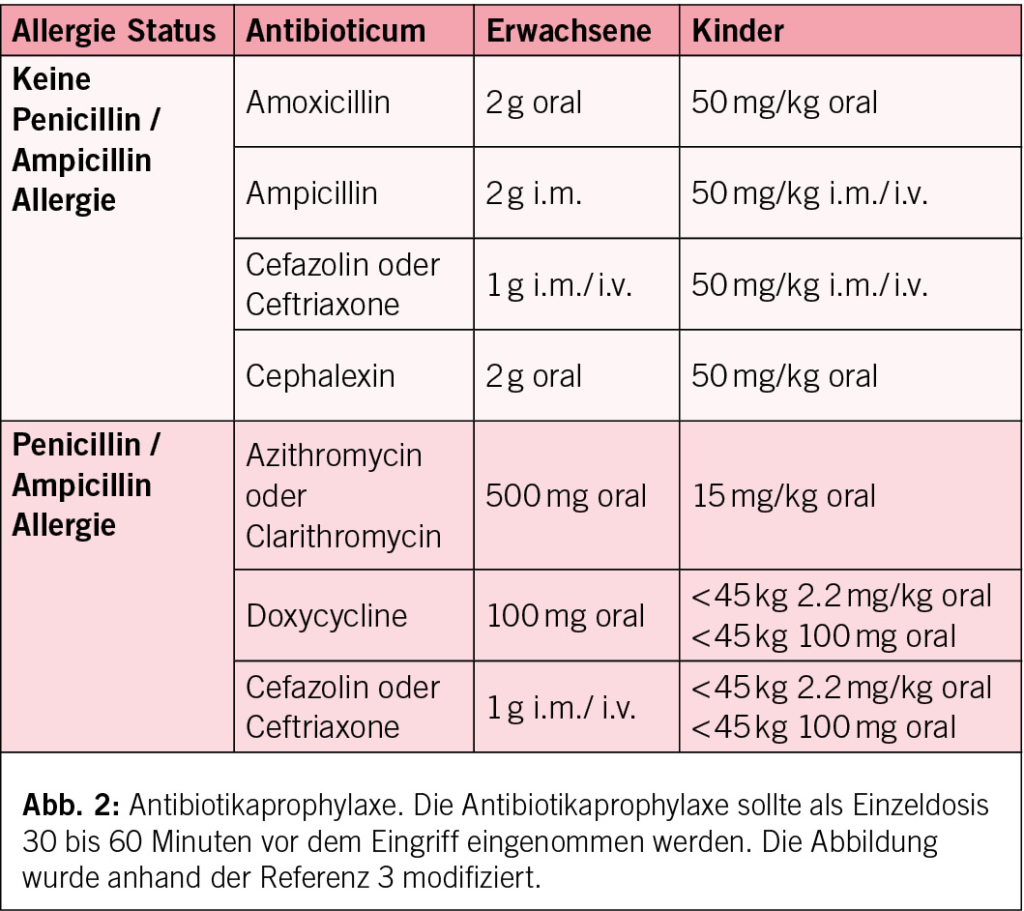
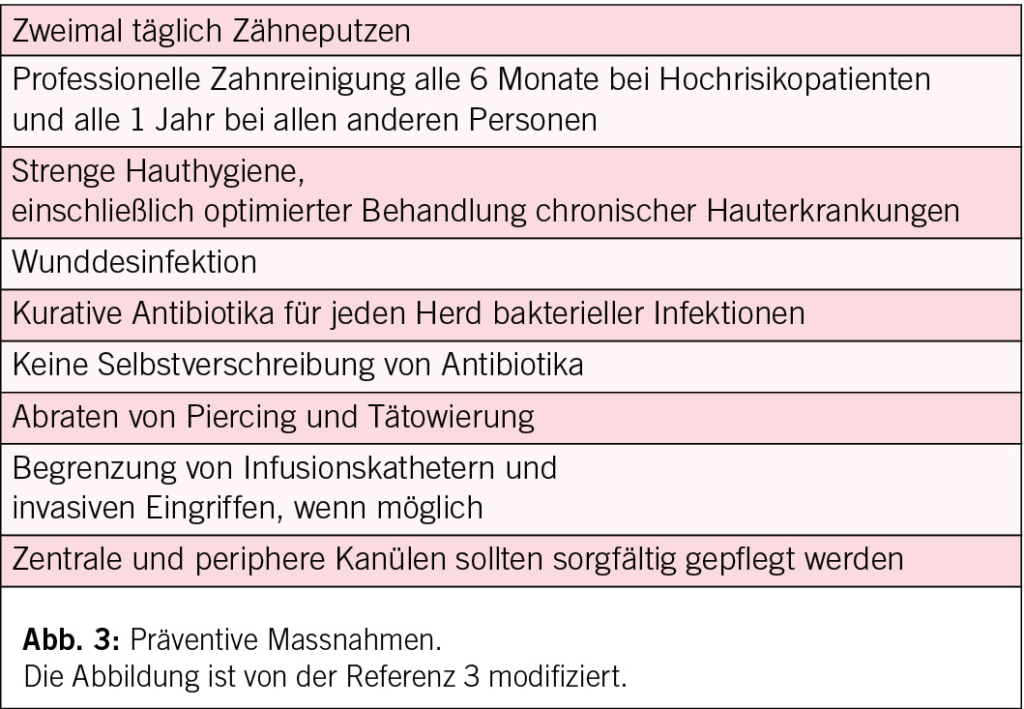
In den ESC-Leitlinien 2023 wird das Risiko der Bevölkerung für Endokarditis in Hoch-, Mittel- und Niedrigrisikogruppen eingeteilt. Die Antibiotikaprophylaxe vor zahnärztlichen Eingriffen wird nur bei Patienten mit hohem Risiko (Klasse I) empfohlen, während bei Patienten mit mittlerem Risiko (und idealerweise auch bei solchen mit niedrigem Risiko) Präventionsmassnahmen zwingend empfohlen werden (Abb. 1, 2 und 3).
Zur Hochrisikogruppe gehören die folgenden vier Kategorien von Patienten:
• Patienten mit vorheriger Endokarditis;
• Patienten, die mit chirurgisch oder per Transkatheter implantierten Herzklappenprothesen oder mit jeglichem Material für die Herzklappenreparatur behandelt wurden;
• Patienten mit unbehandeltem zyanotischem angeborenem Herzfehler und Patienten, die mit chirurgischen oder Transkatheterverfahren, mit postoperativen palliativen Shunts, Conduits oder anderen Prothesen behandelt wurden. Nach der Reparatur, bei Abwesenheit von Restdefekten oder Herzklappenprothesen wird eine Antibiotikaprophylaxe nur für die ersten 6 Monate nach dem Eingriff empfohlen.
• Patienten mit «Ventricular Assist Devices», die als Zieltherapie implantiert wurden.
Auch wenn die Evidenz begrenzt ist und hauptsächlich auf Fallberichten beruht, schlägt die Arbeitsgruppe vor, dass eine Antibiotikaprophylaxe auch bei Patienten mit Transkatheter-Edge-to-Edge-Reparatur der Mitral- oder Trikuspidalklappe in Betracht gezogen werden kann (Klasse IIa).
Zu den Patienten mit mittlerem Risiko gehören: rheumatische Herzkrankheiten, nicht-rheumatische degenerative Klappenerkrankungen, angeborene Klappenanomalien ohne hohes Risiko, implantierte kardiovaskuläre elektronische Geräte und hypertrophe Kardiomyopathie. Bei diesen Patienten wird eine Antibiotikaprophylaxe nicht routinemässig empfohlen.
Abgesehen von zahnärztlichen Eingriffen haben einige Observationsstudien gezeigt, dass auch andere Eingriffe ein erhöhtes Risiko für Endokarditis tragen können, beispielsweise kardiovaskuläre Eingriffe, Hauteingriffe und Wundbehandlung, Transfusionen, Dialyse, Knochenmarkspunktionen und endoskopische Eingriffe. (5, 6) Aus diesem Grund wurde in den Leitlinien 2023 die Klasse der Antibiotikaprophylaxe von III auf IIb (kann in Betracht gezogen werden) heraufgestuft.
Ein weiterer wichtiger Aspekt betrifft die Antibiotikaprophylaxe vor kardiologischen Eingriffen. Diese wird in der Regel vor der Implantation einer Transkatheter-Klappenprothese, der Implantation eines elektronischen Geräts und von Verschlüssen oder Transplantaten empfohlen (Klasse I). Das empfohlene Antibiotikum ist Cefazolin 1g i.v. für die Implantation von elektronischen Geräten und Amoxicillin / Clavulanic 2 g oder Ampicillin 3 g für die Implantation von Transkatheterprothesen.
Endokarditis-Team
Die Endokarditis ist eine sehr komplexe und multisystemische Erkrankung, die einen multidisziplinären Ansatz für die Diagnose, die Erkennung von Komplikationen, die Antibiotikabehandlung, die chirurgische Behandlung und die Nachsorge der Patienten erfordert. Ein solcher multidisziplinärer Ansatz verbessert nachweislich den Outcome der Patienten mit einer geringeren Spital- und erste-Jahres-Mortalität. Daher wird ein Endokarditis-Team, das sich aus mehreren Fachleuten des Gesundheitswesens zusammensetzt, bereits in der Frühphase und während der Nachsorge dringend empfohlen. (7) Es ist sehr wichtig, dass das Team erkennt, ob der Patient z. B. in einem kleinen peripheren Spital behandelt werden kann oder ob er in ein hochspezialisiertes Zentrum mit herzchirurgischen Möglichkeiten (Herzklappenzentrum) verlegt werden muss. Diese Situationen sind unter anderem: hämodynamische Instabilität, Vorliegen einer schweren Klappenfunktionsstörung, Infektion einer Klappenprothese oder eines implantierten elektronischen Geräts, Vorliegen von perivalvulären Komplikationen, Schlaganfall, Auftreten von embolischen Ereignissen, Persistenz positiver Blutkulturen trotz Therapie > 7 Tage oder Vorliegen schwer abzutötender Keime. Zu den Kernmitgliedern des Endokarditis-Teams sollten Kardiologen, Experten für kardiale Bildgebung, Herzchirurgen, Spezialisten für Infektionskrankheiten und Mikrobiologen gehören; auch Mitglieder des Referenzzentrums (Herzklappenzentrum) können dem Team angehören. Weitere Fachleute aus dem Gesundheitswesen, die in die Diskussion einbezogen werden können, sind Neurologen, Pharmakologen, Spezialisten für Nierenerkrankungen und Krankenschwestern.
Diagnose
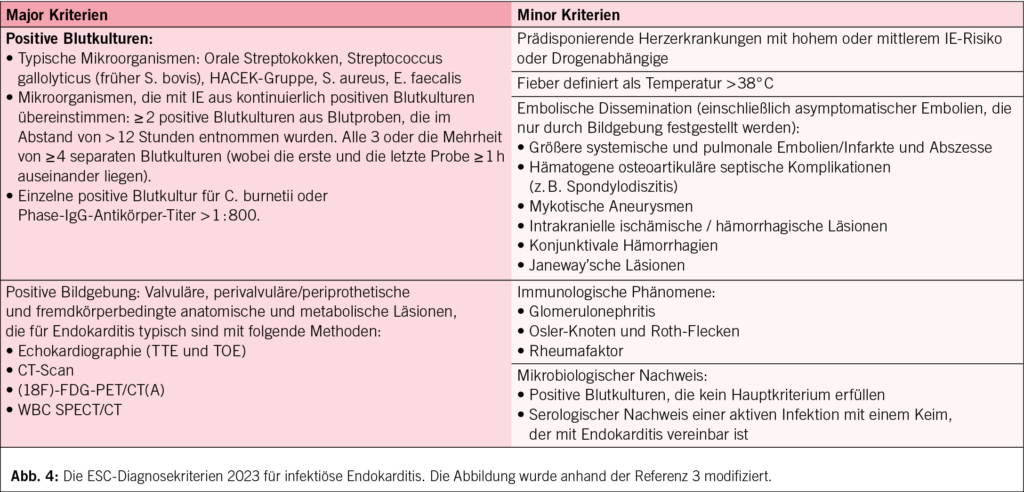
Der erste Verdacht auf eine Endokarditis ergibt sich in der Regel aus klinischen und Labordaten, wobei die kardiale (und extrakardiale) Bildgebung wichtige diagnostische Anhaltspunkte bietet. Die klassischen Duke-Kriterien für die Diagnose wurden in den ESC-Leitlinien 2023 leicht modifiziert und sind in Abb. 4 zusammengefasst.
Anhand der Diagnosekriterien wird eine definitive Endokarditis durch das Vorhandensein von 2 Major- oder 1 Major- und mindestens 3 Minor-Kriterien definiert; eine mögliche Endokarditis wird durch 1 Major- und 1 oder 2 Minor-Kriterien oder 3–4 Minor-Kriterien definiert.
Die wichtigsten Hinweise und Neuerungen für die Diagnose, die in die Leitlinien 2023 aufgenommen wurden, sind die folgenden:
• Enterococcus faecalis wurde zuletzt als häufiger Erreger von Endokarditis beschrieben und wurde als typischer Endokarditis-Erreger in die Major-Kriterien aufgenommen.
• Bei positiven Blutkulturen wird eine MALDI-TOF MS (matrix-assisted laser desorption ionization time-of-flight mass spectrometry) zur schnellen Identifizierung des kausalen Erregers und zur schnellen Empfindlichkeitsprüfung empfohlen, um die geeignete Antibiotikabehandlung festzulegen.
• Im Falle negativer Blutkulturen sollte eine Serologie auf atypische Mikroorganismen durchgeführt werden (C. burnetii, Bartonella spp., Aspergillus spp., L. pneumophila, Brucella spp., M. pneumoniae). Zudem kann eine molekularbiologische Untersuchung (Polymerase-Kettenreaktion-Sequenzierung) von Blut, Emboliematerial, Vegetation oder explantiertem Herzgewebe zur Identifizierung des Mikroorganismus beitragen. Lässt sich weiterhin kein Mikroorganismus identifizieren, kann eine nicht bakterielle thrombotische Endokarditis in Betracht gezogen werden, und die Patienten sollten für eine Antiphospholipid-Antikörper, antinukleäre Antikörper und Anti-Schweinefleisch-Antikörper untersucht werden. Neuere Daten scheinen darauf hinzudeuten, dass eine Endokarditis mit negativen Blutkulturen mit einer schlechteren Prognose verbunden sein kann als eine Endokarditis mit positiven Blutkulturen (8).
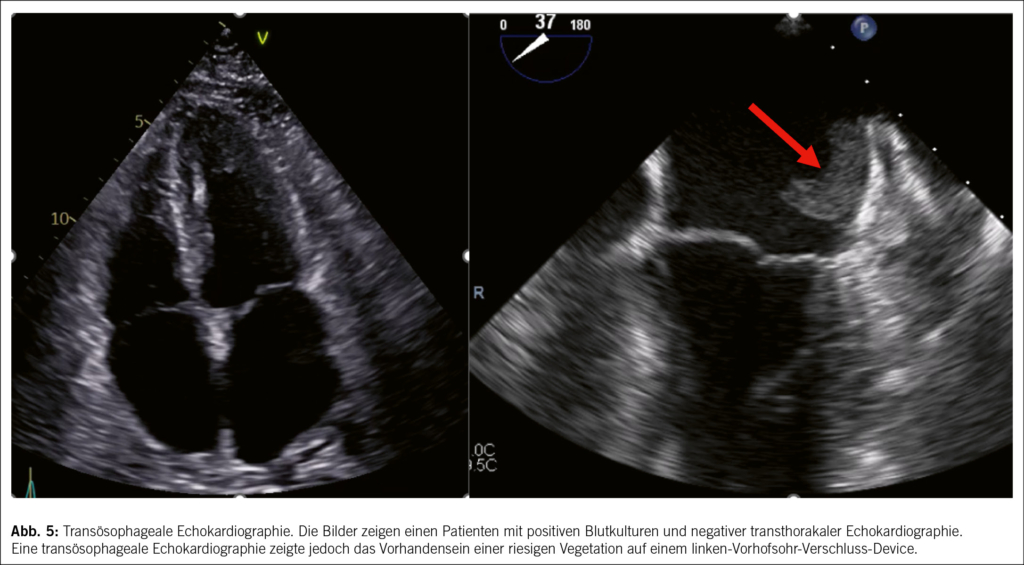
• Was die Echokardiographie anbelangt, so ist die Indikation zur Transoesophageale über die Transthorakale Echokardiographie hinaus inzwischen zu einer Indikation der Klasse I aufgewertet worden. Tatsächlich erlaubt die transoesophageale Echokardiographie bei vielen Patienten eine bessere diagnostische Performance (mit der einzigen möglichen Ausnahme einer isolierten rechtsseitigen Endokarditis) und ermöglicht die frühzeitige Erkennung von Komplikationen, Abb. 5.
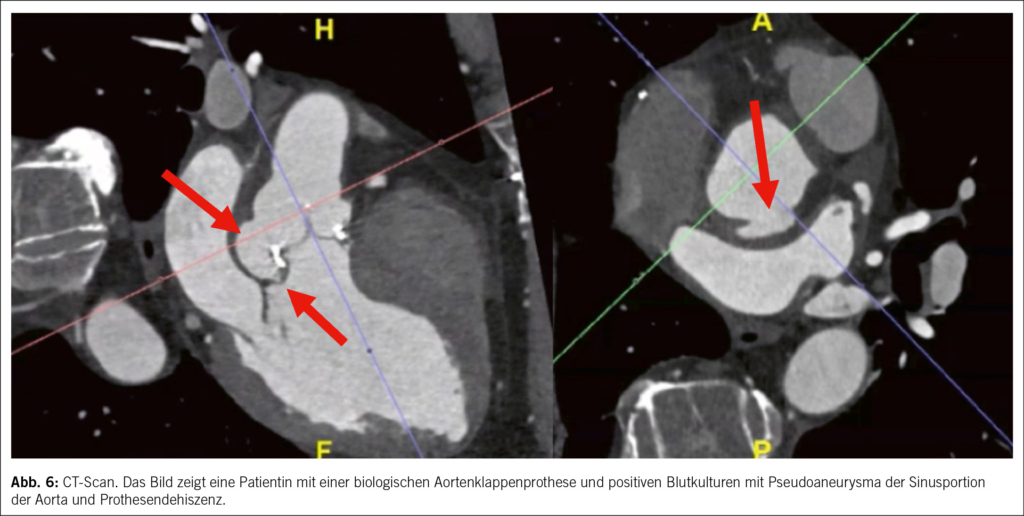
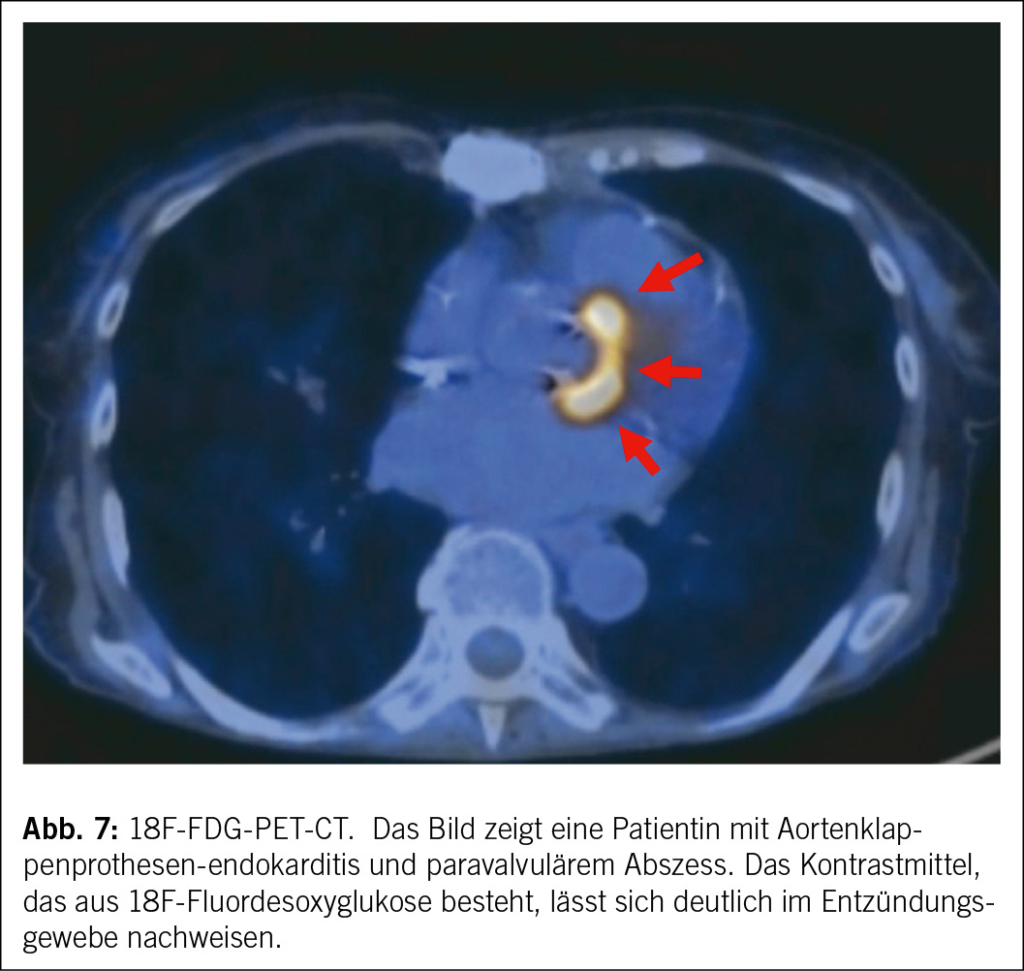
• Ein multimodaler Bildgebungsansatz wird dringend empfohlen. Neuere Studien haben gezeigt, dass die kardiale CT-Scan eine sehr gute diagnostische Aussagekraft für die Diagnose von Herzklappenläsionen und perivalvulären Komplikationen bei nativer Klappenendokarditis hat, während die PET-CT eine sehr gute Aussagekraft für die Diagnose von Endokarditis bei Herzklappenprothesen hat (9, 10), Abb. 6 und 7. Die Magnetresonanz Untersuchung ist nicht geeignet, um kardiale Vegetation oder Komplikationen zu erkennen, kann aber nützlich sein, um Fernläsionen zu entdecken.
• Für Patienten mit nativer oder prothetischer Herzklappenendokarditis wurden spezielle diagnostische Verfahren entwickelt. Insbesondere für den Fall, dass die Diagnose einer linksseitigen nativen oder prothetischen Herzklappenendokarditis nicht definitiv, aber möglich ist, empfiehlt die Leitlinie eine regelmässige Wiederholung der Blutkulturen (falls negativ oder zweifelhaft) und eine Wiederholung der Echokardiographie je 5–7 Tage; falls die Echokardiographie nicht diagnostisch ist, wird bei Patienten mit nativen Herzklappen ein CT-Scan empfohlen; bei prothetischen Herzklappen wird stattdessen ein kardiales CT-Scan oder PET-CT (oder, falls nicht verfügbar, ein White-Blood-Cell-SPECT) empfohlen. Wenn die Diagnose noch immer nicht definit ist, könnte ein weiteres Kriterium hinzugefügt werden, wenn eine extrakardiale Dissemination durch extrakardiale Bildgebungsmodalitäten festgestellt wird.
• Im Falle einer definitiven Endokarditis wird eine kardiale CT-Scan empfohlen, um eine paravalvuläre Komplikation zu erkennen, wenn die Echokardiographie nicht diagnostisch ist. Zusätzlich wird bei symptomatischen Patienten (Klasse I) eine extrakardiale Bildgebung zur Suche nach einer peripheren Dissemination empfohlen und kann bei asymptomatischen Patienten (Klasse IIb) in Betracht gezogen werden.
• Wenn nach den diagnostischen Kriterien eine Endokarditis des implantierten elektronischen Geräts nicht sicher ist, aber für möglich gehalten wird, empfehlen die Leitlinien, die Blutkulturen zu wiederholen (falls negativ oder zweifelhaft) und die Echokardiographie innerhalb von 5–7 Tagen zu wiederholen; falls die Diagnose immer noch unsicher ist, wird ein PET-CT empfohlen, um eine Pocket-Infektion oder eine septische Lungenembolie (Klasse I) oder sogar eine Elektrodeninfektion (Klasse IIb) zu erkennen, oder es kann ein CT-Scan durchgeführt werden, um eine Lungenembolie zu erkennen.
• Die Herz-CT kann auch als Alternative zur invasiven Koronarangiographie für die präoperative Beurteilung der Koronararterien verwendet werden (insbesondere bei Patienten mit Aortenklappenendokarditis).
Antibiotika-Therapie
Die Leitlinien 2023 enthalten sehr detaillierte Tabellen für die spezifische Antibiotikabehandlung entsprechend dem jeweiligen Erreger sowie für die empirische Erstbehandlung. Es wird daher empfohlen, das Dokument zur Entscheidung und Dosierung von Antibiotika heranzuziehen (3). Eine Neuerung der aktuellen Leitlinien besteht darin, dass die MIC-Werte für die Antibiotika gemäss dem EUCAST (European Committee on Antimicrobial Susceptibility Testing) eingeführt wurden (11).
Die Dauer der Antibiotikabehandlung variiert von 2 Wochen bei nicht komplizierten nativen Klappeninfektionen bis zu > 6 Wochen bei Herzklappenprothesen. In beiden Fällen, native oder prothetischen Klappen, richtet sich die Dauer der Behandlung nach dem ersten Tag einer wirksamen Antibiotikatherapie (negative Blutkultur im Falle einer anfänglich positiven Blutkultur), nicht nach dem Tag der Operation.
Die wichtigste Neuerung bei der antibiotischen Behandlung der infektiösen Endokarditis ist die Möglichkeit, nach der Anfangsphase auf eine orale Behandlung umzusteigen, wenn bestimmte Stabilitätskriterien erfüllt sind. Diese Empfehlung stammt aus der POET-Studie, einer randomisierten, multizentrischen Studie, die an 400 Patienten mit linksseitiger Endokarditis durchgeführt wurde; nach einer ersten Phase mit intravenöser Behandlung wurden die Patienten randomisiert, um die intravenöse Behandlung fortzusetzen oder auf eine orale Antibiotikabehandlung umzusteigen, wenn Stabilitätskriterien erfüllt waren. Es gab keinen Unterschied zwischen den intravenös (12 %) und oral (9 %; p = .40) behandelten Patienten in Bezug auf die Gesamtmortalität, ungeplante Herzoperationen, embolische Ereignisse oder ein Rezidiv der Bakteriämie (12). Bei der nachfolgenden veröffentlichten Verlängerung der Follow-up-Studie auf mehr als 5 Jahren zeigte sich die «Step-down»Behandlung mit oraler Therapie sogar als besser mit einer geringeren Inzidenz von Ereignissen bei den oral Behandelten (33 %) im Vergleich zur intravenösen Behandlung (45 %) (13).
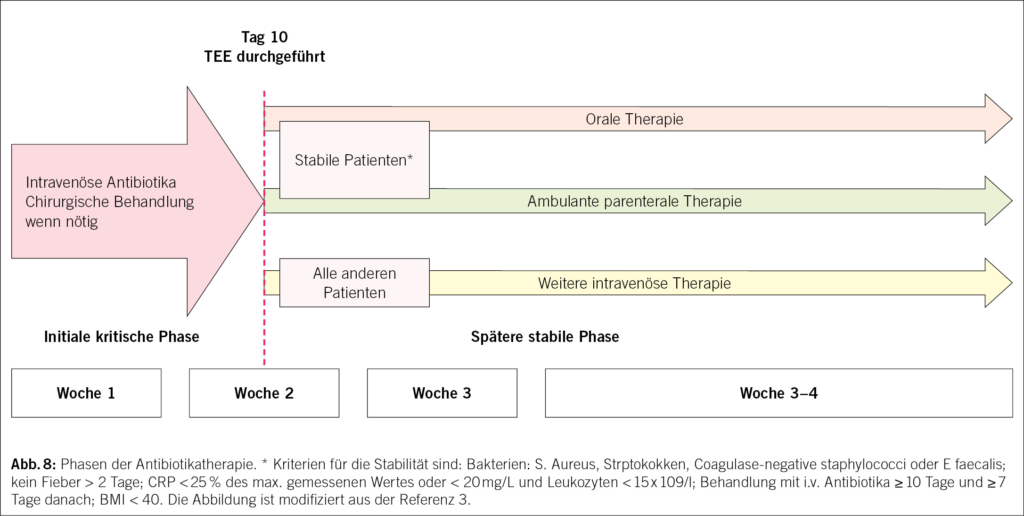
Dementsprechend hat die Endokarditis-Leitlinie 2023 nun zwei Phasen der Antibiotikabehandlung definiert. Die erste Phase ist die so genannte kritische Phase, in der der Patient hospitalisiert wird, eine intravenöse Antibiotikabehandlung durchgeführt wird und die Komplikationen chirurgisch behandelt werden. Nach der Anfangsphase wird eine transösophageale Echokardiographie durchgeführt, und wenn keine neuen Komplikationen auftreten und der Patient klinisch stabil ist, kann eine «Step-down»-Behandlung mit oralen Antibiotika (mit einem 2-Antibiotika-Schema) oder eine ambulante parenterale Behandlung (OPAT) in Betracht gezogen werden, siehe Abb. 8.
Chirurgische Behandlung
Bei einem grossen Teil der Patienten ist die antibiotische Behandlung nicht ausreichend, um die Infektion und ihre Komplikationen zu behandeln, sodass die Patienten einer herzchirurgischen Behandlung bedürfen, um das infektiöse Gewebe zu entfernen und die Beschädigungen zu beheben. Im Euro-Endo-Register lag die Prävalenz der Herzchirurgie in der Population der Patienten mit infektiöser Endokarditis bei 51 % (2).
Die drei Hauptindikationen für eine Operation sind Herzinsuffizienz, Anzeichen einer unkontrollierten Infektion und die Vermeidung von Embolierisiken. Der Zeitpunkt der Operation kann als Notfall eingestuft werden, wenn der Eingriff innerhalb von 24 Stunden durchgeführt werden muss, als dringend, wenn der Eingriff innerhalb von 3 bis 5 Tagen durchgeführt werden sollte, und als nicht dringend, wenn die Indikation zur Durchführung des Eingriffs innerhalb desselben Spitalaufenthalts besteht. Die Abb. 9 gibt einen Überblick über die Indikation und den Zeitpunkt für einen herzchirurgischen Eingriff. Darüber hinaus wird eine chirurgische Behandlung auch bei einer frühen Endokarditis der Herzklappenprothese (innerhalb von 6 Monaten nach der Implantation) empfohlen als Indikation der Klasse I.
Im Hinblick auf die rechtsseitige Endokarditis wurden die folgenden Bedingungen von Klasse IIa in den vorherigen Leitlinien zu Indikationen der Klasse I für eine Operation in den aktuellen Leitlinien überarbeitet: rechtsventrikuläre Dysfunktion aufgrund einer schweren Trikuspidalregurgitation, die nicht auf Diuretika anspricht; persistierende Vegetationen mit wiederkehrenden septischen Lungenembolien, die eine Beatmungsunterstützung erfordern; persistierende Vegetationen > 20 mm nach wiederkehrenden septischen Lungenembolien.
Neurologische Komplikationen
Neurologische Komplikationen sind die am meisten gefürchteten bei Patienten mit Endokarditis, da sie mit einer schlechten Prognose verbunden sind. Ein dringender chirurgischer Eingriff kann in der Tat bei Patienten mit zerebralen Embolien Sorgen verursachen, mit Blick auf das Risiko einer möglichen hämorrhagischen Konversion, die mit dem intraoperativen Einsatz von Heparin verbunden ist; tatsächlich ist in diesen Fällen die Mortalitätsrate extrem hoch. Dieses Risiko sollte jedoch mit dem Risiko hämodynamischer Komplikationen, die eine Verzögerung des Eingriffs mit sich bringen, und mit der Gesamtprognose der Patienten abgewogen werden. Hier ist die Diskussion im Rahmen des Endokarditis-Teams, dem auch ein Neurologe angehört, sehr wichtig. Eine transitorische ischämische Attacke gilt in der Regel nicht als Grund, eine Herzoperation zu verzögern, wenn sie indiziert ist. Bei einem ischämischen Schlaganfall wird die Operation, wenn sie indiziert ist, empfohlen (Klasse I), es sei denn, es gibt Hinweise auf eine hämorrhagische Transformation oder der Patient weist einen schlechten neurologischen Status auf (Glasgow Coma Scale < = 4 oder National Institutes of Health Stroke Scale Score (NIHSS) > 18).
Im Falle eines hämorrhagischen Schlaganfalls ist das Szenario völlig anders, und die Entscheidung sollte von Fall zu Fall nach sorgfältiger Bewertung und Diskussion im Endokarditis-Team getroffen werden. Wenn dies vernünftig erscheint, sollte die Operation unter strikter Überwachung der hämodynamischen Parameter und der neurologischen Bildgebung um 4 Wochen verschoben werden (Klasse IIa), wenn dies nicht möglich ist, sollte eine Notfall- oder Dringlichkeitsoperation unter Abwägung von Risiko und Nutzen in Betracht gezogen werden und wenn ein vernünftiges Ergebnis möglich ist (Klasse IIa). Günstige hämorrhagische Merkmale sind ein Hämorrhagievolumen von < 30 ml oder ein NIHSS < 12.
Kardiovaskuläre implantierte elektronische Geräte
Die Empfehlungen für Patienten mit Endokarditis und kardiovaskulären implantierten elektrischen Geräten wurden auch gemäss einem aktuellen Dokument der European Heart Rhythm Association (14) aktualisiert. Eine konservative Behandlung der Geräteinfektion ist mit einer erhöhten Mortalität verbunden, daher empfehlen die Leitlinien bei definitiver Diagnose einer Geräteinfektion eine vollständige Systemextraktion in erfahrenen Zentren (Indikation Klasse I) (15). Im Falle einer Herzklappenendokarditis, auch ohne Hinweise auf eine Geräte- oder Elektrodenbeteiligung, kann im Falle einer S. Aureus-Infektion eine vollständige Extraktion in Betracht gezogen werden (Klasse IIa); im Falle einer möglichen Geräteendokarditis wird zunächst eine antimikrobielle Therapie empfohlen, aber wenn die Blutkulturen anhaltend positiv sind, sollte das gesamte System entfernt werden. Die Reimplantation des Geräts sollte nach einer angemessenen Antibiotikatherapie an einer anderen Stelle der vorherigen Implantation mindestens 2 Wochen nach Negativierung der Blutkultur (bei Patienten mit Vegetationen) oder mindestens 72 Stunden nach Negativierung der Blutkultur (bei Patienten ohne Vegetationen) erfolgen. Als Überbrückung bis zur nächsten Geräte-Implantation können schrittmacherabhängige Patienten mit einem transjugulären Schrittmacher behandelt werden, oder bei Patienten mit implantierbaren Defibrillatoren kann ein «wearable defibrillator» in Betracht gezogen werden.
Schlussfolgerungen
Mit mehr als dreissig neuen Empfehlungen und einer grossen Anzahl überarbeiteter und aktualisierter Empfehlungen stellen die Leitlinien 2023 der Europäischen Gesellschaft für Kardiologie zur Endokarditis einen grossen Fortschritt gegenüber dem vorherigen Dokument von 2015 dar. Die Arbeitsgruppe räumt ein, dass es noch einige wissenschaftliche Lücken gibt und dass vor allem die Robustheit einiger Empfehlungen aufgrund des Fehlens randomisierter klinischer Studien schwächer ist. Nichtsdestotrotz geben die Leitlinien 2023 den aktuellen Wissensstand im Lichte der neuesten wissenschaftlichen Erkenntnisse wieder und sind ein sehr praktisches und nützliches Dokument für alle Angehörigen der Gesundheitsberufe, die an der Behandlung von Patienten mit Endokarditis beteiligt sind.
Copyright Aerzteverlag medinfo AG
Herzgefässzentrum im Park
Hirslanden Klinik im Park,
Seesstrasse 247
8038 Zürich
Tel. 044 209 20 20
stefano.caselli@hirslanden.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Global Burden of Disease Metrics. Institute for Health Metrics Evaluation. University of Washington, Seattle. Available at: https://vizhub.healthdata.org/gbd-compare/(accessed October 2021).
2. Habib G, Erba PA, Iung B, Donal E, Cosyns B, Laroche C, Popescu BA, Prendergast B, Tornos P, Sadeghpour A, Oliver L, Vaskelyte JJ, Sow R, Axler O, Maggioni AP, Lancellotti P; EURO-ENDO Investigators. Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: a prospective cohort study. Eur Heart J. 2019 Oct 14;40(39):3222-3232. doi: 10.1093/eurheartj/ehz620. Erratum in: Eur Heart J. 2020 Jun 7;41(22):2091. doi: 10.1093/eurheartj/ehz803. PMID: 31504413.
3. Delgado V, Ajmone Marsan N, de Waha S, Bonaros N, Brida M, Burri H, Caselli S, Doenst T, Ederhy S, Erba PA, Foldager D, Fosbøl EL, Kovac J, Mestres CA, Miller OI, Miro JM, Pazdernik M, Pizzi MN, Quintana E, Rasmussen TB, Ristic AD, Rodés-Cabau J, Sionis A, Zühlke LJ, Borger MA; ESC Scientific Document Group. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023 Oct 14;44(39):3948-4042.
4. Thornhill MH, Gibson TB, Yoon F, Dayer MJ, Prendergast BD, Lockhart PB, et al. Antibiotic prophylaxis against infective endocarditis before invasive dental procedures. J Am Coll Cardiol 2022;80:1029–1041. https://doi.org/10.1016/j.jacc.2022.06.030
5. Janszky I, Gémes K, Ahnve S, Asgeirsson H, Möller J. Invasive Procedures Associated With the Development of Infective Endocarditis. J Am Coll Cardiol. 2018 Jun 19;71(24):2744-2752. doi: 10.1016/j.jacc.2018.03.532. PMID: 29903348.
6. Thornhill MH, Crum A, Campbell R, Stone T, Lee EC, Bradburn M, et al. Temporal association between invasive procedures and infective endocarditis. Heart 2023;109: 223–231. https://doi.org/10.1136/heartjnl-2022-321519
7. El-Dalati S, Cronin D, Riddell J 4th, Shea M, Weinberg RL, Washer L, Stoneman E, Perry DA, Bradley S, Burke J, Murali S, Fagan C, Chanderraj R, Christine P, Patel T, Ressler K, Fukuhara S, Romano M, Yang B, Deeb GM. The Clinical Impact of Implementation of a Multidisciplinary Endocarditis Team. Ann Thorac Surg. 2022 Jan;113(1):118-124. doi: 10.1016/j.athoracsur.2021.02.027. Epub 2021 Mar 1. PMID: 33662308.
8. Kong WKF, Salsano A, Giacobbe DR, Popescu BA, Laroche C, Duval X, Schueler R, Moreo A, Colonna P, Piper C, Calvo-Iglesias F, Badano LP, Srdanovic I, Boutoille D, Huttin O, Stöhr E, Timóteo AT, Vaskelyte JJ, Sadeghpour A, Tornos P, Abid L, Poh KK, Habib G, Lancellotti P; The EURO-ENDO Investigators. Outcomes of culture-negative vs. culture-positive infective endocarditis: the ESC-EORP EURO-ENDO registry. Eur Heart J. 2022 Aug 1;43(29):2770-2780. doi: 10.1093/eurheartj/ehac307. Erratum in: Eur Heart J. 2023 Jun 1;44(21):1909. doi: 10.1093/eurheartj/ehad222. PMID: 35695691; PMCID: PMC9459867.
9. Oliveira M, Guittet L, Hamon M, Hamon M. Comparative Value of Cardiac CT and Transesophageal Echocardiography in Infective Endocarditis: A Systematic Review and Meta-Analysis. Radiol Cardiothorac Imaging. 2020 Jun 18;2(3):e190189. doi: 10.1148/ryct.2020190189. PMID: 33778583; PMCID: PMC7977865.
10. Wang TKM, Sánchez-Nadales A, Igbinomwanhia E, Cremer P, Griffin B, Xu B. Diagnosis of Infective Endocarditis by Subtype Using 18F-Fluorodeoxyglucose Positron Emission Tomography/Computed Tomography: A Contemporary Meta-Analysis. Circ Cardiovasc Imaging. 2020 Jun;13(6):e010600. doi: 10.1161/CIRCIMAGING.120.010600. Epub 2020 Jun 8. PMID: 32507019.
11. European Committee on Antimicrobial Susceptibility Testing. The European Committee on Antimicrobial Susceptibility Testing. Breakpoint Tables for Interpretation of MICs and Zone Diameters. Version 12.0, 2022. http://www.eucast.org.
12. Iversen K, Ihlemann N, Gill SU, Madsen T, Elming H, Jensen KT, Bruun NE, Høfsten DE, Fursted K, Christensen JJ, Schultz M, Klein CF, Fosbøll EL, Rosenvinge F, Schønheyder HC, Køber L, Torp-Pedersen C, Helweg-Larsen J, Tønder N, Moser C, Bundgaard H. Partial Oral versus Intravenous Antibiotic Treatment of Endocarditis. N Engl J Med. 2019 Jan 31;380(5):415-424. doi: 10.1056/NEJMoa1808312. Epub 2018 Aug 28. PMID: 30152252.
13. Pries-Heje MM, Wiingaard C, Ihlemann N, Gill SU, Bruun NE, Elming H, Povlsen JA, Madsen T, Jensen KT, Fursted K, Schultz M, Østergaard L, Christensen JJ, Christiansen U, Rosenvinge F, Helweg-Larsen J, Fosbøl EL, Køber L, Torp-Pedersen C, Tønder N, Moser C, Iversen K, Bundgaard H. Five-Year Outcomes of the Partial Oral Treatment of Endocarditis (POET) Trial. N Engl J Med. 2022 Feb 10;386(6):601-602. doi: 10.1056/NEJMc2114046. PMID: 35139280.
14. Blomström-Lundqvist C, Traykov V, Erba PA, Burri H, Nielsen JC, Bongiorni MG, Poole J, Boriani G, Costa R, Deharo JC, Epstein LM, Sághy L, Snygg-Martin U, Starck C, Tascini C, Strathmore N. European Heart Rhythm Association (EHRA) international consensus document on how to prevent, diagnose, and treat cardiac implantable electronic device infections-endorsed by the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), the Latin American Heart Rhythm Society (LAHRS), International Society for Cardiovascular Infectious Diseases (ISCVID), and the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020 Jun 1;41(21):2012-2032. doi: 10.1093/eurheartj/ehaa010. PMID: 32101604.
15. Donal E, Tribouilloy C, Sadeghpour A, Laroche C, Tude Rodrigues AC, Pereira Nunes MDC, Kang DH, Hernadez-Meneses M, Kobalava Z, De Bonis M, Dworakowski R, Ivanovic B, Holicka M, Kitai T, Cruz I, Huttin O, Colonna P, Lancellotti P, Habib G. Cardiac device-related infective endocarditis need for lead extraction whatever the device according to the ESC EORP EURO-ENDO registry. Eur Heart J Open. 2023 Jul 3;3(4):oead064. doi: 10.1093/ehjopen/oead064. PMID: 37465258; PMCID: PMC10351571.
info@herz+gefäss
- Vol. 14
- Ausgabe 5
- November 2024