- Nicht obstruktive Koronarerkrankungen im Fokus: Definition, Diagnostik und Ursachen von ANOCA, INOCA und MINOCA
Herz-Kreislauf-Erkrankungen stellen in Europa neben der Hauptursache für Tod und vorzeitige Sterblichkeit auch zunehmend eine signifikante Belastung der öffentlichen Gesundheit, Produktivität und Gesundheitsressourcen dar. Dabei stellt die koronare Herzerkrankung (KHK) mit 34 % den grössten Anteil dieses Spektrums dar (1). Die KHK mit dem traditionellen Verständnis, das sich fast ausschliesslich auf epikardiale atherosklerotische Stenosen konzentrierte, gilt heutzutage als überholt. Obwohl der nicht obstruktiven KHK zunehmend Aufmerksamkeit geschenkt wird, sind die Mechanismen weitgehend unbekannt, und die Diagnose wird im praktischen Alltag möglicherweise unterschätzt. Daher ist es von entscheidender Bedeutung, die nicht obstruktive KHK zu erkennen, um geeignete Behandlungsstrategien zu entwickeln. Ziel dieses Reviews ist es, einen Überblick zu den gängigen Definitionen, Ursachen und Diagnostik der nicht obstruktiven koronaren Herzerkrankung zu geben.
Schlüsselwörter: INOCA, MINOCA, ANOCA, Ischämie
Einleitung
Im klinischen Alltag kann sich die ischämische Herzerkrankung als akutes Koronarsyndrom (ACS) (z. B. instabile Angina pectoris oder akuter Myokardinfarkt) oder als chronisches Koronarsyndrom (CCS) mit Angina pectoris (AP), Belastungsdyspnoe oder als Leistungsknick präsentieren.
Die Daten zeigen dabei, dass bis zu 40–70 % der Patienten mit Angina pectoris und/oder dokumentierter Myokardischämie sowie bei 10–14 % der Patienten mit ACS kein angiographischer Hinweis auf eine signifikante koronare Herzerkrankung (KHK) (≥ 50 % Stenose des epikardialen Gefässdurchmessers) vorliegt. Dieses Phänomen lässt sich allgemein bei Frauen häufiger betrachten als bei Männern (2–5).
Das Koronarsystem kann grob in drei Widerstandskomponenten unterteilt werden: die leitenden epikardialen Arterien, die Arteriolen, welche die Widerstandsgefässe bilden, und das kapillar-venöse Kompartiment, welches vor allem durch den Blutfluss durch die Arteriolen reguliert wird und zusammen mit diesem die Mikrozirkulation ausmacht (6).
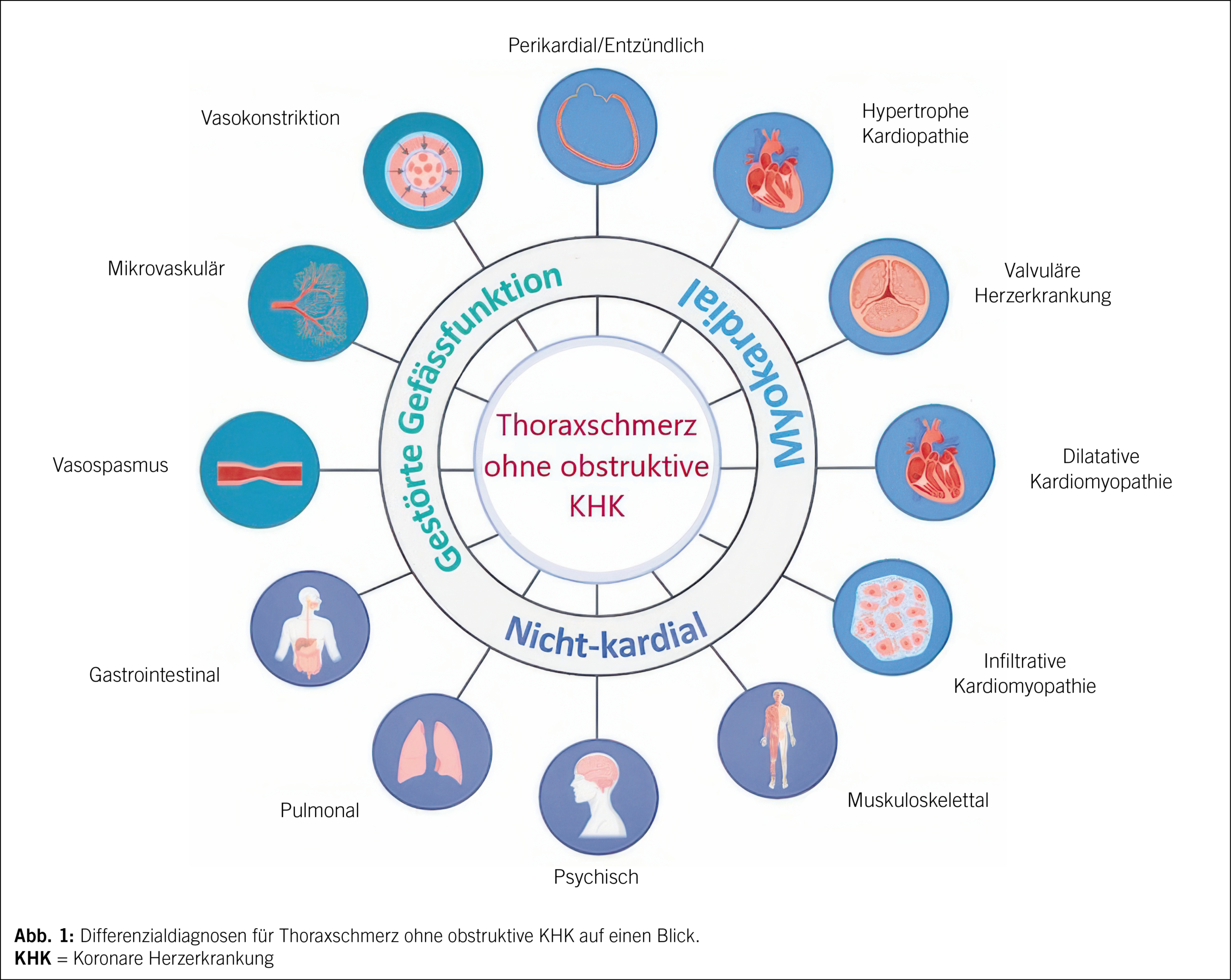
Die komplexe Beziehung der koronaren Autoregulation zwischen epikardialen Gefässen und der mikrovaskulären Versorgung unter physiologischen und pathophysiologischen Bedingungen stellt dabei eine Herausforderung in der Diagnosestellung und zielgerichteten Therapie der zugrunde liegenden Erkrankung dar (Abb. 1).
Definition und Pathophysiologie
Der Überbegriff der ischämischen Herzerkrankung ist breit gefächert und umfasst mehrere epikardiale und mikrovaskuläre Pathologien wie atherosklerotische Erkrankungen, spontane Koronardissektion und Koronarspasmen sowie mikrovaskuläre Anomalien wie mikrovaskuläre Spasmen, gestörte mikrovaskuläre Vasodilatation und erhöhten mikrovaskulären Widerstand. Strukturelle oder funktionelle Anomalien der koronaren Mikrozirkulation, die zu einer beeinträchtigten Vasodilatation führen, können dabei pektanginöse Beschwerden oder ein AP-Äquivalent mit oder ohne Ischämie auslösen.
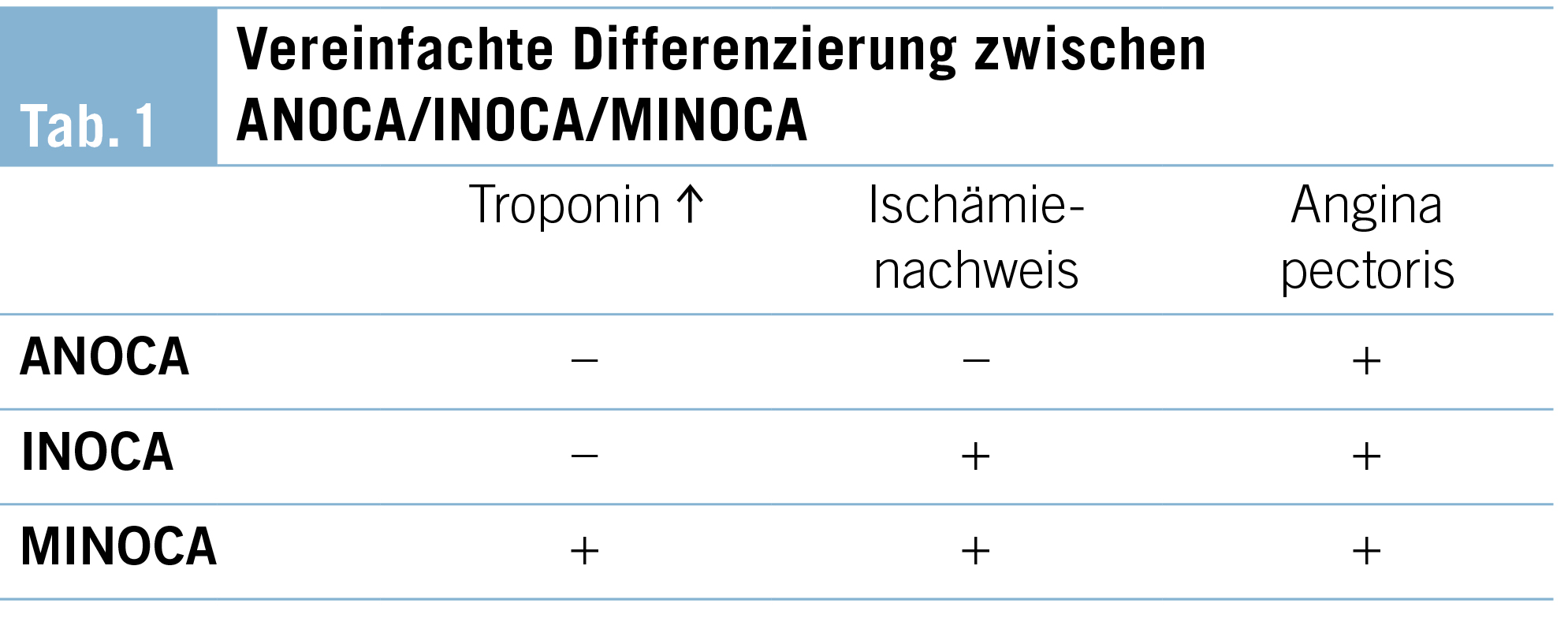
Die verbreiteten und definierten Überbegriffe lassen sich in ANOCA (Angina with Non-Obstructive Coronary Artery Disease), INOCA (Ischemia with Non-Obstructive Coronary Artery Disease) und MINOCA (Myocardial Infarction with Non-Obstructive Coronary Artery Disease) zusammenfassen.
Ihr klinisches Bild unterscheidet sich meist nicht wesentlich von dem der Patienten mit obstruktiver KHK. Die Annahme, dass sie im Vergleich zu Patienten mit typischer KHK mehr atypische Symptome aufweisen, konnte in grossen Kohortenstudien nicht bestätigt werden (7).
ANOCA und INOCA sind vor allem durch chronische pathophysiologische Mechanismen gekennzeichnet, während MINOCA akute Ereignisse beschreibt.
Zugrunde liegend können atherosklerotische Ursachen wie die Plaqueerosion und -ruptur sowie nicht atherosklerotische Ursachen wie epikardialer koronarer Vasospasmus, koronare mikrovaskuläre Dysfunktion (CMD), koronare Embolien und spontane Koronararteriendissektion (SCAD) sein (8).
In jüngster Zeit wurde der Begriff ANOCA geprägt, um alle klinischen Zustände zu erfassen, die durch anginöse Symptome ohne Nachweis einer signifikanten KHK in der Koronarangiographie und Ischämie bestimmt werden. Die pathophysiologischen Ursachen sind dabei unterschiedlich und können neben einer CMD, welche etwa bei zwei-Drittel der Patienten mit ANOCA auftritt, auch durch eine koronare endotheliale Dysfunktion im makrovaskulären epikardialen Gefäss mit Vasospasmus bedingt sein (9).
Wenn anginöse Symptome mit einer dokumentierten Myokardischämie ohne obstruktive KHK einhergehen, wird der Begriff INOCA verwendet. INOCA hat zum Teil ähnliche pathophysiologische Mechanismen wie MINOCA, zu den häufigsten Mechanismen der INOCA zählen die CMD und epikardialer Koronararterienspasmus (8, 10). Die einheitliche Definition der INOCA beschreibt anhaltende (mehrere Wochen oder länger) Symptome, die auf eine ischämische Herzerkrankung hindeuten, ein objektiver Nachweis einer Myokardischämie durch EKG oder nicht invasive kardiale Ischämietestung (z. B. Echokardiographie (TTE), kardialem MRT (cMRT) oder nukleare Bildgebung sowie das Fehlen einer flusslimitierenden Obstruktion in der Koronarangiographie, definiert durch eine epikardiale Koronararterienstenose ≥ 50 % oder eine fraktionelle Flussreserve (FFR) < 0.8 (5).
MINOCA bezeichnet als Syndrom das Vorliegen eines nach den gängigen, universellen Kriterien definierten Myokardinfarkts (MI) mit signifikantem Anstieg des kardialen Troponins (> 99. Perzentile), mit ischämietypischen Symptomen und Ischämienachweis ohne angiographischen Nachweis einer signifikanten epikardialen Koronarstenose. Patienten mit MINOCA zeigen im akuten Setting zudem auch eine schlechte Prognose mit hohen Raten an CV-Ereignissen und Tod auf. Die Langzeitsterblichkeit nach einem Myokardinfarkt ohne nachweisbare obstruktive Koronarerkrankung (MINOCA) ist niedriger als bei Patienten, die einen Myokardinfarkt aufgrund einer obstruktiven Koronarstenose erlitten haben (11). Nach aktuellsten Daten macht MINOCA ca. 2–11 % aller akuten ACS aus (8, 5) (Tab. 1).
Diagnostik
ANOCA/INOCA
Im klinischen Alltag zeigen sich nicht selten diskrepante Befunde bei Patienten mit AP-Beschwerden, unabhängig davon, ob diagnostische Hinweise auf eine zugrunde liegende myokardiale Ischämie vorliegen oder nicht.
Besteht eine persistierende, auf eine myokardiale Minderperfusion hinweisende Symptomatik, sollte neben EKG und Laboranalyse je nach Risikoprofil eine nicht invasive oder invasive Bildgebung evaluiert werden. Bei objektivierbaren Hinweisen einer myokardialen Ischämie sollte mittels invasiver Abklärung eine signifikante KHK (≥ 50 % Stenose des epikardialen Gefässdurchmessers) ausgeschlossen werden (6). Die invasive Funktionstestung der Koronargefässe mittels hämodynamischer Quantifizierung von Stenosen mittleren Grades (40–90 %) hat sich als etablierte Methode zur Differenzierung der Signifikanz der Läsion mit oder ohne Nachweis einer Ischämie etabliert (12, 13). Damit lassen sich aber auch zugrunde liegende pathophysiologische Mechanismen bei nicht obstruktiver KHK identifizieren.
Neben der FFR-Messung, welche das Verhältnis zwischen dem mittleren distalen intrakoronaren Druck und dem mittleren Aortendruck unter maximaler Hyperämie mit typischerweise Adenosin darstellt und Stenosen funktionell quantifizieren kann, bestehen auch Methoden (z. B. iFR), welche unter Ruhebedingungen ohne Stimulation durch Adenosin gleichwertige Resultate liefern.
Die Auflösung zur qualitativen Beurteilung des Koronargefässes reicht mit der Koronarangiographie bis 0.2 mm, moderne ultrahochauflösende Koronar-CT (UHR-CT) schaffen ein räumliches Auflösungsvermögen von bis zu 0.15 mm. Die Arteriolen, welche als Endstromgebiete die Widerstandsgefässe bilden und damit direkt durch Autoregulation die Myokardperfusion auf mikrovaskulärer Ebene steuern, haben eine Grösse von < 0.1 mm und lassen sich daher mit der herkömmlichen Bildgebung nicht darstellen (14, 15).
Zur invasiven Beurteilung der Mikrozirkulation und von Vasospasmen sollten die Quantifizierung der koronaren Flussreserve (CFR) und der Index des mikrovaskulären Widerstands (IMR) unter Hyperämie-Induktion mittels Adenosin erfolgen. Im weiteren Schritt lässt sich zwischen einer endothelunabhängigen bzw. endothelabhängigen Funktion unterteilen, wobei die endothelunabhängige Funktion mittels Adenosin untersucht wird. Die endothelabhängige Funktion erfolgt mittels intrakoronarem Provokationstest mit Acetylcholin und ermöglicht die Erkennung von Koronarspasmen (16).
Die nicht invasive Diagnose der CMD kann mittels PET-CT und cMRT erfolgen, wobei aktuell das PET-CT die genauere und besser validierte Methode ist. Zu den weniger verbreiteten, nicht invasiven Verfahren zur Diagnose einer CMD gehört das TTE und CT (17).
MINOCA
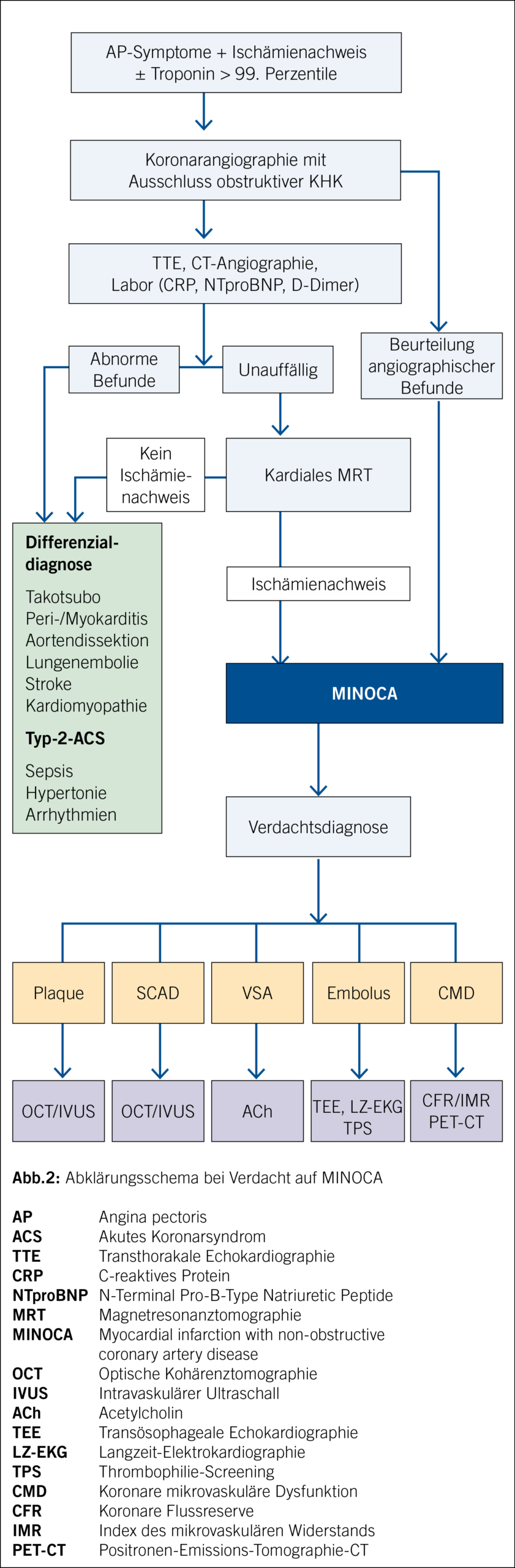
Zeigen sich neben erhöhtem, dynamischem kardialem Troponin auch klinische Hinweise für einen Infarkt (EKG, bildgeberische Hinweise auf Viabilitätsverlust des Myokards), sollten neben Ausschluss einer obstruktiven Koro- narläsion andere Differenzialdiagnosen ausgeschlossen werden (Takotsubo-Syndrom, Myokarditis, Sepsis etc.) (18).
Besteht in der Koronarangiographie keine relevante Stenosierung, empfiehlt sich bereits während der Indexprozedur eine intrakoronare Bildgebung mittels intravaskulären Ultraschalls (IVUS) oder optischer Kohärenztomographie (OCT), um Dissektionen, Thromben, Plaqueerosionen sowie -rupturen identifizieren zu können (10) (Abb. 2).
In den letzten Jahren haben zahlreiche Studien die Nützlichkeit des cMRT zur Diagnose- und Ursachenfindung von Patienten mit MINOCA unterstrichen. Dieses stellt in den neuesten Guidelines der ESC eine 1b-Empfehlung für MINOCA dar (19, 20).
Das cMRT lässt dabei detaillierte Informationen über die Struktur, Funktion des Herzens mittels Visualisierung des transmuralen Myokardflusses sowie der Gewebecharakterisierung, aber auch indirekt die Beurteilung der mikro- vaskulären Funktion zu. Mittels LGE (late gadolinium enhancement) lassen sich insbesondere Myokardnarben visualisieren, was in der Diagnosefindung bei MINOCA eine zentrale Rolle spielt. Zudem lassen sich nicht ischämische Ursachen, wie z. B. Myokarditis oder Takotsubo-Syndrom, ausschliessen (19, 21).
Das cMRT kann bei bis zu 87 % der Patienten mit der Arbeitsdiagnose MINOCA die zugrunde liegende Ursache identifizieren und sollte bei diesen Patienten so bald wie möglich nach der Vorstellung durchgeführt werden (20). Die höchste diagnostische Aussagekraft erreicht das cMRT innerhalb der ersten 2 Wochen nach Ereignis mit erhöhtem Troponin (22). Trotz optimaler diagnostischer Schritte bleibt die Ursache von MINOCA jedoch bei 8–25 % der Patienten unklar (18).
Ursachen
Atherosklerotische Plaques
Bei etwa 38–40 % der Patienten mit MINOCA konnten unter intravaskulärer Bildgebung (IVUS oder OCT) eine Störung der atheromatösen Plaque mit Plaqueerosion, Plaqueruptur oder verkalktem Nodulus nachgewiesen werden (8, 20). Diese können zu Thrombusbildung und Embolisation von atherosklerotischen Fragmenten und Gerinnsel in das distale Koronargefäss führen. In der Koronarangiographie lässt sich aufgrund des endogenen fibrinolytischen Systems sowie eines lokalen, transienten Vasospasmus auf einer instabilen Plaque zumeist keine direkte obstruktive Läsion nachweisen. Das angiographische Erscheinungsbild kann jedoch auf eine Plaquestörung hindeuten, z. B. durch eine Trübung oder einen Füllungsdefekt (8, 23).
Spontane Koronararteriendissektion
Die SCAD, welche im klinischen Alltag häufig übersehen wird und/oder schwer differenzierbar ist, beschreibt eine Dissektion der Intima durch eine darunterliegende intramurale Blutung oder direkten Intimariss mit Obstruktion des koronaren Blutflusses (24).
Diese tritt vor allem bei Frauen zwischen dem 45. und 53. Lebensjahr auf und macht dabei bis zu 35 % der Myokardinfarkte bei Frauen < 50. Lebensjahr aus (25). Es bestehen auch Zusammenhänge zu bekannten Bindegewebs- oder systemischen Erkrankungen. Zudem lassen sich keine direkten Zusammenhänge mit den traditionellen CV-Risikofaktoren erkennen (26–28). Tortuöse Koronargefässe stellen eine Prädisposition dar; der Hauptstamm und RIVA (Ramus interventricularis anterior) und die mittleren und distalen Segmente sind am häufigsten betroffen (25, 26, 29).
Die Diagnose einer SCAD ist in der Regel allein mit der Koronarangiographie möglich, eine intravaskuläre Bildgebung (OCT/IVUS) kann bei der Differenzierung komplexer Läsionen helfen.
Das Koronar-CT eignet sich primär nur zum Ausschluss proximaler SCAD, aufgrund von eingeschränkter räumlicher Auflösung und Artefakten ist die Beurteilung medialer und distaler Läsionen (< 2.5 mm) mit den aktuellen Methoden noch nicht ausreichend (30).
Bei erhaltenem Fluss im Gefäss ist zumeist ein konservatives Procedere ohne Intervention mit einem besseren Outcome verbunden (31).
Vasospasmus
Patienten mit vasospastischer Angina (VSA) haben typischerweise wiederkehrende AP-Episoden ohne eindeutigen Zusammenhang zu körperlicher Belastung und metabolischem Bedarf und treten bei Patienten mit und ohne nachgewiesener KHK auf. Typischerweise treten AP-Episoden von VSA häufiger in Ruhe, in der Nacht und frühmorgens auf, lassen sich durch Hyperventilation provozieren und sind auf Nitroglycerin reversibel. Zudem ist Rauchen ein wichtiger prädisponierender Risikofaktor für VSA (16). Zugrunde liegend sind ein gestörter Gefässtonus und koronare Vasomotorik, welche entscheidend vom Endothel reguliert werden. Vasoaktive Stimuli, wie z. B. Acetylcholin, Serotonin und Histamin, bewirken durch vasoaktive Freisetzung von Stickstoffmonoxid eine physiologische Vasodilatation, können aber bei endothelialer Dysfunktion und durch direkte Interaktion mit den glatten Muskelzellen eine Hyperreaktivität und paradoxe Vasokonstriktion auslösen. Dieser Vasospasmus kann auf epikardialer und mikrovaskulärer Ebene auftreten und bei prolongiertem Spasmus eine myokardiale Ischämie bzw. einen Infarkt auslösen. Eine reproduzierbare vasospastische Angina auf epikardialer und vor allem mikrovaskulärer Ebene tritt bei Frauen häufiger auf als bei Männern (32).
Die Diagnose der VSA wird häufig verpasst, da die Episoden meist selbstlimitierend sind und in der Koronarangiographie oft nicht mehr nachweisbar. Mittels Provokationstest unter intrakoronarer Applikation von Acetylcholin kann bei > 90 % Vasokonstriktion mit gleichzeitigen ischämietypischen EKG-Veränderungen und Reproduzierbarkeit der Symptome eine VSA bestätigt werden. Der Vasospasmus tritt typischerweise in einem Segment des Koronargefässes auf, kann aber auch multifokal in mehreren Segmenten auftreten. Sind mittels Provokationstest neben EKG-Veränderungen und Symptomen keine epikardialen Koronarspasmen (> 90 % des koronaren Gefässdurchmessers) nachweisbar, kann ein mikrovaskulärer Spasmus diagnostiziert werden.
Wichtig ist dabei eine vorangehende Beurteilung der mikrovaskulären Funktion und der endothelunabhängigen CFR mittels Adenosin, um diese differenzieren zu können (16).
Embolus
Die Prävalenz eines ACS mit ursächlichem Koronarembolus ohne Koronarsklerose liegt bei 4–13 %, die Ursache der Embolie ist in der Akutsituation oft schwer differenzierbar (33). Dieser kann direkt aus dem linken Vorhofsohr, linken Ventrikel oder von den linksseitigen Herzklappen als Thrombus, Klappenmaterial oder Neoplasie abgehen. Am häufigsten treten diese Embolien im Rahmen eines Vorhofflimmerns auf (73 %) (34). Weitere Ursachen sind eine paradoxe Embolie mit Übertritt des Embolus vom venösen in den systemischen Kreislauf durch einen Rechts-Links-Shunt, welcher zumeist im Bereich des Vorhofseptums liegt (z. B. PFO, ASD). In den meisten Fällen geht dieser von einer tiefen Venenthrombose aus. Zu den weiteren Ursachen zählen vererbte oder erworbene Koagulopathien, wie z. B. Faktor-V-Leiden, Protein-C- und -S-Mangel oder das Antiphospholipid-Syndrom, die Heparin-induzierte Thrombozytopenie (HIT), hormonelle oder maligne Ursachen (8).
Wichtig zu erwähnen ist, dass die Herzinsuffizienz als eigener Risikofaktor für prothrombotische oder hyperkoagulable
Zustände gilt (35). Intravaskuläre Bildgebung mittels IVUS oder OCT kann helfen, einen koronaren Embolus zu diagnostizieren bzw. andere Ätiologien, wie z. B. Plaqueruptur, auszuschliessen. Bei der Diagnosestellung ist TTE oder TEE unter Verwendung von «Bubble-Kontrast» unverzichtbar.
Koronare mikrovaskuläre Dysfunktion
Die CMD beschreibt eine strukturelle Veränderung und/oder funktionelle Dysregulation der mikrovaskulären Zirkulation, welche etwa 70 % des koronaren Gefässwiderstands ausmacht (36). Vor allem bei ANOCA und INOCA spielt die mikrovaskuläre Dysfunktion eine tragende Rolle, aber auch bei MINOCA. Die CMD tritt bei Frauen häufiger auf als bei Männern (5). Bis zu zwei Drittel der Patienten mit ANOCA und etwa 25 % bei INOCA lässt sich eine CMD nachweisen (37, 38). Zudem begünstigen Mechanismen der CMD das Entstehen von MINOCA (36). Soweit aktuell bekannt, sind verschiedene Faktoren ursächlich für eine CMD: strukturelle Mechanismen mit mikrovaskulärem Gefässumbau, Kapillarverdünnung und Lumenobstruktion sowie funktionelle Mechanismen wie endotheliale Dysfunktion und Hyperaktivität der glatten Muskelzellen.
Bei der strukturellen CMD kommt es zu Veränderungen und Remodeling der kleinen Arteriolen mit einer Abnahme des koronaren Flusses und beeinträchtigter Sauerstoffversorgung im mikrovaskulären Endstromgebiet. Die funktionelle CMD stellt im Gegensatz dazu eine gestörte Vasodilatation dar, welche in endothelabhängig (Dysbalance der vasoreaktiven Mediatoren) oder endothelunabhängig (gestörter Myozytentonus) unterteilt werden kann. Die gestörte Vasomotorik begünstigt zudem koronare Vasospasmen. Es besteht dabei ein Zusammenhang zwischen strukturellen und funktionellen Mechanismen, was zu einem unzureichenden myokardialen Blutfluss und Myokardschaden führt (39–41).
Eine Beeinträchtigung dieser Mechanismen birgt ein erhöhtes Risiko für kardiovaskuläre Ereignisse wie ACS, Herzinsuffizienz und Stroke (42). Die CMD, die zu einer Schädigung der Kardiomyozyten und Myokardsteifigkeit mit negativem Remodeling des linken Ventrikels führen kann, ist mit einem deutlich erhöhten Risiko für HFpEF-Ereignisse (heart failure with preserved ejection fraction) und Hospitalisationen aufgrund Herzinsuffizienz verbunden (43, 44).
Die CMD ist Teil der systemischen mikrovaskulären Erkrankungen, die mehrere Organsysteme wie das Gehirn, die Retina und Niere betreffen können. Zudem besteht ein direkter Zusammenhang zu den traditionellen Risikofaktoren wie Diabetes mellitus, arterielle Hypertonie, Dyslipidämie, Nikotinabusus sowie chronische Nierenerkrankungen (18, 45).
Die Diagnose der CMD basiert auf der invasiven und nicht invasiven Beurteilung der myokardialen Perfusion und des mikrovaskulären Widerstands, die Surrogatmarker für die mikrovaskuläre Funktion sind. Nach Ausschluss einer relevanten Koronarstenose kann mittels invasiver Messung der koronaren Flussreserve (CFR) und Bestimmung des Index des mikrovaskulären Widerstands (IMR) eine CMD bestätigt werden (16). Nicht invasive diagnostische Methoden umfassen das PET-CT und cMRT. Das cMRT zeigt dabei vielversprechende Ergebnisse zur Differenzierung zwischen epikardialen und mikrovaskulären Störungen im Vergleich zur invasiven Diagnostik (46).
Ausblick
Das traditionelle Konzept der koronaren Herzerkrankung mit obstruktiver Stenose ist nicht mehr zeitgemäss. ANOCA, INOCA und MINOCA sind Überbegriffe für verschiedene, teils konfluierende pathophysiologische Mechanismen, welche in einer heterogenen Bevölkerung häufiger auftreten als gedacht und oft unterdiagnostiziert und unterbehandelt bleiben. Zur Diagnose dieser klinischen Entitäten ist neben Risikostratifikation auch das individuelle diagnostische Work-up und eine zielgerichtete Therapie der zugrunde liegenden Erkrankung wichtig.
Es bestehen nach wie vor Wissenslücken zur Pathophysiologie, Prognostik und Therapie, welche in künftigen Studien untersucht werden müssen. Dennoch ist es wichtig, symptomatische Patienten ohne epikardiale Stenose mit oder ohne Ischämienachweis abzuklären und zu behandeln.
Bei allen Formen müssen in jedem Fall neben dem Ausschluss einer koronar-ischämischen Ursache differenzialdiagnostische kardiale Ursachen wie Kardiomyopathien, Takotsubo-Syndrom, Myokarditis, valvuläre und infiltrative Erkrankungen sowie entzündliche und autoimmune Prozesse und extrakardiale Ursachen wie eine Sepsis, Lungenembolie oder Aortendissektion abgeklärt werden (5, 13).
Abkürzungen
ACS Akutes Koronarsyndrom
ANOCA Angina mit nicht obstruktiven Koronararterien / Angina with non-obstructive coronary artery disease
AP Angina pectoris
ASD Atriumseptumdefekt
CCS Chronisches Koronarsyndrom
CFR Koronare Flussreserve
cMRT Kardiales MRT
CMD Koronare mikrovaskuläre Dysfunktion
EKG Elektrokardiogramm
ESC European Society of Cardiology
FFR Fraktionelle Flussreserve
HFpEF Herzinsuffizienz mit erhaltener Auswurffraktion
HIT Heparin-induzierte Thrombozytopenie
iFR Instantaneous Wave-Free Ratio
IMR Index des mikrovaskulären Widerstands
INOCA Ischämie mit nicht obstruktiven Arterien / Ischemia with non-obstructive coronary artery disease
IVUS Intravaskulärer Ultraschall
KHK Koronare Herzerkrankung
RIVA Ramus interventricularis anterior
MINOCA Myokardinfarkt mit nicht obstruktiven Arterien / Myocardial infarction with non-obstructive coronary artery disease
OCT Optische Kohärenztomographie
PFO Persistierendes Foramen ovale
PET-CT Positronen-Emissions-Tomographie-CT
SCAD Spontane Koronararteriendissektion
TEE Transösophageale Echokardiographie
TTE Transthorakale Echokardiographie
UHR-CT Ultrahochauflösende Koronar-Computertomographie
VSA Vasospastische Angina
Herzklinik Hirslanden
Witellikerstrasse 40
8032 Zürich
Odense University Hospital
Odense
– HerzKlinik Hirslanden,
Witellikerstrasse 40
8032 Zürich
– Universität Zürich
Rämistrasse 71
8006 Zürich
christophe.wyss@hirslanden.ch
Die Autorin und Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
Pathophysiologische Mechanismen, welche ANOCA, INOCA und MINOCA zugrunde liegen, sind atherosklerotische Ursachen wie die Plaqueruptur sowie nicht atherosklerotische Ursachen wie epikardialer koronarer Vasospasmus, koronare mikrovaskuläre Dysfunktion (CMD), koronare Embolien und spontane Koronararteriendissektion. In jedem Fall sind eine differenzialdiagnostische Betrachtung und diagnostischer Work-up essenziell.
1. Luengo-Fernandez R, Walli-Attaei M, Gray A, Torbica A, Maggioni AP, Huculeci R, Bairami F, Aboyans V, Timmis AD, Vardas P, Leal J. Economic burden of cardiovascular diseases in the European Union: a population-based cost study. Eur Heart J. 2023 Dec 1;44(45):4752-4767. doi: 10.1093/eurheartj/ehad583. PMID: 37632363; PMCID: PMC10691195.
2. Patel MR, Peterson ED, Dai D, et al. Low diagnostic yield of elective coronary angiography. N Engl J Med. 2010;362:886-895.
3. Vancheri F, Longo G, Vancheri S, Henein M. Coronary Microvascular Dysfunction. J Clin Med. 2020 Sep 6;9(9):2880. doi: 10.3390/jcm9092880. PMID: 32899944; PMCID: PMC7563453.
4. Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation. 2015;131(10):861–70.
5. Kunadian V, Chieffo A, Camici PG, Berry C, Escaned J, Maas A, et al. An EAPCI expert consensus document on ischaemia with non-obstructive coronary arteries in collaboration with European society of cardiology working group on coronary pathophysiology and microcirculation endorsed by coronary vasomotor disorders international study group. Eur Heart J. (2020) 41:3504–20. doi: 10.1093/eurheartj/ehaa503
6. Bairey Merz CN, Pepine CJ, Walsh MN, Fleg JL. Ischemia and no obstructive coronary artery disease (INOCA): developing evidence-based therapies and research agenda for the next decade. Circulation. (2017) 135:1075–92. doi: 10.1161/CIRCULATIONAHA.116.024534
7. Taha YK, Dungan JR, Weaver MT, Xu K, Handberg EM, Pepine CJ, Bairey Merz CN. Symptom Presentation among Women with Suspected Ischemia and No Obstructive Coronary Artery Disease (INOCA). J Clin Med. 2023 Sep 8;12(18):5836. doi: 10.3390/jcm12185836. PMID: 37762777; PMCID: PMC10531826.
8. Herling de Oliveira LL, Correia VM, Nicz PFG, Soares PR, Scudeler TL. MINOCA: One Size Fits All? Probably Not-A Review of Etiology, Investigation, and Treatment. J Clin Med. 2022 Sep 20;11(19):5497. doi: 10.3390/jcm11195497. PMID: 36233366; PMCID: PMC9571924.
9. Perera D, Berry C, Hoole SP UK Coronary Microvascular Dysfunction Working Group, et al. Invasive coronary physiology in patients with angina and non-obstructive coronary artery disease: a consensus document from the coronary microvascular dysfunction workstream of the British Heart Foundation/National Institute for Health Research Partnershi. Heart 2023;109:88-95.
10. Tamis-Holland JE, Jneid H, Reynolds HR, Agewall S, Brilakis ES, et al. Contemporary diagnosis and management of patients with myocardial infarction in the absence of obstructive coronary artery disease: a scientific statement from the American Heart Association. Circulation. (2019) 139:e891–908. doi: 10.1161/CIR.0000000000000670
11. Pelliccia F, Pasceri V, Niccoli G, Tanzilli G, Speciale G, Gaudio C, Crea F, Camici PG. Predictors of Mortality in Myocardial Infarction and Nonobstructed Coronary Arteries: A Systematic Review and Meta-Regression. Am J Med. 2020 Jan;133(1):73-83.e4. doi: 10.1016/j.amjmed.2019.05.048. Epub 2019 Jun 29. PMID: 31260664.
12. Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. (2020) 41:407–77. doi: 10.1093/eurheartj/ehz425
PRAXIS
- Vol. 113
- Ausgabe 10
- November 2024