- «ESC-Guidelines 2024 for the management of elevated blood pressure and hypertension»
Das Paradoxon Hypertonie
Bluthochdruck ist der bedeutendste singuläre Risikofaktor für die Gesamtsterblichkeit weltweit, verantwortlich für etwa 13 % aller Todesfälle (1, 2). Uns stehen über 50 gebräuchliche antihypertensive Substanzen zur Verfügung, welche allesamt generisch sind. Die Tagestherapiekosten belaufen sich für den durchschnittlichen Hypertoniker auf weit unter 1 CHF/Tag. Dennoch erreichen in der Schweiz nur 60.9 % von einem Idealkollektiv, welches diagnostiziert, behandelt und wahrscheinlich therapieadhärent ist, und nur 39.4 % von allen Patienten mit Hypertonie das liberalste aller Blutdruckziele (< 140/90 mmHg) (3). Der niedrige Leidensdruck, komplexe Therapieschemata sowie die häufigen Nebenwirkungen der antihypertensiven Therapie und die damit verbundene niedrige Therapieadhärenz, Schwierigkeiten einer validen Blutdruckmessung und auch die Trägheit der Ärzte, eine notwendige Therapieintensivierung vorzunehmen («physicians` inertia»), sind die grössten Hürden, eine adäquate Blutdruckkontrolle zu erreichen (4, 5).
Die neuen ESC-Guidelines – das Wichtigste für die tägliche Praxis eines Kardiologen
Wie ist Bluthochdruck definiert?
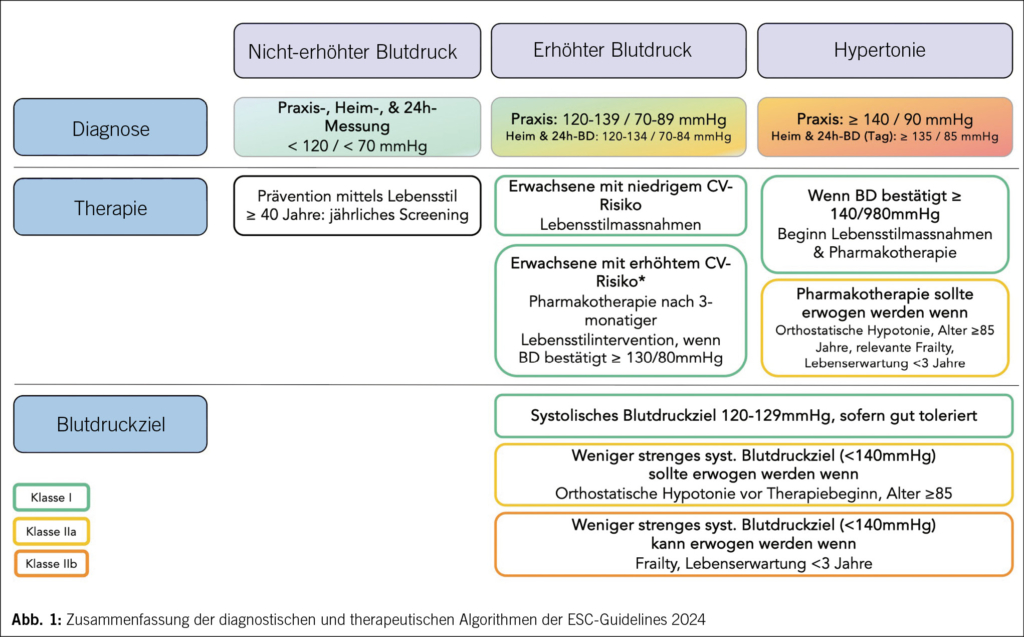
Bei der Benennung der diagnostischen Blutdruckkategorien wurde einerseits zur Kenntnis genommen, dass der Begriff «Normotonie» schwierig zu definieren ist, da das Risiko für kardiovaskuläre Ereignisse bereits ab 90 mmHg systolisch zu steigen beginnt. Bei indigenen Bevölkerungen, die unserem Lebensstil nicht ausgesetzt sind, können auch in späteren Lebensdekaden systolische Blutdruckwerte von 100 mmHg dokumentiert werden (6). Unter anderem hat auch durch den Einbezug von Patienten-Repräsentanten eine Vereinfachung der Klassifizierung stattgefunden, wie in Abb. 1 gezeigt (7).
Screening und Diagnose
Es wird empfohlen, den Blutdruck mit einem validierten und kalibrierten Gerät zu messen, die korrekte Messtechnik durchzusetzen und bei jedem Patienten einen einheitlichen Ansatz für die Blutdruckmessung anzuwenden (Klasse I) (7). Für diagnostische Zwecke wird die ambulante Blutdruckmessung (Heim- oder 24-h-Blutdruckmessung) empfohlen, vor allem, weil damit sowohl die Weisskittelhypertonie als auch die maskierte Hypertonie erkannt werden können. Opportunistisches Screening wird, auch bei Personen mit nicht erhöhtem Blutdruck, alle 3 Jahre empfohlen, bei allen anderen Personen/Patienten sind mindestens jährliche BD-Messungen empfehlenswert.
Nicht pharmakologische Therapie
Lifestyle-Massnahmen wurden bei allen Patienten, inklusive Patienten mit nicht erhöhten Blutdruck, empfohlen. Dazu gehören: eine gesunde Ernährung (z. B. mediterrane Diät), die Kaliumzufuhr zu erhöhen, ein regelmässiges aerobes Training (150 min/Woche), ein stabiler und normaler «body mass index» (BMI 20–25 kg/m2), die Salzaufnahme (< 2 g/Tag) und den Alkoholkonsum (< 100 g/Woche) zu reduzieren und das Rauchen zu stoppen.
Ab wann sollte eine Pharmakotherapie initiiert werden?
Während eine sofortige Einleitung einer Pharmakotherapie bei einem bestätigten Praxis-Blutdruck von ≥ 140/90 mmHg (oder den korrespondierenden Heim- oder 24-h-Blutdruckwerten, Abb. 1) weiterhin indiziert ist, geben die aktuellen Leitlinien viel detaillierter Aufschluss darüber, welche Patientengruppen mit erhöhtem Blutdruck (120–139 mmHg systolisch) eine medikamentöse Therapie erhalten sollten. Da etwa die Hälfte aller Patienten mit manifester Hypertonie nicht von ihrer Erkrankung weiss und der Grossteil der Patienten mit manifester Hypertonie in Europa, inklusive Schweiz, weit entfernt von einer Blutdruckzielerreichung ist, stellt sich die Frage, welche Berufsgruppe sich mit dieser Nischenkategorie in dem geforderten Detail auseinandersetzen soll (8–10). Konkret empfehlen die Leitlinien bei Patienten mit erhöhtem Blutdruck
1) festzustellen, ob eine etablierte kardiovaskuläre Erkrankung, mässige bis schwere Niereninsuffizienz, ein Hypertonie-assoziierter Endorganschaden oder eine familiäre Hypercholesterinämie vorliegen.
2) Falls nicht, sollte der SCORE2 oder der SCORE2-OP («older persons») ausgerechnet werden, zur Abschätzung des 10-Jahres-Risiko für tödliche und nicht tödliche Herz-Kreislauf-Erkrankungen.
3) Liegt dieser bei ≥ 10 %, sollte nach 3-monatiger Lebensstilintervention eine Pharmakotherapie begonnen werden, wenn weiterhin ein bestätigter Blutdruck von ≥ 130/80 mmHg vorliegt.
4) Liegt dieser zwischen 5 und 10 %, sollten entweder weitere «risk modifiers» oder «risk tools» evaluiert werden (Auflistung siehe Legende Abb. 1).
Diese ausgesprochen detaillierte Aufarbeitung von Patienten hat dann eine therapeutische Konsequenz, wenn ein systolischer Blutdruck von 130–139 mmHg oder ein diastolischer Blutdruck von 80–89 mmHg mittels mehrmaliger Praxis-Messung bestätigt werden kann bzw. idealerweise eine Weisskittelhypertonie mittels Heim- oder 24-h-Blutdruckmessung ausgeschlossen wurden. Da die Messschwankungen diesen Korridor oft übersteigen, die Kapazitäten der Allgemeinmedizin in Europa/der Schweiz hierfür limitiert (bzw. inexistent) sind und solche Patienten selten den Weg zu Kardiologen oder Nephrologen mit hypertensiologischem Einschlag finden, erscheint der praktische Impact dieses neuen Algorithmus gering auszufallen.
Welches Blutdruckziel sollte im Fall einer Therapieindikation angestrebt werden?
Die vorherige Auflage der ESC-Guidelines aus dem Jahr 2018 hat enge Blutdruckzielkorridore für verschiedene Komorbiditäten (Diabetes, Niereninsuffizienz, koronare Herzerkrankung, stattgehabter Schlaganfall oder TIA) vorgegeben, stratifiziert nach Alterskategorien. Diese komplexen Grenzwerte in einem Band von 10-mmHg-Breite waren aufgrund der oft darüber hinausgehenden intraindividuellen Messschwankungen und realistischen (individuellen sowie flächendeckenden) Erreichbarkeit mehr akademischer als praktischer Natur (11).
Basierend auf metaanalytischer Evidenz konnte bis zu einem systolischen Blutdruck von 120 mmHg kein Blutdruckziel identifiziert werden, welches nicht mit einer Risikoreduktion für kardiovaskuläre Ereignisse assoziiert wäre (12–14). Eine Kontroverse besteht, bei welchem therapienaivem Ausgangsblutdruck (d.h. absoluten kardiovaskulären Risiko) eine Blutdrucksenkung tatsächlich zu einer relevanten Risikoreduktion beiträgt.
Diesen Umständen geschuldet und auch aufgrund des Einflusses von Patienten-Repräsentanten liegen nun Empfehlungen vor, die in der Praxis umsetzbarer erscheinen.
Es wird das ALARA-Prinzip («as low as reasonably achievable»), welches wir aus dem Strahlenschutz kennen, genannt. Die Leitlinien nennen nun eine Klasse-I-Indikation für ein systolisches Blutdruckziel von 120–129 mmHg, sofern dieses toleriert wird. Eine Blutdrucksenkung < 140 mmHg systolisch sollte jedenfalls angestrebt werden, und es werden klinische Limitationen aufgeführt welche ein darüber hinaus weniger aggressiveres Vorgehen befürworten (Abb. 1). Erfreulicherweise ist durch das Wegfallen der weniger stark evidenzbasierten diastolischen Blutdruckgrenzwerte die Empfehlung noch konziser (7).
Pharmakotherapie
Für die meisten Patienten mit manifester Hypertonie betonen die Leitlinien einmal mehr den Einsatz von Kombinationspräparaten (initial ACE-Hemmer / Angiotensinrezeptorblocker + Kalziumkanalblocker oder Diuretikum, Klasse I), mit Intensivierung auf eine Tripel-Kombination nach 1–3 Monaten (Klasse I), und Betablocker bei relevanter koexistenter Indikation (Angina, nach Myokardinfarkt, systolische Herzinsuffizienz, Frequenzkontrolle).
Betablocker als antihypertensive Erstlinientherapie sind aufgrund der geringen bzw. fehlenden Risikoreduktion für Schlaganfälle nicht empfohlen (15). Gemäss ganz aktueller Daten verbessert eine Betablockertherapie auch unmittelbar nach Myokardinfarkt mit normaler systolischer LV-Funktion sowie in der chronischen Phase nach Myokardinfarkt das Outcome nicht (16, 17).
Es kann nicht oft genug betont werden, dass aus hausärztlicher Sicht die Verschreibung von Kombinationspräparaten die effizienteste Massnahme ist, zur Verbesserung der individuellen und populationsbasierten Blutdruckkontrolle beizutragen. Durch die Reduktion von Polypharmazie und nicht notwendigen mehrfach täglichen Gaben wird die Therapieadhärenz wesentlich verbessert (18).
An dieser Stelle muss auch mit der Misskonzeption aufgeräumt werden, dass eine Dosissteigerung von Erstliniensubstanzen zu einer weiteren Senkung des Blutdrucks führt. Die Dosis-Wirkungs-Beziehung von Erstlinien-Antihypertensiva ist marginal. Eine Vervierfachung der Dosis führt zu einer systolischen Blutdrucksenkung von ca. 2 mmHg (19–21). Deswegen sind Konsultationen zur Blutdruckeinstellung, bei denen mit Dosierungen und Morgen-Abend-Gaben gespielt wird (auch basierend auf den Halbwertszeiten der Präparate, z.B. Amlodipin mit ca. 40 h Halbwertszeit), wirkungslos, folglich sowohl für Patient als auch Arzt letztendlich frustrierend. Wenig überraschend hat eine am ESC-Kongress präsentierte Metaanalyse von 5 Studien, welche Patienten zu einer Morgen- oder Abendgabe aller Antihypertensiva randomisiert haben, keinen Unterschied in kardiovaskulären Outcomes oder hypotensiven Episoden zeigen können (22).
Selbstverständlich ist die Dosismaximierung in der Indikation Herzinsuffizienz ein Eckpfeiler des Therapiekonzeptes.
Therapieresistente Hypertonie
Weiterhin ist diese Entität mit einem Blutdruck ≥ 140/90 mmHg unter Behandlung mit 3 verschiedenen antihypertensiven Substanzklassen inklusive eines Diuretikums definiert. Die häufigste Ursache ist die Pseudoresistenz in bis zu zwei Drittel der Fälle aufgrund von Non-Adhärenz (23). Erfreulicherweise nennen die Leitlinien nebst Urinsampling die beobachtete Medikamenteneinnahme als Massnahme zur Überprüfung der Adhärenz. Aus eigener Erfahrung sollte ein Venenzugang für eine etwaige Katecholamingabe und intensivmedizinische Betreuung zur Verfügung stehen, besonders wenn 5–6 Antihypertensiva auf einmal beobachtet eingenommen werden.
Zu den weiteren häufigsten Ursachen gehört der Hyperaldosteronismus, speziell bei adipösen Patienten. Deshalb sollte als 4. Substanzklasse (nach Dreifachkombination mit ACE-Hemmer / Angiotensinrezeptorblocker, Kalziumkanalantagonist und Diuretikum) Spironolacton oder alternativ Eplerenon hinzugegeben werden (Klasse-IIa-Indikation). Nebst Betablocker und Reservemedikamenten erhielt die renale Denervation nach einem «shared decision making» eine Klasse-IIb-Indikation (7).
Fazit
Etwa die Hälfte aller Personen mit manifester arterieller Hypertonie ist nicht diagnostiziert (4). Zudem wurde weltweit gezeigt, dass selbst Patienten, welche in observierenden oder randomisierten Studien zur Blutdruckkontrolle teilgenommen haben, nach Studienende nur in 40–50 % der Fälle das liberalste aller Blutdruckziele erreichen (3, 9, 10, 24–26). Die aktuellen ESC-Leitlinien erleichtern zwar die Zielerreichung per se nicht, aber die Vereinfachung mancher diagnostischer und therapeutischer Algorithmen ist sicherlich hilfreich bei der Problembewältigung.
Historie:
Manuskript eingegangen: 05.12.2024
Angenommen nach Revision: 20.01.2025
Universitätsklinik für Kardiologie
Inselspital
Freiburgstrasse 20
CH-3010 Bern
Schweiz
miklos.rohla@insel.ch
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Kintscher U. The burden of hypertension. EuroIntervention 2013; 9 Suppl R: R12-5.
2. Chobanian AV. Shattuck Lecture. The hypertension paradox–more uncontrolled disease despite improved therapy. N Engl J Med 2009; 361(9): 878-87.
3. Damianaki A, Wang W, Beaney T, et al. May Measurement Month 2017-2019: results from Switzerland(). Eur Heart J Suppl 2022; 24(Suppl F): F38-F40.
4. Mills KT, Bundy JD, Kelly TN, et al. Global Disparities of Hypertension Prevalence and Control: A Systematic Analysis of Population-Based Studies From 90 Countries. Circulation 2016; 134(6): 441-50.
5. Ogedegbe G. Barriers to optimal hypertension control. J Clin Hypertens (Greenwich) 2008; 10(8): 644-6.
6. Carvalho JJ, Baruzzi RG, Howard PF, et al. Blood pressure in four remote populations in the INTERSALT Study. Hypertension 1989; 14(3): 238-46.
7. McEvoy JW, McCarthy CP, Bruno RM, et al. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J 2024.
8. Weber T, Protogerou A. Assessing blood pressure and arterial aging in pharmacies-New hope for blood pressure control in the community? J Clin Hypertens (Greenwich) 2019; 21(6): 822-4.
9. Rohla M, Haberfeld H, Sinzinger H, et al. Systematic screening for cardiovascular risk at pharmacies. Open Heart 2016; 3(2): e000497.
10. Rohla M, Haberfeld H, Tscharre M, Huber K, Weiss TW. Awareness, treatment, and control of hypertension in Austria: a multicentre cross-sectional study. J Hypertens 2016; 34(7): 1432-40.
11. Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39(33): 3021-104.
12. Blood Pressure Lowering Treatment Trialists C. Pharmacological blood pressure lowering for primary and secondary prevention of cardiovascular disease across different levels of blood pressure: an individual participant-level data meta-analysis. Lancet 2021; 397(10285): 1625-36.
13. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 2. Effects at different baseline and achieved blood pressure levels–overview and meta-analyses of randomized trials. J Hypertens 2014; 32(12): 2296-304.
14. Kreutz R, Brunstrom M, Thomopoulos C, Carlberg B, Mancia G. Do recent meta-analyses truly prove that treatment with blood pressure-lowering drugs is beneficial at any blood pressure value, no matter how low? A critical review. J Hypertens 2022; 40(5): 839-46.
15. Lindholm LH, Carlberg B, Samuelsson O. Should beta blockers remain first choice in the treatment of primary hypertension? A meta-analysis. Lancet 2005; 366(9496): 1545-53.
16. Yndigegn T, Lindahl B, Mars K, et al. Beta-Blockers after Myocardial Infarction and Preserved Ejection Fraction. N Engl J Med 2024; 390(15): 1372-81.
17. Silvain J, Cayla G, Ferrari E, et al. Beta-Blocker Interruption or Continuation after Myocardial Infarction. N Engl J Med 2024.
18. Gupta AK, Arshad S, Poulter NR. Compliance, safety, and effectiveness of fixed-dose combinations of antihypertensive agents: a meta-analysis. Hypertension 2010; 55(2): 399-407.
19. Wald DS, Law M, Morris JK, Bestwick JP, Wald NJ. Combination therapy versus monotherapy in reducing blood pressure: meta-analysis on 11,000 participants from 42 trials. Am J Med 2009; 122(3): 290-300.
20. Law MR, Wald NJ, Morris JK, Jordan RE. Value of low dose combination treatment with blood pressure lowering drugs: analysis of 354 randomised trials. BMJ 2003; 326(7404): 1427.
21. Makani H, Bangalore S, Supariwala A, Romero J, Argulian E, Messerli FH. Antihypertensive efficacy of angiotensin receptor blockers as monotherapy as evaluated by ambulatory blood pressure monitoring: a meta-analysis. Eur Heart J 2014; 35(26): 1732-42.
22. Turgeon R. Meta-analysis of trials of antihypertensive medication bedtime dosing including individual-patient data from BedMed and BedMed-Frail. Presented at ESC Congress 2024.
23. De Geest S, Ruppar T, Berben L, Schonfeld S, Hill MN. Medication non-adherence as a critical factor in the management of presumed resistant hypertension: a narrative review. EuroIntervention 2014; 9(9): 1102-9.
24. Rohla M, Tscharre M, Huber K, Weiss TW. Lowering blood pressure in primary care in Vienna (LOW-BP-VIENNA) : A cluster-randomized trial. Wien Klin Wochenschr 2018; 130(23-24): 698-706.
25. Rohla M, Haberfeld H, Tscharre M, Huber K, Weiss TW. Pharmacist interventions to improve blood pressure control in primary care: a cluster randomised trial. Int J Clin Pharm 2023; 45(1): 126-36.
26. Beaney T, Burrell LM, Castillo RR, et al. May Measurement Month 2018: a pragmatic global screening campaign to raise awareness of blood pressure by the International Society of Hypertension. Eur Heart J 2019; 40(25): 2006-17.
PRAXIS
- Vol. 114
- Ausgabe 2
- Februar 2025






