- Hyperkaliämie bei chronischer Herzinsuffizienz
Die Hyperkaliämie (HK) stellt eine potentiell lebensbedrohliche Elektrolytstörung dar. Die Hauptursachen hierfür sind in einer Verschiebung von Kalium aus den Zellen oder in einer verminderten renalen Kaliumausscheidung zu finden. Diese tritt häufig bei Patienten mit einer Herz-Kreislauf-Erkrankung auf. Das Beibehalten der RAAS-Blockade bei einer Herzinsuffizienz (HI) mit reduzierter LV-EF ist trotz einer Hyperkaliämie essenziell, da ein Absetzen oder eine Dosisreduktion mit einer erhöhten Mortalität einhergehen. Auch bei einer LV-EF ≥ 40 % kann neben einem SGLT2-Hemmer die Gabe eines MRA erwogen werden. Daher kommt der Prävention, Erkennung und Behandlung einer Hyperkaliämie, insbesondere bei kardio-renalen-metabolischen Patienten, eine wichtige Bedeutung zu.
Hyperkalemia (HK) is a potentially life-threatening electrolyte disorder. The main causes are a shift of potassium from the cells or reduced renal excretion of potassium. It is common in patients with cardiovascular disease. Maintaining RAAS blockade in heart failure (HF) with reduced LV EF despite hyperkalemia is essential as discontinuation or dose reduction is associated with increased mortality. The addition of an MRA to an SGLT2 inhibitor may also be considered when LVEF is ≥ 40 %. Therefore, the prevention, detection and treatment of hyperkalemia, especially in cardio-renal-metabolic patients, is of great importance.
Key words: Hyperkalemia, Heart failure, RAASi, MRA, Finerenon, CKD, Diabetes Typ 2, Potassium binder
Einleitung
Eine Hyperkaliämie (HK) > 5.0–5.5 mmol/l resultiert hauptsächlich aus der Verschiebung von Kalium aus den Zellen (Umverteilung) oder aus einer abnormalen renalen Kaliumausscheidung. Die Zellverschiebung (Hyperglykämie bei Diabetes mellitus, Azidose, ausgedehnter Zellzerfall) führt zu einem vorübergehenden Anstieg der Kaliumkonzentration im Plasma, während eine verminderte renale Ausscheidung von Kalium eine anhaltende HK auslöst. Beeinträchtigungen der renalen Kaliumausscheidung können das Ergebnis einer verminderten Natriumabgabe an das distale Nephron, eines verminderten Mineralokortikoid-Spiegels bzw. einer verminderten Mineralokortikoid-Aktivität oder von Anomalien im kortikalen Sammelkanal sein. In einigen Fällen sind alle drei Störungen vorhanden. Auch eine übermäßige Aufnahme von Kalium (gewisse Nahrungsmittel, Ersatzsalze) kann eine HK verursachen, dies jedoch in der Regel bei eingeschränkter Nierenfunktion. Bei einer eGFR > 60 ml/min/1.73m2 ist eine HK ungewöhnlich. Eine Gewebenekrose oder gewisse Medikamente können auch verantwortlich sein (1, 2).
Kalium wird im oberen Dünndarm aufgenommen und befindet sich zu 98 % intrazellulär. Der physiologische Gegenspieler ist Natrium, dieses ist vor allem extrazellulär. Zusammen sind diese essentiell für die Zellphysiologie. Die Kaliumhomöostase ist entscheidend für die Aufrechterhaltung des Ruhepotenzials der Zellmembranen, insbesondere in Herzzellen, und jedes Ungleichgewicht kann zu elektrophysiologischen Störungen einschliesslich maligner Herzrhythmusstörungen führen.
90 % des Kaliums wird renal mit circadianer Variabilität ausgeschieden, 10 % gastrointestinal. Die hormonelle Steuerung findet durch Insulin, Katecholamine und Aldosteron statt (1).
Epidemiologie, Pathophysiologie
In der Allgemeinbevölkerung ist eine HK mit 2–3 % selten. Ihre Inzidenz wird aber unterschätzt, da kein routinemässiges Kalium-Screening durchgeführt wird; selbst bei Hochrisikopatienten. Auch findet man unterschiedliche Kalium-Schwellenwerte für eine HK. Diese ist häufig nur vorübergehend. Prospektive Studien gibt es hierzu allerdings nicht.
Eine RAAS-Blockade (RAASi) mit ACE-H./ARB/ARNI und einem MRA ist bei diversen kardio-renalen Erkrankungen hoch effektiv: diese ist antihypertensiv, kardio- und nephroprotektiv wirksam. Bei Patienten mit einer HI mit reduzierter Ejektionsfraktion (HFrEF) verbessern Renin-Angiotensin-Aldosteron-System-Inhibitoren (RAASis), einschließlich Mineralokortikoid-Rezeptor-Antagonisten (MRAs) die Symptome, verringern das Risiko eines Krankenhausaufenthalts und Todes durch HI und werden von den US-amerikanischen und europäischen Herzinsuffizienz-Richtlinien empfohlen (IA).
Diese protektiven Eigenschaften haben auch SGLT2-Hemmer unabhängig von der LVEF.
Eine potentielle HK als Folge der RAASi stellt häufig ein Problem bei älteren, multimorbiden Patienten mit einer HI dar. Insbesondere tritt diese beim Vorhandensein einer chronischen Niereninsuffizienz (CKD) und/oder eines Diabetes mellitus Typ 2 (T2DM) auf. Die HK ist mit einer erhöhten Mortalität und mit einer erhöhten Hospitalisationsrate assoziiert (1–4). Das höchste Risiko für eine HK findet man bei denjenigen, die am meisten von einer RAAS-Hemmung profitieren:
• In bis zu 40–50 % bei einer CKD über 1 Jahr ab einer eGFR < 30 ml/min/1.73m2, speziell bei denen mit T2DM und unter RAASi; cave: metabolische Azidose
• In bis zu 40 % bei schwerer HI ab einer Spironolactondosis 50mg/die
• In ca. 17 % bei einem T2DM über einen Zeitraum von 3 Jahren
• In ca. 8–17 % bei einer resistenten Hypertonie mit zusätzlicher MRA-Therapie
• Bei Patienten >80 Jahre
• Bei Status nach einer Hyperkaliämie
Patienten mit einer CKD und einer HI haben meist mit wiederkehrenden und zunehmenden HK-Episoden zu rechnen, diese treten dann in kürzeren Intervallen auf. Im schwedischen Herzinsuffizienz-Register hatten bei 43 000 Patienten 51 % eine CKD, 24 % ein T2DM, 13 % eine CKD+T2DM, 21 % ein VHFLi. Eine HK ist ein Risikomarker für ein schlechteres Outcome, unter anderem infolge suboptimaler Verwendung der RAASi-Therapie. Durch eine HK, einen Kreatinin Anstieg, eine Hypotonie, das Alter und Frailty werden die HI-Medikamente nicht Leitlinienkonform eingesetzt (5, www.ukidney.com). Auch in einer aktuellen Arbeit im JACC zeigte eine rezidivierende HK bei einer CKD (G3/G4) bei 6337 älteren Patienten, davon 2129 HI-Patienten, eine erhöhte Gesamtmortalität, mehr kardiovaskuläre Ereignisse und mehr Arrhythmien, dies im Vergleich zu einer Normokaliämie (6).
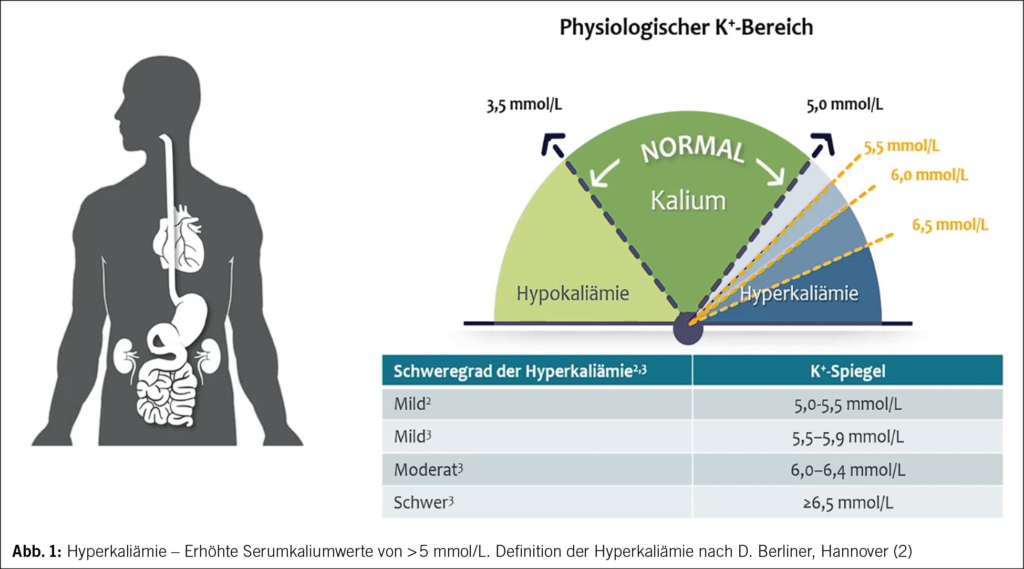
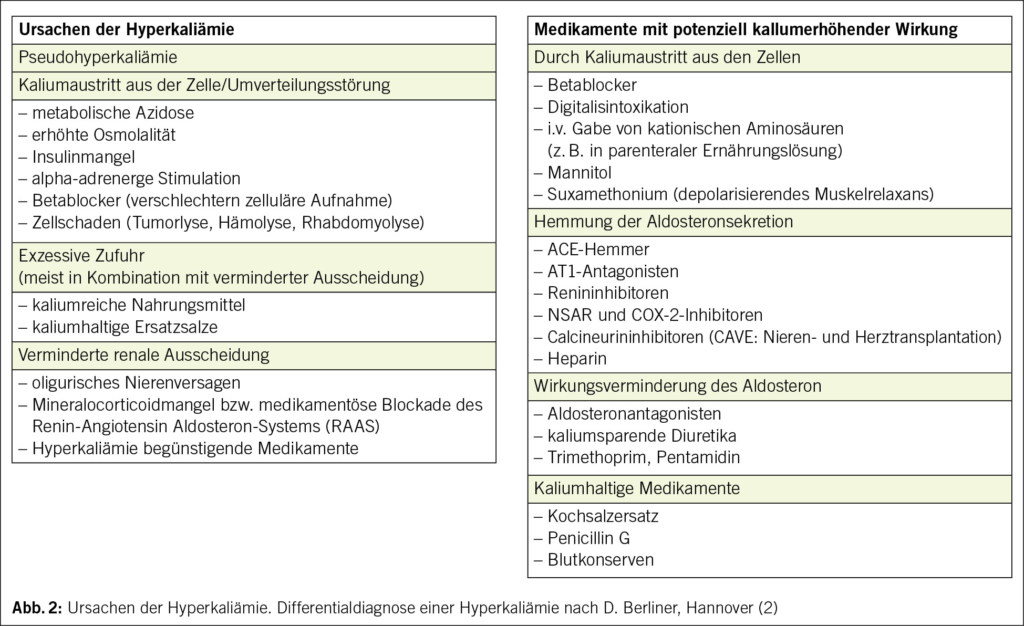
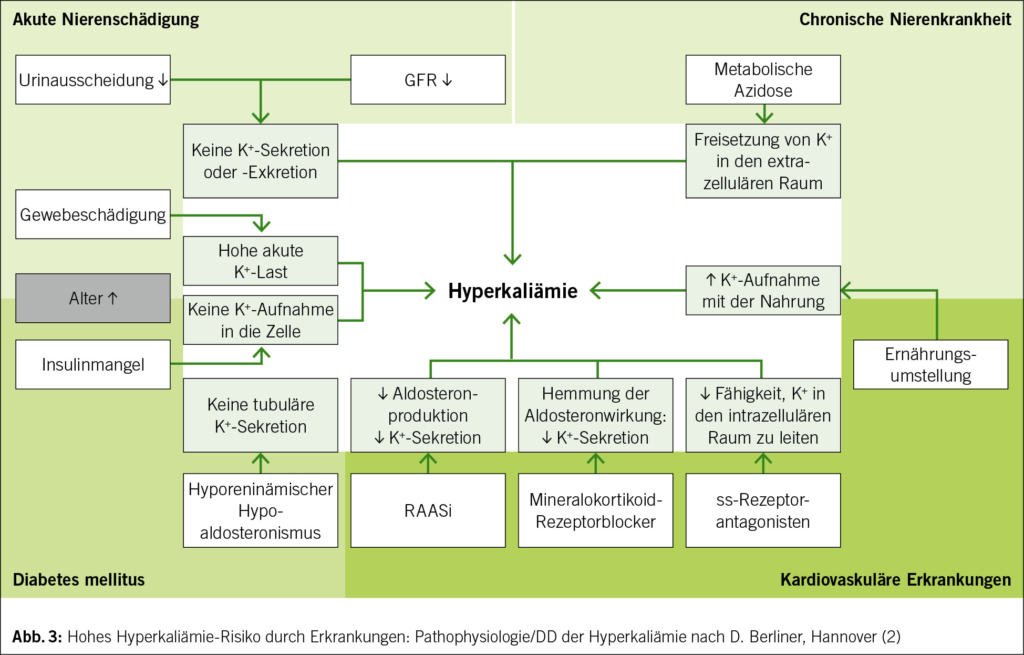
Eine HK wird in verschiedene Schweregrade eingeteilt – vgl. Abb. 1. Ab einem Serumkalium von > 5 mmol/l ist der Wert erhöht. Gefährlich ist ein Wert ≥ 6.0 mmol/l. Bei einem bestätigten Serum-Kalium von ≥ 6.5 mmol/l bedarf es wegen Lebensbedrohung einer Notfallhospitalisation mit EKG-Monitoring und Einleitung spezifischer therapeutischer Massnahmen. Bezüglich Differentialdiagnose und Pathophysiologie einer HK vgl. Abb. 2 und 3 (1–4). Deshalb sollte eine HK frühzeitig erkannt werden.
Klinik
Eine HK verläuft meist asymptomatisch oder symptomarm mit unspezifischen Beschwerden wie Übelkeit, Erbrechen, Diarrhoe, periorale Parästhesien, Ameisenlaufen, Taubheitsgefühl. So wird diese lange nicht erkannt. Es können neuromuskuläre Manifestationen mit Parästhesien und Faszikulationen in den Extremitäten auftreten. Bei einer schweren Hyperkaliämie (> 6.5 mmol/l) sind aufsteigende Lähmungen mit schliesslich schlaffer Tetraplegie der Extremitäten oder ein Ileus möglich. Eine depolarisierende Wirkung mit typischen EKG-Veränderungen tritt bei einer akuten HK (> 6.0–6.4 mmol/l) in bis zu 67.5 % auf. Diese umfassen eine spitze T–Welle (bei ≥ 5.5–6 mmol/l in 31.8 %) in V2–5, eine niedrige Amplitude der P-Welle (> 6–6.5 mmol/l), einer Verlängerung des P-R Intervals und ein breites QRS (26.2 %). Überleitungsstörungen, Bradykardien, Verlust von P mit sinusoidaler Welle, KT, KFli oder Asystolie können bei einem (K+) > 8–9 mmol/l auftreten. Symptome und EKG sind jedoch keine guten Prädiktoren für die Mortalität, es besteht eine niedrige Sensitivität und Spezifität, insbesondere bei Herzkrankheiten. Letale Arrhythmien ohne vorherige EKG-Veränderungen sind möglich. Das EKG kann nicht zum Ausschluss einer Hyperkaliämie verwendet werden. Darum sind regelmässige Kalium- und Kreatinin- Kontrollen, insbesondere bei Medikamenten- und Dosisänderungen, alle 1 bis 2 Wochen entscheidend (1, 2, 7, 8).
Hypokaliämie
Auch eine Hypokaliämie (< 3.5 mmol/L), die häufigste Elektrolytstörung bei einer HI (–50 %), ist gefährlich. Sie führt zu vermehrten ventrikulären und atrialen Arrhythmien und erhöhter kardiovaskulären Mortalität. Ursächlich sind eine Umverteilungsstörung (Verschiebung von Kalium in die Zellen via Katecholamine) sowie renale und nicht renale Verluste (erhöhter Aldosteronspiegel bei HI, Diuretika, Diarrhoe, Erbrechen, starkes Schwitzen u.a.) verantwortlich. Symptome sind hier vor allem Muskelschwäche, Erschöpfung. Im EKG finden sich eine U-Welle, QT-Verlängerung und schlimmstenfalls eine Torsades de pointes. Ein Magnesiummangel ist häufig eine Begleiterscheinung der Hypokaliämie.
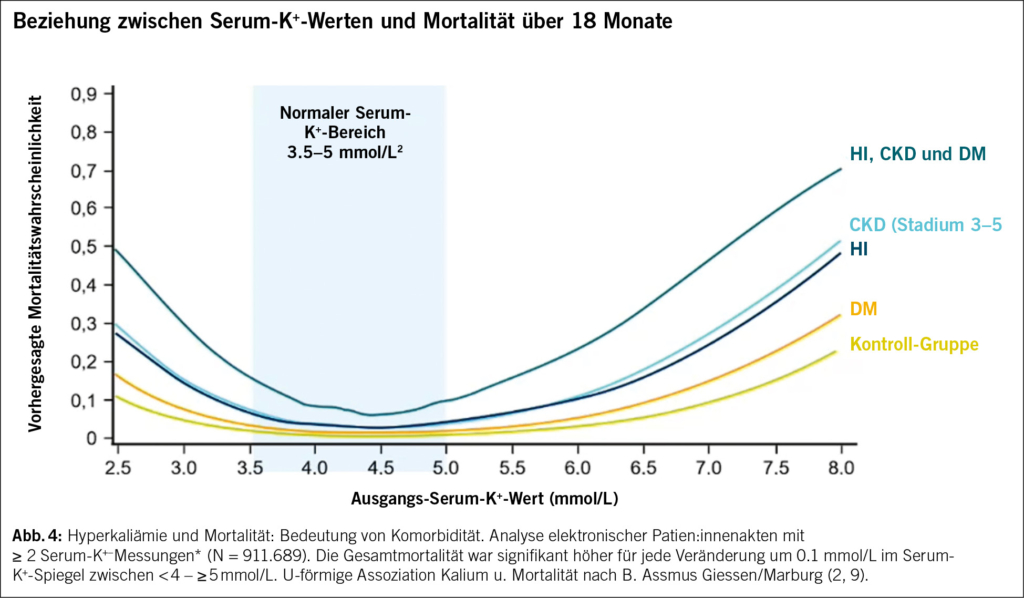
Die Assoziation zwischen Serum-Kalium und dem Mortalitätsrisiko unter Einbezug eines T2DM, einer HI und einer CKD (G3–G5) in Abhängigkeit der Nierenfunktion ist der Abb. 4 zu entnehmen. Man findet eine steigende Mortalitätsrate in Abhängigkeit des Kaliumspiegels und der erwähnten Komorbiditäten (9, 10). Die tiefste Mortalität findet man bei einem Serum-Kalium von 4.0 bis 5.0 mmol/l.
Bedeutung der MRA’s bei der Therapie der chron. HI
Eine HI ist, unabhängig von der LVEF, eine chronisch progrediente Erkrankung mit hoher Mortalität und beinhaltet ein hohes Risiko für (erneute) Ereignisse, insbesondere eine HI-Hospitalisation. Das Ziel ist daher eine Optimierung der RAASi-Therapie solange das Serum-Kalium < 5.0 mmol/l beträgt. Diese Therapie ist kardio- und nephroprotektiv. Bei einer HFrEF führen die «fantastic four» (ACE-H./ARNI, Betablocker, SGLT2-H., MRA) in Kombination zu einer signifikanten Verbesserung der Prognose bez. Gesamtmortalität von 61 % (11). Wichtig ist dabei die korrekte Dosierung, welche in den ESC-Leitlinien durch rasche Auftitrierung erreicht werden soll (12:S.23, Tab. 8; 13, 14).
Die Anwendung von Spironolacton war mit einer geringeren Hypokaliämie und einem verbesserten Überleben bei Patienten mit schwerer HI verbunden, selbst bei mäßiger Hyperkaliämie (2, 15). Gefährliche Hypokaliämien sind unter MRA’s bei einer HI mit Diuretika deutlich
seltener.
Nach der STRONG-HF Studie ist eine intensive Optimierungsstrategie, die nach Hospitalisation wegen akuter HI eine rasche Aufstockung der leitliniengerechten Medikation und eine engmaschige Nachsorge vorsieht, wichtig. Eine solche wurde von den Patienten bereitwillig angenommen, da sie die Symptome reduzierte, die Lebensqualität verbesserte und das Risiko einer Wiederaufnahme wegen HI bereits nach 6 Monaten im Vergleich zur üblichen Versorgung verringerte (16). Diese Wirkung konnte auch in zwei früheren Studien (ATLAS, BIOSTAT-HF) mit ACE-H./ARB oder einem Betablocker in der korrekten Dosierung nachgewiesen werden. Ursächlich für ein Nichtverschreiben resp. eine verzögerte Auftitration der RAASi resp. der MRA’s waren eine Verschlechterung der Nierenfunktion und/oder eine HK. In bis zu 76 % werden diese Medikamente in der Folge nicht wieder eingesetzt (2, 14, 15, 17). Bei einer Dosisreduktion oder einem Absetzen der RAAS-H. kommt es zu mehr als einer Verdoppelung der Mortalität. Daher ist die maximale resp. maximal verträgliche Dosis entscheidend (12, 16, 18).
Unter ARNI ist das Risiko einer moderaten bis schweren HK und eines Kreatinin Anstiegs (PARADIGM-HF) bei einer HFrEF etwas geringer als unter Enalapril. Ebenso unter einer Therapie mit einem SGLT2-Hemmer (12, 13, 19).
Die Verordnung eines MRA’s bei einer HI, bei einem systolischen BD > 100 mmHg, einer eGFR > 30 ml/min/1.73 m2 und einem Serum-Kalium < 5 mmol/l, gilt auf Grund der Guidelines und Expertenmeinungen, bei günstigen klinischen Ergebnissen, neben den drei anderen medikamentösen Säulen als entscheidend. Sie können wie die SGLT2-H. (IA) unabhängig von der LVEF eingesetzt werden, haben aber aktuell bei einer LVEF ≥ 40 % noch eine IIbC-Indikation (12). Bei einer eGFR < 30 ml/min muss auf die Gabe von MRA’s und ARNI verzichtet werden – (geringe Dosis eines Betablockers und ACE-H., SGLT2-H. sofern > 20 ml/min) (20). Bei einer CKD im Stadium G 4–5 liegt ausser für SGLT2-H. gar keine oder nur eine begrenzte Evidenz vor. Hier bedarf es einer interdisziplinären Absprache zwischen Kardiologie und Nephrologie.
Bei einer LVEF < 40 % (HFrEF) werden steroidale MRAs wie Spironolacton oder Eplerenon (IA) verordnet. In der 1999 publizierten RALES Studie ergab sich mit 25mg Spironolacton/die eine Mortalitätsreduktion von 30 % und eine sign. Senkung der HI-Hospitalisationen von 35 % mit deutlicher Verbesserung der HI-Symptomatik (21). Auch in der EMPHASIS-HF mit Eplerenon (–50 mg/die) kam es zu einer Senkung der kardiovaskulären Mortalität und HI-Hospitalisation (–37 %). 11.8 % hatten eine HK mit einem Serum-Kalium > 5.5 mmol/l (22). Eplerenon senkt etwas weniger den BD und macht keine Gynäkomastie vgl. mit Spironolacton.
Bei einer HI mit einer LVEF ≥ 40 % mit leicht reduzierter Ejektionsfraktion (HFmrEF: LVEF 41–49 %) oder mit erhaltener Ejektionsfraktion (HFpEF: LVEF ≥ 50 %) war der therapeutische Stellenwert von MRA’s bis zum ESC 2024, im Gegensatz zu den SGLT2-H., unklar. Die TOPCAT-Studie 2014, mit methodischen Mängeln, war neutral.
Finerenon
Dieser neue nicht-steroidale (ns) MRA scheint einen grösseren Nutzen (hohe Selektivität und Potenz, kürzere t/2, ausgeglichene Gewebsverteilung: Herz u. Nieren) bei weniger NW (keine Metaboliten, keine geschlechtshormonelle NW, weniger HK, noch weniger BD-Effekt) zu haben. Eliminiert via CYP3A4, eGFR sollte zu Beginn > 25 ml/min/1.73 m2 sein.
Finerenon (F), zeigte in der randomisierten, doppelblinden, placebokontrollierten FINEARTS-HF Studie bei 6001 symptomatischen älteren HI-Risiko Patienten bei einer LVEF ≥ 40 % (NYHA II-IV, erhöhtes NT-pro-BNP, strukturelle Herzkrankheit, Diuretika), mit einer eGFR > 25 ml/min/1.73m2 (48 % < 60 ml/min/1.73m2) und einem Serumkalium < 5.0 mmol/l, unter 20–40 mg Finerenon/die (je nach eGFR), eine positive Wirkung mit einer signifikanten Reduktion des primären zusammengesetzten Endpunkts d. h. des kardiovaskulären Todes und der Gesamtzahl sich verschlechternder HI-Ereignisse (HR 0.84) über 32 Monate. Dieser Effekt basierte auf einer signifikanten Reduktion der Verschlechterung der HI um 18 %. Bei der kardiovaskulären Mortalität bestand dagegen kein Unterschied zwischen F. und Placebo. Die Lebensqualität wurde deutlich verbessert. Auch ältere Patienten und alle weiteren Subgruppen profitierten (23).
Diese Ergebnisse unterstützen den Einsatz von ns MRA’s bei Patienten mit HI mit leicht reduzierter oder erhaltener Ejektionsfraktion mit und ohne CKD.
Das Serumkalium sollte zu Beginn einer F.-Therapie ≤ 4.8–5.0 mmol/l betragen. Nicht unerwartet ging die F.-Therapie mit einem erhöhten Risiko für Hyperkaliämie einher. Serum-[K+] > 5.5: 14.3 vs. 6.9 %, [K+] > 6.0: 3.0 vs. 1.4 %. Bei engmaschiger Überwachung und Dosisanpassung blieb der klinische Nutzen von F. im Vergleich zu Placebo jedoch auch bei Patienten erhalten, deren Kaliumspiegel auf über 5.5 mmol/l anstieg. Das Risiko einer HK betrug 2.16. Die mediane Kaliumdifferenz betrug im Verlauf zwischen F. und Placebo 0.2 mmol/l (24). F. reduzierte das Risiko des primären Endpunkts in ähnlicher Weise bei Frauen und Männern mit dieser Form der HI bei ähnlicher Verträglichkeit (25).
Einer der Hauptunterschiede zwischen FINEARTS-HF und vielen anderen HI-Studien ist, dass fast 20 % der Patienten entweder in der Klinik oder kurz nach der Entlassung in die Studie aufgenommen wurden. Der Behandlungsnutzen von F. im Besonderen und vielleicht auch von MRAs im Allgemeinen war bei Patienten, die gerade eingewiesen wurden, mindestens genauso groß ist wie bei Patienten, die weiter von einer HI Verschlechterung entfernt waren (26).
Bei FINEARTS-HF, einer Population mit geringem Risiko für unerwünschte Nierenergebnisse, veränderte F. die Resultate des kombinierten Nierenendpunkts nicht signifikant. F. führte anfänglich zu einer stärkeren Reduktion der eGFR, führte jedoch nicht zu einem signifikanten Unterschied der eGFR im weiteren Verlauf. F. führte jedoch zu einer frühen und anhaltenden Verringerung der Albuminurie und verringerte das Risiko einer neu auftretenden Mikro- und Makroalbuminurie (27). Eine eGFR-Abnahme (≥15 %) zu Beginn einer Therapie (23 %) sollte nicht automatisch zum Absetzen der MRA führen. Ein anfänglicher Rückgang der eGFR war mit einer höheren Inzidenz von HK verbunden. Anders als unter Placebo ist der Nierenfunktionsverlust aber nicht mit einer Verschlechterung der Prognose verbunden. Sofern das Serum-Kalium < 5.5mol/l beträgt kann nach den Autoren weiter vorsichtig auftitriert werden (28). Wichtig bleiben die engmaschigen Kalium und Kreatinin (eGFR) Kontrollen; zu Beginn wöchentlich.
Auch in einer, noch kleinen, Subgruppe von 14 % der Studienteilnehmer mit SGLT2-H. zeigte die MRA-Therapie mit F. ähnliche Effekte wie bei damit nicht vorbehandelten Patienten. Die neuesten Daten deuten darauf hin, dass die kombinierte Anwendung eines SGLT2-H. und eines ns-MRA einen zusätzlichen Schutz vor kardiovaskulären Ereignissen bieten und bei Patienten mit HI, mit und ohne CKD, mit leicht reduzierter oder erhaltener LV-EF eine additive Rolle spielen (23, 29).
Auf Grund einer Metaanalyse der bisherigen vier HI-Studien mit MRA’s verringern steroidale MRAs das Risiko des kardiovaskulären Todes oder einer Hospitalisierung wegen HI bei Patienten mit einer HFrEF und nichtsteroidale MRAs verringern signifikant das Risiko einer HI-Hospitalisation bei Patienten mit HFmrEF oder HFpEF. Das absolute Risiko einer schweren HK ([K+] > 6 mmol/l) war gering – ca. 3 % in der MRA-Behandlungsgruppe (30). HK waren in allen Untergruppen einer Kombinationstherapie mit F. klinisch beherrschbar, mit einem Trend zu weniger behandlungsbedingten Notfall-Hyperkaliämien bei Kombination mit SGLT2-Hemmern.
In den kommenden Jahren werden eine Menge neuer Studiendaten zu den steroidalen und ns MRA’s und den neuen Kombinationstherapien bei der HI publiziert. Erwartet wird, dass es aufgrund der FINEARTS-HF-Ergebnisse in künftigen Leitlinien zu einer Änderung der derzeit noch schwachen Klasse-IIb-Empfehlung von MRA’s bei der chronischen HI mit einer LVEF ≥ 40 % zugunsten einer stärkeren Empfehlung kommen wird.
Aktuell fehlt im Gegensatz zur diabetischen Nephropathie noch die Zulassung für F. (Kerendia®) bei einer HI in der EU und in der Schweiz (Zulassungserweiterung 2026 erwartet).
Bei einer diabetischen Nephropathie (G3/G4) mit Albuminurie konnte mit Finerenon in der FIDELITY Analyse bei 13026 Patienten über 3 Jahre eine renoprotektive Wirkung mit Verminderung der Albuminurie erzielt werden. F. reduziert das Risiko klinischer kardiovaskulärer Folgen (HR 0.86) und das Fortschreiten der Nierenerkrankung (HR 0.77) bei einem breiten Spektrum von Patienten mit CKD und T2DM. Das Screening auf Albuminurie zur Identifizierung von Risikopatienten bei T2DM erleichtert die Verringerung sowohl der kardiovaskulären als auch der renalen Belastung. Eine HK wurde bei 1.7 % nachgewiesen (31). In der FIDELITY-Studie könnte nach einem Abstract am ASN 2024 die gleichzeitige Anwendung von F. mit SGLT2-H. + GLP-1 RA bei Patienten mit T2DM und CKD im Vergleich zu Placebo einen zusätzlichen Nutzen für die Nieren haben – UACR-Reduktion. Es gab auch weniger Patienten mit einem Serum-[K+] > 5.5/> 6 mmol/l in der Behandlungsgruppe mit gleichzeitiger Anwendung von F. mit SGLT2-H. + GLP-1 RA im Vergleich zu F. allein. Bei Patienten mit T2DM waren SGLT2-H. und GLP-1 RA mit einem geringeren Risiko für HK verbunden (32, 33).Aktuelle IA-Indikation von F.: F. wird zusätzlich zu ACE-H. oder ARB bei Personen mit T2DM und einer eGFR > 60 ml/min/1.73m2 mit einer UACR von ≥ 300 mg/g oder einer eGFR 25–60 ml/min/1.73 m2 und UACR ≥ 30 mg/g empfohlen, um das Risiko für kardiovaskuläre Ereignisse und die Progression des Nierenversagens zu reduzieren (34).
Massnahmen bei einer Hyperkaliämie
Bei einem erhöhten Serum-Kalium muss zunächst ein Fehler in der Präanalytik bei 59 Störfaktoren ausgeschlossen werden (Pseudo-HK). Dazu zählen: 1) Hämolyse durch eine zu lange Stauung resp. ein zu starkes Vakuum beim Aspirieren, 2) Verschiebung des Kaliums nach intrazellulär mit Glukose bei einer Raumtemp. von 25–30 Grad Celsius, 3) Zeit bis zur Zentrifuge > 2 h, 4) Vollblut nach der Blutentnahme zu kurz (< 20 Min.) stehen lassen, insbesondere bei Blutverdünnung (1, 2).
Bei Verdacht auf eine Pseudo-HK muss das Labor wiederholt werden, zusätzlich sollte Kreatinin und LDH abgenommen werden, in der Klinik zusätzliche Abnahme einer BGA.
Bei bestätigter HK stellen sich die Fragen nach einer hohen Zufuhr (Kaliumreiche Nahrungsmittel, Kaliumhaltige Ersatzsalze) oder einem Zellzerfall (Rhabdomyolyse, Tumorlyse, Hämolyse), nach einer Umverteilungsstörung wie eine Azidose oder ein Insulinmangel, nach einer Nieren-Eliminationsstörung sowie nach einem Hypoaldosteronismus. Daneben sollte die Begleitmedikation (NSAR, Betablocker, kaliumsparende Diuretika u.a.) und der Volumenstatus überprüft werden – vgl. Abb. 2 und 3.
Bei einem Kalium von 5.1–5.9 mmol/l kommt es bezüglich des weiteren Vorgehens neben einer Beobachtung und Vorbeugung auf verschiedene Umstände an: akute oder chronische HK, Genese der HK inkl. Medikamente, e-GFR, Dialyse, EKG-Veränderungen u.a. Hier primär Einsatz von Diuretika.
Eine weitere Massnahme zur Kaliumreduktion ist, falls eine entsprechende Indikation besteht, der Einsatz eines SGLT2-H., welcher zu einer signifikanten Senkung (HR:0.84) des Serum-Kaliums führt. Dies konnte in einer grossen Metaanalyse von 6 RCT-Studien bei 49 875 Patienten mit T2DM und hohem cv Risiko oder mit einer CKD bei einer schweren Hyperkaliämie ≥ 6.0 mmol/l nachgewiesen werden, dies ohne Risiko für eine Hypokaliämie (35).
Bei einer schweren HK (≥ 6.5 mmol/l) müssen die Medikamente der RAAS-Blockade pausiert werden (2, 12, 20, 36). Zu den akuten Massnahmen in der Klinik zählen:
A) Intrazellulärer Kalium-Shift: Insulin + Glucose intravenös und/oder Salbutamol Inhalation; bei einer Azidose mit einem Bicarbonat <18mmol/l Gabe von NaHCO3; bei einem Kalium ≥6.5mmol/l Kalzium intravenös. Diese Notfalltherapie wirkt nur vorübergehend durch eine Verschiebung von Kalium in die Zelle, es kann daher zu einem Rebound kommen.
B) Elimination von Kalium: je nach Volumenstatus Lasix intravenös oder Gabe von Volumen; bei schwerer CKD/ERD Hämodialyse. Einsatz eines modernen Kaliumbinders.
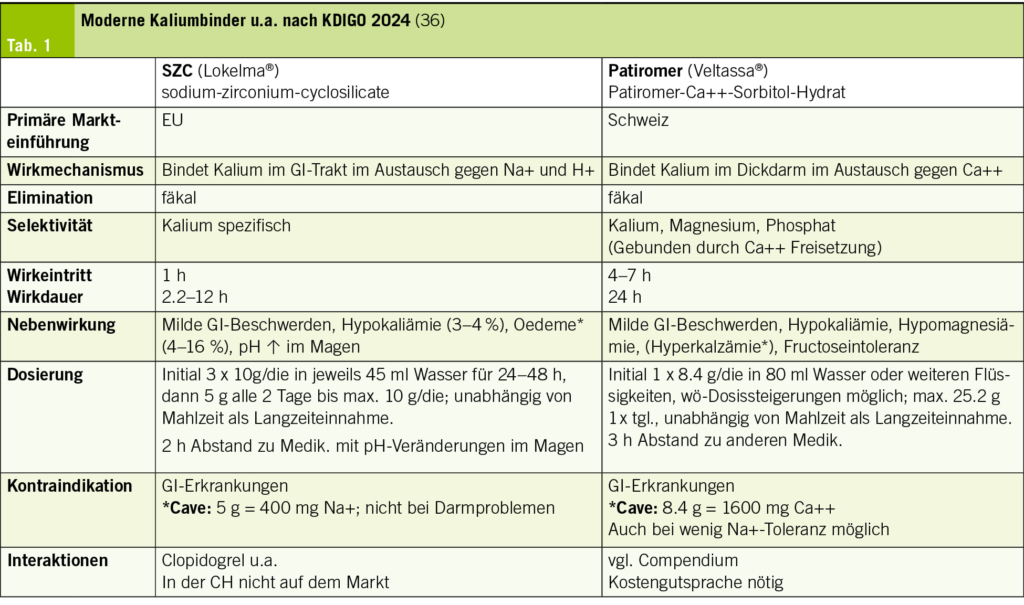
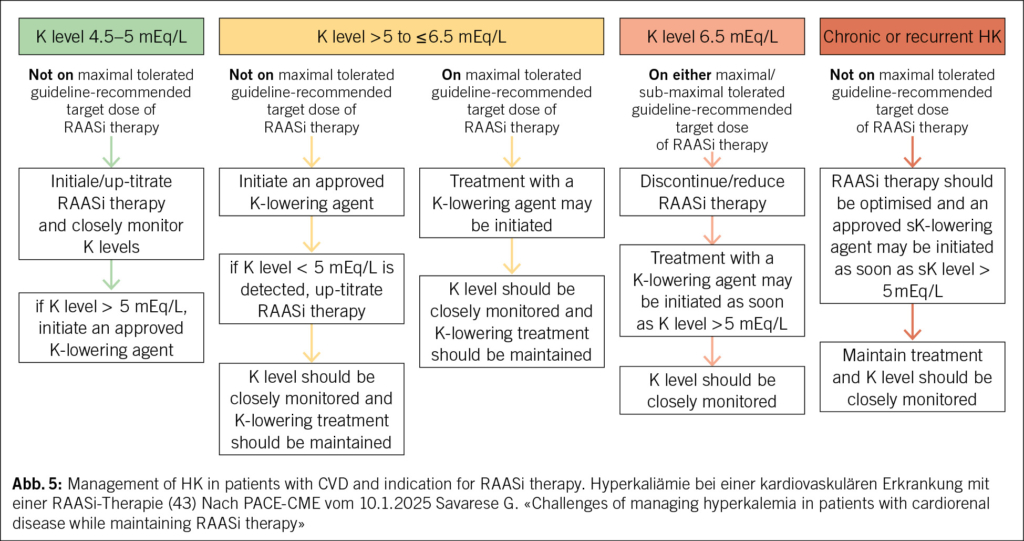
Nach den internationalen Leitlinien (ERC 2025/2021, AHA/ACC/HFSA 2022, KDIGO 2020–2024, ESC-HF 2021/2023) sollte bei einer Hyperkaliämie von ≥ 6.0 mmol/l auch ein moderner Kaliumsenker (Patiromer oder Natrium-Zirkonium-Cyclosilikat SZC) eingesetzt werden (12, 36). Dieser sollte beibehalten werden, es sei denn, eine andere, behandelbare Ätiologie (Medikamente, Nierenfunktion, Flüssigkeitsstatus, BD, Typ der HI) der HK wurde identifiziert und entsprechend therapiert.
Diese beiden Medikamente binden an Kalium im Magen-Darm-Trakt und verringern dessen Resorption. Zu den Kaliumbindern gehörten früher Natrium-PolystyrolSulfonat (Resonium®) und Calcium-Polystyrol-Sulfonat (Sorbisterit®).
Heute sollte das deutlich besser verträgliche Patiromer (Veltassa®), ein nicht resorbierbares Kationenaustauschpolymer oder Natrium-Zirkonium-Cyclosilikat (SZC) verordnet werden. Beide Substanzen erhöhen die Kalium-Ausscheidung im Stuhl und senken den erhöhten Serum-Kaliumspiegel um ca. 1 mmol/l. Sie halten eine Normokaliämie aufrecht und verhindern das Wiederauftreten einer HK. Die Verabreichung eines dieser beiden Medikamente kann bei erhöhtem Serum-Kalium bei einem grossen Teil der Patienten die Einleitung oder Auftitration der RAASi und speziell der MRA in 74–89 % über mehrere Monate ermöglichen (2, 12, 37–40). Eine tägliche Kalium-Kontrolle ist nicht notwendig; die Elektrolyte sollten aber kontrolliert werden.
Diese beiden Medikamente sind hoch effektiv und werden gut toleriert. Langzeitdaten zu NW sind aber nicht vorhanden. Medikamenteninteraktionen sind zu beachten. Patiromer senkt die Bioverfügbarkeit von Ciproxin, Levothyroxin und Metformin. Daher ist der 3 h-Abstand auch zu anderen Medikamenten wichtig.
Zum Patiromer gibt es eine fundierte Studienlage (OPAL-HK, PEARL-HF, AMBER, AMETHYST-DN) bezüglich RAASi, den erwähnten Begleiterkrankungen und HK. In der DIAMOND-Studie konnte dies bei einer HFrEF mit einer aktuellen oder früheren HK unter RAAS-H. mit bis 50 mg MRA (Spironolacton/Eplerenon) und ≥ 50 % der Zieldosis von RAASi über 3 Jahre nachgewiesen werden. Ein Serum-Kalium > 5.5 mmol/l konnte um 37 % gesenkt werden. Bei Patienten mit einer HK vor der RAASi-Optimierung kann die Verwendung von Patiromer vorteilhafter sein, um die MRA-Zieldosis zu erreichen und beizubehalten. Am effektivsten war Patiromer bei einer eGFR < 45 ml/min (37).
Für SZC gibt es auch diverse Studien, aktuell wurde im November 2024 am AHA in einer prospektiven doppelblinden randomisierten multizentrischen Studie (REALIZE-K+) gezeigt, dass durch die Verwendung von SCZ (10 g/die) eine MRA-Therapie bei 203 Patienten mit einer HFrEF (LVEF ≤ 40 %, NYHA II–IV) optimiert (≥ 25 mg Spironolacton) werden konnte. Notfallmassnahmen wegen einer schweren Hyperkaliämie waren nicht notwendig. Eine leitliniengemässe HFrEF-Therapie inkl. MRA konnte deutlich häufiger eingesetzt werden (12 Suppl., 38–40).
Ein Problem ist der hohe Preis der modernen Kaliumsenker. Veltassa® bedarf in der Schweiz einer Kostengutsprache, diese muss vom Kardiologen oder Nephrologen verordnet werden. Lokelma® ist im Gegensatz zur EU auf dem Schweizer Markt nicht erhältlich.
Aus Analysen von grossen Krankenkassendaten bei 46 588 Patienten von 2019–2022 aus Deutschland (RWE-Studie) mit einer HI und HK, wissen wir, dass die Umsetzung der Leitlinienempfehlungen bezüglich eines Hyperkaliämie-Managements bez. Kaliumbinder (3.2–11 %, moderner KB in nur 1.3 %) suboptimal ist. Ein häufiges Problem sind dabei die Rezidive mit knapp 45 %, dabei wurde nur bei 8.5 % ein Kaliumbinder eingesetzt. Meist wurde eine Therapie nur bis zur Normalisierung des Serum-Kaliums durchgeführt, sollte doch eine Erhaltungstherapie verordnet werden. Mit modernen Kaliumbinder können Anteil und Kosten einer Hospitalisierung reduziert werden (2).
Eine weitere therapeutische Option ist die Aufnahme einer kaliumsparenden Ernährung. Hierzu sollten Fertigprodukte/Kalium aus Lebensmittelzusatzstoffen möglichst vermieden werden, da diese eine hohe Kaliumabsorption von bis zu 90 % bewirken. Fleischprodukte haben ebenfalls eine hohe Resorptionsrate von 70–90 % mit einer Ansäuerung und dadurch zusätzlich erhöhtem Serum-Kalium. Im Gegensatz zu früher sind heute Früchte und Gemüse erlaubt. Pflanzliche Nahrungsprodukte haben für Kalium lediglich eine Absorptionsrate von 50–60 %, zugleich eine alkalisierende Wirkung. Die enthaltenen Kohlenhydrate führen zu einem Kalium–Shift in die Zelle. Diese Mechanismen wirken somit günstig (36, 41, 42). Obstsäfte sind hingegen zu vermeiden.
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
- Eine Hyperkaliämie (HK) mit einem Serum-Kalium ≥ 5 mmol/l tritt bei Patienten mit einer Herz-Kreislauf-Erkrankung und einer korrekten Therapie häufig auf. Die Folgen können schwerwiegend und lebensbedrohlich sein. Diagnose, Prävention und Behandlung haben daher eine grosse Bedeutung um die Fortführung der RAASi-Therapie zu ermöglichen.
- Bei einer HI ist die Therapie mit einer RAAS-Blockade (ACE-H./ARB/ARNI und einem MRA) bei max. verträglicher und zugelassener Dosis essenziell; ein Absetzen oder eine Dosisreduktion wegen einer HK oder einem Kreatinin Anstieg geht bei Patienten mit einer HI oder einer CKD mit einer mehr als 2-fach erhöhten Mortalität einher und die HI-Hospitalisationen steigen.
- SGLT2-H. und MRA’s werden heute bei der Therapie einer HI unabhängig von der LV-EF verwendet. Beträgt diese < 40 %, so wird Spironolacton oder Eplerenon eingesetzt. Bei einer LV-EF ≥ 40 % das ns MRA Finerenon. Diese Medikamente senken das Risiko einer HI-Hospitalisation, verbessern die Lebensqualität und sind nephroprotektiv. Das Serumkalium wird auch bei F. erhöht, der Benefit ist grösser als das Risiko bei den meisten Patienten mit einer HI.
- Finerenon ist heute bei einer diabetischen Nephropathie, noch nicht aber bei der HI (HFmrEF/HFpEF) zugelassen. Für F. besteht eine potentielle Rolle beim kardio-renalen-metabolischen Syndrom.
- Die aktuellen ESC-, ACC/AHA- und KDIGO-Guidelines empfehlen bei einer chronischen HI mit HK (> 5.5 mmol/l) den Einsatz eines modernen Kaliumbinders zur Dosis Optimierung der RAASi inkl. MRA-Therapie. Indiziert ist dieser auch bei einer HI mit HK mit weiteren Begleitkrankheiten wie: CKD, T2DM, Hypertonie. Vorgängig Versuch durch Gabe eines SGLT2-H. und/oder evt. eines GLP-1 RA. Bei einer schweren HK erst nach Versagen aller diskutierten Massnahmen Reduktion oder Absetzen von RAASi.
1. Palmer BF, Clegg DJ. Diagnose und Behandlung der Hyperkaliämie. Cleve Clin J Med. 2017; 84 (12):934-942. DOI: 10.3949/CCJM.84A.17056. PMID: 29244647.
2. Cardiomed Live Vortrag «Hyperkaliämie im Spektrum der Kardiologie» vom 02.12.2024: Prof. Dres: M.Boehm, Homburg/ D. Berliner, Hannover/ B. Assmus, Giessen u. Marburg/ I. Emrich Saarland
3. Gilbertson D. et al., Nephrol Dial Transplant 2018;33 (suppl 1) Abs SP 324
4. Humphrey T. et al., How common is hyperkalaemia? A systematic review and meta-analysis of the prevalence and incidence of hyperkalaemia reported in observational studies, Clinical Kidney J 2021,15(4):727-737
5. Thomsen RW et al. Elevated potassium levels in patients with chronic kidney disease: occurrence, risk factors and clinical outcomes-a Danish population-based cohort study. Nephrol Dial Transplant. 2018 Sep 1;33(9):1610-1620. doi: 10.1093/ndt/gfx312.
6. Bakris G. et al., Effects of recurrent hyperkalaemia on cardiovascular outcomes and mortality JACC Adv. 2024 Nov, 3 (11) 101331
7. Clase CM et al., Potassium homeostasis and management of dyskalemia in kidney diseases: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference, Kidney Int.2020;97:42-61
8. Montague BT. et al., Retrospective review of the frequency of ECG changes in hyperkalemia, Clin J Am Soc Nephrol. 2008;3(2):324-330
9. Collins AJ. Et al., Association of Serum Potassium with All-Cause Mortality in Patients with and without Heart Failure, Chronic Kidney Disease, and/or Diabetes, Am J Nephrol. 2017; 46(3):213-221
10. Einhorn LM. et al., The frequency of hyperkalaemia and its significance in chronic kidney disease, Arch Int Med 2009;169(12):1156-1162
11. Tromp et al., A Systematic Review and Network Meta-Analysis of PharmacologicalTreatment of Heart Failure With Reduced Ejection Fraction, JACC HI 2022,10:73-84
12. Mc Donagh TA. et al., 2021ESCGuidelinesfor the diagnosis and treatment of acute and chronic heart failure Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC), European Heart Journal (2021) 42: 3599-3726
13. Heidenreich PA. et al., 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines Circulation 2022;145(18):e895-e1032
14. Fonarow GC et al., Rapid and Intensive Guideline-Directed Medical Therapy for Heart Failure, JACC 2023,81 (22):2145-2148
15. Vardeny O et al., Incidence, predictors, and outcomes related to hypo- and hyperkalemia in patients with severe heart failure treated with a mineralocorticoid receptor antagonist. Circ Heart Fail. 2014 Jul;7(4):573-579
16. Mebazaa A. et al., Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial, Lancet 2022 Dec 3;400 (10367):1938-1952
17. Komajda M. et al., Physicians‘ adherence to guideline-recommended medications in heart failure with reduced ejection fraction: data from the QUALIFY global survey, eur j heart fail 2016, 18:514-522
18. Epstein M. et al., Evaluation of the treatment gap between clinical guidelines and the utilization of renin-angiotensin-aldosterone system inhibitors, Am J Manag Care, 2015 Sep.;21(11 Suppl): S212-20.
19. Mc Murray J.J.V. et al., Angiotensin–Neprilysin Inhibition versus Enalapril in Heart Failure, PARADIGM-HF, N Engl J Med 2014;371:993-1004
20. Mullens W. et al., Renal effects of guideline-directed medical therapies in heart failure: a consensus document from the Heart Failure Association of the European Society of Cardiology Eur J Heart Fail 2022 Apr;24(4):603-619. doi: 10.1002/ejhf.2471. Epub 2022 Mar 27
21. B. Pitt et al., The Effect of Spironolactone on Morbidity and Mortality in Patients with Severe Heart Failure, N Engl J Med 1999;341:709-717
22. Zannad F. et al., Eplerenone in patients with systolic heart failure and mild symptoms, EMPHASIS-HF, N Engl J Med 2011 Jan 6;364(1):11-21
23. Salomo S.D. et al., Finerenone in Heart Failure with Mildly Reduced or Preserved Ejection Fraction, FINEARTS-HF, N Engl J Med 2024 September 1, 2024, 391:1475-1485, DOI: 10.1056/NEJMoa2407107
24. Vardeny O. et al., Finerenone, Serum Potassium, and Clinical Outcomes in Heart Failure With Mildly Reduced or Preserved Ejection Fraction, JAMA Cardiol 2025 Jan 1;10(1):42-48. doi: 10.1001/jamacardio.2024.4539
25. M. Chimura et al., Finerenone in Women and Men With Heart Failure With Mildly Reduced or Preserved Ejection Fraction: A Secondary Analysis of the FINEARTS-HF Randomized Clinical Trial, JAMA Cardiol 2025 Jan 1;10(1):59-70. doi: 10.1001/jamacardio.2024.4613
26. Desai A.S. et al., Finerenone in Patients With a Recent Worsening Heart Failure Event The FINEARTS-HF Trial, JACC 2025, 85(2): 106-116
27. Causland Mc F.R. et al., Finerenone and renal outcomes in patients with heart failure: the FINEARTS-HF study, JACC. 2025 Januar, 85 (2) 159–168 DOI: 10.1016/J.JACC.2024.10.091. Epub 25. Oktober 2024
28. Matsumoto S et al. Initial Decline in Glomerular Filtration Rate With Finerenone in HFmrEF/HFpEF. J Am Coll Cardiol 2025;85:173–185; https://doi.org/10.1016/j.jacc.2024.11.020
29. Vaduganathan M. et al., Effects of the Nonsteroidal MRA Finerenone With and Without Concomitant SGLT2 Inhibitor Use in Heart Failure, Circulation 2025;151:149–158. DOI: 10.1161/CIRCULATIONAHA.124.072055
30. Jhund P.S. et al., Mineralocorticoid receptor antagonists in heart failure: an individual patient level, meta-analysis, Lancet 2024; 404( 10458) :1119-1131
31. Agarwal R et al., Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis, Eur Heart J 2022 Feb. 10;43(6):474-484
32. Singh A. et al., ASN Kidney Week 2024, Abstract TH-OR46
33. Fu E.L. et al., SGLT-2 inhibitors, GLP-1 receptor agonists and DPP-4 inhibitors and risk of hyperkalaemia among people with type 2 diabetes in clinical practice: population based cohort study, BMJ 2024; 385:e078483
34. Marx-Schütt K. et al., Konsensuspapier zum Management kardiovasulärer Erkrankungen bei chronischer Nierenkrankheit, Konsensuspapier DGK u. DGfN, Die Kardiologie 2025,https:// doi.org/10.1007/s12181-024-00716-6
35. Neuen BL. et al., Sodium-Glucose Cotransporter 2 Inhibitors and Risk of Hyperkalemia in People With Type 2 Diabetes: A Meta-Analysis of Individual Participant Data From Randomized, Controlled Trials, Circulation 2022,145, (19): 1460-1470
36. KDIGO 2024, CLINICAL PRACTICE GUIDELINE FOR THE EVALUATION AND MANAGEMENT OF CHRONIC KIDNEY DISEASE, Kidney International (2024) 105 (Suppl 4S), S117–S314
37. Butler J. et al., Patiromer for the management of hyperkalemia in heart failure with reduced ejection fraction: the DIAMOND trial, Eur Heart J, 43, 41, 1 November 2022: 4362–4373
38. Kosiborod MN. et al., Sodium Zirconium Cyclosilicate for Management of Hyperkalemia During Spironolactone Optimization in Patients with Heart Failure, J Am Coll Cardiol. 2024 Nov 15: S0735-1097(24)10430
39. Rastogi A, et al. ZORA: Maintained RAASi Therapy with Sodium Zirconium Cyclosilicate Following a Hyperkalaemia Episode: A Multi-Country Cohort Study, presented at American Society of Nephrology Kidney Week, 1-5th November 2023, Philadelphia, PA, USA
40. Rastogi A, et al. ZORA: Association between reduced RAASi therapy and progression to ESKD in hyperkalaemic CKD patients, presented at American Society of Nephrology Kidney Week, 1-5th November 2023, Philadelphia, PA, USA
41. Picard K et al., Handouts for Low-Potassium Diets Disproportionately Restrict Fruits and Vegetables, J Ren Nutr. 2021, 31 (2):210-214
der informierte @rzt
- Vol. 15
- Ausgabe 2
- Februar 2025








