- Phosphatidylethanol in der Diagnostik und Therapie von alkoholbezogenen Störungen
Einleitung
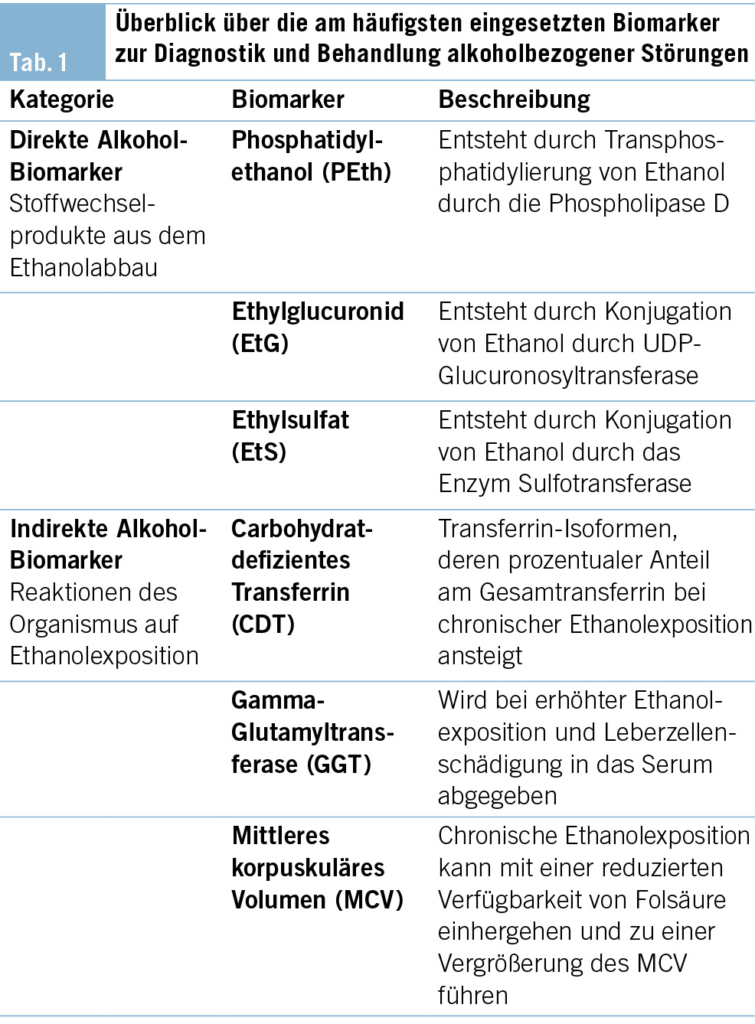
Unter ungesundem Alkoholkonsum versteht man in der Regel die Menge, welche körperliche oder psychosoziale Schäden verursacht. Dieser reicht von übermässigem Trinken, gelegentlichem starken Trinken bis hin zu einem schädlichen Gebrauch und einer Abhängigkeit von Alkohol (1). Letztere werden gemäss dem Klassifikationssystem der ICD-11 den «Störungen durch Alkohol» im Kapitel «Störungen durch Substanzgebrauch oder Verhaltenssüchte» zugeordnet (2). In den letzten Jahren gibt es zudem eine neue Evidenz für eine Dosis-Wirkungs-Beziehung zwischen konsumierter Alkoholmenge, schädlicher Wirkung und Mortalität (3). Im Gegensatz zu vielen anderen psychiatrischen Störungsbildern ist der Einsatz von Biomarkern bei Substanzkonsumstörungen (z. B. Urintest auf Drogen) und insbesondere bei den Alkoholkonsumstörungen in Diagnostik und Behandlung im klinischen Alltag bereits etabliert (4). Bei den Alkoholkonsumstörungen werden Biomarker in der klinischen Routine häufig zu diagnostischen Zwecken zu Beginn der Behandlung eingesetzt, jedoch seltener systematisch zur Verbesserung einer Therapie genutzt (5). Alkoholbezogene Biomarker können nach unterschiedlichen Kriterien eingeteilt werden: Einerseits können sie über die Ausprägung einzelner Konsumereignisse Informationen geben und vereinfachen eine Abschätzung der konsumierten Alkoholmenge (z. B. Ethylglukuronid [EtG] im Urin). Andererseits erlaubt der Einsatz von alkoholbezogenen Biomarkern auch eine Einschätzung des Alkohol(über-)konsums im längeren Verlauf (z. B. Carbohydrat-defizientes Transferrin [CDT] im Blutserum). Eine wichtige Unterscheidung ist diejenige, ob es sich um einen direkten oder indirekten alkoholbezogenen Biomarker handelt (6). Bei Letzterem werden biologische Messwerte erhoben, die auf eine unmittelbare Gewebsschädigung (z. B. erhöhte Nachweisbarkeit von Gamma-Glutamyltransferase [GGT] im Serum) oder sekundäre Abbauprodukte von Ethanol (z. B. CDT) durch den Alkoholkonsum schliessen lassen. Bei den direkten Biomarkern hingegen werden ethanolspezifische Abbauprodukte, die nach dem Konsum von Alkohol bei der Metabolisierung im Körper entstehen, nachgewiesen (z. B. EtG im Urin, Phosphatidylethanol [PEth] im Blut). Direkte alkoholbezogene Biomarker weisen auch eine deutlich höhere Spezifität für den Nachweis von Alkoholkonsum auf und werden daher häufig bei forensischen Fragestellungen eingesetzt (z. B. Überprüfung der Fahreignung) (7, 8). Ein Überblick über die am weitesten in der Diagnostik der Alkoholkonsumstörung verbreiteten Biomarker findet sich in der Tab. 1.
Im folgenden Artikel geben wir zunächst einen kurzen Überblick über klinisch relevante direkte Alkohol-Biomarker in Diagnostik und Therapie von alkoholbezogenen Störungen. Im Anschluss möchten wir vertieft auf die Anwendung von PEth in Diagnostik und Therapie von Alkoholkonsumstörungen eingehen. Aufgrund der hohen Spezifität und Sensitivität von PEth sowie der einfachen Handhabung erscheint dieser Biomarker besonders geeignet für den klinischen Einsatz.
Direkte Biomarker im Vergleich
Ethylglucuronid (EtG)
EtG entsteht beim Abbau von Ethanol durch Glucuronidierung durch das katalysierende Enzym UDP-Glucuronosyl-Transferase. Es ist ein Nebenprodukt des Ethanolabbaus, von dem der höhere Anteil zu Acetaldehyd oxidiert wird. EtG wird bereits nach geringen Konsummengen von Alkohol erzeugt und verteilt sich im gesamten Organismus. Klinisch kann es im Urin, Serum oder in den Haaren nachgewiesen werden (9–11).
Phosphatidylethanol (PEth)
PEth ist ein Lipidmetabolit, der beim Abbau von Ethanol entsteht. Es wird bereits bei geringen Konzentrationen von Ethanol im Blut durch das Enzym Phospholipase D gebildet und in den Zellmembranen der Erythrozyten akkumuliert. Insgesamt gibt es mehr als 50 PEth-Varianten, von denen sich die PEth-Analoga 16:0/18:1 und 16:0/18:2 als Standardmarker durchgesetzt haben. PEth kann heutzutage durch kapillare Blutentnahme als Dried Blood Spot (DBS) (Trockenblutprobe) abgenommen und gelagert werden, was die klinische Handhabung sehr vereinfacht (12, 13). Weiterhin können neu entwickelte volumetrische DBS-Abnahmesysteme (DBS-V) vom Patienten selbst oder z. B. in einer Apotheke oder Arztpraxis zur Probengewinnung von Kapillarblut verwendet werden (14). Ein Überblick über Vor- und Nachteile von PEth und EtG findet sich in der Tab. 2.
Klinische Befunde zum Einsatz von PEth
Wie im vorherigen Abschnitt beschrieben, kann die Entstehung und Lagerung von PEth im menschlichen Körper wissenschaftlich inzwischen gut erklärt werden. Weniger Klarheit herrscht dagegen bezüglich der Elimination und Interpretation von PEth-Konzentrationen im Blut (15). So ergaben Trinkversuche bei freiwilligen Probanden mit einem PEth-Wert unterhalb der klinischen Nachweisgrenze (< 20 ng/ml), dass ein durchschnittlicher Alkoholkonsum von etwa 78 Gramm Alkohol pro Tag über 5 Tage (entspricht etwa 6 Stangen [à 0.3 l] Bier) zu PEth-Werten im Blut von 74 bis 237 ng/ml führten (16). Die Eliminationszeit, bis PEth im Blut unter die Nachweisgrenze abgebaut wurde, variierte hingegen zwischen den einzelnen Probanden des Versuchs erheblich (zwischen drei und sechs Tagen). PEth-Werte im Blut von Patienten mit regelmässig exzessivem Alkoholkonsum variieren ebenfalls erheblich und lassen nur eingeschränkt Rückschlüsse auf vorangegangene kumulative Trinkmengen zu (17). So fanden sich in einer Kohorte von Patienten, die zu Beginn eines stationären Alkoholentzugs untersucht wurden, grosse Unterschiede bei den PEth-Werten mit einer Bandbreite von 20 bis zu mehr als 2500 ng/ml ohne signifikante Korrelation mit den angegebenen Trinkmengen. Auch die Zeit, bis definierte PEth-Cut-off-Werte erreicht wurden, variierten zwischen einer und mehr als sechs Wochen, abhängig von der PEth-Konzentration zu Beginn einer Abstinenz (18). In einer anderen Studie wurde bei alkoholabhängigen Patienten die tägliche Konsummenge Alkohol über einen Zeitraum von 14 Tagen erhoben. In der anschliessenden Messung der Biomarker wies PEth im Vergleich zu CDT und GGT die höchste Sensitivität (99 %) sowie die höchste Korrelation zur Trinkmenge auf (19).
Um nach längerer Abstinenz und negativen PEth-Konzentrationen erneut eine PEth-Konzentration im Blut über dem Grenzwert von 20 ng/ml zu erreichen, muss einmalig eine Mindesttrinkmenge aufgenommen werden, die zu einer Blutalkoholkonzentration von ca. 0.6 bis 0.75 g/kg (Promille) führt. Dies konnte in Trinkversuchen mit kleinen Trinkmengen gezeigt werden, wobei dann die Nachweisbarkeit bei ca. 1–2 Tagen lag (14, 20).
Aufnahme von Spuren von Alkohol (z. B. durch Einatmen bei der Händedesinfektion oder Ähnliches) sind deshalb eher unwahrscheinlich als Ursache für einen positiven PEth-Wert.
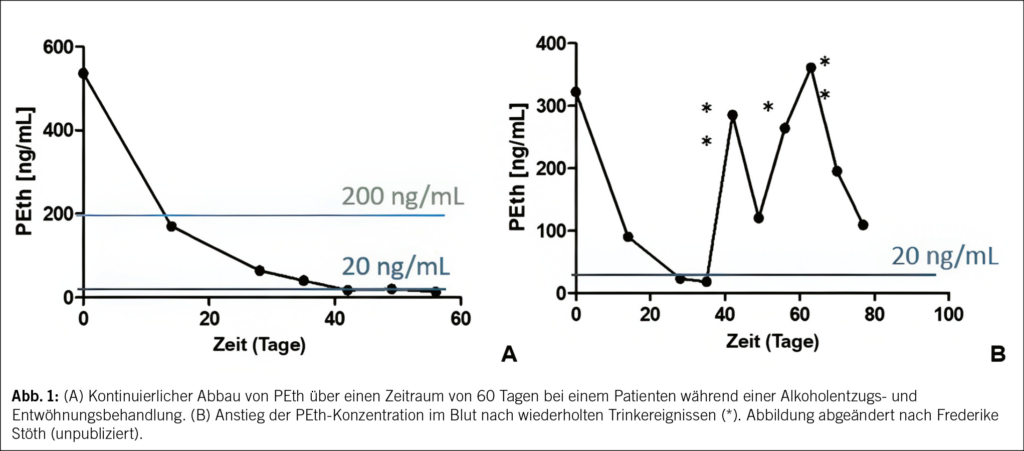
Um eine Abstinenz zu monitoren, kann eine Verlaufskontrolle der PEth-Konzentration im Blut im Abstand von ca. 3–4 Wochen mittels Kapillarblutanalyse genutzt werden.
In der Abbildung werden beispielhafte Verläufe von PEth- Konzentrationen im Blut bei Abstinenz und bei Trinkereignissen gezeigt (Abb. 1).
Inzwischen ist auch eine App verfügbar, mit der gegebenenfalls eine Abstinenz bestätigt oder bei auffälligem PEth-Konzentrationsverlauf angezweifelt werden kann (https://peth.shinyapps.io/Kathleen/). Das zugrunde liegende Kinetikmodell wurde in einer Studie in Belgien anhand von ca. 800 Versuchspersonen entwickelt. Voraussetzung ist dabei, dass wiederholt quantitative Analysen mittels LC-MS/MS im Abstand von ca. 3–4 Wochen durchgeführt werden, da PEth eine terminale Eliminationshalbwertszeit von bis zu 14 Tagen aufweist (21).
Obwohl PEth eine hohe Spezifität und Sensitivität für Ethanol aufweist, kann die Bestimmung eines Biomarkers allein nicht die klinische Diagnose einer Abhängigkeit oder eines schädlichen Gebrauchs ersetzen. Das bekannteste Instrument hierfür ist der von der WHO empfohlene Alcohol Use Disorder Identification Test (AUDIT), der weltweit und nicht nur in Studien als Standard eingesetzt werden sollte. Die Ergebnisse mehrerer klinischer Studien, die den Zusammenhang von (indirekten) Biomarkern, PEth und AUDIT-Scores untersucht haben, kommen daher zu dem Schluss, dass der Goldstandard in der Diagnostik von Alkoholkonsumstörungen in der komplementären Information von PEth und einem klinischen Test liegen sollte, da sich subjektive Angaben zu Trinkmengen in der Regel als unzuverlässig erwiesen haben (22–24).
Da die Erforschung und der Einsatz von PEth in der klinischen Medizin stetig zugenommen haben, konnten in den letzten Jahren in einer internationalen wissenschaftlichen Konsensusgruppe gültige Referenzwerte für den Einsatz von PEth in Diagnostik und Therapie etabliert werden (Tab. 3) (25).
Diese erlauben es jetzt, valide klinische Einschätzungen des Alkoholkonsums im Langzeitverlauf abzugeben, vergleichbar etwa mit dem Einsatz von HbA1C in der Behandlung und Monitorisierung bei der Therapie eines Diabetes mellitus in der Inneren Medizin. In mehreren europäischen (z. B. Schweden) und nicht europäischen Ländern ist PEth inzwischen ein fester Bestandteil der klinisch eingesetzten Laborwerte für die diagnostische und therapeutische Anwendung im Praxisalltag (26).
PEth zur Verbesserung der Therapie von Alkoholkonsumstörungen
Die Therapie von Alkoholkonsumstörungen stellt die Behandler immer wieder vor komplexe Herausforderungen und Fragestellungen. Die spezifischen und evidenzbasierten Therapieempfehlungen hierzu findet man in der seit Jahren im deutschsprachigen Raum etablierten S3-Leitlinie Screening, Diagnostik und Behandlung alkoholbezogener Störungen (27). Darin wird der Einsatz von PEth als direkter Zustandsmarker mit einem hohen Empfehlungsgrad A (Sollempfehlung) in verschiedenen Kontexten (Hausarztpraxis, stationäre Aufnahme, Notaufnahme, präoperatives Screening, Intensivstation) empfohlen. Dass der Einsatz von PEth mit einer Qualitätsverbesserung in der Behandlung einhergehen kann, zeigte eine klinische Studie bei Patienten mit Alkoholkonsumstörung. Darin wurde PEth zur Verlaufskontrolle während einer Therapie eingesetzt und die Werte den Teilnehmenden regelmässig zurückgemeldet. Im Verlauf der Behandlung konnte mittels Messung der PEth-Werte eine zunehmende Validität der Angabe subjektiver Trinkmengen erreicht werden (28). Die Behandlung alkoholbezogener Störungsbilder stellt die therapeutische Fachperson jedoch auch vor spezielle Herausforderungen hinsichtlich der Kommunikation und des individuellen Umgangs mit den Betroffenen. Die weiterhin hohe gesellschaftliche Stigmatisierung von Menschen mit Alkoholproblemen und die damit verbundenen negativen Emotionen (Scham, Schuld) können die Gesprächsführung und den Zugang zum Patienten im medizinischen Kontext deutlich erschweren. Dies insbesondere auch im Vergleich zu anderen Krankheitsbildern, die in der allgemeinen internistischen Medizin sonst behandelt werden (z. B. Diabetes, arterielle Hypertonie). Dass der Einsatz von PEth nicht nur zu einer Optimierung der medizinischen Versorgung führen kann, sondern auch eine deutliche Verbesserung für die ärztliche Kommunikation im Umgang mit Patienten mit Alkoholkonsumstörungen bedeutet, zeigte eine im hausärztlichen Kontext in Schweden durchgeführte Studie: In einem qualitativen Studiendesign erhielten mehrere Hausärzte die Möglichkeit, PEth gezielt bei der Diagnostik und Behandlung der arteriellen Hypertonie in ihrer Praxis einzusetzen (29). Anschliessend nahmen sie gemeinsam an Fokusgruppeninterviews teil, in denen sie zu ihren Erfahrungen im Einsatz von PEth strukturiert befragt wurden. Unter anderem wurde erfragt, wie Hausärzte im Allgemeinen das Thema Alkohol ansprechen, wie der Einsatz von PEth den Dialog mit den Betroffenen ändert und wie die Patienten reagieren, wenn PEth in der Behandlung eingesetzt wird. Darüber hinaus wurden weitere fachspezifische Fragen zur Behandlung der arteriellen Hypertonie sowie zum Erfahrungshorizont der Hausärzte beim Thema Alkohol thematisiert. Als Ergebnis stellten die teilnehmenden Allgemeinmediziner fest, dass PEth die eigenen Routinen bei der Identifizierung von und im Umgang mit gefährlichem Alkoholkonsum geändert und verbessert hatte. Insbesondere erleichterte der Einsatz von PEth den Dialog mit den Patienten über das Thema Alkohol sowie die Beurteilung, ob Alkohol zum hohen Blutdruck beitrug. Die Schwelle, den Alkoholkonsum anzusprechen, wurde reduziert und normalisiert, die Patienten reagierten selten negativ auf den Einsatz von PEth in der Behandlung. Alle an der Studie beteiligten Hausärzte befürworteten eine routinemässige Anwendung von PEth in der Primärversorgung und bewerteten den Einsatz des Biomarkers als sehr hilfreich. Charakteristische Aussagen einiger teilnehmender Ärzte sind in der Tab. 4 zusammengefasst.
Wie der zielgerichtete Einsatz von PEth die Behandlung von alkoholbezogenen Störungsbildern sowohl in der Kommunikation mit dem Patienten als auch in der Diagnostik und im longitudinalen Verlauf der Behandlung verbessert, zeigt ein der klinischen Praxis entnommenes Fallbeispiel.
Fallbeispiel
Ein 48-jähriger verheirateter und selbständig als Malermeister und Betriebsinhaber arbeitender Familienvater kommt zum jährlichen Check-up in Ihre Hausarztpraxis. Der Patient ist Nichtraucher, nimmt keine Medikamente ein und ist körperlich gesund, Grösse 180 cm, Körpergewicht 85 kg. Spontan äussert der Patient keine Beschwerden. Die Routineparameter sind unauffällig (Blutbild, HbA1C, EKG), lediglich die Blutdruckwerte sind nach mehrmaliger Messung erhöht (RR 149/83 mmHg). In der weiteren Anamnese berichtet der Patient, dass er viel Stress habe, sich häufig erschöpft fühle und zwischenzeitlich an Ein- oder Durchschlafstörungen leide. Vor einigen Tagen habe er sich unwohl gefühlt und sich einmalig übergeben müssen. Sie entscheiden daraufhin, weitere Laborparameter abzunehmen (AST, ALT, GGT, CRP, Elektrolyte) und ihn in einer Woche wieder einzubestellen. Bis zum Termin soll er zweimal täglich den Blutdruck messen und ein Protokoll über die Werte führen.
Nach einer Woche erscheint der Patient im Gesundheitszustand unverändert bei Ihnen, die gastrointestinalen Beschwerden sind sistiert. Die protokollierten Blutdruckwerte sind weiterhin durchgehend erhöht. Im Labor zeigt sich eine leicht erhöhte Gamma-GT, sonst ist der Laborbefund blande. Sie befragen den Patienten nach regelmässigem Alkoholkonsum. Dieser gibt darauf zu Protokoll, dass er unregelmässig abends nach der Arbeit ein bis zwei Feierabendbiere trinke und hin und wieder mal auch einen Whisky. Im von Ihnen durchgeführten AUDIT-Test erreicht er einen Score von 8 (Hinweis auf schädlichen Gebrauch von Alkohol). Sie schlagen dem Patienten daraufhin vor, einen PEth-Wert im Blut bestimmen zu lassen, um den Alkoholkonsum zu objektivieren. In der nächsten Sitzung besprechen Sie mit ihm das Ergebnis des PEth-Tests (234 ng/ml). Sie erklären dem Patienten, dass der Wert Hinweise auf einen chronisch erhöhten Alkoholkonsum ergibt. Nach Mitteilung des Ergebnisses bleibt der Patient zunächst still, öffnet sich im weiteren Verlauf aber zunehmend und berichtet, dass er wohl in letzter Zeit zunehmend mehr Alkohol am Abend konsumiert habe, einfach weil er befürchtet habe, sonst nicht einschlafen zu können, und dass er bereits darüber nachgedacht habe, den Konsum zu reduzieren. Sie informieren den Patienten, dass die erhöhten Blutdruck- und Leberwerte möglicherweise auf den Alkoholkonsum zurückzuführen seien, und motivieren ihn, sich bezüglich des Alkoholkonsums Ziele zu setzen. Nach der Intervention entscheidet sich der Patient, in Zukunft kontrollierter Alkohol zu trinken und gegen eine komplette Abstinenz. Sie unterstützen den Patienten dabei, Strategien zur Erreichung seiner Ziele zu erarbeiten und vereinbaren einen Kontrolltermin in drei Wochen. Am Kontrolltermin nehmen Sie erneut eine Kapillarblutprobe (oder Venenblutprobe) zur PEth-Bestimmung ab, die schliesslich einen PEth-Wert von 98 ng/ml ergibt. Sie loben den Patienten, da er seine Ziele einer Konsumreduktion erreicht hat und zudem die durchschnittlichen Blutdruckwerte ebenfalls gesunken sind. Sie vereinbaren mit dem Patienten erneut Ziele bezüglich des Alkoholkonsums und stellen ihn für weitere Kontrolltermine ein, bei denen der PEth-Wert regelmässig kontrolliert wird.
Zusammenfassung
Zusammengefasst stellten wir in dem vorliegenden Übersichtsartikel am Beispiel von PEth die Verbesserungen dar, die in der Behandlung alkoholbezogener Störungen erzielt werden können, wenn direkte Biomarker in der klinischen Routine zielführend eingesetzt werden. Die Bestimmung von PEth wird dadurch vereinfacht, dass inzwischen kapilläre Blutentnahmen und einfache Lager- und Transportmöglichkeiten mittels Dried Blood Spots zur Verfügung stehen (14). In der Schweiz werden die Analysen von Blutproben (Venenblut oder Kapillarblut als DBS) inzwischen für klinische und forensische Anwendungen von einzelnen Laboren und flächendeckend von einschlägigen Labordienstleistern angeboten. Da die Kosten von den Patienten selbst getragen werden müssen und nicht von Tarmed abgegolten werden (bzw. nicht auf der Analysenliste des BAG aufgeführt sind), gibt es noch Hindernisse finanzieller Art. Eine am Institut für Rechtsmedizin der Universität Bern angesiedelte Arbeitsgruppe bemüht sich momentan darum, die Anwendung von PEth in der allgemeinen Hausarztmedizin zu etablieren sowie einen Antrag für eine allgemeine Kostenerstattung im Rahmen von Tarmed beim Bundesamt für Gesundheit einzureichen.
Universitäre Psychiatrische Dienste Bern (UPD)
Bolligenstrasse 111
3000 Bern 60
philippe.pfeifer@upd.ch
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Donroe JH, Edelman EJ. Alcohol Use. Ann Intern Med. 2022;175(10):ITC145-ITC60.
2. WHO. World Health Organization, International Statistical Classification of Diseases and Related Health Problems (ICD) 2025 [Available from: https://www.who.int/standards/classifications/classification-of-diseases.
3. Zhao J, Stockwell T, Naimi T, Churchill S, Clay J, Sherk A. Association Between Daily Alcohol Intake and Risk of All-Cause Mortality: A Systematic Review and Meta-analyses. JAMA Netw Open. 2023;6(3):e236185.
4. Helander A. Biological markers in alcoholism. J Neural Transm Suppl. 2003(66):15-32.
5. Andresen-Streichert H, Muller A, Glahn A, Skopp G, Sterneck M. Alcohol Biomarkers in Clinical and Forensic Contexts. Dtsch Arztebl Int. 2018;115(18):309-15.
6. Jones AW. Brief history of the alcohol biomarkers CDT, EtG, EtS, 5-HTOL, and PEth. Drug Test Anal. 2024;16(6):570-87.
7. Wurst FM, Vogel R, Jachau K, Varga A, Alling C, Alt A, et al. Ethyl glucuronide discloses recent covert alcohol use not detected by standard testing in forensic psychiatric inpatients. Alcohol Clin Exp Res. 2003;27(3):471-6.
8. Schrock A, Hernandez Redondo A, Martin Fabritius M, Konig S, Weinmann W. Phosphatidylethanol (PEth) in blood samples from „driving under the influence“ cases as indicator for prolonged excessive alcohol consumption. Int J Legal Med. 2016;130(2):393-400.
9. Schmitt G, Aderjan R, Keller T, Wu M. Ethyl glucuronide: an unusual ethanol metabolite in humans. Synthesis, analytical data, and determination in serum and urine. J Anal Toxicol. 1995;19(2):91-4.
10. Alt A, Janda I, Seidl S, Wurst FM. Determination of ethyl glucuronide in hair samples. Alcohol Alcohol. 2000;35(3):313-4.
11. Neumann J, Beck O, Bottcher M. Phosphatidylethanol, ethyl glucuronide and ethanol in blood as complementary biomarkers for alcohol consumption. J Mass Spectrom Adv Clin Lab. 2021;22:3-7.
12. Isaksson A, Walther L, Hansson T, Andersson A, Alling C. Phosphatidylethanol in blood (B-PEth): a marker for alcohol use and abuse. Drug Test Anal. 2011;3(4):195-200.
13. Luginbuhl M, Weinmann W, Butzke I, Pfeifer P. Monitoring of direct alcohol markers in alcohol use disorder patients during withdrawal treatment and successive rehabilitation. Drug Test Anal. 2019;11(6):859-69.
14. Stoth F, Koch K, Bantle M, Putz P, Wortmann F, Weinmann W. Increase of PEth after Single Consumption of Alcohol and Evaluation of a Volumetric DBS Filter Paper Device. J Anal Toxicol. 2023;47(4):379-84.
15. Aradottir S, Moller K, Alling C. Phosphatidylethanol formation and degradation in human and rat blood. Alcohol Alcohol. 2004;39(1):8-13.
16. Gnann H, Weinmann W, Thierauf A. Formation of phosphatidylethanol and its subsequent elimination during an extensive drinking experiment over 5 days. Alcohol Clin Exp Res. 2012;36(9):1507-11.
17. Aboutara N, Jungen H, Szewczyk A, Muller A, Iwersen-Bergmann S. PEth 16:0/18:1 and 16:0/18:2 after consumption of low doses of alcohol-A contribution to cutoff discussion. Drug Test Anal. 2023;15(1):104-14.
18. Stoth F, Weinmann W, Soravia LM, Pfeifer P. Evaluation of Phosphatidylethanol Elimination in Alcohol Use Disorder Patients Undergoing Withdrawal Treatment. Alcohol Alcohol. 2023;58(3):266-73.
19. Aradottir S, Asanovska G, Gjerss S, Hansson P, Alling C. PHosphatidylethanol (PEth) concentrations in blood are correlated to reported alcohol intake in alcohol-dependent patients. Alcohol Alcohol. 2006;41(4):431-7.
20. Spleis F, Bantle M, Schuldis D, Bell LM, Thierauf-Emberger A, Weinmann W. Detection of phosphatidylethanol after ethanol intake with targeted blood alcohol concentrations of 0.6 g/kg and 0.75 g/kg. Int J Legal Med. 2025;139(2):589-96.
21. Van Uytfanghe K, Heughebaert L, Abatih E, Stove CP. Set-up of a population-based model to verify alcohol abstinence via monitoring of the direct alcohol marker phosphatidylethanol 16:0/18:1. Addiction. 2022;117(7):2108-18.
22. Kip MJ, Spies CD, Neumann T, Nachbar Y, Alling C, Aradottir S, et al. The usefulness of direct ethanol metabolites in assessing alcohol intake in nonintoxicated male patients in an emergency room setting. Alcohol Clin Exp Res. 2008;32(7):1284-91.
23. Hartmann S, Aradottir S, Graf M, Wiesbeck G, Lesch O, Ramskogler K, et al. Phosphatidylethanol as a sensitive and specific biomarker: comparison with gamma-glutamyl transpeptidase, mean corpuscular volume and carbohydrate-deficient transferrin. Addict Biol. 2007;12(1):81-4.
24. Baggio S, Trachsel B, Rousson V, Rothen S, Studer J, Marmet S, et al. Identifying an accurate self-reported screening tool for alcohol use disorder: evidence from a Swiss, male population-based assessment. Addiction. 2020;115(3):426-36.
25. Luginbuhl M, Wurst FM, Stoth F, Weinmann W, Stove CP, Van Uytfanghe K. Consensus for the use of the alcohol biomarker phosphatidylethanol (PEth) for the assessment of abstinence and alcohol consumption in clinical and forensic practice (2022 Consensus of Basel). Drug Test Anal. 2022;14(10):1800-2.
26. Helander A, Hansson T. The alcohol biomarker phosphatidylethanol (PEth) – test performance and experiences from routine analysis and external quality assessment. Scand J Clin Lab Invest. 2023;83(6):424-31.
27. S3 Screening, Diagnostik, Behandlung alkoholbezogener Störungen 2021 [Available from: https://register.awmf.org/assets/guidelines/076-001l_S3-Screening-Diagnose-Behandlung-alkoholbezogene-Stoerungen_2021-02.pdf.
28. Hammarberg A, Ingesson Hammarberg S, Redegren Cuellar S, Guterstam J. Phosphatidylethanol as an outcome measure in treatment aimed at controlled drinking. Alcohol Alcohol. 2024;59(6).
29. Thurfjell A, Sandlund C, Adami J, Hasselstrom J, Hagstromer M, Lundh L. GPs‘ experiences of phosphatidylethanol in treatment of hypertension: a qualitative study. BJGP Open. 2023;7(4).
Therapeutische Umschau
- Vol. 82
- Ausgabe 2
- April 2025