- Innovative Therapiestrategien
Kombinierte Strategien spielen eine immer wichtigere Rolle in der Onkologie. Bi- Tri- und sogar multimodale Therapiestrategien bestehend aus Chirurgie, Radiotherapie, Chemotherapie und seit neuestem auch Immuntherapie werden in verschiedenen Kombinationen heutzutage vermehrt eingesetzt. Die stereotaktische Radiotherapie (SBRT: stereotactic body radio-
therapy) stellt eine effektive Behandlungsmethode dar um eine hohe lokale Kontrolle bei niedrigen Nebenwirkungen sowie kurzer Behandlungsdauer zu erreichen. Darauf basierend, wird sie immer häufiger angewendet um entweder eine Nebenwirkungs-trächtige Systemtherapie in einzelnen Fällen zu meiden oder andererseits eine gut verträgliche Systemtherapie fortzuführen und damit den Wechsel auf eine Zweitlinientherapie zu verzögern. Ein Paradebeispiel in welchem beide Strategien zur Geltung kommen ist das oligometastasierte Stadium.
Les stratégies combinées jouent un rôle de plus en plus important en oncologie. Aujourd’ hui, les stratégies thérapeutiques bi-tri-modales, voire multimodales, comprenant la chirurgie, la radiothérapie, la chimiothérapie et, plus récemment, l’immunothérapie, sont de plus en plus utilisées dans diverses combinaisons. La radiothérapie stéréotaxique (SBRT) est une méthode de traitement efficace pour obtenir un contrôle local élevé avec de faibles effets secondaires et une courte durée de traitement. Sur cette base, elle est de plus en plus utilisée soit pour éviter une thérapie systémique associée à des effets secondaires fréquents dans des cas individuels, soit pour continuer une thérapie systémique bien tolérée et ainsi retarder le passage à une thérapie de deuxième ligne. Un excellent exemple dans lequel les deux stratégies viennent au premier plan est le stade oligométastasé.
Kombinierte Therapieverfahren gewinnen mehr und mehr an Bedeutung in der Krebstherapie. Obwohl bereits seit längerem, aufgrund ihrer verbesserten Ergebnisse, bei einzelnen Entitäten als Standardtherapie gesehen u.a. bei fortgeschrittenen Kopfhalspa-tienten (1) oder in adjuvanter Situation beim Glioblastom (2) erleben diese einen neuen Aufschwung. Die Vorteile basieren vor allem auf einem synergetischen Effekt. Dabei spielen die Sequenz sowie Intervall zwischen den verschiedenen Behandlungsoptionen als auch die Selektion der Patienten eine wichtige Rolle. Zugleich verfügt die Radioonkologie heute mit der stereotaktischen Bestrahlung über eine fokussierte hoch-präzise Behandlungsmethode die der konventionellen Bestrahlungstechnik in verschiedenen Punkten überlegen ist : Sie ermöglicht eine lokale, ablative Dosis mit gleichzeitiger besserer Schonung der umherliegenden Organe sowie kürzeren Behandlungszeiten: Die kürzlich publizierte CHISEL Studie, eine randomisierte Phase III Studie hat die normofraktionierte Radiotherapie mit der SBRT beim lokalisierten inoperablen Stadium I Lungenkarzinom verglichen: nach einer medialen Beobachtungszeit von 2.1 Jahren zeigte sich nach SBRT eine deutlich verbesserte lokale Kontrolle (HR 0.32; 95% CI 0.13-0.77, p = 0.0077) ohne erhöhte Nebenwirkungen (3).
Radiobiologische Vorteile einer Kombination
Präklinische Daten haben ergeben, dass die Strahlentherapie das adaptative Immunsystem aktivieren kann, dies mittels einer vermehrten Präsentation von Antigenen durch Antigen präsentierende Zellen. Darüber hinaus kommt es zu einer verstärkten PD-L1 Expression durch die Tumorzellen. Dank dieser immun-modulatorischen Fähigkeiten könnte die Radiotherapie eine wichtige Rolle spielen immunresistente in immunogene Tumore umzuwandeln, «kalte» Tumore in «heisse» Tumore zu ändern (4-6). Zusätzlich haben präklinische Modelle gezeigt, dass eine gleichzeitige Bestrahlung und Gabe einer Immuntherapie bessere Resultate erzielen im Vergleich zu sequentiellen Schemata, und dass höhere Bestrahlungsdosen beziehungsweise eine stereotaktische Radiotherapie einer normofraktionierten überlegen ist (7, 8). Zusätzlich gibt es vermehrt Hinweise, dass die Strahlentherapie zusätzlich zu ihrem lokalen Effekt aktuell auch einen systemischen Effekt haben kann, sprich einen Effekt ausserhalb des Strahlenfeldes (9).
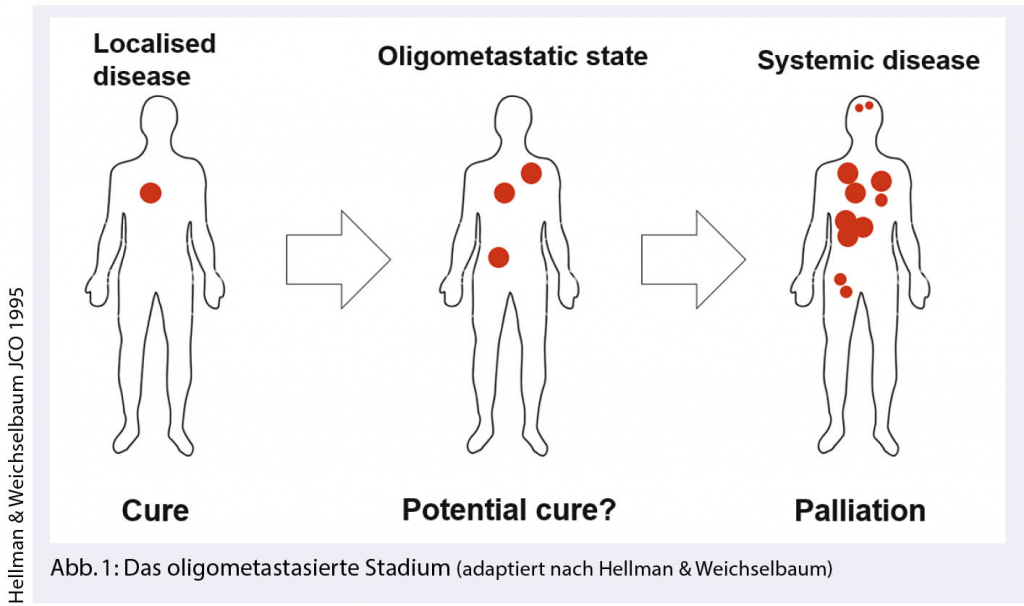
Das oligometastasierte Stadium
Die Oligometastasierung stellt ein begrenzt metastasiertes Stadium dar. Hellman und Weichselbaum beschrieben erstmals dieses Konzept als eigene Entität zwischen dem lokal-begrenzten und dem metastasierten Stadium (10): in diesem Konzept erzielt eine lokal ablative Behandlung aller Tumorlokalisationen einen Überlebensvorteil. Evidenz für diese Theorie, gibt es von der seit kurzem veröffentlichten COMET Studie: Dabei wurden Patienten mit einem kontrollierten Primarius sowie 1 bis maximal 5 Metastasen eingeschlossen und randomisiert zwischen einer palliativen Standardtherapie (Arm 1) und zusätzlich einer stereotaktischen Radiotherapie aller Herde (Arm 2): Zwischen 2012 und 2016 wurden 99 Patienten rekrutiert. Mediane Beobachtungszeit war 27 Monate: Das mediane Gesamtüberleben konnte von 28 Monate im Arm 1 (95% CI 19-33) auf 41 Monate im Arm 2 verbessert werden (95% CI: 26-NA; p = 0.09) (11).
Das oligometastasierte Stadium ist allerdings komplexer und es müssen verschiedene klinische Situationen unterschieden werden. Die beiden am besten Untersuchten sollen im Folgenden vorgestellt und diskutiert werden. 1. Die Oligorezidivsituation stellt ein Stadium dar, in welchem der Patient nach Behandlung des Primarius – metachron – in einer Behandlungs-freien Phase eine Oligometastasierung entwickelt. 2. In Oligoprogression unter laufender Systemtherapie einer polymetastasierten Erkrankung entwickeln wenige Metastasen eine Resistenz und sind dann Ziel einer lokal ablativen Behandlung.
Prostata-Karzinom
Die diesjährig publizierte «Milestone» Studie STAMPEDE ist eine internationale, mehrarmige randomisierte Mehrphasen Kontrollstudie, die das Prostatakarzinom im fortgeschrittenen Stadium untersucht. Die Studie zeigt eindrücklich, dass eine Kombination einer Bestrahlung der Prostata zusätzlich zur Standard- Systemtherapie das progressionsfreie Überleben verbessert (HR = 0.76; 95% CI 0.68-0.84; < 0.0001). Darüber hinaus hat eine geplante Subgruppenanalyse ergeben, dass bei Patienten mit einem gering metastatischen Befall (weniger als 4 Knochenmetastasen) das Gesamtüberleben signifikant verbessert werden konnte (HR 0·68, 95% CI 0·52–0·90; p = 0·007; 3-Jahres Überleben von 73% ohne RT vs. 81% mit RT (12).
Offen ist der Nutzen der sogenannten Metastasen-gerichteten Therapie (MDT: Metastatic directed therapy) u.a einer stereotaktischen Radiotherapie in diesem Patientenkollektiv. Erwähnenswert hier ist die abgeschlossene STOMP Studie von P. Ost et al. Dabei handelt es sich um eine randomisierte, multizentrische Phase II Studie die zwischen 2012 und 2015, 62 Patienten rekrutierte in entweder den Beobachtungsarm oder den MDT Arm, in dem alle sichtbaren Metastasen lokal behandelt wurden. Nach einer medianen Beobachtungszeit von 3 Jahren lag das Hormontherapie-freie Überleben bei 21 Monaten in der MDT Gruppe im Vergleich zu 13 Monaten in der Beobachtungsgruppe. (HR 0.60(80% CI 0.40- 0.90; log-rank p = 0.11). Auch in der Oligorezidivsituation mit regionalen PSMA positiven Lymphknoten nach primärer Therapie wird aktuell eine Kombination zwischen einer MDT und einer 6-monatigen Hormontherapie mit oder ohne elektive Beckenbestrahlung untersucht. (PEACE V: NCT03569241): Eine andere interessante Studie die den Nutzen einer stereotaktischen Bestrahlung bei M1a-b Prostatapatienten untersucht, kommt aus dem Sunnybrook Hospital (Toronto, Kanada). In diesem Protokoll werden Patienten mit maximal 5 Metastasen behandelt. Das Behandlungsschema sieht 5 Fraktionen vor, dies bis zu einer Gesamtdosis von 35-40 Gray auf die Prostata, 25-35 Gray auf die Lymphabflusswege und 30-40 Gray auf alle Metastasen in Kombination zur einer einjährigen Androgendeprivation.
Nicht-kleinzelliges Lungenkarzinom
Die randomisierte Phase III PACIFIC Studie konnte einen signifikanten Überlebensvorteil im Stadium IIIB NSCLC mit Durvalumab Erhaltungstherapie im Vergleich zu Placebo nach abgeschlossener Radiochemotherapie (RCT) feststellen und stellt somit den neuen Goldstandard in diesem Stadium dar [2 Jahres Überlebensrate 66.3 (95% CI 61.7-70.4) versus 55.6% (95% CI 48.9-61.8)] (13). Erwähnenswert ist die Subgruppenanalyse die zeigte, dass eine frühe erste Gabe Durvalumab weniger als 14 Tage nach Ende der RCT ein besseres Ergebnis erzielte (oral presentation, ESMO 2018).
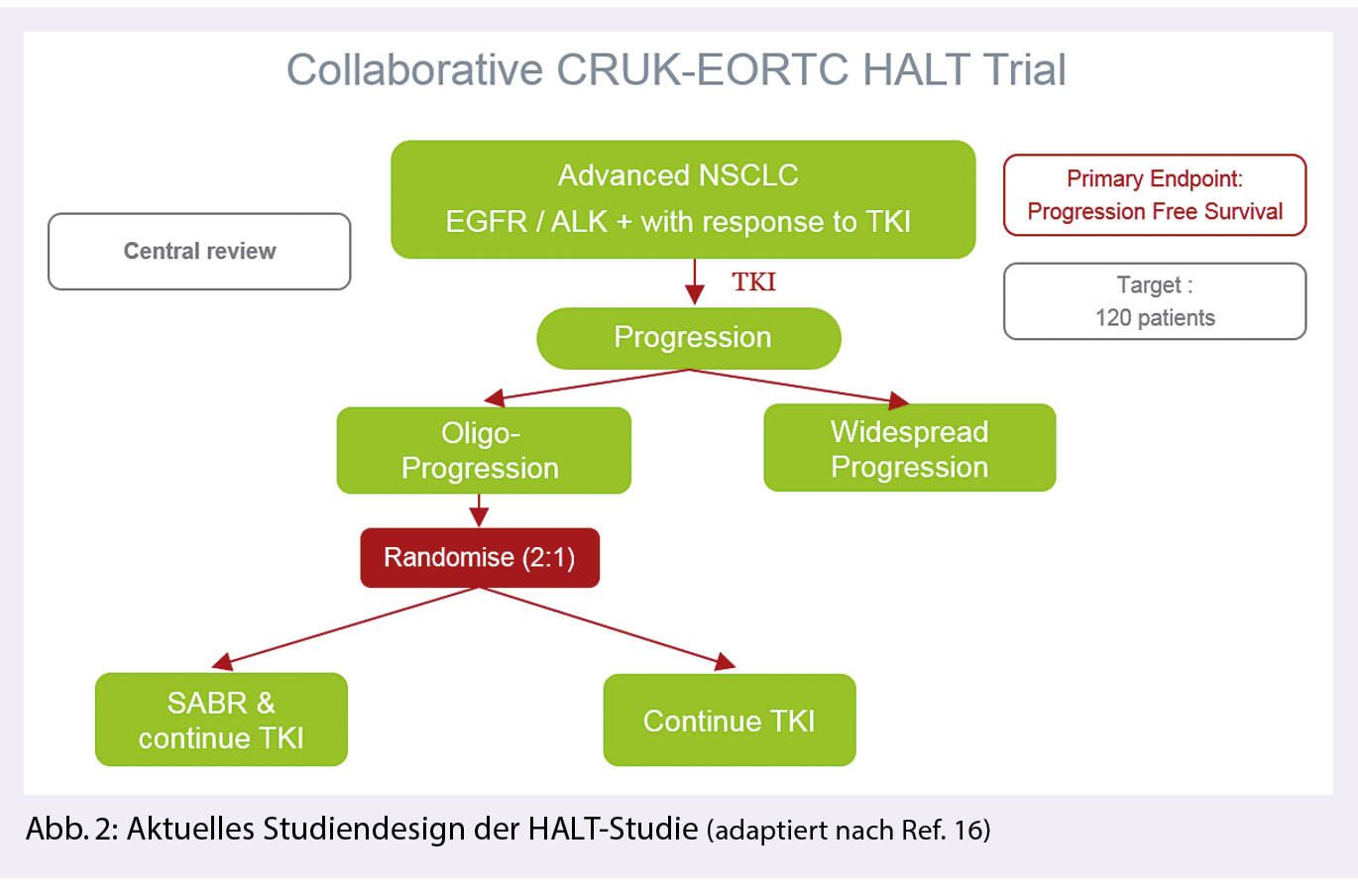
Was das oligometastasierte Lungenkarzinom (NSCLC) betrifft, so gibt es auch hier Evidenz welche den Nutzen einer lokalen Therapie zusätzlich zur Systemtherapie untermauern: In einer Phase II Studie wurden Patienten mit einem Stadium IV NSCLC (≤ 3 Metastasen) randomisiert zwischen der Standardtherapie und einer zusätzlich konsolidierenden lokalen Therapie aller Tumormanifestationen: nach einer medianen Beobachtungszeit von 14.2 Monaten konnte ein Vorteil der MDT mit Verbesserung des progressionsfreien Überlebens von 14.2 Monaten (95% CI 7.4-24.3) versus 4.4 Monate ( 95% CI 2.2-8.3;p = 0.017) nachgewiesen werden. Dabei wurde keine erhöhte Grad III oder mehr Toxizität festgestellt (14). Mit einer längeren Beobachtungszeit von median 38.8 Monaten, konnte sogar eine Verbesserung des Gesamtüberlebens gezeigt werden (15): medianes Überleben von 41.2 Monaten (95% CI 18.9, NA) vs. 17 Monaten (95% CI 10.1, 39.8; p = 0.017). Auch in der Oligoprogressionssituation gibt es in der Zwischenzeit interessante Studien: Eine wichtige Studie ist die «HALT Studie» (Targeted therapy with or without dose intensified radiotHerapy for oligo-progressive disease in oncogene-Addicted Lung Tumours): Dies ist eine Phase II-III, multizentrische Studie. Einschlusskriterien sind Patienten mit einem mutierten und somit gut ansprechenden Tumor auf Tyrosinkinaseinhibitoren (TKI) sowie bis zu drei progredienten Herden, die resistent gegen die TKI geworden sind. Eine erste Phase II Studie untersucht ob eine zusätzliche SBRT auf eine limitierte (≤ 3) Anzahl an Metastasen mit Fortführung der Systemtherapie das Progressionsfreie Überleben verbessert im Vergleich zur alleinigen TKI Therapie. (16).
Aktuelle klinische Studien zur Kombination SBRT und Immuntherapie
Die Kombination einer Immuntherapie mit Bestrahlung wurde vor allem im metastasierten Stadium analysiert. Eine Zweitanalyse von 98 Patienten mit metastasiertem NSCLC wurden in der Keynote 001 mit Pembrolizumab durchgeführt. Dabei wurde eine Verbesserung des Progressionsfreien Überlebens (HR = 0.56, 95%; CI: 0.34–0.91) als auch des Gesamtüberlebens (HR = 0.58, 95% CI, 0.36–0.94) festgestellt bei Patienten die vorher eine RT erhielten. Eine SBRT wurde dabei in 29% der Fälle angewendet (17). Eine weitere Studie mit stereotaktischer Bestrahlung und sequentieller Therapie mit Pembrolizumab bei Patienten mit multimetastasierten soliden Tumoren ergab ein Ansprechen in nicht bestrahlten Metastasen von bis zu 27% sowie ein globales Ansprechen von 13.2%. Diese Resultate in einer sehr heterogenen Gruppe sowie unabhängig vom PD-L1 Status sind vielversprechend und unterstützen zukünftige Studien die eine SBRT mit einer Immuntherapie kombinieren (18).
Klinik Radioonkologie
Rämistrasse 100
8091 Zürich
Jean-Jacques.Stelmes@usz.ch
Klinik Radioonkologie
Rämistrasse 100
8091 Zürich
Klinik Radioonkologie
Rämistrasse 100
8091 Zürich
Die Autoren geben an, dass für diese Publikation kein Interessenskonflikt vorliegt.
- Der Stellenwert von kombinierten Strategien wird immer bedeutender in der modernen Krebstherapie. Dabei spielt die Sequenz, das
Intervall sowie die Patientenselektion eine wichtige Rolle. - Patienten mit einer limitierten Anzahl an Metastasen und dies
unabhängig von der Tumorentität, können in bestimmten Fällen von einer stereotaktischen Bestrahlung profitieren. - Die stereotaktische Bestrahlung stellt dabei eine innovative Behandlungsoption dar, dies aufgrund ihrer schonenden und zugleich lokal kurativen Möglichkeiten.
- Die immunomodulatorischen Effekte stereotaktischer Bestrahlung eröffnen neue Möglichkeiten in Kombination mit Immun Checkpoint Inhibitoren, auch in der multimetastasierten Situation; diese Strategien werden aktuell prospektiv untersucht.
Messages à retenir
- L’ importance des stratégies combinées devient de plus en plus importante dans le traitement moderne du cancer. La séquence, l’ intervalle et la sélection des patients jouent un rôle important.
- Les patients présentant un nombre limité de métastases, quel que soit l’entité tumorale, peuvent bénéficier d’un rayonnement stéréotaxique dans certains cas.
- L’ irradiation stéréotaxique est une option de traitement innovante grâce à ses possibilités indulgentes et en même temps curatives locales.
- Les effets immunomodulateurs de l’ irradiation stéréotaxique ouvrent
de nouvelles possibilités en combinaison avec des inhibiteurs immunitaires, même dans des situations multimétastatiques ; ces stratégies font actuellement l’ objet d’une étude prospective.
1. Bourhis, J., C. Amand, and J.P. Pignon, Update of MACH-NC (Meta-Analysis of Chemotherapy in Head & Neck Cancer) database focused on concomitant chemoradiotherapy. J Clin Oncol., ASCO Annual Meeting Proceedings (Post-Meeting Edition), 2004. 22.
2. Stupp , R., et al., Radiotherapy plus Concomitant and Adjuvant Temozolomide for Glioblastoma. New England Journal of Medicine, 2005. 352(10): p. 987-996.
3. Ball, D., et al., Stereotactic ablative radiotherapy versus standard radiotherapy in stage 1 non-small-cell lung cancer (TROG 09.02 CHISEL): a phase 3, open-label, randomised controlled trial. The Lancet Oncology, 2019.
4. Gupta, A., et al., Radiotherapy promotes tumor-specific effector CD8+ T cells via dendritic cell activation. J Immunol, 2012. 189(2): p. 558-66.
5. Sharabi, A.B., et al., Radiation and checkpoint blockade immunotherapy: radiosensitisation and potential mechanisms of synergy. Lancet Oncol, 2015. 16(13): p. e498-509.
6. Sharabi, A.B., et al., Stereotactic Radiation Therapy Augments Antigen-Specific PD-1-Mediated Antitumor Immune Responses via Cross-Presentation of Tumor Antigen. Cancer Immunol Res, 2015. 3(4): p. 345-55.
7. Seung, S.K., et al., Phase 1 Study of Stereotactic Body Radiotherapy and Interleukin-2—Tumor and Immunological Responses. Science Translational Medicine, 2012. 4(137): p. 137ra74.
8. Walshaw, R.C., J. Honeychurch, and T.M. Illidge, Stereotactic ablative radiotherapy and immunotherapy combinations: turning the future into systemic therapy? The British journal of radiology, 2016. 89(1066): p. 20160472-20160472.
9. Formenti, S.C. and S. Demaria, Systemic effects of local radiotherapy. Lancet Oncol, 2009. 10(7): p. 718-26.
10. Hellman, S. and R.R. Weichselbaum, Oligometastases. J Clin Oncol, 1995. 13(1): p. 8-10.
11. Palma, D.A., et al., Stereotactic Ablative Radiation Therapy for the Comprehensive Treatment of Oligometastatic Tumors (SABR-COMET): Results of a Randomized Trial. International Journal of Radiation Oncology • Biology • Physics, 2018. 102(3): p. S3-S4.
12. Parker, C.C., et al., Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet, 2018. 392(10162): p. 2353-2366.
13. Antonia, S.J., et al., Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. 2018. 379(24): p. 2342-2350.
14. Gomez, D.R., et al., Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after first-line systemic therapy: a multicentre, randomised, controlled, phase 2 study. Lancet Oncol, 2016. 17(12): p. 1672-1682.
15. Gomez, D.R., et al., Local Consolidative Therapy (LCT) Improves Overall Survival (OS) Compared to Maintenance Therapy/Observation in Oligometastatic Non-Small Cell Lung Cancer (NSCLC): Final Results of a Multicenter, Randomized, Controlled Phase 2 Trial. International Journal of Radiation Oncology • Biology • Physics, 2018. 102(5): p. 1604.
16. McDonald, F., et al., 125: HALT: Targeted therapy beyond progression with or without dose-intensified radiotherapy in oligoprogressive disease in oncogene addicted lung tumours. Lung Cancer, 2017. 103: p. S57.
17. Shaverdian, N., et al., Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer: a secondary analysis of the KEYNOTE-001 phase 1 trial. The Lancet Oncology, 2017. 18(7): p. 895-903.
18. Luke, J.J., et al., Safety and Clinical Activity of Pembrolizumab and Multisite Stereotactic Body Radiotherapy in Patients With Advanced Solid Tumors. 2018. 36(16): p. 1611-1618.
info@onco-suisse
- Vol. 9
- Ausgabe 2
- April 2019