- Personalisiertes Finetuning 2019
Da ca. 50% der Männer im Alter über 50 Jahren Prostata-Tumorzellträger sind, aber nur 8% zeitlebens daran erkranken werden, basiert die differenzierte Prostatakrebsvorsorge insbesondere auf Daten der fast 2 Jahrzehnte langen, prospektiv randomisierten ERSPC- und PLCO-Studien mit evidenzbasierter Mortalitätsreduktion und Unterscheidung von relevanten vs. insignifikanten Prostatakarzinomen (P-CA). Klinische Konsequenz ist nach einem «informed consent»-Gespräch das im Risikoalter 45-50 Jahren beginnende kostengünstige sog. «organisierte PSA-Finetuning» mit Einsatz der aus der ERSPC entwickelten Risiko-Kalkulatoren (SWOT Rotterdam/ProstateCheck Aargau) zur Festlegung der Kontrollintervalle bzw. weiterer notwendiger Abklärungen.
Étant donné qu’environ 50 % des hommes de plus de 50 ans sont porteurs de cellules tumorales de la prostate, mais que seulement 8 % développeront un cancer de la prostate au cours de leur vie, le dépistage différencié du cancer de la prostate est fondé en particulier sur les données de près de deux décennies d’études randomisées prospectivement ERSPC et PLCO avec réduction de mortalité et différenciation des carcinomes pertinents et non significatifs de la prostate (P-CA) basées sur des preuves. Après un entretien de consentement éclairé, la conséquence clinique est ce qu’il est convenu d’ appeler le «réglage fin organisé de l’ APS», qui commence à l’ âge de 45-50 ans et utilise les calculateurs de risque développés par ERSPC (SWOT Rotterdam/ProstateCheck Aargau) pour déterminer les intervalles de contrôle et d‘autres précisions nécessaires.
Da PSA bei Männern mit kleineren Prostatae ein optimaler Risiko-Parameter für die Langzeitentwicklung (15-20 Jahre) eines relevanten Karzinoms ist, können Kontrollintervalle bei mehr als der Hälfte der Männer durch die Kalkulatoren auf bis zu 4-6 Jahre ausgedehnt werden. Neben PSA und freiem PSA bieten andere Kallikreine keine wesentlichen Zusatzinformationen zu den Kalkulatoren. Bei weiteren Abklärungen ist das MRI der Prostata in der Diskussion als Direktuntersuchung vor einer Biopsie, es ist spätestens vor der Rebiopsie indiziert. Genetische Untersuchungen von Mutationen (SNPs) müssen weiter validiert werden, um in ihrer klinischen Bedeutung einen Stand in der Diagnostik zu erlangen. Die Vorsorge verliert ihren Wert bei einer Lebenserwartung von weniger als 10 Jahren.
PSA-Screening reduziert die Prostatakarzinom-Mortalität
Die langjährigen Diskussionen zwischen den Ergebnissen der prospektiv randomisierten Vorsorgestudien ERSPC und PLCO zeigen schlussendlich, dass in beiden Studien eine Mortalitätsreduktion von 25-32% nach 11 Jahren besteht (1). Die schon 2012 von uns beschriebene, das Ergebnis verzerrende extrem hohe Kontaminationsrate des PLCO-Kontrollarms, hat erst vor 2 Jahren Eingang in die Korrektur des PLCO Trials gefunden (2). Die ERSPC-Daten dokumentieren zudem, dass mit längerer Beobachtungsdauer sich die NND (Number Necessary to diagnose) von 76 (9 Jahre) auf 34 (11 Jahre), 26 (13 Jahre) und 18 (16 Jahre) weiter reduziert (2,3,4). Die 16-Jahres Ergebnisse werden in Bälde publiziert. In einer separaten populationsbasierten Kohorten-Studie beträgt die NND 16 für PSA Screening zwischen 50-54 Jahren. Verglichen mit den retrospektiven Malmö-Daten (absolut kein Screening) ist die Mortalität um 71% reduziert (6). Die USPSTF hat mittlerweile ihre Recommendation D auf C im 2017 umgestellt.
PSA ist «der» Gatekeeper für das Langzeitrisiko einer Prostatakarzinom-Entwicklung.
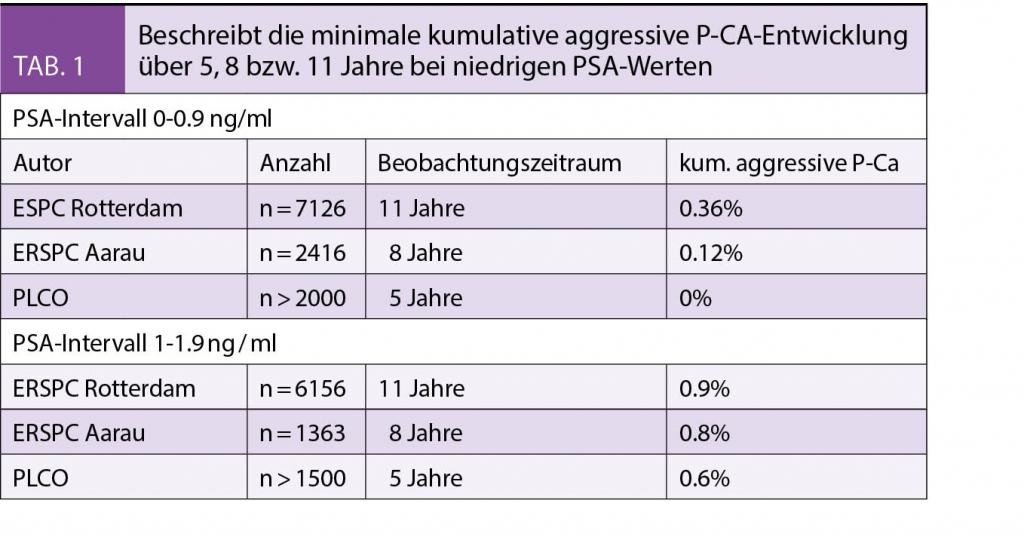
Die Frage des Finetunings in Bezug auf PSA-Kontrollintervalle lässt sich anhand retrospektiver (7) und prospektiver Daten (PLCO, Swiss ERSPC; Rotterdam ERSPC) wesentlich optimaler handhaben (Tab. 1). Dabei präsentiert sich der PSA-Wert als Prognoseparameter für das Langzeitrisiko der Entwicklung eines Prostatakarzinoms. Vickers et al konnten in einer Case Control Study dokumentieren, dass z.B. die oberste 10% Percentile im Alter 45-49 (PSA >1.6ng/ml) insgesamt 44% aller P-Ca-Toten nach 25 Jahren ausmacht (6). Umgekehrt zeigen Männer mit Werten < 1.0ng/ml (50% der Probanden) im PLCO, ERSPC Aargau und Rotterdam ERSPC nach 5, 8 bzw. 11 Jahren so gut wie nie ein Karzinom: 0%; 0,12% bzw. 0.36% liegt kumulativ ein aggressives P-Ca vor (?) (Tab.1.). D.h. es gibt eine grosse Gruppe von Männern, deren Kontrollintervalle auf ca. 5 und mehr Jahre verlängert werden können (8,9). Auch in der Gruppe PSA 1-1.9ng/ml können die u.g. Kalkulatoren Kontrollintervalle über ein/zwei Jahre hinaus verlängern. Dies ermöglicht die fehlende PSA-Ausschüttung bei nicht oder nur minim vorhandener benigner Prostatahyperplasie, die bei grösseren Hyperplasien einen Tumor kaschieren würde. Der PSA-Wert charakterisiert dadurch deutlicher die periphere Zone, wo am häufigsten die Karzinome entstehen (10).
Individuell «organisiertes PSA-Finetuning» ist besser als opportunistisches Gelegenheitsscreening zum Sichern des kurativen «Window of opportunity»
Es stellt sich die Frage, welche Form des Screenings die besten Ergebnisse erzielt? Dabei ist zu beachten, dass es ein «Window of Opportunity» mit kurativer Intention gibt, das nur durch kontinuierliches, aber nicht starres Follow up getroffen werden kann. Zu häufige Tests beinhalten die Gefahr der Überdiagnostik, zu seltene die des Verpassens. Ergebnisse der prospektiven Multicenter CAP-Studie dokumentieren, dass eine nur einmalige PSA-Messung die P-CA-Mortalität nach 10 Jahren nicht beeinflusst (11). Die Ergebnisse des Kontrollarms der Schwedischen ERSPC-Teilnehmer bestätigen, dass opportunistisches, unorganisiertes Screening dem organisierten unterlegen ist. Die Kontamination im Kontrollarm führte zu einer doppelt so hohen Inzidenz als erwartet, hatte jedoch nur einen minimalen Effekt auf die Mortalität. Im organisierten Screening Arm ging die Mortalität jedoch um 42% zurück (12).
Nutzen multiparametrischer Risikokalkulatoren, um Kontrollintervalle bzw. Indikationen zur weiteren Abklärung festzulegen
In Rotterdam und Aarau sind die initialen PSA-Messungen und deren Follow up nach 4, 8 und 12 Jahren in Risikokalkulatoren eingeflossen. Neben PSA können freies PSA (interessant bei kleinen Prostatae), digitale rektale Untersuchung, Alter, Familienanamnese und das Prostatavolumen mitberücksichtigt werden (13). Einerseits werden Kontrollintervalle verlängert, andererseits Biopsien gespart. Cave vor der Benutzung des amerikanischen PCPT-Kalkulators, der lediglich eine einmalige statische, bioptische Entdeckungswahrscheinlichkeit eines Karzinoms angibt und bei fehlendem FU keine Aussage zur klinischen Wertigkeit des Befundes machen kann. Z.B. wird das Karzinomrisiko für PSA < 0.9 ng / ml mit 10% angegeben, obwohl klinisch in 11 Jahren lediglich 0.36% kumulativ ein Karzinom entwickeln (Tab.1.) (14). – Der Einsatz von 4 Kallekreinen (4K) Score war dem Rotterdam-Kalkulator nicht überlegen(15).
Aktuell ist der erste Kalkulator mit jeweiligem MRI-Ergebnis verfügbar (MRI–ERSPC-RC4), der 36% der Biopsien spart, dafür 4% der aggressiven Tumore übersieht (16). Er beruht auf 2 Tesla-Geräten und ist sicher noch verbesserungswürdig. Die Rolle von Genommarkern für den Einsatz in der Diagnostik und Prognostik sind ermutigend im Sinne einer Zusatzinformation, müssen in Multi-Center-Studien jedoch noch validiert werden, bevor der Einzug in die Klinik stattfinden kann (17).
mpMRI spätestens vor der Rebiopsie
Auch wenn die Leitlinien der EAU und DGU das mpMRI erst vor der Re-Biopsie empfehlen, so tritt in der täglichen Praxis die Untersuchung gehäuft schon direkt nach der Risikostratifizierung ein. Wenn mpMRI, sollte es mit einem 3-Tesla durchgeführt werden. Sog. Ultraschall-Fusions-gesteuerte randomisierte Biopsien incl. mpMRI auffälliger Target-Biopsien sind z.Zt. State of the Art. Bei blandem mpMRI darf nicht auf die randomisierte Biopsie verzichtet werden, da ca. 20% P-Ca peripher übersehen werden (18). Die Anzahl Biopsien sowie der Zugangsweg transrektal vs. trans-
perineal sind in der Diskussion. Leider wird auch immer öfter ausserhalb von Studien die komplette bioptische, histologische Abbildung der Prostata durch eine sog. Template-Biopsie erhoben (n = 30-50 Biopsien), so dass die gefundene Inzidenz dann nahe an die autoptische Prävalenz von 50-80% reicht. Auswuchs ist mittlerweile eine bioptische Inzidenz von beispielsweise 47% vermeintlich relevanten Karzinomen, wenn Autoren bei einem PSA von median 5.9ng/ml trotz einer niedrigen PSA-Dichte von nur 0.12 von einem klinisch relevanten Karzinom sprechen (19). Die bisherigen Kriterien für insignifikante Karzinome zur Einleitung einer Active-Surveillance-Therapie sind unter diesen Umständen zu strikt (Epstein, PRIAS) und sollten unbedingt revidiert werden, da sie ohne mpMRI und lediglich mit 12 randomisierten Biopsien erstellt wurden.
Prostata- und Uroonkologisches Zentrum, Kantonsspital Aarau AG
Tellstrasse 25
5001 Aarau
franz.recker@ksa.ch
Prostata- und Uroonkologisches Zentrum
Kantonsspital Aarau AG
Tellstrasse 25
5001 Aarau
Prostata- und Uroonkologisches Zentrum
Kantonsspital Aarau AG
Tellstrasse 25
5001 Aarau
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- PSA-Screening reduziert die Prostatakarzinom-Mortalität
- PSA ist «der» Gatekeeper für das Langzeitrisiko einer Prostatakarzinom-Entwicklung.
- Individuell «organisiertes PSA-Finetuning» ist besser als opportunistisches Gelegenheitsscreening, um das kurative «Window of oppor-
tunity» nicht zu verfehlen. - Nutzen multiparametrischer Risikokalkulatoren, um Kontrollintervalle oder aber Indikationen zur weiteren Abklärung festzulegen
- mpMRI in der Praxis vor der ersten Biopsie, Leitlinien-gerecht spätestens vor der Rebiopsie
Messages à retenir
- Le dépistage du PSA réduit la mortalité par cancer de la prostate
- Le PSA est le «gardien» du risque à long terme de développement du cancer de la prostate.
- Mieux vaut un «réglage fin organisé» individuel de la PSA qu’un
dépistage occasionnel opportuniste afin de ne pas rater la «fenêtre d’opportunité» curative. - L’ utilisation de calculateurs de risques multiparamétriques pour définir des intervalles de contrôle ou des indications pour plus d‘évaluations
- Le mpMRI en pratique avant la première biopsie, conforme aux lignes directrices au plus tard avant la rébiopsie.
1. Tosdikov, A., et al Reconcilling the Effects of Screening on Prostate Cancer Mortality in the ERSPC and PLCO Trials Annals Intern.Med. 2017 Oct.3, 167(7) 449-455
2. Kwiatkowski M. et al. Comment on the US Prevventive Services Task Force`s draft recommendation on screening for prostate cancer Eur Urol 2012 April 61 851-4
3 Schroder, F.H., et al., Screening and prostate-cancer mortality in a randomized European study. N Engl J Med, 2009. 360(13): p. 1320-8.
4. Schroder, F.H., et al., Prostate-cancer mortality at 11 years of follow-up. N Engl J Med, 2012. 366(11): p. 981-90.
5. Schroder, F.H., et al., Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet, 2014. 384(9959): p. 2027-35.
6 Carlsson S. et al. : Screening for Prostate Cancer Starting at age 50-54 Years. A Population-based Cohort study Eur Urol 71 (2017): 46-52
7. Vickers AJ et al.:Strategy for detection of prostate cancer based on relation between prostate specific antigen at age 40-55 and long term risk of metastasis: case control study BMJ 2013 Apr 15; 346
8. Bul M. et al.: Prostate cancer incidence and disease specific survival of men with initial prostate specific antigen < 3.0ng/ml who are participating in the ERSPC Rotterdam Eur Urol 2011 Apf. 59: 498-505
9. Randazzo M.: A PSA Pyramid for men with initial prostate specific antigen <= 3ng/ml: a plea for individualized prostate cancer screening Eur Urol 2015 Oct. 68:591-7
10. Recker F et al.:Enhanced expression of prostate-specific antigen in the transition zone of the prostate. A characterization folling prostatectomy for benign hyperplasia Eur Urol 1998, 33:549-55
11. Martin, R.M., et al., Effect of a Low-Intensity PSA-Based Screening Intervention on Prostate Cancer Mortality: The CAP Randomized Clinical Trial. JAMA, 2018. 319(9): p. 883-895.
12. Godtman RA et al: Opportunistic Testimg Versus Organized Prostate Specific Antigen Screening Outcome After 18 Years in the Göteborg Randomized Population-based Prostate Cancer Screening Trial Eur Urol(2015) 354-360
13. Robool M. et al: A calculator for Prostate Cancer Risk 4 Years After an Initially Negative Screen: Findings from ERSPC Rotterdam Eur Urol 2013 Apr;63(4):627-33
14. Poyet C et al: External Evaluation of a Novel Prostate Cancer Risk Calculator (ProstateCheck) Based on Data from the Swiss Arm of the ERSPC J Urol 2016; 1402-1407
15 Verbeek JFM et al: Reducing unnecessary biopsies while detecting clinically significant prostate cancer including cibriform growth with the ERSPC Rotterdam risk calculator and 4 K Score. Urol Oncol 2019 Feb.37138-144
16. Alberts AR et al:Prediction of high Grade Prostate Cancer Following Multiparametric Magnetic resonance Imaging.Improving the Rotterdam European Randomized Study of Screening for Prostate Cancer Risk Kalculator. Eur Urol 2019 Febr.: 310-318
17. Cucchiara V. et al : Genomic Markers in Prostate Cancer Decision Making Eur Urol 2018 Apr. 73: 572-582
18. Porpiglia F et al Diagnostic Pathway with Multiparametric magnetic Resonance Imaging Versus Standard Pathway: Results from a Randomized Prospective Study in Biopsy-naive Patients with suspected Prostate Cancer Eur Urol 2017 Aug 72:282-288
info@onco-suisse
- Vol. 9
- Ausgabe 2
- April 2019