- Vitamine, Multivitamine und spezielle Risikosituationen in der Schwangerschaft
Der Bedarf an Mikronährstoffen und Vitaminen, besonders für Eisen, Folsäure, Vitamin D, Jod und Kalzium, steigt in der Schwangerschaft exponentiell im Gegensatz zu der geringen Erhöhung an Kalorien und Makronährstoffen von ca. 10%. Das Gefälle zwischen dem gesteigerten Bedarf und der Verfügbarkeit an entsprechenden Mikronährstoffen für Schwangere in einkommensschwachen Ländern, resp. dem Ernährungsverhalten in einkommensreichen Ländern, ist gross. In beiden Fällen ergibt sich häufig ein Mangel an Nährstoffen.
Pendant la grossesse, les besoins en micro-aliments et vitamines, en particulier fer, acide folique, vitamine D, iode et calcium accroissent de manière exponentielle, alors que l’augmentation – modeste – des besoins en calories et macro-aliments n’est que de 10 % environ. L’écart entre besoin accru et disponibilité pour les micro-aliments en question est grand, et ceci dans les pays à bas revenu comme dans ceux
à haut revenu. Dans les deux cas le résultat est souvent une carence en nutriments.
The WHO recommends multivitamin supplementation in those pregnant women who have a high prevalence of nutrient deficiencies to reduce the risk of low birth weight (LBW) and small for gestational age (SGA) (1,2). In countries with adequate nutrition, a lack of vitamins may arise for the following reasons (3):
- High calorie diet with low vitamin content
- Obesity with relative vitamin deficiency
- Inadequate or late adjustment of diet in pregnancy
- Specific pregnancy disorders such as hyperemesis gravidarum
- Pregnancy after bariatric surgery
- Pregnant women with increased needs
Folic acid and vitamin B12
The need for folic acid increases by 50-80% during pregnancy and this increase can only be partially compensated for by increased absorption of folic acid-rich food. Folic acid is responsible for DNA synthesis, cell replication on the one hand and methylation processes on DNA, but also on proteins and other molecules. Folic acid and vitamin B12 are involved in the conversion of homocysteine to methionine.
Folic acid supplementation at 400-600 μg / d – two months pre-conception to 3 months after conception – has shown an 80% reduction in cranial (anencephalus, encephalocele) and caudal neural tube defects (NRD) (spina bifida, myelomeningocele) in randomized trials (RCTs). shown (4). The risk of recurrence can also be reduced by 67% by folic acid supplementation (4-5 mg / d). A reduction in other fissures or other malformations (cardiac, urogenital) could be demonstrated only in some studies. Meta-analyzes and systematic reviews show that folic acid supplementation reduces the risk of autism disease by 33% and can reduce the risk for SGA children (5, 6). Recent work has also shown an association between maternal folate intake and first-trimester embryonic growth (7). The influence of folic acid on DNA methylation and thus also epigenetic modulation of the expression of genes associated with metabolism, growth, and appetite regulation may also explain the influence on diseases that only occur in adults (8). Apart from the risk of malformation, a folic acid deficiency or an increase in homocysteine is associated with vascular endothelial damage such as abortion, vascular diseases, neurological disorders, diabetes and carcinomas outside of pregnancy (9).
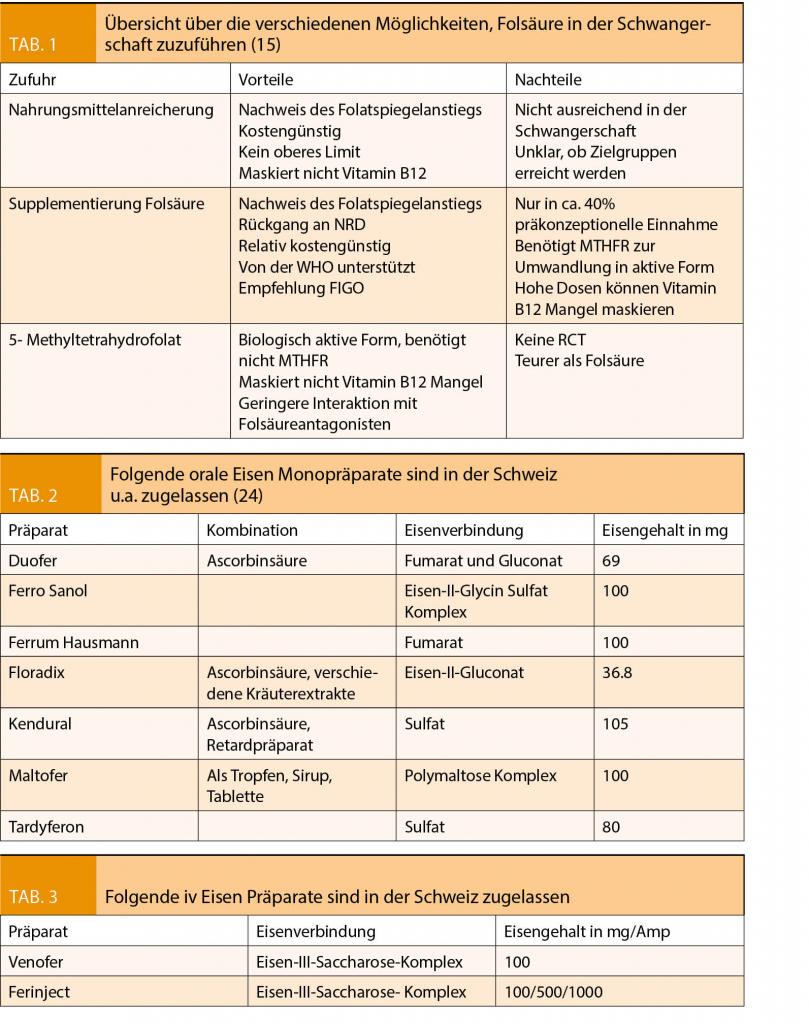
Folsäure liegt in drei verschiedenen Formen vor (10):
- Synthetisch produzierte Folsäure wird in über 50 Ländern (z.B. USA, Kanada) seit 1998 in Lebensmitteln verwendet. Sie wird allein oder in Kombination mit Multivitaminen zur Supplementierung in der Schwangerschaft angeboten. Nach intrazellulärer Aufnahme ist eine enzymatisch gesteuerte Umwandlung in das 5 Methyl-Tetrahydrofolat notwendig.
- Folsäure liegt in seiner biologischen Form in der Nahrung als 5- Formyl-Tetrahydrofolat vor. Hauptvertreter sind Weizenkeime, Sonnenblumenkerne, Linsen, Tomaten, Orangen und grünes Gemüse.
- 5 Methyl-Tetrahydrofolat ist die aktive Form der Folsäure.
20-40% der Kaukasier in den USA, 10-14% aller Spanier und Italiener, aber nur 2% aller Schwarzafrikaner aus Subsahara-Afrika weisen einen Polymorphismus in der Synthese der Methylentetrahydrofolatreduktase (MTHFR) auf (11). In der heterozygoten Form führt dies zu einer Aktivitätseinschränkung der normalen Enzymfunktion um 30%, in seiner homozygoten Form um 50-60%. Die synthetisch hergestellte Folsäure benötigt bei der Umwandlung in die aktive Form die MTHFR. Liegt ein Polymorphismus dieses Enzyms vor, ist sowohl die Resorption als auch die Umwandlung der Folsäure reduziert. Eine Metanalyse konnte zeigen, dass die OR für Neuralrohrdefekte mit 1.03 (1.09-1.56) erhöht ist, wenn bei der Mutter ein MTHFR Polymorphismus vorliegt (12).
Folsäureantagonisten wie Methotrexat oder Trimethoprim reduzieren ebenfalls die intestinale Absorption von Folsäure via Blockierung der Dihydrofolatreduktase.
Ein Mangel an Vitamin B12 kann wie ein Folsäuremangel zu einer megaloblastären (MCV > 100fl/Zelle) Anämie führen. Eine Folsäuresupplementierung korrigiert die Anämie, kann aber zu einer Progression neurologischer Symptome (Neuropathie, Parästhesien, Muskelparesen, depressive Verstimmung) führen, die bei einem Vitamin B12 Mangel auftreten können. Somit wird der Vitamin B12 Mangel maskiert. Liegt eine makrozytäre Anämie vor, sollte vor Folsäuresupplementierung der Vitamin B12 Status erhoben werden (13).
Hinweise für ein erhöhtes Risiko für Mammakarzinom oder kolorektale Karzinome nach Folsäureeinnahme (bis max. 5mg/d) während der Schwangerschaft haben sich in einer 35 Jahre Follow up Studie nicht gezeigt (14).
Vitamin B1 (Thiamin)
Thiamin ist ein wasserlösliches Vitamin mit einer kurzen Halbwertzeit von 10-20 Tagen. Die gespeicherte Gesamtmenge an Thiamin beträgt 30 mg. Die tägliche notwendige Zufuhr beträgt 1.4 mg, in der Schwangerschaft steigt der Bedarf nur gering um zusätzliche 0.3 mg/Tag. Der Bedarf für den Kohlenhydratstoffwechsel im Gehirn steigt jedoch in der Schwangerschaft um 45%. Vitamin B1 spielt bei der Energiegewinnung aus Glucose eine Rolle. Thiaminmangel führt zu einem eingeschränkten oxydativen und Energiemetabolismus. Unbehandelt können irreversible neurologische Störungen auftreten, unter anderem die Wernicke Enzephalopathie (Trias aus Ataxie, Nystagmus, Enzephalopathie).
Ausserhalb der Schwangerschaft zeigt sich ein Thiaminmangel bei schwerem Alkoholismus. In der Schwangerschaft sind zwei klinische Situationen bekannt (16):
1. Hyperemesis
a. Prolongiert mehr als 4 Wochen, Beginn nach 10 SSW
b. Unter totaler parenteraler Ernährung (17)
2. Schwangerschaft nach bariatrischem Eingriff ohne Substitution
Die Prodrome der Wernicke Enzephalopathie sind dieselben wie bei einer Hyperemesis gravidarum und können zu einer verzögerten Diagnose führen: Inappetenz, Übelkeit und Erbrechen. Dazu kommen aber noch unscharfes Sehen oder Doppelbilder. Im Durchschnitt hatten diese Patientinnen einen Gewichtsverlust von mehr als 12 kg, bevor sie eine Wernicke Enzephalopathie entwickelten. Bei Hyperemesis gravidarum wird von den meisten Fachgesellschaften eine prophylaktische Gabe von 100 mg Thiamin intravenös oder intramuskulär empfohlen. Bei akuten Zeichen für eine Wernicke Enzephalopathie sollten 3 x 50 mg/d Thiamin appliziert werden, bis zum Verschwinden der Symptome (18-20).
Eisen
Der Bedarf an Eisen verdoppelt sich in der Schwangerschaft und kann nur teilweise durch Steigerung der Resorption aus dem Dünndarm kompensiert werden. Die WHO schätzt, dass 45 Mio. Schwangere von einer Eisenmangelanämie betroffen sind (21). In Ländern mit niedrigem Einkommen ist fast jede Schwangere betroffen, in den einkommensstarken Ländern ca. 40%. Eine präventive Eisensupplementierung reduziert eine maternale Anämie um 70% (22). In der Schweiz existiert ein Screening auf Eisenmangel in der Frühschwangerschaft (Serum Ferritinbestimmung < 30 µg/l bei normalem CRP), um damit eine unnötige Eisensupplementierung zu vermeiden bzw. vor Eintreten einer Anämie präventiv zu behandeln. Es ist bekannt, dass die Anämie in Abhängigkeit des Schweregrades, einen bedeutenden Risikofaktor in Bezug auf die mütterliche und fetale Morbidität und Mortalität darstellt. Hierzu gehören auf der fetalen Seite eine erhöhte Frühgeburtsrate, intrauterine Wachstumsretardierung und verminderte neonatale Eisenspeicher im Falle einer Eisenmangelanämie der Mutter. Zu den mütterlichen Risiken gehören: erhöhtes Infektionsrisiko, verminderte Blutreserven bei der Geburt und damit ein erhöhtes Risiko der Fremdblutgabe bei grösserem Blutverlust, kardiovaskuläre Belastung, Anämie Symptome, verminderte Milchproduktion im Wochenbett, erhöhtes Risiko für postpartale Depressionen, verminderte mütterliche Eisenspeicher postpartal und in der Folgezeit (23). Da heutzutage eine Vielzahl der Sectiones geplant ist, bietet die frühe Eisensupplementierung bei Eisenmangel im Sinn eines geburtshilflichen «patient blood management» eine optimale Möglichkeit, eine präoperative Eisenmangelanämie und damit unnötige Bluttransfusionen zu vermeiden.
Eisen liegt in verschiedenen Formen vor:
- Orale Monopräparate (Dragée, Kapseln, Tropfen, Sirup):
- Zweiwertiges Eisen (Fe2 + ): bessere Absorption, mehr Nebenwirkungen
- Dreiwertiges Eisen (Fe3 + )
Intravenöse Therapie:
- Eisen- Carboxymaltose
- Eisen- Saccharat
Vitamin D
Je früher, desto besser, lautet die Überschrift im The Lancet Diabetes/Endocrinology (25). Diese Aussage bezog sich auf eine Studie, bei der eine Relation zwischen dem Vit. D Spiegel präkonzeptionell und der Rate an Lebendgeburten gefunden wurde. Das sogenannte Sonnenscheinvitamin ist dafür bekannt, dass es für den maternalen Kalziumstoffwechsel und damit für den fetalen Knochen und Muskelaufbau verantwortlich ist. Es besitzt darüber hinaus antiproliferative und immunmodulierende Eigenschaften. Nur ein Viertel wird via Nahrung aufgenommen, drei Viertel durch Eigensynthese, abhängig von der Sonnenexposition. Gemäss dem Bericht der eidgenössischen Ernährungskommission wird eine generelle Supplementierung bei Schwangeren mit 600 IU/d empfohlen, eine Vit. D Bestimmung bei allen Risikogruppen, die ein erhöhtes Risiko für einen Vit. D Mangel haben (26). Dazu zählen dunkelhäutige Schwangere, Frauen mit geringer Lichtexposition, erhöhtem Risiko für Präeklampsie, Gestationsdiabetes, Malabsorptionssyndrom, Niereninsuffizienz, Einnahme von Vit. D hemmenden Medikamenten oder Mehrlingsschwangerschaften. Als Vit. D Mangel wird ein 25-Hydroxyvitamin D Wert unter 50 nmol/l, ein ausgeprägter Mangel unter 25 nmol/l bezeichnet. Der Tagesbedarf inklusive Supplementierung und Nahrungsmittel sollte bei 1000-2000 IU/d liegen.
Vitaminsupplementierung bei Schwangeren nach bariatrischen Eingriffen
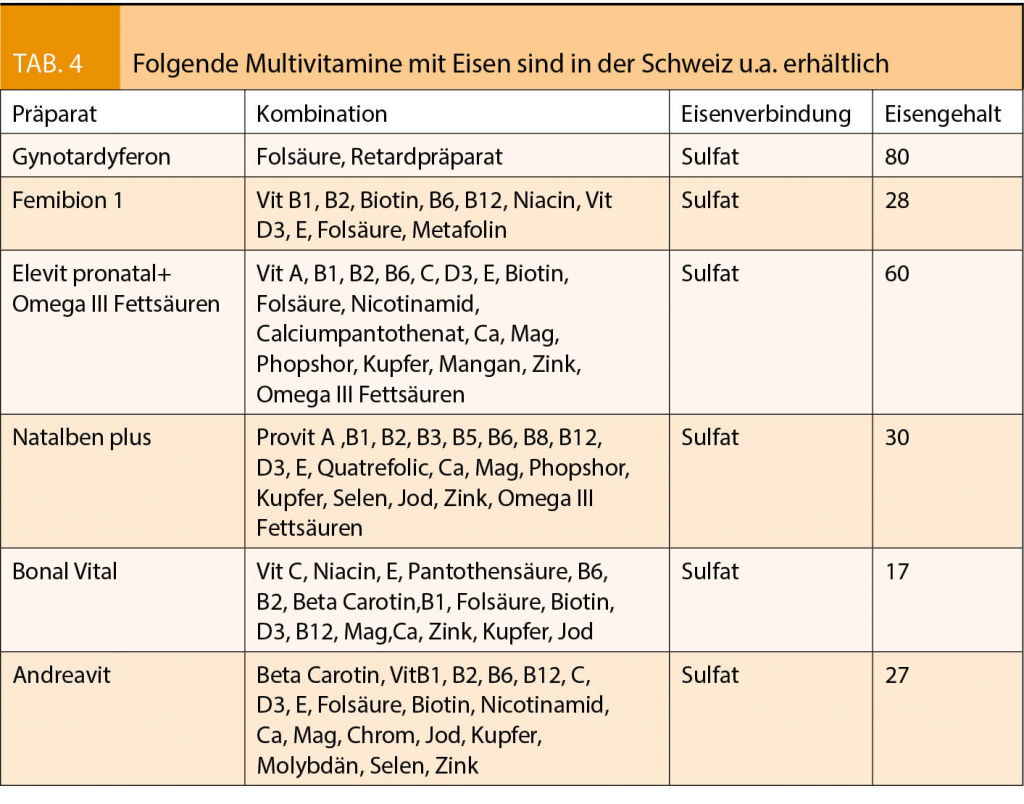
Die Anzahl bariatrischer Eingriffe hat sich innerhalb von 7 Jahren in den USA verzehnfacht und betrifft in 80% Frauen, in der Hälfte Frauen im reproduktiven Alter. Schwangerschaften mit erfolgreicher Gewichtsabnahme nach bariatrischen Eingriffen haben weniger Schwangerschaftskomplikationen, seltener eine Präeklampsie oder Gestationsdiabetes (27). Wenn chirurgische malabsorptive Massnahmen (Magenbypass, Biliopankreatische Diversion) bei den bariatrischen Eingriffen angewendet werden, beeinflussen sie die Resorption von Makro- und Mikronutrients. Die Ausschaltung von Teilen des Dünndarms mit verdauungsfördernden Enzymen reduziert die Aufnahme der fettlöslichen Vitamine (D, B1 und B12) sowie bedeutsamer Spurenelemente (Eisen, Zink, Magnesium und Kalzium). Die wichtigsten Vitamine bzw. Mineralstoffe, die in der Schwangerschaftskontrolle kontrolliert und trotz empfohlener Einnahme eines Multivitamins eventuell substituiert werden müssen, sind nachfolgend aufgeführt: (28, 29)
Eisen: das Risiko für Eisenmangelanämien ist erhöht. Sowohl präkonzeptionell als auch in jedem Trimenon sollten Serum Ferritinwerte kontrolliert werden. Der Bedarf liegt zwischen 100-200 mg/d.
Vitamin B1: 12-15 mg/d oder entsprechendes Multivitamin, entsprechende Erhöhung auf 200-300 mg/ bei prolongiertem Erbrechen.
Vitamin B12: Der Vitamin B12 Spiegel sollte alle 3 Monate während der Schwangerschaft kontrolliert werden. Eine Vit. B 12 Therapie ist sowohl mit einer 4-12 wöchentlichen i.m. Injektionen von 1000 µg als auch mit einer sublingualen Applikation von 350 µg/d oder oralen täglichen Gabe von 1000 µg möglich.
Vitamin D3 und Kalzium: Bei Adipositas ist der Vit. D 3 Spiegel in bis zu 74% präoperativ erniedrigt, auf Grund des tiefen Vit. D3 und Kalziumspiegels kommt es oft zu einem sekundären Hyperparathyreoidismus mit Anstieg des Parathormons. Für eine normale fetale Knochenmineralisation ist nach bariatrischen Eingriffen eine Vit. D 3 Supplementation von 800-1000 IE Vit. D3/d und eine Kalziumsupplementierung zwischen 1000-2000 mg Kalziumzitrat/d mit Verlaufskontrollen notwendig.
Folsäure: Die Standardeinnahme von 400 µg/d Folsäure gilt auch nach bariatrischen Eingriffen, eine höhere Dosierung ist nur bei erniedrigtem Folatspiegel zu empfehlen. Präkonzeptionell werden bis zu 5mg/d bis zur 12. SSW empfohlen.
Vitamin A: Eine zusätzliche Substitution ist nicht erforderlich. Keine Retinol basierten Vit. A Präparate, Beta Carotin möglich.
Vitamin E und Vitamin K: Regelmässige Vitaminkontrollen werden empfohlen.
Zink: 15 µg /d werden zusätzlich empfohlen oder entsprechendes Multivitamin, Ratio 8-15 mg Zink zu 1mg Kupfer
Selen: im Mutlivitamin
Kupfer: im Multivitamin
Protein: eine Proteinzufuhr von 60 mg wird empfohlen.
Basel
Die Autorin deklariert keine Interessenskonflikte im Zuammenhang mit diesem Artikel.
- Sowohl in einkommensarmen als auch einkommensstarken Ländern besteht ein Defizit an Mikronährstoffen, insbesondere an Eisen,
Folsäure und Vitamin D. - Folsäure liegt in verschiedenen Formen vor, bei einer makrozytären Anämie muss ein zusätzlicher Vitamin B12 Mangel ausgeschlossen werden.
- Die Zunahme an bariatrischen Eingriffen benötigt in der Schwangerschaft zusätzliche Supplementierung und Verlaufskontrollen von Mikronährstoffen.
- Auch bei der Hyperemesis gravidarum ist speziell eine Thiamin-substitution zu bedenken, um irreversible neurologische Schäden zu verhindern.
Messages à retenir
- Dans les pays à bas revenu comme dans ceux à haut revenu, on observe un déficit en micro-aliments, notamment pour le fer, l’ acide folique et la vitamine D.
- L’ acide folique est disponible sous 3 formes. En cas d’anémie macrocytaire, il faut exclure un manque concomitant de vitamine B12.
- L’augmentation du nombre de grossesses après chirurgie bariatrique nécessite pour les micro-aliments des substitutions et des contrôles
de suivi supplémentaires. - En cas de vomissements gravidiques incoercibles, il faut penser en particulier à la substitution de la thiamine afin d’éviter des dommages neurologiques irréversibles.
1. Moos, M.K., et al., Healthier women, healthier reproductive outcomes: recommendations for the routine care of all women of reproductive age. Am J Obstet Gynecol, 2008. 199(6 Suppl 2): p. S280-9.
2. Haider, B.A. and Z.A. Bhutta, Multiple-micronutrient supplementation for women during pregnancy. Cochrane Database Syst Rev, 2017. 4: p. CD004905.
3. Parisi, F., et al., Micronutrient supplementation in pregnancy: Who, what and how much? Obstet Med, 2019. 12(1): p. 5-13.
4. De-Regil, L.M., et al., Effects and safety of periconceptional oral folate supplementation for preventing birth defects. Cochrane Database Syst Rev, 2015(12): p. CD007950.
5. Wang, M., et al., The association between maternal use of folic acid supplements during pregnancy and risk of autism spectrum disorders in children: a meta-analysis. Mol Autism, 2017. 8: p. 51.
6. Hodgetts, V.A., et al., Effectiveness of folic acid supplementation in pregnancy on reducing the risk of small-for-gestational age neonates: a population study, systematic review and meta-analysis. BJOG, 2015. 122(4): p. 478-90.
7. van Uitert, E.M., et al., Human embryonic growth trajectories and associations with fetal growth and birthweight. Hum Reprod, 2013. 28(7): p. 1753-61.
8. Pauwels, S., et al., Maternal intake of methyl-group donors affects DNA methylation of metabolic genes in infants. Clin Epigenetics, 2017. 9: p. 16.
9. Liew, S.C. and E.D. Gupta, Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism: epidemiology, metabolism and the associated diseases. Eur J Med Genet, 2015. 58(1): p. 1-10.
10. Obeid, R., W. Holzgreve, and K. Pietrzik, Is 5-methyltetrahydrofolate an alternative to folic acid for the prevention of neural tube defects? J Perinat Med, 2013. 41(5): p. 469- 83.
11. Binia, A., et al., Geographical and ethnic distribution of single nucleotide polymorphisms within genes of the folate/homocysteine pathway metabolism. Genes Nutr, 2014. 9(5): p. 421.
12. Yan, L., et al., Association of the maternal MTHFR C677T polymorphism with susceptibility to neural tube defects in offsprings: evidence from 25 case-control studies. PLoS One, 2012. 7(10): p. e41689.
13. Reynolds, E., Vitamin B12, folic acid, and the nervous system. Lancet Neurol, 2006. 5(11): p. 949-60.
14. Charles, D., et al., Taking folate in pregnancy and risk of maternal breast cancer.BMJ, 2004. 329(7479): p. 1375-6.
15. Pietrzik, K., L. Bailey, and B. Shane, Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin Pharmacokinet, 2010. 49(8): p. 535-48.
16. Frank, L.L., Thiamin in Clinical Practice. JPEN J Parenter Enteral Nutr, 2015. 39(5): p. 503-20.
17. Giugale, L.E., O.M. Young, and D.C. Streitman, Iatrogenic Wernicke encephalopathy in a patient with severe hyperemesis gravidarum. Obstet Gynecol, 2015. 125(5): p. 1150-2.
18. Oudman, E., et al., Wernicke’s encephalopathy in hyperemesis gravidarum: A systematic review. Eur J Obstet Gynecol Reprod Biol, 2019. 236: p. 84-93.
19. Nagarajan, E., C. Rupareliya, and P.C. Bollu, Wernicke’s Encephalopathy as a Rare Complication of Hyperemesis Gravidarum: A Case Report and Review of Literature. Cureus, 2018. 10(5): p. e2597.
20. Sechi, G. and A. Serra, Wernicke’s encephalopathy: new clinical settings and recent advances in diagnosis and management. Lancet Neurol, 2007. 6(5): p. 442-55.
21. McLean, E., et al., Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005. Public Health Nutr, 2009. 12(4): p. 444-54.
22. Cantor, A.G., et al., Routine iron supplementation and screening for iron deficiency anemia in pregnancy: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med, 2015. 162(8): p. 566-76.
23. C. Breymann, C.H., I. Hösli, D. Surbek, Diagnostik und Therapie der Eisenmangelanämie in der Schwangerschaft und postpartal. Expertenbrief No 48 SGGG, 2017.
24. A, T., Eisenmangel und Eisentherapie. Der informierte Arzt, 2013. 10.
25. Hewison, M., The earlier the better: preconception vitamin D and protection against pregnancy loss. Lancet Diabetes Endocrinol, 2018. 6(9): p. 680-681.
26. Nutrition, F.C.f., Vitamin D deficiency: Evidence, safety, and recommendations for the Swiss Population. Expert report of the FCN. Federal Office for Public Health. 2012.
27. ACOG practice bulletin no. 105: bariatric surgery and pregnancy. Obstet Gynecol, 2009. 113 (6): p. 1405-13.
28. Slater, C., et al., Nutrition in Pregnancy Following Bariatric Surgery. Nutrients, 2017. 9 (12).
29. O’Kane, M., et al., Guidelines for the follow-up of patients undergoing bariatric surgery. Clin Obes, 2016. 6 (3): p. 210-24.
info@gynäkologie
- Vol. 9
- Ausgabe 2
- April 2019