- Infections sexuellement transmissibles en grossesse
Les infections sexuellement transmissibles (IST) représentent actuellement un problème de santé majeur au niveau mondial. Touchant la population féminine en âge de procréer la plus touchée, les IST ont un impact direct sur la santé reproductive, pouvant causer des complications en cours de grossesse chez la mère et le fœtus ainsi que le nouveau-né. La prise en charge est souvent multidisciplinaire, mais c’ est au gynécologue-obstétricien de savoir dépister, suivre, reconnaitre les signes d’ atteinte fœtale et maternelle et gérer l’ accouchement en cas d’ infection durant la grossesse.
Sexuell übertragbare Infektionen (STIs) sind derzeit weltweit ein grosses Gesundheitsproblem. Bei der am stärksten betroffenen weiblichen Bevölkerung im gebärfähigen Alter haben STIs einen direkten Einfluss auf die reproduktive Gesundheit, was während der Schwangerschaft Komplikationen für Mutter und Fötus sowie für das Neugeborene verursachen kann. Das Management ist oft multidisziplinär, aber es liegt am Geburtshelfer, die Anzeichen einer fetalen und mütterlichen Ansteckung festzustellen, zu überwachen, zu erkennen und im Falle einer Infektion während der Schwangerschaft ein entsprechendes Geburtsmanagement zu gewährleisten.
Chlamydia trachomatis
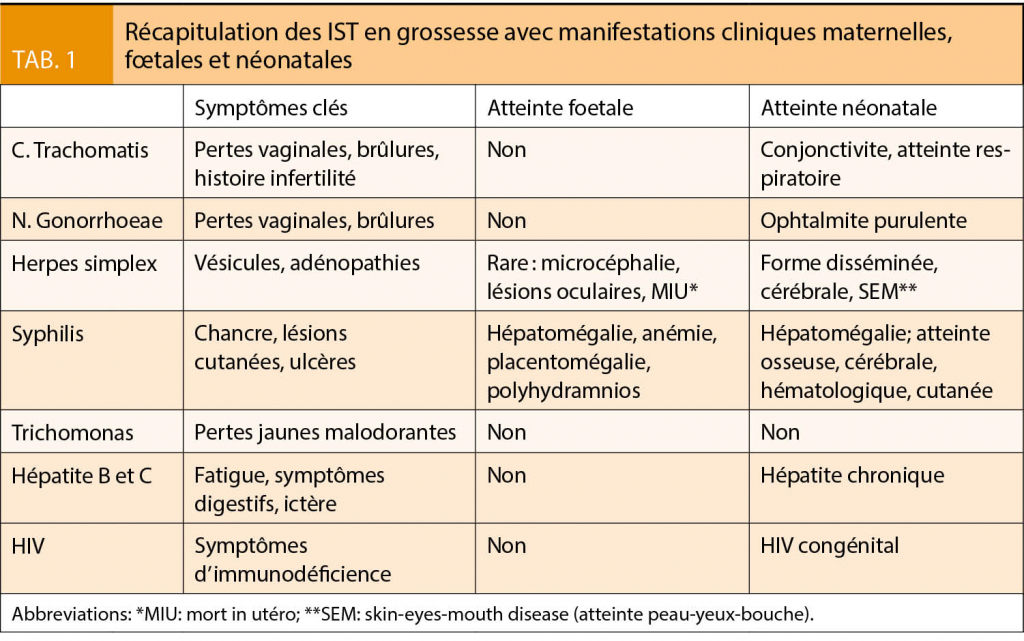
Première IST notifiée par fréquence en cours de grossesse, l’ infection à Chlamydia est en augmentation, notamment chez les jeunes femmes entre 15 et 24 ans (11 000 nouveaux cas en Suisse en 2017) (1). Durant la grossesse l’ infection est souvent asymptomatique et de découverte fortuite. Des études ont trouvé une association avec un risque accru de fausse couche précoce (2, 3, 4), d’ accouchement prématuré, de retard de croissance intra-utérin (RCIU) et de mort in utéro (MIU) notamment dans les pays en voie de développement (5, 6, 7, 8). Le risque de transmission verticale à l’ accouchement est estimé à < 2 % (9; 10). Les manifestations cliniques chez le nouveau-né sont la conjonctivite (50 %) à 5-14 jours de vie et les atteintes respiratoires (5-15 %) à 3-7 semaines de vie. L’ endométrite du post-partum est rare. Un dépistage en début de grossesse s’ impose pour toute femme de moins de 25 ans, ayant des partenaires multiples et / ou antécédents d’ IST. Il est réalisé par PCR sur frottis cervical ou vaginal selon les recommandations suisses (11, 12). Le traitement de premier choix pendant la grossesse est une dose unique de Azythromicine 1g PO avec un frottis de contrôle à 6 semaines (13). Le traitement en dose unique doit être également proposé au(x) partenaire(s) sans nécessité de dépistage.
Herpes simplex (HSV)
La séropositivité de HSV (types 1 et 2 confondus) chez les femmes enceintes est d’ environ 70-80 % (14); l’ infection par HSV2 reste la plus fréquente au niveau génital. La grossesse ne modifie pas la symptomatologie. Durant la grossesse le risque de primo-infection génitale est de 1-5 % (20 % si partenaire séropositif) et favorisé par la co-infection avec une autre IST (15). Une transmission in utéro est possible, mais très rare, pouvant causer des lésions graves (microcéphalie, lésions oculaires) et MIU; un suivi échographique spécialisé n’ est pas indiqué. La transmission à l’ accouchement est plus fréquente (1/10 000 naissances vivantes aux USA). Le risque est environ de 60 % en cas de primo-infection proche de l’ accouchement (moins de 6 semaines) mais chute à < 3 % en cas de récurrence (notamment en cas de HSV1). Les symptômes néonataux sous forme soit disséminée, cérébrale ou SEM (skin-eyes-mouth disease) se manifestent jusqu’ à 4-6 semaines après l’ accouchement avec un taux de mortalité confondu de 35 % (16). Le dépistage systématique n’ a pas montré de bénéfices, cependant la recherche anamnestique doit être systématique. Il est recommandé de réaliser une césarienne si la primo-infection a eu lieu à l’ accouchement et jusqu’ à 6 semaines avant, dans un délais idéal < 4h de la rupture des membranes (RM). En cas de récurrence au niveau vulvaire à l’ accouchement, certains pays (UK) permettent un accouchement par voie basse (AVB) après discussion avec la patiente. En cas de lésions à distance de la vulve un AVB peut être indiqué après isolement des lésions ; une augmentation du risque de transmission par manœuvres invasives en cours de travail (pH scalp, amniotomie, instrumentation) reste controversée. En cas de rupture prématurée des membranes (RPM) < 37 SA et récurrence, une attitude expectative sous traitement antiviral peut être envisagée (17, 14, 18). Une prophylaxie est à introduire dès 36 SA (32 SA si risque d’ accouchement prématuré) en cas de primo-infection au 1er-2ème trimestre et de récurrences fréquentes (19). Le risque de transmission en post-natal est de 10 %, surtout par HSV1 (entourage). L’ allaitement maternel n’ est pas contre-indiqué.
Syphilis
Selon l’ OMS la syphilis est encore aujourd’ hui la 1ère cause d’ infection congénitale et la 2ème de mortalité in utéro (après le paludisme) au niveau mondial (20; 21). Dans les pays européens en 2017, l’ incidence de la syphilis congénitale était de 1.1/100 000 naissances (22); seulement 2 cas ont été déclarés en Suisse (1). Le dépistage durant la grossesse se fait au 1er trimestre (à contrôler au 3ème si groupe à risque) (23). Le diagnostic se fait par combinaison de tests tréponémiques (FTA, TPHA, ELISA) pour la détection, et non tréponémiques (RPR, VDRL) pour la datation de l’ infection et le suivi. En l’ absence de traitement, la transmission verticale se fait dès 11-16 SA par voie transplacentaire à tout stade de maladie (si syphilis récente > 50 %, si syphilis latente précoce 35 %, si tardive 8 %) et pendant toute la grossesse, avec risque d’ accouchement prématuré, MIU (par altération de la vascularisation placentaire), RCIU. On recherche une atteinte fœtale par échographie à partir de 20 SA avec, classiquement, hépatomégalie, anémie fœtale (augmentation pic systolique ACM, hydrops), placentomégalie, polyhydramnios. Une échographie normale n’ exclut pas une atteinte fœtale (24). Parmi les nouveau-nés atteints de syphilis congénitale, 35 % seront asymptomatiques à la naissance; dans 40 % des cas, en absence de traitement, ils développeront par la suite une hépatomégalie, des altérations hématologiques/osseuses/cutanées et des séquelles neurologiques/osseuses. Le traitement est 2.4 MU de Benzathine pénicilline G IM avec nombre de doses variable en fonction de l’ ancienneté de l’ infection, à tout moment de la grossesse (23). Le suivi se fait par décroissance des tests non tréponémiques et par amélioration échographique (25). La réaction d’ Herxheimer peut engendrer des contractions utérines, des anomalies du rythme et du RCIU. Le traitement sera donc à donner sous surveillance au 3ème trimestre. L’ allaitement n’ est pas contre-indiqué.
Neisseriae Gonorrhoeae (NG)
Avec 2800 cas déclarés en Suisse en 2017 (soit 4 % plus qu’ en 2016), laNG est la deuxième IST la plus fréquente (1). L’ incidence de l’ infection en cours de grossesse est d’ environ 4.9/100 femmes/année (26). Le dépistage par PCR sur frottis cervical n’ est pas systématique mais est à envisager en cas de groupes à risque, partenaires multiples ou co-infection par un autre IST (Chlamydia in primis). La transmission ascendante de l’ infection est responsable d’ une cervicite, pouvant entrainer dans des rares cas : une RPM, une chorioamniotite ou un accouchement prématuré. La transmission verticale se fait par contact avec le développement d’ une ophtalmite purulente chez le nouveau-né à 3-15 jours de vie. Le traitement est de 500mg de Ceftriaxone IM associé à une dose unique de Azithromycine 1g (réduisant la résistance à la Ceftriaxone et pour traiter une éventuelle co-infection par Chlamydia) (27, 28, 10). Un frottis de contrôle et le traitement pour le(s) partenaire(s) doivent être réalisés.
Trichmonas vaginalis
Non dépistée systématiquement et non déclarée, la trichomonase est une IST avec une incidence presque double par apport à la chlamydiose. Des pertes vaginales malodorantes jaunâtres et une irritation vaginale ne sont présentes que dans 20-30 % des cas (10). Le diagnostic se fait par visualisation du parasite au microscope sur échantillon frais à une sensibilité de 50 %; la PCR est le gold standard du diagnostic (29). L’ association avec un risque accru d’ accouchement prématuré reste controversée. Le traitement recommandé est une dose unique de Metronidazole 2 g à tout terme de la grossesse (partenaire inclus) même si le bénéfice sur les issues de la grossesse reste incertain (30; 31). D’anecdotiques cas d’ infection respiratoires chez le nouveau-né suite à une transmission verticale par contact direct ont été reportés.
Hépatite B (HBV)
La prévalence de AgHBs (+) chez les femmes enceintes en Suisse est <2 %. Le taux de transmission verticale en cas d’ absence de prophylaxie durant la grossesse est de 10-40 % en cas de AgHBs (+) ; il augmente à 70-90 % en cas de AgHBe (+). Ce taux est de 10 % si l’infection a été acquise au 1er trimestre, de 80-90 % au 3ème. Le risque de chronicité pour les nouveaux nés infectés est de 90 %. Durant la grossesse le dépistage est obligatoire et un traitement est possible en cas de AgHBs et AgHBe positifs et par forte virémie. Le nouveau-né de mère infectée (AgHBs positifs sans ou avec positivité pour AgHbe) doit recevoir dans les premières 12h de vie une immunisation active et passive pour réduire le risque de transmission (jusqu’ à 90 %). 2 doses supplémentaires de vaccin seront à donner au cours de 6 mois. L’ allaitement n’ est pas contre-indiqué. La vaccination en cours de grossesse peut être indiquée en cas de population à risque (32, 33, 34, 35, 36).
Hépatite C (HCV)
La prévalence de HCV chez les femmes enceintes est de 0.6-6 % au niveau mondial avec un taux de transmission verticale (in utéro et à l’ accouchement) de 2-8 %, surtout en cas de charge virale (CV) élevée (> 106). Le dépistage n’ est pas systématique. Le diagnostic se fait par recherche d’ Ac antiHCV et virémie. Aucun traitement n’ est actuellement envisageable durant la grossesse. La transmission à l’ accouchement semble être favorisée par les procédures invasives et RM > 6 h. L’ allaitement n’ est pas contre-indiqué (35, 37).
HIV
Le dépistage systématique, les traitements antiviraux, ainsi qu’ un suivi spécifique durant la grossesse, l’ accouchement et le post-partum a permis de réduire la transmission verticale de 25 à moins de 1 %. Voici les principales lignes directrices pour la prise en charge. Dépistage systématique au 1er trimestre et à chaque grossesse. Monitorer la charge virale avec un contrôle vers 36 SA en adaptant le traitement pour obtenir une charge indétectable; un traitement doit être instauré au plus vite et poursuivi jusqu’ à l’ accouchement, une supplémentation par Zidovudine à l’ accouchement est indiquée en cas de CV > 1000 copies / mL. L’ accouchement vaginal est le gold standard en cas de virémie <50copies/mL sans réserve pour les manœuvres obstétricales ni la durée du travail; la césarienne est réservée aux patientes avec une CV > 50 copies / mL ou découverte de l’ infection à l’ accouchement (idéalement dans un délai <4h si RM). L’ allaitement est envisageable en cas de CV négative et bonne compliance au traitement mais doit être discuté cas par cas (38, 39, 40).
Département de la femme, de l’ enfant et de l’ adolescent
Service d’obstétrique
Hôpitaux Universitaires de Genève
Boulevard de la Cluse 30
1205 Genève
alessandra.vanetti@hcuge.ch
Département de la femme, de l’ enfant et de l’ adolescent
Service d’obstétrique
Hôpitaux Universitaires de Genève
Boulevard de la Cluse 30
1205 Genève
begona.martinezdetejada@hcuge.ch
Les auteurs n’ ont déclaré aucun conflit d’ intérêts en relation avec cet article.
- Le dépistage de HIV, HBV et syphilis est systématique pendant la grossesse; celui de Chlamydia, Gonocoque et HCV est réservé aux femmes à risque.
- Si positivité pour une IST il faut dépister systématiquement les autres. Le partenaire ne doit pas être oublié.
- Avec un traitement adéquat et une correcte information l’ accouchement par voie basse est aujourd’ hui le gold standard dans la majorité des cas.
Take-Home Message
- Das Screening auf HIV, HBV und Syphilis ist während der Schwangerschaft systematisch; dasjenige auf Chlamydien, Gonococcus und HCV ist auf Frauen mit einem Risiko beschränkt.
- Bei positivem Testresultat für eine STI sollte systematisch auf weitere untersucht werden. Der Partner darf nicht vergessen werden.
- Mit der richtigen Behandlung und Information ist die vaginale Geburt heute in den meisten Fällen der Goldstandard.
1. OFSP Bulletin 47-2018. 2018, Vol. 47.
2. Chlamydia trachomatis Infection of Human Trophoblast Alters Estrogen and Progesterone Biosynthesis: an insight into role of infection in pregnancy sequelae. Azenabor, AA. 2007, Int J Med Sci, Vol. 4(4), p. 223-231.
3. Chlamydia trachomatis infection of human endometrial stromal cells induces defective decidualisation and chemokine release. S, Giakoumelou. 2017, Sci Rep, Vol. 7(1):2001.
4. Differential expression of circulating Th1/ Th2/ Th17 cytokines in serum of Chlamydia trachomatis-infected women undergoing incomplete spontaneous abortion. P, Prasad. 2017, Microb Pathog, Vol. 110, p. 152-158.
5. Chlamydia trachomatis and the risk of spontaneous preterm birth, babies who are born small for gestational age, and stillbirth: a population-based cohort study. J., Reekie. 2018, Lancet Infect Dis, Vol. 18(4), p. 452-460.
6. Chlamydia trachomatis infection during pregnancy associated with preterm delivery: a population-based prospective cohort study. GI, Rours. 2011, Eur J Epidemiol, Vol. 26(6), p. 493-502.
7. Pregnancy outcomes in women infected with Chlamydia trachomatis: a population-based cohort study in Washington State. MM, Blas. 2007, Sex Transm Infect, Vol. 83(4), p. 314–318.
8. Chlamydia trachomatis and Adverse Pregnancy Outcomes: Meta-analysis of Patients With and Without Infection. C, Olson Chen. 2018, Maternal Child Health J, Vol. 22(6), p. 812-821.
9. Probability of vertical transmission of Chlamydia trachomatis estimated from national registry data. M, Honkila. 2017, Sex Transm Infect, Vol. 93, p. 416-420.
10. Centers for Disease Control and Prevention Sexually Transmitted Diseases Treatment Guidelines. KA, Workowski. 2015, Clin Infect Dis, Vol. 61(8), p. 759-62.
11. Infections sexuellement transmissibles à Chlamydia trachomatis: recommendations de la Commission fédérale pour la santé sexuelle (CFSS) et de la Société Suisse d’Infectiologie (SSI). 2017, Bulletin 35.
12. Pelvic inflammatory disease risk following negative results from chlamydia nucleic acid amplification tests (NAATs) versus non-NAATs in Denmark: A retrospective cohort. B, Davies. 2018, PLoS med, Vol. 15(1):e1002483.
13. Screening and treatment of Chlamydia trachomatis infections. S, Kalwij. 2010, BMJ, Vol. 340, p. 912-917.
14. Prevention and management of genital herpes simplex infection during pregnancy and delivery. Guidelines from the French College of Gynaecologists and Obstetricians (CNGOF). MV, Sénat. 2018, Eur J Obstet Gynecol Reprod Biol, Vol. 224, p. 93–101.
15. The Acquisition of Herpes Simplex Virus during Pregnancy. ZA, Brown. 1997, N Engl J Med, Vol. 337(8), p. 509-515.
16. First estimates of the global and regional incidence of neonatal herpes infection. KJ, Looker. 2017, Lancet Glob Health, Vol. 5(3), p. e300-e309.
17. Management of Genital Herpes in Pregnancy. RCOG. 2014, reviewed 2018.
18. No. 208-Guidelines for the Management of Herpes Simplex Virus in Pregnancy. DM, Money. 2017, J Obstet Gynaecol Can, Vol. 39(8), p. e199-e205.
19. Third trimester antiviral prophylaxis for preventing maternal genital herpes simplex virus (HSV) recurrences and neonatal infection. LM, Hollier. 2008, Cochrane Database Syst Rev, Vol. (1):CD004946.
20. Global burden of maternal and congenital syphilis in 2008 and 2012: a health systems modelling study. NS, Wijesooriya. 2016 Aug, Lancet Glob Health, Vol. 4(8), p. e525-33.
21. Stillbirths: rates, risk factors, and acceleration towards 2030. JE, Lawn. 2016, Lancet, Vol. 387(10018), p. 587-603.
22. Annual Epidemiological Report for 2017, Congenital syphilis. ECDC, European Centre for Disease Prevention and Control. 2018.
23. WHO guideline on syphilis screening and treatment for pregnant women. World Health Organisation. 2017.
24. Syphilis during pregnancy: a preventable threat to maternal-fetal health. MW, Rac. 2016, Am J Obstet Gynecol, Vol. 216(4), p. 352–363.
25. Progression of ultrasound findings of fetal syphilis after maternal treatment. MW, Rac. 2014, Am J Obstet Gynecol, Vol. 211(4), p. 426.e1-6.
26. Incidence of sexually transmitted infections during pregnancy. CA, Teasdale. 2018, PLoS One, Vol. 13(5):e0197696.
27. Gonorrhée: nouvelles recommandations en matière de diagnostic et de traitement. L, Toutous Trellu. 2014, Swiss Médical Forum, Vol. 20.
28. Chlamydia trachomatis among Patients Infected with and Treated for Neisseria gonorrhoeae in Sexually Transmitted Disease Clinics in the United States. SB, Lyss. 2003, Ann Intern Med, Vol. 139(3), p. 178-85.
29. Comparison of APTIMA Trichomonas vaginalis transcription-mediated amplification to wet mount microscopy, culture, and polymerase chain reaction for diagnosis of trichomoniasis in men and women. MB, Nye. 2009, Am J Obstet Gynecol, Vol. 200(2), p. 188.e1-7.
30. Interventions for trichomoniasis in pregnancy. AM, Gülmezoglu. 2011, Cochrane Database Syst Rev, Vol. (5):CD000220.
31. Failure of Metronidazole to prevent preterm delivery among pregnant women with asymptomatic Trichomonas vaginalis infection. M, Klebanoff. 2001, N Engl J Med, Vol. 345, p. 487–93.
32. Prevalence of hepatitis B surface antigen in pregnant mothers and its perinatal transmission. S, Biswas. 1989, Trans R Soc Trop Med Hyg, Vol. 83, p. 698–700.
33. Risks of chronicity following acute hepa-titis B virus infection: a review. KC, Hyams. 1995, Clin Infect Dis, Vol. 20(4), p. 992-1000.
34. Recommandations pour la prévention de la transmission mère-enfant de l’ hépatite B. OFSP, vaccinations, Commission fédérale pour les e Groupe de travail, Prévention de la transmission mère-enfant de l’hépatite B. 2007, Paediatrica, Vol. 18 n.2.
35. ACOG Practice Bulletin No. 86: Viral hepatitis in pregnancy. 86, 2007, Obstet Gynecol, Vol. 110(4), p. 941-56.
36. Hepatitis B Management in the Pregnant Patient: An Update. WS, Ayoub. 2016, J Clin Transl Hepatol, Vol. 4(3), p. 241–247.
37. Risk Factors for Perinatal Transmission of Hepatitis C Virus (HCV) and the Natural History of HCV Infection Acquired in Infancy. EE, Mast. 2005, J Infect Dis, Vol. 192(11), p. 1880-9.
38. Grossesse et VIH : prévention de la transmission verticale du VIH. B, Martinez de Tejada. 2018 n. 60, SGGG avis d’expert.
info@gynäkologie
- Vol. 9
- Ausgabe 2
- April 2019