- Thrombose veineuse profonde
La thrombose veineuse profonde est l’ une des deux manifestations (l’ autre est l’ embolie pulmonaire) de la maladie thromboembolique veineuse qui représente une des principales causes de morbidité et mortalité cardiovasculaire.
Le but de cet article est de réviser les connaissances concernant la prévention et le traitement de la TVP.
La thrombose veineuse profonde (TVP) est l’ une des deux manifestations (l’ autre est l’ embolie pulmonaire) de la maladie thromboembolique veineuse (MTEV) qui représente une des principales causes de morbidité et mortalité cardiovasculaire avec une prévalence dans la population générale de 1 - 2/1000 (1).
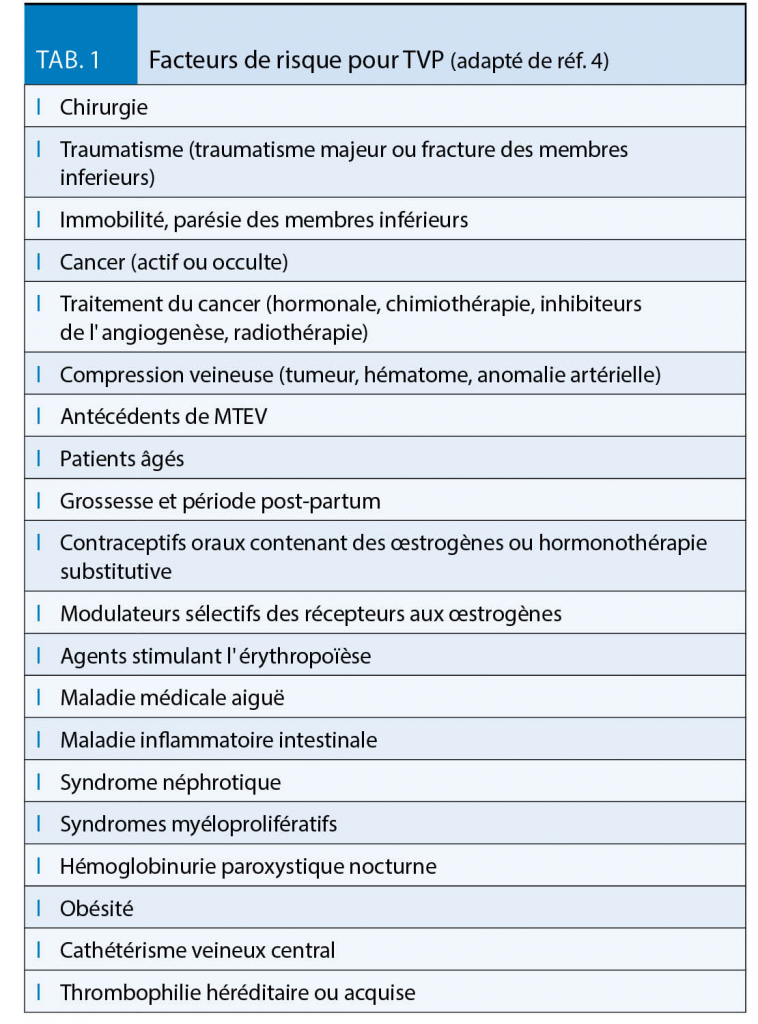
Bien qu’ une TVP puisse survenir secondairement à un facteur de risque transitoire (p.e. chirurgie, traumatisme, immobilisation prolongée, etc.) ou persistant (cancer, antécédents MTEV, thrombophilie, etc.), dans 20 à 40% des cas il n’ y a pas de facteur déclenchant évident. Dans ce cas nous parlons de TVP idiopathique ou non provoquée (2).
Les symptômes classiques d’ une TVP (douleur, œdème et rougeur) sont très aspécifiques et pour cette raison la suspicion de TVP doit toujours être confirmé par un test objectif. Le duplex veineux est le test de choix pour confirmer une TVP (3). Le but de cet article est de réviser les connaissances concernant la prévention et le traitement de la TVP.
Prévention
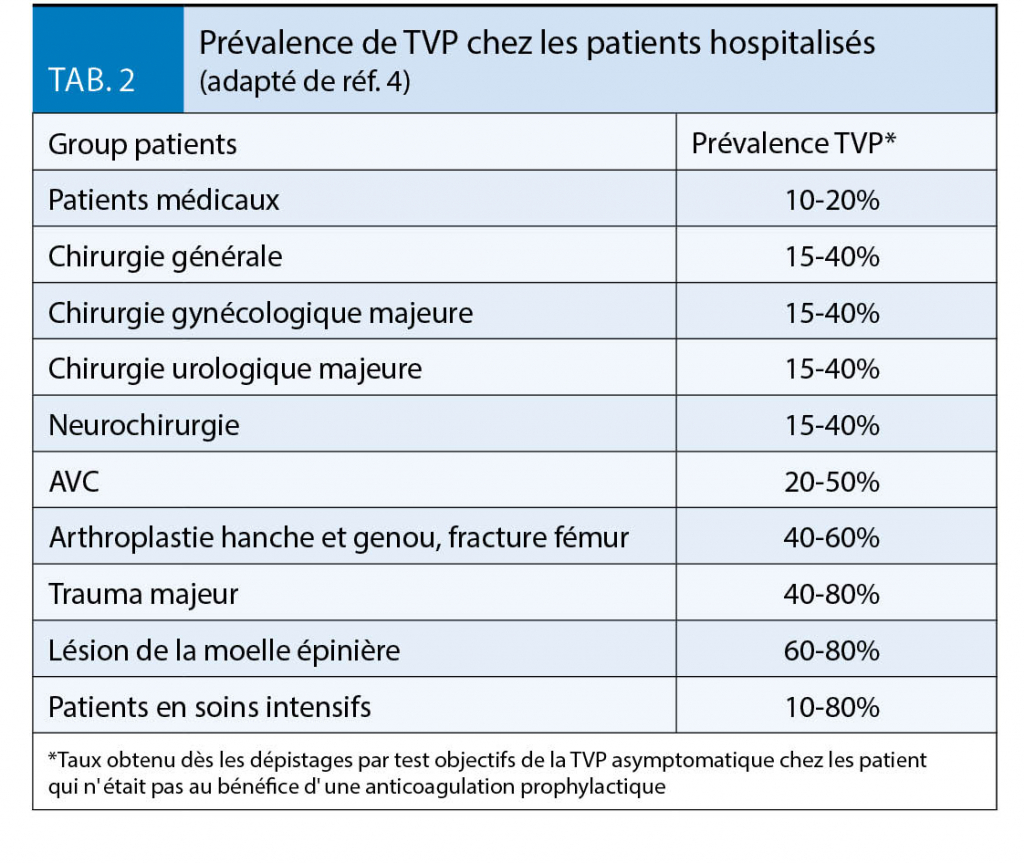
La plupart des patients hospitalisés ont au moins un facteur de risque de MTEV, et environ 40% ont trois facteurs de risque ou plus (tab. 1) (4). Sans une thromboprophylaxie adéquate, la prévalence de TVP chez les patients hospitalisés est d’ environ 10-20% chez les patients médicaux, 10 - 40% après chirurgie générale et 40-60% après chirurgie orthopédique majeure (notamment chirurgie pour prothèse de hanche, prothèse de genou et fracture du fémur) (tab. 2) (4).
En chirurgie orthopédique majeure, les héparines de bas poids moléculaire (HBPM) ont longtemps représenté la pierre angulaire de la prévention de la MTEV (5). Les guidelines proposaient comme deuxième choix également l’ héparine non fractionnée à doses abaissées (HNF - DB), le fondaparinux, les AVK et même l’ Aspirine (5). La durée de la prophylaxie recommandée est de 35 jours post opératoires. Depuis quelques années, des nouveaux anticoagulants oraux directes (ACOD) sont disponibles (6). Rivaroxaban, apixaban et dabigatran ont démontré une efficacité et sécurité au moins superposable aux HBPM dans la prévention de la MTEV après chirurgie orthopédique (7, 8). A noter néanmoins que le dabigatran n’ a pas encore été autorisé en Suisse dans cette indication.
Dans les cas de chirurgie non orthopédique, les HBPM, le fondaparinux et l’ HNF-DB se sont révélés efficaces (9). Les ACOD n’ ont pas été testés et ne sont donc pas recommandés. La durée de l’ anticoagulation après chirurgies majeures telles que gastro-intestinales, gynécologique, cardio-thoracique, neurologique ou urologique devrait être d’ au moins 5 - 7 jours, mais à poursuivre jusqu’ à remobilisation complète (9). En cas de risque thrombotique élevé (p.e. chirurgie oncologique abdominale ou pelvienne), une prolongation de la prophylaxie jusqu’ à 4 semaines est recommandée (9).
Chez les patients médicaux, une thromboprophylaxie est également recommandée en cas de pathologie sévère aiguë (pneumonie, décompensation cardiaque, etc.), à mettre en balance avec le risque hémorragique du patient. Plusieurs modèles (scores) pour identifier les patients à risque thrombotique élevé ont été développés (10). HBPM, fondaparinux et HNF-DB sont recommandées par les guidelines (11) pour une durée de 10-14 jours. Les ACOD ne sont pas autorisés en Suisse dans cette indication.
Le bénéfice d’ une extension de la prophylaxie jusqu’ à 4 semaines a été démontré chez les patients âgés > 75 ans, de sexe féminin et avec mobilité réduite (12).
En parallèle d’ une prophylaxie pharmacologique ou en cas de contre-indication à celle-ci, des mesures de prophylaxie mécanique peuvent être utilisées de routine (11). Les bas de compression graduée, les appareils à compression intermittente, ou des pompes au niveau des pieds sont les systèmes les plus utilisés avec une efficacité équivalente (11).
Traitement
Traitement anticoagulant
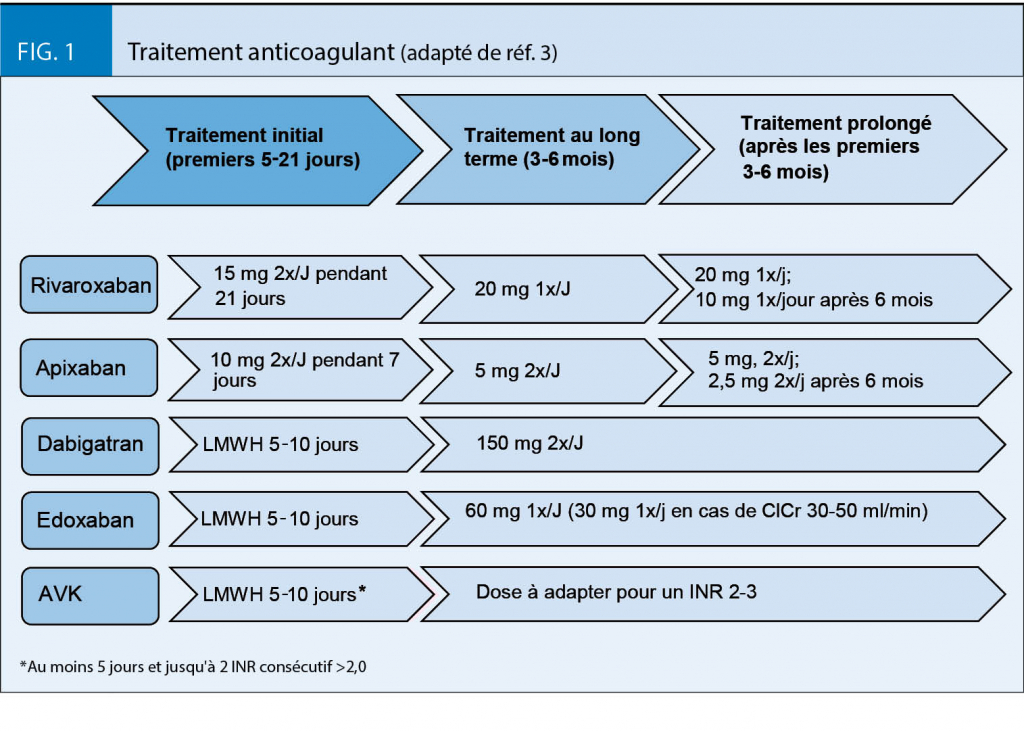
Le traitement de la TVP se compose de trois phases (fig. 1):
initiale correspondant aux premiers 5 - 21 jours après le diagnostic ; au long terme (les premiers 3 - 6 mois) et traitement prolongé au-delà des premiers 3 - 6 mois. Les deux premières phases sont obligatoires pour tous les patients avec TVP, la troisième est à considérer pour les patients avec risque élevé de récidive thrombotique (3, 13).
Durant la phase initiale les patients bénéficient d’ un traitement parentéral (par HBPM, Fondaparinux ou HNF) avec un relais par AVK ou utilisent les ACOD à doses élevées (fig.1). L’ HBPM est le traitement parentéral de choix, mais le fondaparinux est une alternative également efficace. L’ HNF est préférable chez les patients avec insuffisance rénale sévère (clairance de la créatinine < 30 mL / min) (3, 13).
Pour le traitement au long terme les AVK ou les ACOD peuvent être utilisés. Ces derniers se sont révélés au moins aussi efficaces que les héparines et AVK avec l’ avantage d’ être donnés à dose fixe, sans nécessité de monitoring de laboratoire et avec moins d’ interactions avec la nourriture ou d’ autres médicaments pris en parallèle. Ils sont, de plus, probablement plus sûrs que le traitement par héparine / AVK, notamment en terme de risque hémorragique (14). Les ACOD doivent donc être considérés comme premier choix chez les patients présentant un épisode de TVP aiguë (3, 13). Etant éliminés principalement par les reins ils sont contre-indiqués en cas d’ insuffisance rénale sévère. Ils ne sont également pas recommandés en cas de poids supérieurs à 120 kg (6). Dans ces situations, les AVK sont préférables (3, 6, 13). Enfin, chez les patients avec TVP dans un contexte de cancer actif, un traitement avec HBPM seule pour au moins 3 - 6 mois est recommandé (3, 13). Le traitement par HBPM seule est supérieur au traitement par héparine / AVK avec une réduction du risque de récidive thrombotique d’ environ 50% (15). Deux études ont récemment démontré une non-infériorité de l’ edoxaban (16) et du rivaroxaban (17) par rapport aux HBPM dans le traitement des TVP cancer-associés mais au prix d’ une augmentation significative du risque de saignement majeur, surtout au niveau gastro-intestinal (15-17).
Thrombolyse
Le rationnel pour l’ utilisation de la thrombolyse dans les patients avec TVP est qu’ une résolution précoce de la thrombose pourrait empêcher le développement du syndrome post-thrombotique (SPT). Toutefois, le rôle de la thrombolyse a été considérablement réduit après la publication de l’ étude ATTRACT (18). Dans cette grande étude clinique, qui a recruté 692 patients avec TVP proximale aiguë, l’ ajout d’ une thrombolyse par cathéter à l’ anticoagulation n’ a pas réduit le risque de SPT mais a, par contre, accru le risque de saignement majeur (18). La thrombolyse doit donc être réservée à des cas sélectionnés (p.e. risque vital pour le membre à la suite d’ une TVP avec phlegmasie) (3, 13).
Filtre veine cave inférieure
La pose d’ un filtre dans la veine cave inférieure est indiquée chez les patients présentant une TVP proximale aiguë avec contre-indication absolue à l’ anticoagulation thérapeutique. En dehors de cette indication la pose d’ un filtre n’ est pas indiquée (3, 13). Parmi les complications majeures nous retrouvons la thrombose du filtre et son déplacement qui peut compromettre un retrait ultérieur. Pour cette raison, l’ anticoagulation doit être débutée et le filtre retiré dès que possible.
Compression élastique
Le but de la compression est de soulager les symptômes veineux et éventuellement de prévenir le SPT. L’ efficacité des bas de compression dans la prévention du SPT a été remise en question par l’ étude SOX qui n’ a pas montré des bénéfices dans la prévention du SPT (19).
Toutefois, le port de bas de compression reste une option raisonnable pour contrôler les symptômes de TVP proximale aiguë (20). A noter que la compression doit être utilisée avec prudence chez les patients avec artériopathie grave des membres inférieurs.
Durée anticoagulation/prolongation du traitement
Après un premier épisode de TVP, le risque de récidive à 12 mois après arrêt de l’ anticoagulation est faible (1%) si l’ évènement était secondaire à un risque transitoire majeur (p.e. chirurgie); intermédiaire (4-5%) si secondaire à un facteur transitoire médical (p.e. maladie inflammatoire aiguë); élevé (jusqu’ à 9-10%) en cas de TVP non provoquée; très élevé (jusqu’ à 15-20%) en cas de facteurs de risque persistants (cancer actif, syndrome anticorps antiphospholipides et autre thrombophilie sévère).
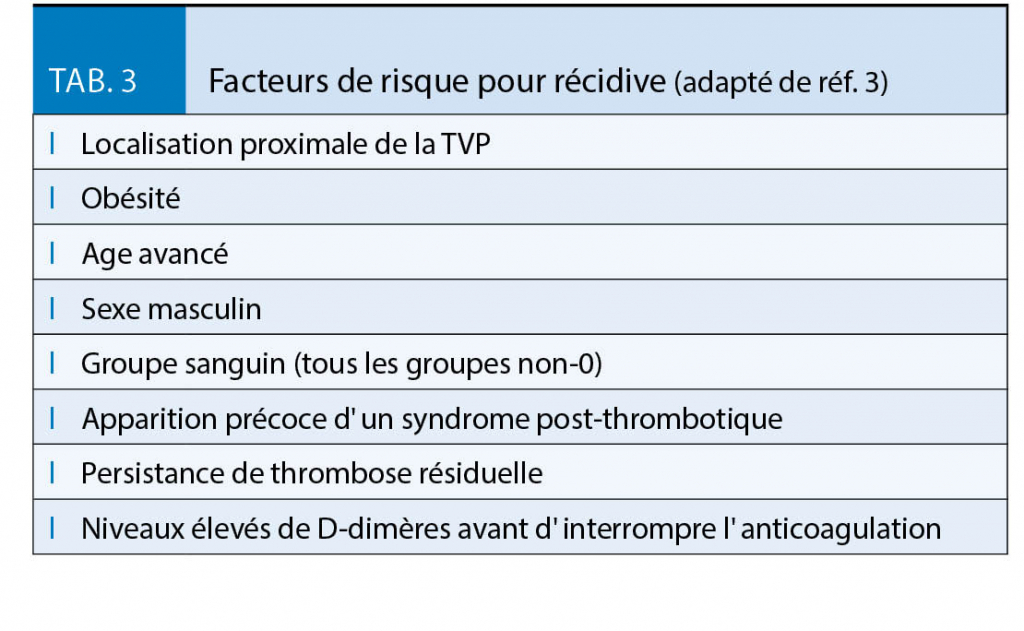
Une durée d’ anticoagulation de 3 mois est recommandée après le premier épisode de TVP pour les patients avec faible risque de récidive (3, 13). Pour tous les autres patients, la durée de l’ anticoagulation doit être individualisée en considérant le risque de récidive sans anticoagulation (tab. 3), le risque hémorragique sous anticoagulation et les préférences du patient (3, 13).
En cas de prolongation du traitement, les ACOD à dosage standard et les AVK (INR 2,0-3,0) peuvent être utilisés. Deux études cliniques récentes ont montré l’ efficacité et la sécurité de l’ apixaban (21) et du rivaroxaban (22) à dosage abaissé (apixaban 2,5 mg, 2 x / j et rivaroxaban 10 mg, 1 x / j) après 6 mois de traitement standard (cf fig. 1).
Conclusion
La TVP représente une des principales causes de morbidité et mortalité cardiovasculaire. Chez les patients hospitalisés une prophylaxie adéquate doit être adopté en cas de facteurs de risque thromboemboliques. Les ACOD et les HBPM sont les molécules de premier choix en chirurgie orthopédique majeure. Les HPBM lors de toutes autre conditions de risque thromboembolique. Des mesures de prophylaxie non-pharmacologiques peuvent être utilisées en association avec les médicaments chez les patients à risque élevé ou comme alternative en cas de contre-indication à l’ anticoagulation.
Les ACOD ainsi que l’ association HBPM / AVK et l’ HBPM seule (chez les patients avec cancer actif) sont les options thérapeutiques disponibles pour le traitement de la TVP. La durée de l’ anticoagulation recommandée est de 3 mois si risque faible de récidive. Pour tous les autres patients, la durée de l’ anticoagulation doit être individualisée.
Cet article a été publié dans “info@coeur+vaisseau 5/2018.”
Centre Hospitalier Universitaire Vaudois
Service d’ Angiologie
Chemin de Mont-Paisible 18
1011 Lausanne
adriano.alatri@chuv.ch
Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec cet article.
- Chez les patients hospitalisés une prophylaxie adéquate doit être adoptée en cas de facteurs de risque thromboemboliques.
- Les ACOD et les HBPM sont les molécules de premier choix pour la thromboprophylaxie en chirurgie orthopédique majeure. Les HPBM lors de toutes autres conditions de risque thromboembolique.
- Les ACOD ainsi que l’ association HBPM/AVK sont les options thérapeutiques disponibles pour le traitement de la TVP.
- L’ HBPM seule est le traitement de choix chez les patients avec TVP et cancer actif. L’ edoxaban et le rivaroxaban sont une alternative possible chez les patients à risque hémorragique faible.
- La durée de l’ anticoagulation recommandée est de 3 mois en cas de faible risque de récidive. Pour tous les autres patients, la durée de l’ anticoagulation doit être individualisée.
Références :
1 Naess IA, Christiansen SC, Romundstad P, Cannegieter SC, Rosendaal FR, Hammerstrom J. Incidence and mortality of venous thrombosis: a population-based study. J Thromb Haemost. 2007; 5: 692-9.
2 Kearon C, Ageno W, Cannegieter SC, Cosmi B, Geersing GJ, Kyrle PA. Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH. J Thromb Haemost. 2016; 14: 1480-3.
3 Mazzolai L, Aboyans V, Ageno W, Agnelli G, Alatri A, Bauersachs R, Brekelmans MP, Buller HR, Elias A, Farge D, Konstantinides S, Palareti G, Prandoni P, Righini M, Torbicki A, Vlachopoulos C, Brodmann M. Diagnosis and management of acute deep vein thrombosis: a joint consensus document from the European society of cardiology working groups of aorta and peripheral circulation and pulmonary circulation and right ventricular function. Eur Heart J. 2017.
4 Geerts WH, Bergqvist D, Pineo GF, Heit JA, Samama CM, Lassen MR, Colwell CW. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008; 133: 381s-453s.
5 Falck-Ytter Y, Francis CW, Johanson NA, Curley C, Dahl OE, Schulman S, Ortel TL, Pauker SG, Colwell CW, Jr. Prevention of VTE in orthopedic surgery patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141: e278S-e325S.
6 Alatri A, Mazzolai L. Les nouveaux anticoagulants oraux. info@herz+gefäss. 2016; 1: 18-22.
7 Quinlan DJ, Eriksson BI. Novel oral anticoagulants for thromboprophylaxis after orthopaedic surgery. Best Pract Res Clin Haematol. 2013; 26: 171-82.
8 Rachidi S, Aldin ES, Greenberg C, Sachs B, Streiff M, Zeidan AM. The use of novel oral anticoagulants for thromboprophylaxis after elective major orthopedic surgery. Expert Rev Hematol. 2013; 6: 677-95.
9 Gould MK, Garcia DA, Wren SM, Karanicolas PJ, Arcelus JI, Heit JA, Samama CM. Prevention of VTE in nonorthopedic surgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141: e227S-e77S.
10 Stuck AK, Spirk D, Schaudt J, Kucher N. Risk assessment models for venous thromboembolism in acutely ill medical patients. A systematic review. Thromb Haemost. 2017; 117: 801-8.
11 Kahn SR, Lim W, Dunn AS, Cushman M, Dentali F, Akl EA, Cook DJ, Balekian AA, Klein RC, Le H, Schulman S, Murad MH. Prevention of VTE in nonsurgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141: e195S-e226S.
12 Hull RD, Schellong SM, Tapson VF, Monreal M, Samama MM, Nicol P, Vicaut E, Turpie AG, Yusen RD. Extended-duration venous thromboembolism prophylaxis in acutely ill medical patients with recently reduced mobility: a randomized trial. Ann Intern Med. 2010; 153: 8-18.
13 Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H, Huisman M, King CS, Morris TA, Sood N, Stevens SM, Vintch JR, Wells P, Woller SC, Moores L. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016; 149: 315-52.
14 van Es N, Coppens M, Schulman S, Middeldorp S, Buller HR. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood. 2014; 124: 1968-75.
15 Wang TF, Li A, Garcia D. Managing thrombosis in cancer patients. Res Pract Thromb Haemost. 2018; 0: 1–10. https://doi.org/.1002/rth2.12102.
16 Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D, Grosso MA, Kakkar AK, Kovacs MJ, Mercuri MF, Meyer G, Segers A, Shi M, Wang TF, Yeo E, Zhang G, Zwicker JI, Weitz JI, Buller HR. Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism. N Engl J Med. 2018; 378: 615-24.
17 Young AM, Marshall A, Thirlwall J, Chapman O, Lokare A, Hill C, Hale D, Dunn JA, Lyman GH, Hutchinson C, MacCallum P, Kakkar A, Hobbs FDR, Petrou S, Dale J, Poole CJ, Maraveyas A, Levine M. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT-D). J Clin Oncol. 2018: Jco2018788034.
18 Vedantham S, Goldhaber SZ, Julian JA, Kahn SR, Jaff MR, Cohen DJ, Magnuson E, Razavi MK, Comerota AJ, Gornik HL, Murphy TP, Lewis L, Duncan JR, Nieters P, Derfler MC, Filion M, Gu CS, Kee S, Schneider J, Saad N, Blinder M, Moll S, Sacks D, Lin J, Rundback J, Garcia M, Razdan R, VanderWoude E, Marques V, Kearon C. Pharmacomechanical Catheter-Directed Thrombolysis for Deep-Vein Thrombosis. N Engl J Med. 2017; 377: 2240-52.
19 Kahn SR, Shapiro S, Wells PS, Rodger MA, Kovacs MJ, Anderson DR, Tagalakis V, Houweling AH, Ducruet T, Holcroft C, Johri M, Solymoss S, Miron MJ, Yeo E, Smith R, Schulman S, Kassis J, Kearon C, Chagnon I, Wong T, Demers C, Hanmiah R, Kaatz S, Selby R, Rathbun S, Desmarais S, Opatrny L, Ortel TL, Ginsberg JS. Compression stockings to prevent post-thrombotic syndrome: a randomised placebo-controlled trial. Lancet. 2014; 383: 880-8.
20 Kahn SR, Comerota AJ, Cushman M, Evans NS, Ginsberg JS, Goldenberg NA, Gupta DK, Prandoni P, Vedantham S, Walsh ME, Weitz JI, American Heart Association Council on Peripheral Vascular Disease CoCC, Council on C, Stroke N. The postthrombotic syndrome: evidence-based prevention, diagnosis, and treatment strategies: a scientific statement from the American Heart Association. Circulation. 2014; 130: 1636-61.
21 Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, Porcari A, Raskob GE, Weitz JI, Investigators P-E. Apixaban for extended treatment of venous thromboembolism. N Engl J Med. 2013; 368: 699-708.
22 Weitz JI, Lensing AWA, Prins MH, Bauersachs R, Beyer-Westendorf J, Bounameaux H, Brighton TA, Cohen AT, Davidson BL, Decousus H, Freitas MCS, Holberg G, Kakkar AK, Haskell L, van Bellen B, Pap AF, Berkowitz SD, Verhamme P, Wells PS, Prandoni P. Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism. N Engl J Med. 2017; 376: 1211-22.
la gazette médicale
- Vol. 8
- Ausgabe 1
- Januar 2019