- Sarkopenie: Diagnose und Prävention
Physiologisches Altern ist mit einer Veränderung der Körperzusammensetzung verbunden, insbesondere einer Abnahme der Muskelmasse (Magermasse). Dieser Rückgang der Muskelmasse führt zu einem Mangel an Kraft und muskulärer Leistung, die sich auf die täglichen Aktivitäten und die Unabhängigkeit des älteren Menschen auswirken können. Dieser Artikel erörtert die verfügbaren Diagnosemethoden und beleuchtet Aspekte im Zusammenhang mit der Prävention und Behandlung der Sarkopenie.
Aus epidemiologischen Gründen im Zusammenhang mit der Alterung der Bevölkerung stellt die Sarkopenie der älteren Menschen eine wichtige Herausforderung für das öffentliche Gesundheitswesen dar. Sie führt zu einem Rückgang der Autonomie und der Lebensqualität sowie zu einem Anstieg der Morbidität und Mortalität der betroffenen Patienten.
Definition
Der Begriff Sarkopenie leitet sich vom griechischen sarx (Fleisch) und penia (Verlust) ab und definiert ursprünglich den Verlust von Muskelmasse (3). In der Folge wurde der Begriff auch auf Verlust von Muskelkraft und Muskelleistung erweitert. Die Muskelkraft ist eine wichtige Determinante des Funktionsniveaus, aber die Leistungsfähigkeit (pro Zeiteinheit verfügbare Kraft) ist wahrscheinlich ein noch kritischerer Faktor, der früher und stärker abnimmt als die Kraft mit dem Alter (1, 2).
Epidemiologie
Die Prävalenz der Sarkopenie variiert stark je nach Studien, analysierten Populationen und verwendeten Definitionen. In einem systematischen Review von 2014 fand sich bei Personen über 50 Jahre in der Ambulanz eine Prävalenz der Sarkopenie gemäss europäischer Definition von 1-29%, von 14-33% in Pflegeinstitutionen und von 10% in einem Akutspital (4).
Risikofaktoren für die Entwicklung der Sarkopenie
Das Alter ist der wichtigste prädisponierende Faktor für die primäre Sarkopenie. Zu den Mechanismen der altersbedingten Sarkopenie gehören die Atrophie der Muskelfasern (insbesondere der Typ-II-Fasern), die Abnahme der muskulären Stammzellen und der motorischen Einheiten sowie der Rückgang der Hormonsekretion (Testosteron, Wachstumshormon), die Zunahme der inflammatorischen Zytokine, die Abnahme der mitochondrialen Funktion und die abnormale Myokin-Produktion. Betreffend Risikofaktoren für eine sekundäre Sarkopenie sei die verminderte körperliche Aktivität infolge osteoartikulärer Störungen oder psychosozialer Faktoren (Depression, Isolation) erwähnt.Wichtige Organopathien (chronische Lungenerkrankung, Herzinsuffizienz, Niereninsuffizienz) sowie Entzündungskrankheiten, onkologische Erkrankungen oder endokrine oder metabolische Pathologien mit Malabsorption begünstigen ebenfalls die Entstehung einer Sarkopenie (5).
Schliesslich können die Anorexie bei älteren Menschen (Appetitlosigkeit durch verminderte Ghrelin-Sekretion, Dysfunktion des Verdauungssystems, Polypharmazie, psychosoziale Faktoren) und ungünstige Wahl von Nahrungskomponenten zu einem Protein-Energie-Mangel führen.
Diagnose
Methoden zur Bewertung der Muskelmasse
Der CT-Scan und die MRT ermöglichen es, mit hoher Genauigkeit zwischen Muskel und Fett zu unterscheiden. V.a. aufgrund der Strahlenbelastung resp. dem Aufwand werden diese Techniken für diese Indikation nicht eingesetzt.
Bei der Bioelektrischen Impedanzanalyse (BIA) wird die Zusammensetzung von Fett- und Magermasse aufgrund der elektrischen Impedanz von biologischen Geweben mit Algorithmen berechnet. Ein Problem dabei ist die geringe Genauigkeit der Methode.
Isotopenmethoden werden hauptsächlich in der Forschung eingesetzt. Anthropometrische Messungen (Arm-/ Wadenumfang) sind mit der Muskelmasse korreliert, aber zu ungenau, um für diagnostische Zwecke verwendet zu werden.
Die DXA (Doppelröntgenabsorptiometrie)) bleibt die Referenzmethode zur Messung der Körperzusammensetzung, einschliesslich Knochen-, Fett- und Magermasse. Die Strahlenbelastung ist gering und die Genauigkeit der Messung ist gut (1, 6).
Verfahren zur Messung der Muskelkraft
Manuelle Dynamometer ermöglichen die isometrische Messung der Greifkraft. Das am häufigsten verwendete Protokoll besteht aus drei Messungen an beiden Händen, wobei jeweils der höchste Wert berücksichtigt wird. Eine geringe Greifkraft stellt einen klinischen Marker für Fragilität dar. Es gibt alters- und geschlechtsbezogene Skalen (1, 7).
Messung der körperlichen Leistungsfähigkeit
Viele Funktionstests können verwendet werden, um die klinischen Auswirkungen der Sarkopenie zu beurteilen.
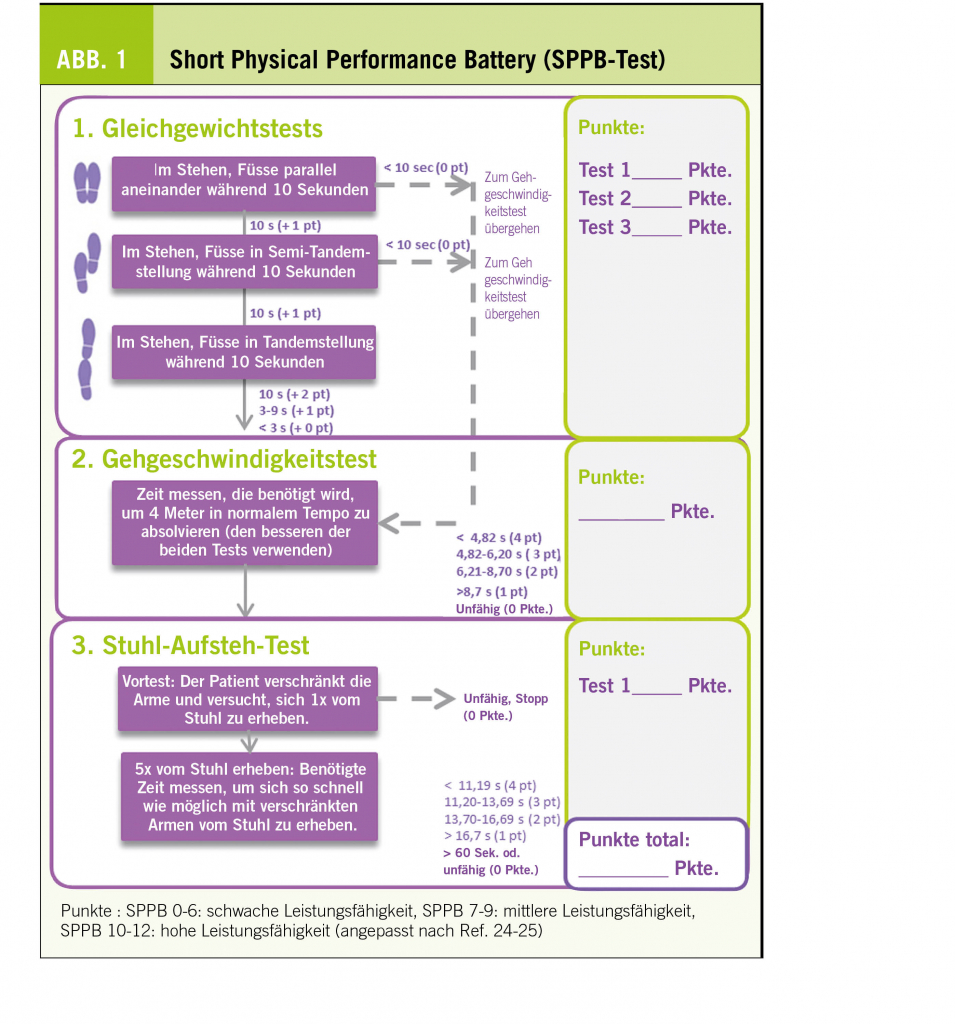
Die short physical performance battery (SPPB) ist ein Instrument aus mehreren Komponenten zur Beurteilung der körperlichen Leistungsfähigkeit, der Haltungsstabilität (Gleichgewichtstest), einer Muskelschwäche der unteren Extremitäten (Stuhl-Aufsteh-Test) und einer reduzierten Gehgeschwindigkeit (Gehgeschwindigkeitstest). Ein Wert von weniger als 8 Punkten (von insgesamt 12) ist ein Indikator für das Risiko einer Sarkopenie (Abb. 1). Die Gehgeschwindigkeit kann allein genutzt werden, der Timed up and Go-Test bewertet die Zeit, die benötigt wird, um von einem Stuhl aufzustehen, drei Meter zu gehen, um 180° zu drehen, zum Stuhl zurückzukehren und sich wieder hinzusetzen, wobei der Patient bei Bedarf eine Gehhilfe benutzen kann. Eine Zeit von mehr als 14 Sekunden ist pathologisch und ein Indikator für ein hohes Sturzrisiko (1, 8).
Diagnoseverfahren mit Hilfe von Fragebögen
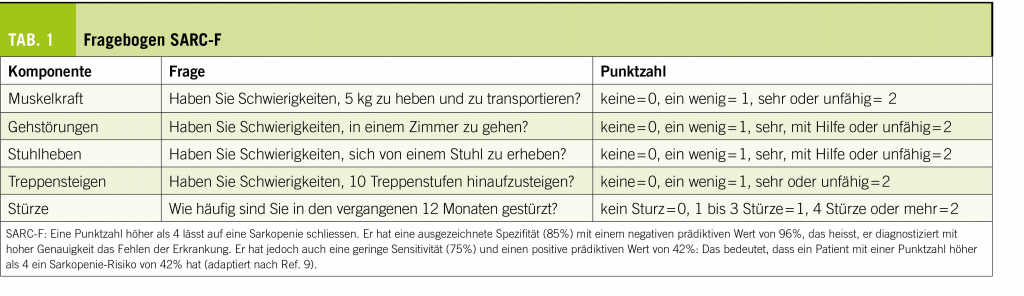
Der Fragebogen SARC-F wurde für die Diagnose der Sarkopenie validiert. Er besteht aus fünf Fragen zur Beurteilung von Muskelkraft, Gehstörungen und Stürzen. Die diagnostische Sensitivität ist gering, aber die Spezifität ist gut (1, 9) (Tab. 1).
Biochemische Marker für Entzündungen
Es besteht eine Assoziation zwischen Befunden von Entzündungsmarkern wie CRP, GM-CSF, IFNγ, IL 6 und 8 sowie TNF α und niedriger Muskelmasse und Muskelschwäche. Andere Proteine oder Peptide wie das C-terminale Agrinfragment (CAF) oder die High-temperature requirement serine protease A1 (HtrA1) sind ebenfalls mit Sarkope-nie assoziiert. Chronischer Entzündungszustand und oxidativer Stress prädisponieren für Sarkopenie, indem sie das Protease-Ubiquitin-System aktivieren und die anabole Wirkung von IGF-1 reduzieren (2, 10).
Leider bestehen heute noch keine Daten für die Verwendung dieser Parameter in der täglichen klinischen Praxis.
Diagnostiche Kriterien
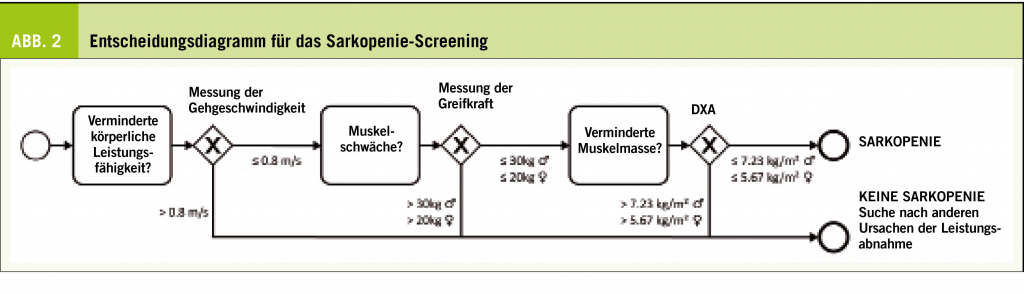
Zu den diagnostischen Kriterien der «European Working Group on Sarcopenia in Older People (EWGSOP)» gehören ein Mass für die Muskelmasse (appendikuläre Magermasse: MMA/Grösse2 < 5,67 kg/m2 bei Frauen und < 7,23 kg/m2 bei Männern), die Muskelkraft (Greifkraft < 20 kg bei Frauen und < 30 kg bei Männern) und die körperliche Leistungsfähigkeit (Gehgeschwindigkeit < 0,8 m/s) (Abb. 2). Die «Founda-
tion for the National Institutes of Health (FNIH) Biomarkers Consortium Sarcopenia Project» in den USA hat Schwellenwerte definiert für die Greifkraft < 26 kg bei Männern und < 16 kg bei Frauen (als Alternative: Greifkraft angepasst für Body-Mass-Index < 1 bei Männern und < 0.56 für Frauen) und für die Magermasse angepasst an den BMI < 0,789 für Männer und < 0,512 für Frauen (als Alternative: MMA < 19,75 kg für Männer und < 15,05 kg für Frauen) (1, 11).
Konsequenzen
Ein systematisches Screening auf Sarkopenie bei älteren Menschen ist wichtig. Sarkopenie-Patienten zeigen mehr Komorbiditäten, konsultieren öfter einen Arzt, sind öfter polymediziert, werden häufiger ins Krankenhaus eingeliefert, stürzen öfter und fallen mit schwerwiegenderen Folgen als eine gleichaltrige Bevölkerung ohne Sarkopenie (12).
Prävention und Behandlung
Rolle der Ernährung
Zunächst sollte der individuelle Energiebedarf mit der Formel 27-30 kcal/kg/Tag (empfohlene Werte für ältere polymorbide Patienten) geschätzt werden (20).
Proteinangereicherte Ernährung
Eine Proteinzufuhr von 1 bis 1,2 g/kg/Tag wurde als Minimum zur Aufrechterhaltung der Muskelmasse bei gesunden älteren Menschen nachgewiesen und ein Bedarf von 1,2 bis 1,6 g/kg/Tag bei älteren Pa-
tienten mit chronischen Erkrankungen. Eine ausgewogene Verteilung der Proteinzufuhr während 3 Hauptmahlzeiten während des Tages ist vorteilhafter als eine grosse Menge einmal am Tag. Die empfohlene Menge pro Mahlzeit beträgt 20-30 g, was dem Proteingehalt von 200 ml eines oralen Nahrungsergänzungsmittels (ONS) entspricht (Fresubin, Resource, Ensure, usw.). Die Art und Weise, wie Proteine verabreicht werden, bleibt jedoch umstritten, wobei einige die Zufuhr von so viel Protein wie möglich bei einer Mahlzeit, sog. «pulse feeding», befürworten, um die Proteinsynthese anzuregen und die splanchnische Sequestration zu überwinden (13-15, 20, 22, 23).
In Bezug auf die Bedeutung der essentiellen Aminosäuren zu erwähnen ist das Beispiel der Supplementierung mit β-Hydroxy-β-Methylbutyrat (HMB), einem Leucin-Metaboliten, der einen Einfluss auf den Erhalt der Muskelmasse bei längerer Bettlägerigkeit zu haben scheint. Diese Ergebnisse müssen in grossen Studien bestätigt werden (21). Kreatin wird aus den Aminosäuren (Glycin, Arginin und
Methionin) in Leber, Pankreas und Nieren natürlich synthetisiert. Als Nahrungsergänzungsmittel erhöht Kreatin (kombiniert mit gezielter körperlicher Aktivität) signifikant die Muskelmasse und -kraft signifikant. Kreatin optimiert auf natürliche Weise das zelluläre Energiepotential, indem es die Resynthese von ATP während der körperlichen Aktivität beschleunigt, wodurch die Muskelarbeit intensiver und effektiver wird. Zudem stimuliert Kreatin die Proteinsynthese, indem es bestimmte intrazelluläre Signalwege aktiviert (16).£
Vitamin-D-Substitution
Skelettmuskelzellen haben einen Vitamin-D-Rezeptor (VDR), dessen Expression mit zunehmendem Alter abnimmt. Es wurde berichtet, dass Vitamin D im Muskelgewebe eine regulatorische Wirkung hat auf Genexpression, Kalziumfluss, mineralische Homöostase und bestimmte Signalwege, die den Proteinabbau steuern (17, 19). Die Ergebnisse einer Meta-Analyse zeigen, dass bestimmte Ernährungsinterventionen zur Steigerung der Muskelmasse beitragen können, aber die Empfehlungen sind derzeit nicht abschliessend (4).
Antioxidantien
Angesichts des Zusammenhangs zwischen oxidativem Stress und Sarkopenie können die klassischen Antioxidantien Selen, die Vitamine A, C und E sowie Beta-Carotine vielversprechend sein. Dennoch können sie paradoxerweise als starke Prooxidantien wirken und so das Sterberisiko erhöhen.
Körperliches Training
Mehrere Studien haben die Auswirkungen eines gezielten Trainingsprogramms (progressive resistance exercise training, PRT) zur Prävention oder Behandlung von Sarkopenie untersucht. Diese Interventionen zeigten einen signifikanten Anstieg der appendikulären Muskelmasse, der Quadrizeps-Kraft und der Gehgeschwindigkeit (13, 17).
Medikamentöse Therapie
Einige Moleküle, wie beispielsweise selektive Androgenrezeptor-Modulatoren (SARMs), wurden an einer kleinen Gruppe von Patienten mit Sarkopenie getestet. Obwohl eine Zunahme der Muskelmasse gemessen werden konnte, konnte keine signifikante Zunahme der Muskelkraft oder der Gehgeschwindigkeit nachgewiesen werden. Diese Behandlung wird daher derzeit nicht empfohlen ohne ausdrückliche Indikation (Hypogonadismus) (13).
Unter den ACEs (Angiotensin-Converting-Enzym-Inhibitoren) hat Perindopril einen positiven Effekt auf die körperliche Leistungsfähigkeit gezeigt, insbesondere durch eine Erhöhung der Gehstrecke im 6-Minuten-Gehtest und eine Verringerung der Rate von Hüftfrakturen bei älteren Menschen. Es sollte daher vorrangig bei Patienten mit einer Indikation für diese Art der Behandlung verschrieben werden (17, 18).
Sturzprävention
Da die Behandlung der Sarkopenie in den meisten Fällen eher eine unterstützende als eine kurative Behandlung bleibt, spielen die verschiedenen Stuzpräventionsstrategien (Bereitstellung von Hilfsmitteln wie Gehhilfen, Anpassung der Umgebung usw.) nach wie vor eine grosse Rolle bei der Versorgung älterer Patienten mit Sarkopenie.
Schlussfolgerungen
Da die Sarkopenie ein häufiges geriatrisches Syndrom ist und mit diesem unerwünschte klinische Ereignisse verbunden sind, sollte ein Screening durchgeführt werden. Die Beurteilung eines Patienten mit Verdacht auf Sarkopenie sollte mit einem physischen Leistungstest beginnen; wenn dieser pathologisch ist, sollte die Beurteilung der Muskelkraft durch den Greiftest erfolgen. Ein Rückgang der Muskelmasse kann bei Bedarf durch DXA nachgewiesen werden. Prävention und Behandlung basieren auf einer adäquaten Zufuhr von Protein und Energie sowie regelmässiger körperlicher Aktivität.
Hôpital Fribourgeois Site de Riaz
Rue de l’Hôpital 9
1632 Riaz
sophie.schaller@h-fr.ch
Die Autorin hat keine Interessenskonflikte in Zusammenhang mit diesem Beitrag.
- Die Sarkopenie ist ein häufiges geriatrisches Syndrom, das durch einen Rückgang der Muskelmasse und -kraft definiert ist.
- Die Sarkopenie prädisponiert ältere Menschen für Abhängigkeit, erhöht das Risiko von Stürzen und Frakturen sowie die allgemeine Sterblichkeit.
- Die Hauptrisikofaktoren sind Alter, verminderte körperliche Aktivität, Protein-Energie-Mangelernährung und chronische Entzündungen.
- Die Diagnosemethoden umfassen Messungen der Muskelmasse (DXA), der Greifkraft und der körperlichen Leistung (Gehgeschwindigkeit).
- Für die Sarkopenie gibt es derzeitkeine spezifische Behandlung; zu den Massnahmen, die sich auf die Prävention auswirken, gehören eine protein. und energiegerechte Ernährung, gezieltes körperliches Training und Sturzprävention sowie Korrektur eines Vitamin-D-Mangels.
Literatur:
1. Trombetti A. Définition et évaluation de la sarcopénie au cabinet. Rev Med Suisse 2015;11:651-6
2. Masahiro A. Definitions and diagnosis of sarcopenia. Geriatr Gerontol Int 2018;18(Suppl.1):7-12
3. Rosenberg IH. Sarcopenia:Origins and clinical relevance. J Nutr 1997;127(Suppl.5):990S-1
4. Cruz-Jentoft AJ. Prevalence of and interventions for sarcopenia in ageing adults, Report of the International Sarcopenia Initiative. 2014;43:748-59
5. Hiroshi S. Epidemiology of sarcopenia. Geriatr Gerontol Int 2018;18(Suppl.1):13-22
6. Heymsfield S. Human body composition. Human Kinetics 2005
7. Al Shin S. Hand grip strength and incident ADL disability in elderly Mexican Americans. Aging Clin Exp Res 2004;16:481-6
8. Podsaldio D. The timed «Up and Go»: a test of basic functional mobility. J Am Geriatr Soc 1991;39:142-8
9. Woo J. Validating the SARC-F: a suitable community screening tool for sarcopenia? J Am Med Dir Assoc 2014;15:630-4
10. Calvani R. The «Biomarkers associated with Sarcopenia in Elderly Persons». Eur J Intern Med 2018, https://doi.org/10.1016/j.ejim.2018.05.001
11. Cruz-Jentoft AJ. European Consensus on Definition and Diagnosis. Age Aging 2010;39:412-23
12. Li Feng Tan. Screening for Frailty and Sarcopenia and its associations with healthcare burden. JAMDA 2017;18(7):583–7
13. Hidenori A. Treatment of sarcopenia. Geriatr Gerontol Int 2018;18(Suppl.1):28-44
14. Ten Haaf Dominique S.M. Protein Intake and Distribution in Relation to Physical Functioning and Quality of Life in elderly people. Nutrients 2018;10(4):506
15. Liguori I. Sarcopenia: assessment of disease burden and strategies to improve outcomes. Clin Interv Aging 2018;13:913-27
16. Chilibeck P. Effect of creatine supplementation during resistance training. Open Access Journal of Sports Medicine 2017:8 213-26
17. Yong-Chan Ha. Malnutrition and chronic inflammation as risk factors for sarcopenia. Asia Pac J Clin Nutr 2017, https://doi.org/10.6133/apjcn.082017.02
18. Morley JE. Pharmacologic options for the treatment of sarcopenia. Calcif Tissue Int 2016;98(4):319-33
19. Kim K. The vitamin D receptor expression in skeletal muscle of women with distal radius fracture. Arch Osteoporos 2018;13(1):24
20. Gomes F et al. ESPEN guidelines on nutritional support for polymorbid internal medicine patients. Clin Nutr 2018;37(1):336-53
21. Deutz NEP. Effect of ß-hydroxy-ß-methylbutyrate (HMB) on lean body mass during 10 days of bed rest in older adults. Clin Nutr 2013;32(5):704-12
22. Deutz NEP. Protein intake and exercise for optimal muscle function with aging: Recommendations from the ESPEN Expert Group. Clin. Nut 2014;33(6):929-36
23. Bauer J. Evidence-Based Recommendations for Optimal Dietary Protein Intake in Older People: A Position Paper From the PROT-AGE Study Group. JAMDA 2013;14(8):542-59
24. Guralnik JM et al. Lower extremity function and subsequent disability: consistency across studies, predictive models, and value of gait speed alone compared with the short physical performance battery. J Gerontol A Biol Sci Med Sci 2000;55(4):M221-31
25. http://www.toutsurlasarcopenie.fr/depistage/sppb
der informierte @rzt
- Vol. 8
- Ausgabe 9
- September 2018








