- Antidiabetika beim herzkranken Patienten
Kardiovaskuläre (CV) Erkrankungen sind eine häufige Komplikation und die Haupttodesursache bei Patienten mit Diabetes. Bei Typ II Diabetes verdoppelt sich das Mortalitätsrisiko und das Risiko für Myokardinfarkt oder Apoplex ist 2- bis 3fach erhöht, unabhängig von anderen kardiovaskulären Risikofaktoren, was die Lebenserwartung um etwa 8 Jahre reduziert.
Les maladies cardiovasculaires sont une complication courante et la cause principale de décès chez les patients diabétiques. Le diabète de type II double le risque de mortalité et le risque d’infarctus du myocarde ou d’apoplexie est 2 à 3 fois plus élevé, indépendamment d’autres facteurs de risque cardiovasculaire, réduisant l’espérance de vie d’environ 8 ans.
Typ-2-Diabetes und CV Risiko
1998 konnte in der UKPDS (1) Studie eine signifikante Verbesserung der mikrovaskulären Komplikationen durch intensive Blutzuckereinstellung gezeigt werden. In der Folgestudie 10 Jahre später konnte eine Verbesserung auch der makrovaskulären Komplikationen bei der initialen Studienpopulation gezeigt werden, welche zumindest während der Studiendauer von 5 Jahren eine sehr gute Blutzuckereinstellung erreicht hatten. Dieser Effekt wurde «metabolisches Gedächtnis» oder «legacy effect» genannt. Dies führte zu einer Anpassung der Leitlinien und sehr strengen Zielwerte für die Blutzuckereinstellung und Hb-A1c-Werte in unter 7 respektive 6,5 %.
Die Annahme, dass strenge, nahezu normale Blutzuckerkontrolle das kardiovaskuläre Risiko der Typ II Patienten reduzieren konnte, wurde erschüttert nachdem 2008 verschiedene Studien zeigten, dass eine intensive Blutzuckerkontrolle nicht nur kardiovaskuläre Ereignisse nicht signifikant reduzieren konnte sondern in manchen Fällen sogar gefährlich war (ACCORD, ADVANCE, VADT) (2-4).
CV Studien als Teil des Zulassungsprozesses
Bereits 2007 hatten Daten aus Glitazon Studien eine erhöhte Mortalität und Morbidität inklusive Herzinsuffizienz gezeigt (5). Dies führte dazu, dass nun sowohl die FDA als auch die EMA für alle zukünftigen oralen Antidiabetika kardiovaskuläre Studien forderte, die sowohl während der Entwicklung als auch in den Post Marketing Phasen durchgeführt werden sollten. Von neuen Medikamenten wurde eine zumindest non inferiority in Bezug auf kardiovaskuläre Sicherheit im Vergleich zu konventionellem Behandlungsschema gefordert. Im Folgenden werden wir auf die vorhandenen Studien für alle aktuell zugelassenen Medikamentengruppen eingehen und ihre Bedeutung für den klinischen Alltag.
Grundsätzliche Überlegungen
Vor allem zu Beginn der Erkrankung weisen orale Antidiabetika einen wichtigen Stellenwert in der Behandlung des Diabetes auf. Wenn es nicht möglich ist, die glykämischen Behandlungsziele mit nicht-medikamentösen Massnahmen (Lebensstil Modifikationen mit den Zielen der Intensivierung der körperlichen Bewegung, der Vermeidung überkalorischer Nahrungsaufnahme und der Reduktion kardiovaskulärer Risikofaktoren) zu erreichen, soll innerhalb weniger Monate (oder bei Stoffwechseldekompensation sofort) mit einer medikamentösen Diabetestherapie begonnen werden. Dabei müssen individualisierte Therapieziele definiert werden, die die Fähigkeiten und die Motivation des Patienten genauso berücksichtigen wie sein Alter, seine Hypoglykämie Gefährdung, seine Begleiterkrankungen, eventuelle Folgekomplikationen, die Diabetesdauer und die Ressourcen.
Orale Antidiabetika und deren Eigenschaften
Metformin: Metformin hemmt vor allem die Glukose Freisetzung aus der Leber und hat dadurch eine gute Wirkung auf die Nüchternblutzucker. Das Hypoglykämie Risiko ist aufgrund des Wirkmechanismus sehr gering. Da bei Metformin Gabe und vor allem bei Akkumulation von Metformin im intermediären Stoffwechsel vermehrt Laktat anfällt, ist Metformin bei deutlich eingeschränkter Nierenfunktion (GFR < 30 ml/min) und bei Zuständen mit ausgeprägter Gewebshypoxie kontraindiziert.
OP Kontrastmittelgabe: Nach den aktuellen Richtlinien sollte man Metformin 48 Stunden vor einer Operation oder einer i.v. Kontrastmittelgabe, spätestens jedoch am Tag des Eingriffs pausieren und erst wieder ansetzen, wenn orale Kost sicher vertragen wird, keine anderweitigen Kontraindikationen bestehen und insbesondere die Nierenfunktion eine GFR von > 45 ml/min aufweist.
Nierenfunktionseinschränkungen: Unter besonderen Vorsichtsmassnahmen kann die Therapie mit Metformin auch bei einer GFR unter 45 ml/min durchgeführt werden. (günstiges Nutzen Risikoprofil, fehlende Alternativen, dominierende Insulinresistenz). Dabei sollte man die Nierenfunktion situativ und engmaschig überwachen. Unterhalb einer GFR von 30 ml/min ist die Metformin Gabe absolut kontraindiziert.
Herzinsuffizienz: Metformin ist bei einer Herzinsuffizienz in den Stadien NYHA 3 und 4 kontraindiziert weil bei der dann unzureichenden Pumpfunktion saure Metaboliten akkumulieren und die Gefahr einer Laktatazidose besteht. Andererseits deuten retrospektive Studien an Herzinsuffizienten in niedrigeren NYHA Stadien auf einen Langzeit Überlebensvorteil durch Metformin hin. Die Metformintherapie ist daher bei Patienten mit Diabetes mellitus und begleitender Herzinsuffizienz in den Stadien 1-2 nach NYHA durchaus zu empfehlen.
Studien: Metformin war das erste orale Antidiabetikum, für das eine signifikante Reduktion der kardiovaskulären Komplikationen nachgewiesen werden konnte (UKPDS 34 1998) (6). Dies konnte zum damaligen Zeitpunkt jedoch nur in einer kleinen Gruppe adipöser Patienten (n = 342) nachgewiesen werden. (NNT 14/10a CV event) Für die Kombination von Metformin und Sulfonylharnstoffen konnte dieser Effekt hingegen nicht gezeigt werden, es zeigte sich im Gegensatz sogar eine erhöhte Mortalität im Vergleich zur Kontrollgruppe (UKPDS 34). Bis auf die wenig belastbaren Daten aus der UKPDS zu positiven klinischen Endunkten, haben neuere Metaanalysen weder positive noch negative Effekte von Metformin auf kardiovaskuläre Endpunkte zeigen können. Es gibt auch keine Hinweise für einen Vorteil von Metformin für eine bestimmte Kombinationstherapie in Hinblick auf kardiovaskuläre Endpunkte und Gesamtmortalität (7). Die lange Erfahrung, das geringe Nebenwirkungsprofil und ökonomische Vorteile haben Metformin jedoch bisher nicht als erste Wahl verdrängt.
Sulfonylharnstoffe und Glinide
Wirkung: Sulfonylharnstoffe und Glinide setzen unabhängig von der Höhe der Plasma Glukose Insulin aus den Betazellen frei.
Hypoglykämie Risiko: Der Wirkmechanismus erklärt das hohe Hypoglykämie Potenzial, das mit den Sulfonylharnstoffen assoziiert ist, besonders für die Substanzen, die eine lange biologische Halbwertszeit und / oder aktive Metaboliten haben. Eine vor kurzem in Grossbritannien durchgeführte grosse retrospektive Studie hat eine signifikant erhöhte Mortalität bei Patienten unter Sulfonylharnstoff Therapie im Vergleich zu Metformin behandelten Patienten mit Typ -2-Diabetes gezeigt (8). Vor allem ältere Patienten mit langer Diabetesdauer sowie Patienten mit einem koronaren Vor-Ereignis sind durch eine zu intensive Blutzuckersenkung möglicherweise gefährdet. Durch Hypoglykämien ausgelöste Arrhythmien und andere EKG-Veränderungen werden hierfür als Ursache diskutiert. Bei KHK Patienten sollten daher Hypoglykämien strikt vermieden werden.
Studien: Viele retrospektive Studien, Metaanalysen und Cochrane Reviews zu Sulfonylharnstoffen mit und ohne Metformin in den letzten Jahren zeigen keinen eindeutigen Benefit dieser Substanz als Mono wie als Kombinationstherapie in Hinblick auf kardiovaskuläre Endpunkte. Günstige Effekte auf mikrovaskuläre Endpunkte zeigten sich in der UK PDS erst nach mehr als 6 Jahren Therapie. Bezüglich makrovaskulärer Endpunkte hatten Sulfonylharnstoffe keinen Vorteil und waren aber auch nicht mit signifikanten Steigerungen der kardiovaskulären Morbidität und Mortalität assoziiert. Die Assoziation des Risikos von Gesamtmortalität und kardiovaskulärer Mortalität war geringer unter Gliclazid und Glimepirid im Vergleich zu Glibenclamid (9, 10).
NAVIGATOR (Nateglinid): kein CV Vorteil für Patienten im Vergleich zu Placebo (11)
ADVANCE (Diamicron): keine CV Vorteile, Verbesserung der mikrovaskulären Komplikationen (NNT 65/ 5a), aber schwere Hypoglykämien (83 /5y) (12).
Nierenfunktionsstörung: Bei eingeschränkter Nierenfunktion können renal eliminierte Sulfonylharnstoffe akkumulieren und zu gefährlichen Hypoglykämien führen. Dies gilt insbesondere für die lang wirkenden Präparate Glibenclamid und Glimepirid, bei denen Hypoglykämien auch noch mehrere Tage nach Absetzen der Therapie auftreten können. Daher sind Sulfonylharnstoffe bei einer Niereninsuffizienz im Stadium 4-5 (GFR < 30 ml/min) kontraindiziert und sollten auch bei älteren Patienten mit wechselnder Nierenfunktion nicht eingesetzt werden. Glinide werden dagegen fast ausschliesslich hepatisch eliminiert, sodass sie auch bei einer Niereninsuffizienz eingesetzt werden können (auch bei Clearance < 25 ml/min).
Leberfunktionsstörung: Bei eingeschränkter Leberfunktion ist bei der Therapie mit Sulfonylharnstoffen und Gliniden zu bedenken, dass die Hypoglykämiegefahr allein aufgrund der gestörten hepatischen Glukoneogenese deutlich erhöht ist. Glinide sind bei Leberinsuffizienz kontraindiziert. Eine Kontraindikation besteht ferner für Sulfonylharnstoffe im Falle einer fortgeschrittenen Leberfunktionsstörung.
Glitazone
Wirkung: Pioglitazon ist das einzige noch erhältliche Thiazolidinedion (TZD), Es bindet an den intranukleären PPAR gamma Rezeptor, ein Transkriptionsfaktor, der die Aktivität wichtiger Stoffwechselgene reguliert. Pioglitazon hat ein sehr niedriges Hypoglykämie Potenzial, führt jedoch zu Gewichtszunahme und Flüssigkeitsretention. Die Wirkung von Pio-glitazon ist erst nach 12 bis 16 Wochen Behandlung effektiv und messbar.
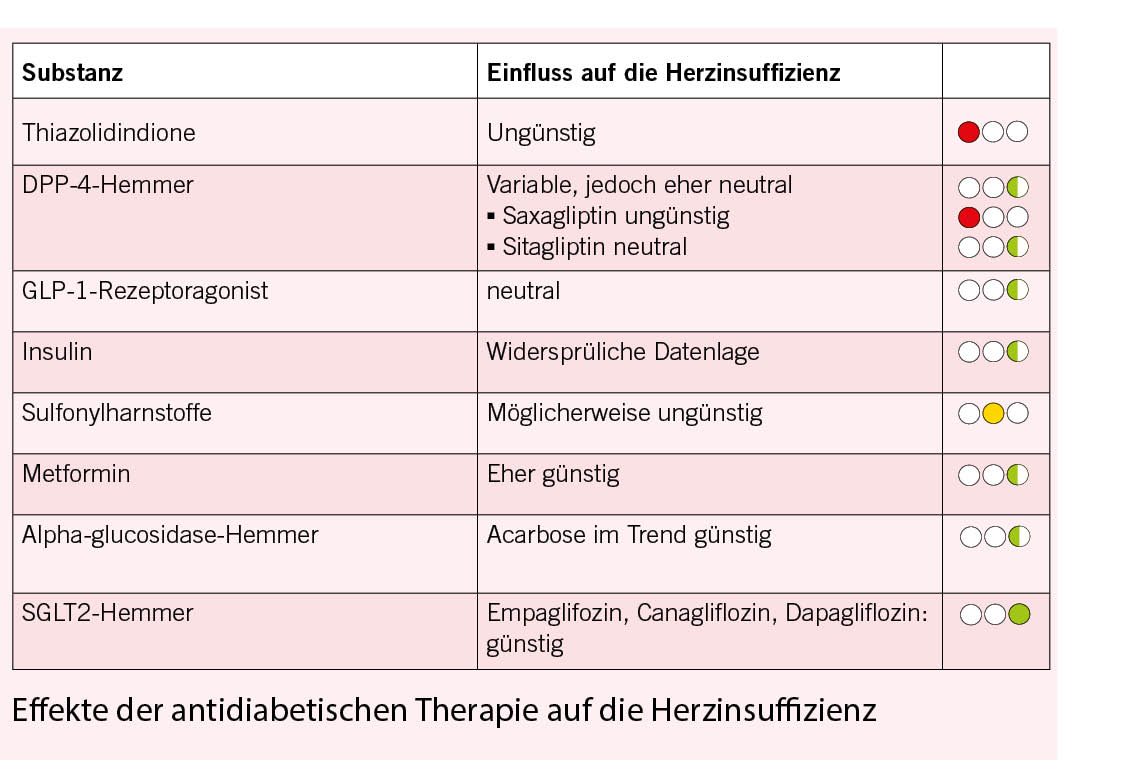
Herzinsuffizienz: für Pioglitazon hat eine grosse Anzahl Studien eine erhöhte Inzidenz kardialer Dekompensation gezeigt. Es ist daher bei jedem Grad einer Herzinsuffizienz kontraindiziert.
Nierenfunktionsstörung: Bei Niereninsuffizienz ist bis zum Stadium 5 prinzipiell eine Behandlung möglich, ohne die Dosis anzupassen.
Karzinomrisiko: Weiterhin besteht der Verdacht auf ein erhöhtes Risiko für Blasenkarzinome bei langjährigem Gebrauch von Pioglitazon (3 Fälle zusätzlich auf 10.000 Patienten / Jahr) (13).
Studienlage: In der PROACTIVE Studie (14) wurde der Effekt von Pioglitazon auf die sekundär Prävention von makrovaskulären Ereignissen untersucht. Der primäre Endpunkt aus Mortalität, Myokardinfarkt Apoplex, akutem Koronarsyndrom und Bypassoperationen zeigte keinen Unterschied zur Placebogruppe, hingegen konnte der sekundäre Endpunkt eine 16%ige signifikante Risikoreduktion von Tod, nicht tödlichem Myokardinfarkt und Apoplex zeigen. Im Gegensatz dazu zeigte sich eine signifikant erhöhte Anzahl von Spitaleinweisungen wegen Herzinsuffizienz. Die Mortalität wurde hingegen dadurch nicht verändert. In der PROACTIVE Studie wurde nach der UKPDS zum ersten Mal eine signifikante kardiovaskuläre Risikoreduktion beschrieben. Es war die erste Studie, bei der ein modernes kardiovaskuläres Risiko Management zur Basistherapie der beiden Gruppen gehört hatte. (NNT 50 für 2.9 Jahre / CV Events)
IRIS Studie (15) 3876 Insulinresistenz Patienten mit vorausgegangenem zerebralen Ereignis aber ohne Typ II Diabetes. Nach 4,8 Jahren zeigte sich eine signifikante Reduktion des primären Endpunkts (tödlicher oder nicht tödlicher Myokardinfarkt oder Apoplex) jedoch kein Unterschied in der Gesamtmortalität und eine höhere Frequenz von Gewichtszunahme und osteoporotischen Knochenfrakturen.
DPP4-Hemmer
Wirkung: Die DPP4-Inhibitoren hemmen den Abbau des körpereigenen Inkretinhormons GLP1. GLP1 wird postprandial von den Leberzellen des Darms freigesetzt, stimuliert bei Hyperglykämie die Insulinfreisetzung und hemmt die Glukagon Freisetzung.
Hypoglykämie Risiko: DPP4-Hemmer haben ein sehr geringes Hypoglykämie Risiko und können bei eingeschränkter Nierenfunktion in angepasster Dosierung weiter gegeben werden.
Studien: In kürzlich publizierten Endpunkt Studien in Patientenkollektiven mit kardiovaskulären Vorerkrankungen oder kardiovaskulärem Risikoprofil (TECOS, SAVOR, EXAMINE, Ref. 16-18) wurde kein Unterschied bei harten kardiovaskulären Endpunkten beobachtet, eine geringe, aber signifikante Zunahme an Spitalaufnahmen wegen Herzinsuffizienz wurde jedoch für Saxagliptin (SAVOR) beschrieben. Für Algogliptin (EXAMINE) zeigte sich diesbezüglich lediglich ein nicht signifikanter Trend und bei Sitagliptin (TECOS) zeigte sich keinerlei Signal. In einer derzeit laufenden kardiovaskulären Sicherheits Studie wird die Therapie mit dem DPP4-Hemmer Linagliptin direkt mit dem Sulfonylharnstoff Glimepirid verglichen (CAROLINA). Bei einer umfangreichen Metaanalyse zum Risiko von DPP-4-Inhibitoren auf eine Herzinsuffizienz oder eine Hospitalisierung wegen Herzinsuffizienz unter Einbeziehung von randomisierten kontrollierten Studien und Beobachtungsstudien kamen die Autoren zu dem Schluss, dass der Effekt von DPP4-Hemmern auf eine Herzinsuffizienz allgemein ungewiss bleibt. Grund für diese Einschätzung sind die relativ kurzen Beobachtungszeiten in den Studien und eine schlechte Qualität der Evidenz. Bei der Analyse der Hospitalisierungsraten wegen Herzinsuffizienz fand sich ein leicht erhöhtes Risiko unter DPP-4-Inhibitoren bei Patienten mit existierender kardiovaskulärer Erkrankung oder multiplen Risikofaktoren für Gefässerkrankungen(19). DPP-4-Inhibitoren sind nicht mit einer erhöhten Gesamt Mortalitätsrate verbunden wie eine umfangreiche aktuelle Metaanalyse mit dem Einschluss von 189 randomisierten kontrollierten Studien mit 155.145 Patienten gezeigt hatte (20). In der Metaanalyse der 3 R CTs über DPP-4-Inhibitoren (Savor TIMI 53, EXAMINE und TECOS) fand sich eine erhöhte Inzidenz von akuter Pankreatitis im Vergleich zu entsprechenden Kontrollen (Odds Ratio 1,79 KI 1,13-2,82, P = 0,0 13) wobei das absolute Risiko einer akuten Pankreatitis insgesamt gering und unter DPP-4-Inhibitoren absolut nur um 0,13 % höher war (21).
SGLT-2-Hemmer
Wirkung: SGLT-2-Hemmer wirken Blutzucker senkend, in dem sie die renale Glukose Resorption hemmen. Sie senken nicht nur den Blutzucker, sondern bewirken auch eine klinisch relevante Gewichtsreduktion von 2-3 kg und reduzieren den Blutdruck. Aufgrund ihres Wirkmechanismus haben die SGLT-2-Hemmer kein Hypoglykämie Risiko.
Niereninsuffizienz: Die Glukose senkende Effektivität ist abhängig von der Nierenfunktion. Bei Nierenfunktionseinschränkung (GFR < 45 ml/min) wird der Einsatz von SGLT-2-Hemmern wegen Nachlassen der Effektivität nicht mehr empfohlen. Eventuell wird sich dies jedoch auf Grund der neuen Datenlage bald ändern (22).
Harnwegsinfekte und genitale Mykosen: Unter Therapie ist die Rate an Harnwegsinfektionen leicht, die Rate an Genitalinfektionen signifikant erhöht, besonders bei Frauen (10%).
Ketoazidose: Beim Einsatz von SGLT-2-Hemmern wurden sehr vereinzelt Ketoazidosen bei Menschen mit Typ-II-Diabetes beo-bachtet, häufiger bei Menschen mit Typ I Diabetes (23, 24). Die FDA und die EMA haben vor Ketoazidosen unter SGL T2 Inhibitoren gewarnt. Die detaillierte Analyse von 2397 Berichten von Ketoazidose im FAERS (Food and Drug Administration Adverse Events
Reporting System) zeigte eine Dominanz bei Menschen mit Typ I Diabetes, bei Frauen, in einem extrem grossen Alters- und Körpergewichtsbereich und eine hohe Variabilität in der Dauer der SGLT-2-Inhibitor Therapie. 37 Menschen (1,54 %) starben in einer Ketoazidose. Der Einsatz von SGLT-2-Hemmern ist im Vergleich zu DPP4-Hemmern mit einer doppelt so hohen Rate an Ketoazidosen assoziiert, obgleich eine Hospitalisierung in der Mehrheit selten war. Dieses potenzielle Risiko von SGLT-2-Hemmern sollte daher in der Therapie und bei Auftreten von verdächtigen Symptomen nicht vergessen werden. Eine Normoglykämie oder eine leichte Hypergly-kämie schliesst eine Ketoazidose nicht aus (25).
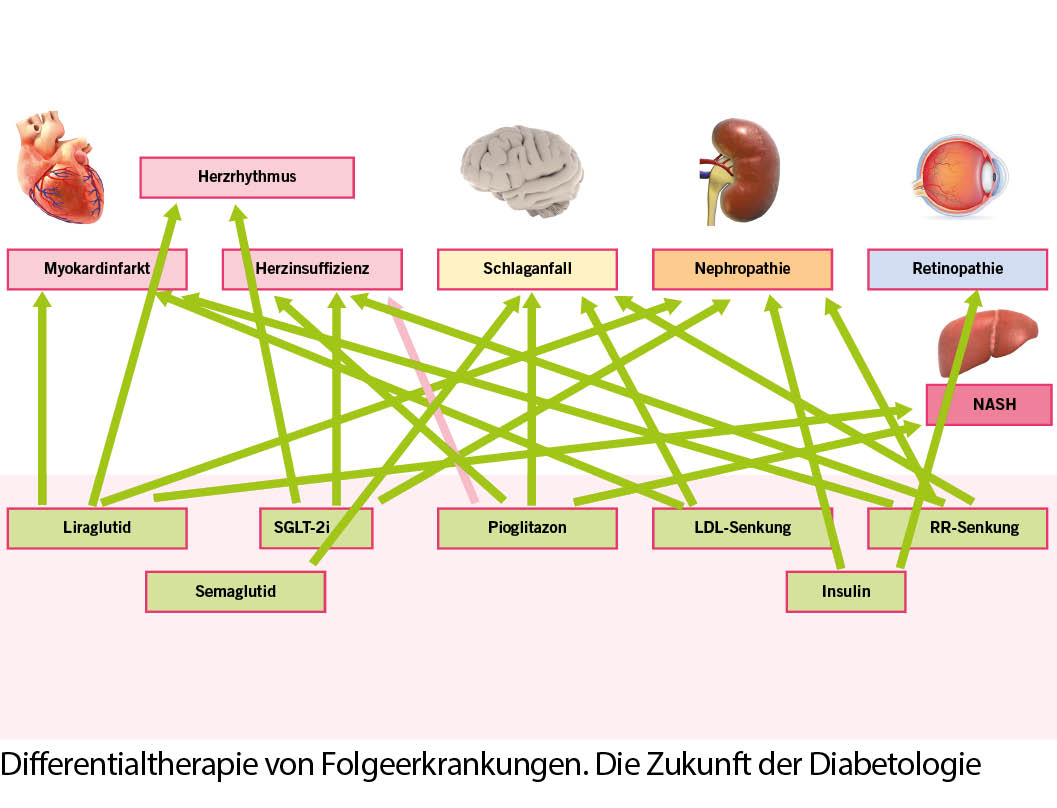
Studien: In der kardiovaskulären Sicherheitsstudie EMPA REG OUTCOMETM konnte bei Patienten mit hohem kardiovaskulären Risiko ein signifikanter Vorteil für den zusammengesetzten primären kardiovaskulären Endpunkt gegenüber der Standardtherapie gezeigt werden. Die NN T, um ein kardiovaskuläres Ereignis zu verhindern, lag bei 39 für 3.1 Jahre. Ebenso konnte eine signifikante Reduktion im Auftreten von mikrovaskulären Nierenschäden festgestellt werden. Der genaue Mechanismus, der zu diesen Resultaten geführt hat, ist noch unbekannt (26). In einer 2017 veröffentlichten Studie zur SGLT-2-Hemmertherapie (CVD Real Study) wurden anhand ambulanter und klinischer Patienten Dateien und nationaler Register aus Dänemark, Deutschland, Norwegen, Schweden, UK und USA Daten für Herzinsuffizienz und Mortalität berechnet. Es wurden die Daten von 450 000 Patienten analysiert. Die Einnahme von SGLT-2-Inhibitoren (Cana 53%, Dapa 42% und Empa 5%) im Vergleich zu anderen glukosesenkenden Therapien war assoziiert mit deutlich niedrigeren Raten für Herzinsuffizienz (HR 0,61; 95 % KI 0,51-0,73; P < 0,001), Tod (HR 0,45; 95 % KI 0,41-0,57; P < 0,001) und Herzinsuffizienz oder Tod (HR 0,54; 95 % KI 0,48-0,60: P <0,001) (27).
In weiteren Analysen der EMPA-REG Outcome Study konnte gezeigt werden, dass Empagliflozin die Entwicklung und Progression einer Nephropathie bei Patienten mit einer geschätzten glomerulären Filtrationsrate initial von mindestens 30 ml/min verlangsamt. Beginn oder Progression der Nephropathie im Vergleich zur Standardtherapie (12,7 versus 18,8 %; HR 0,61; KI 0,53-0,70; p < 0,001). Damit ist für den SGLT-2-Inhibitor Empagliflozin eindrücklich dessen positive Wirkung auf kardiovaskuläre und renale Endpunkte belegt. Die zugrunde liegenden Mechanismen der kardialen und renalen Protektion sind Gegenstand umfangreicher Studien (22).
Aktuelle Outcome RCT Daten zu Canagliflozin (28) weisen in die gleiche Richtung, nämlich eine signifikante Senkung des Composite Endpunktes durch Cana im Vergleich zu Plazebo um 14 %, Rückgang der Hospitalisierungsrate aufgrund einer Herzinsuffizienz um 33 % und renale Outcomedaten mit einer Reduktion der Progression einer Albuminurie um 27 % sowie dem zusammengesetzen Endpunkt um 40 %.
Im Gegensatz zur EMPA-REG OUTCOME™ Studie, in der eine signifikante niedrigere Ereignisrate für kardiovaskuläre Mortalität, für Gesamtmortalität und Hospitalisierung wegen Herzinsuffizienz gefunden wurde, zeigte sich in der CANVAS-Studie zwar eine signifikante Reduktion des primären Composite Endpunktes aber keine entscheidende Verbesserung des Outcomes der Einzelparameter.
Ob es sich bei der Reduktion von Gesamtmortalität, kardiovasku-lärer Mortalität und Morbidität und der SGLT-2-Inhibitoren um einen Klasseneffekt handelt, kann derzeit noch nicht mit Sicherheit beurteilt werden, auch wenn eine aktuelle Metaanalyse dies suggeriert (Monami M Acta Diabetol 2017). In der EMPA-REG und in der CANVAS-Studie ergeben sich nämlich sowohl bei den Endpunkten als auch bei den unerwünschten Ereignissen Unterschiede. Die DECLARE-Studie erreichte ihren primären Sicherheitsendpunkt einer Nicht-Unterlegenheit bei schwerwiegenden unerwünschten kardiovaskulären Ereignissen und erreichte eine statistisch signifi-kante Reduktion des kombinierten Endpunktes einer Hospitalisierung wegen Herzinsuffizienz oder eines kardiovaskulären Todes – und wird somit als positiv gewertet. Im zweiten kombinierten Wirksamkeitsendpunkt – bestehend aus schwerwiegenden unerwünschten kardiovaskulären Ereignissen (MACE) – traten im Dapagliflozin-Studienarm weniger kardiovaskuläre Ereignisse auf; diese Ereignisverringerung erreichte jedoch keine statistische Signifikanz (28).
Die EMA hat einem Reviewprozess gestartet, um der Frage nachzugehen ob die Therapie mit Cana zu einem erhöhten Amputations-risiko führt.
(Erhöhtes Amputationsrisiko bei Canagliflozin (HR 1.97) und Frakturrisiko (HR 1.23) (29).
Die FDA hat eine Warnung für Nierenversagen unter Dapa und Cana publiziert, welches zumindest für Cana anhand der CANVAS-
Daten nicht aufrechterhalten werden kann.
GLP-1-Analoga
Wirkung: GLP-1 ist ein Inkretinhormon aus der Darmschleimhaut, das die Insulinsekretion Glukose abhängig stimuliert und die Glukagon Sekretion vermindert. Synthetische GLP1 Rezeptor Agonisten imitieren den Effekt von GLP1 aber sind resistent gegenüber dem Abbau durch DPP-4. GLP-1-Analoga verzögern die Magenentleerung und erhöhen das Sättigungsgefühl. Aktuell sind 5 GLP1 Analoga auf dem Markt. Sie haben kein Hypoglykämierisiko. Die HbA1c Reduktion beträgt etwa 1-1,5 % begleitet von einer moderaten Gewichtsreduktion von 2-5 kg.
Niereninsuffizienz: GLP-1-Analoga sind ab einer GFR von < 50 ml/min nicht mehr zugelassen.
Nebenwirkungen: Es kommt vor allem zu gastrointestinalen Nebenwirkungen wie Übelkeit und Änderung der Stuhlfrequenz. Das Risiko für Pankreatitiden ist möglicherweise erhöht und GLP-1 sollte bei einer vorbestehenden Anamnese nicht eingesetzt werden. Es besteht bisher kein Nachweis eines erhöhten Risikos von Pankreas- oder medullären Schilddrüsenkarzinomen trotz vereinzelten Hinweisen aus Studiendaten.
Studien: LEADER (Liraglutid) (30): Liraglutid ist ein 1x tägliches GLP-1-Präparat mit einer HWZ von 11-15h. Kürzlich wurden die Ergebnisse der Leader Studie veröffentlicht. (9000 Patienten mit erhöhten CV Risiko über 45 Monate). Der primäre Endpunkt war ein zusammengesetzter Endpunkt aus kardiovaskulärem Tod, nicht tödlichem Myokardinfarkt und nicht tödlichem Schlaganfall. Nach einem mittleren Follow Up von 3,8 Jahren hatten 13 % der Liraglutid Patienten und 14,9 % in der Placebogruppe den primären Endpunkt erreicht und eine signifikante Verminderung der kardiovaskulären Mortalität in der Liraglutid Gruppe 4,7 % versus 6 % (p = 0.007, NNT 77).
ELIXA (Lixisenatid, in der Schweiz als Lyxumia® im Handel (31).
Kurzwirksames GLP-1 Analogon (6000 Typ-2 Pat.ienten mit erhöhtem CV Risiko für 25 Monate) Es konnte eine non-inferiority bewiesen werden aber kein signifikanter Vorteil gegenüber Plazebo.
SUSTAIN-6 mit Semaglutid (32), seit September 2018 in der Schweiz erhältlich als Ozempic®, 3297 Patienten mit hohem CV Risikoprofil, 104 Wochen, der zusammengesetzte kardiovaskuläre Endpunkt war signifikant tiefer als im Vergleich zu Plazebo ((hazard ratio, 0.74; 95% confidence interval [CI], 0.58 to 0.95; P<0.001 for noninferiority; P=0.02 for superiority), was vor allem durch eine deutliche Reduktion der zerebrovaskulären Ereignisse verursacht wurde( 39% RR) (NNT 45/ 2.5y).
EXSCEL (Exenatid) (33): Kein Einfluss auf Mace. Rewind (Dulaglutid): Signifikante Reduktion von Mace bei Patienten mit und ohne vorbestehende CVD.
Alle Substanzen zeigten ein wenigstens kardiovaskulär neutrales Sicherheitsprofil, im Fall von Liraglutid, Semaglutid und Dulaglutid sogar Überlegenheit, die sich aus der MACE-3 Berechnung ergab. In punkto Herzinsuffizienz ist keine der Substanzen einer Standardtherapie überlegen, zu Liraglutid liegen hier weitere Studien vor. In der FIGHT (34) und der LIVE (35) Studie hat Liraglutid zu keiner Verbesserung der kardialen Funktion bei Patienten mit fortgeschrittener Herzinsuffizienz über 180 Tage Therapiedauer geführt. Nach bisheriger Datenlage ist die Therapie des herzinsuffizienten Diabetikers mit GLP-1 Analogon also als sicher einzustufen, generiert aber für diese Patientengruppe keinen Vorteil bezüglich der LVEF.
Kombination SGLT-2 und GLP-1 bisher nicht zugelassen, keine Langzeitstudien.
Insulintherapie
Wirkung: Exogen zugeführtes Insulin unterstützt die Blutzuckerkontrolle nach dem Sekretionsversagen der Betazellen.
Nieren- und Leberinsuffizienz: Insulintherapie ist nicht kontra-indiziert und nahezu immer einsetzbar
Nebenwirkungen: Gefahr von Unterzuckerungen und Gewichtszunahme, generell aber sehr gute Verträglichkeit
Studien: ORIGIN Studie zeigt kardiovaskuläre und onkologische Sicherheit bei 12000 Patienten über 7 Jahre (37).
Insulin Deglutec (Tresiba) ist insulin Glargin U 100 (Lantus) in der Therapie bei Menschen mit Typ-II-Diabetes mit hohem Risiko für kardiovaskuläre Ereignisse in Hinblick auf MACE nicht unterlegen. Die HbA1c Werte waren in beiden Gruppen über den Beobachtungszeitraum von 2 Jahren identisch, die Nüchtern Plasmaglucosewerte aber unter Insulin Deglutec signifikant niedriger. Weiterhin war die Rate schwerer Hypoglykämien (sekundärer Endpunkt) unter Insulin Deglutec signifikant niedriger als unter Insulin Glargin. Die Rate schwerer Nebenwirkungen z.B. benigne und maligne Neoplasien waren vergleichbar) (30, 38).
Leitende Ärztin Diabetologie
Kantonsspital Baselland
4101 Bruderholz
Barbara.Felix@ksbl.ch
Die Autorin hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
1. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998 Sep 12;352(9131):837-5
2. ACCORD Study Group, Gerstein HC et al. Effects of intensive glucose lowering in type 2 diabetes. NEJM 2008;358(24):2545-59
3. ADVANCE Collaborative Group, Patel A et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358(24):2560-7
4. Duckworth W. et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360(2):129-39
5. Nissen SE et al. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007;356(24):2457-71
6. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998;352(9131):854-6
7. Palmer SC et al. Comparison of Clinical Outcomes and Adverse Events Associated With Glucose-Lowering Drugs in Patients With Type 2 Diabetes: A Meta-analysis. JAMA 2016;316(3):313-24. doi: 10.1001/jama.2016.9400
8. Bannister CA et al. Can people with type 2 diabetes live longer than those without? A comparison of mortality in people initiated with metformin or sulphonylurea monotherapy and matched, non-diabetic controls. Diabetes Obes Metab 2014;16(11):1165-7
9. Bain S et al. Cardiovascular events and all-cause mortality associated with sulphonylureas compared with other antihyperglycaemic drugs: A Bayesian meta-analysis of survival data. Diabetes Obes Metab 2017;19:329-35
10. Simpson SH et al. Mortality risk among sulfonylureas: a systematic review and network meta-analysis. Lancet Diabetes Endocrinol 2015 Jan;3(1):43-51
11. NAVIGATOR Study Group, Holman RR et al. Effect of nateglinide on the incidence of diabetes and cardiovascular events. N Engl J Med 2010;362(16):1463-76
12. ADVANCE Collaborative Group, Patel A et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358(24):2560-72
13. Dormandy JA et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macrovascular Events): a randomised controlled trial. Lancet 2005;366(9493):1279-89
14. Kernan WN et al. Pioglitazone after Ischemic Stroke or Transient Ischemic Attack. N Engl J Med 2016;374(14):1321-31
15. Tuccori M et al. Pioglitazone use and risk of bladder cancer: population based cohort study. BMJ 2016;352:i154
16. Green JB et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015;373(3):232-4
17. Udell JA et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes and moderate or severe renal impairment: observations from the SAVOR-TIMI 53 Trial. Diabetes Care 2015;38(4):696-705
18. Zannad F. et al. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet 2015;385(9982):2067-76
19. Li L et al. Dipeptidyl peptidase-4 inhibitors and risk of heart failure in type 2 diabetes: systematic review and meta-analysis of randomised and observational studies. BMJ 2016;352:i610. doi: 10.1136/bmj.i610.
20. Filion KB et al. A Multicenter Observational Study of Incretin-based Drugs and Heart Failure. N Engl J Med 2016;374(12):1145-54. doi: 10.1056/NEJMoa1506115.
21. Tkáˇc I, Raz I. Combined Analysis of Three Large Interventional Trials With Gliptins Indicates Increased Incidence of Acute Pancreatitis in Patients With Type 2 Diabetes. Diabetes Care. 2017 Feb;40(2):284-286. doi: 10.2337/dc15-1707
22. Wanner C et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016 Jul 28;375(4):323-34
23. Peters AL et al. Euglycemic Diabetic Ketoacidosis: A Potential Complication of Treatment With Sodium-Glucose Cotransporter 2 Inhibition. Diabetes Care. 2015 Sep;38(9):1687-93.
24. Peters AL et al. Diabetic Ketoacidosis With Canagliflozin, a Sodium-Glucose Cotransporter 2 Inhibitor, in Patients With Type 1 Diabetes. Diabetes Care 2016;39(4):532-8
25. Fadini GP et al. SGLT2 inhibitors and diabetic ketoacidosis: data from the FDA Adverse Event Reporting System. Diabetologia. 2017;60(8):1385-9
26. Zinman B et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. EMPA-REG OUTCOME Investigators. N Engl J Med 2015;373(22):2117-28
27. Kosiborod M et al. Lower Risk of Heart Failure and Death in Patients Initiated on Sodium-Glucose Cotransporter-2 Inhibitors Versus Other Glucose-Lowering Drugs: The CVD-REAL Study (Comparative Effectiveness of Cardiovascular Outcomes in New Users of Sodium-Glucose Cotransporter-2 Inhibitors). Circulation 2017;136(3):249-59
28. Wiviott SD et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2018 Nov 10. doi: 10.1056/NEJMoa1812389. [Epub ahead of print]
29. Neal N et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017;377(7):644-57
30. LEADER Trial Investigators, Marso SP et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016;375(4):311-22
31. ELIXA Investigators, Pfeffer MA et al. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med 2015;373(23):2247-5
32. SUSTAIN-6 Investigators, Marso SP et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016,375:1834-44. doi:10.1056/NEJMoa1607141
33. Holman RR et al. Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2017;377(13):1228-39
34. Margulies KB et al. Effects of Liraglutide on Clinical Stability Among Patients With Advanced Heart Failure and Reduced Ejection Fraction: A Randomized Clinical Trial. JAMA 2016;316(5):500-8
35. Jorsal A et al. Effect of liraglutide, a glucagon-like peptide-1 analogue, on left ventricular function in stable chronic heart failure patients with and without diabetes (LIVE)-a multicentre, double-blind, randomised, placebo-controlled trial. Eur J Heart Fail 2017;19(1):69-77
36. Billings LK et al. Efficacy and Safety of IDegLira Versus Basal-Bolus Insulin Therapy in Patients With Type 2 Diabetes Uncontrolled on Metformin and Basal Insulin: The DUAL VII Randomized Clinical Trial. Diabetes Care 2018;41(5):1009-16
37. The ORIGIN Trial Investigators, Gerstein HC et al. Basal Insulin and Cardiovascular and Other Outcomes in Dysglycemia. N Engl J Med 2012;367(4):319-28
38. Cheng A et al. Similar Glycemic Control and Less or Comparable Hypoglycemia with Insulin Glargine 300 U/mL (Gla-300) vs Degludec 100 U/mL (IDeg-100) in Insulin-Naïve T2DM on Antihyperglycemic Drugs ± GLP-1 RAs: The BRIGHT Randomized Study. Presentation 301-OR, American Diabetes Association (ADA) 78th annual congress in Orlando, Florida, U.S., June 25, 2018
info@herz+gefäss
- Vol. 9
- Ausgabe 3
- Mai 2019