- Vom Paradigma des sterilen Urins zur Eubiose der Blase
Im Zuge der neuen Verfahren des «DNA Sequencing» wurde im Jahre 2008 das «Microbiome Project» auf die Beine gestellt. Dieses analysiert Mikrobiome in der Umwelt, der Ernährung und im Menschen. Das Letztere, als «Human Microbiome Project» bezeichnet, analysiert das Körper-Mikrobiom zum Beispiel im Darm, auf der Haut, vaginal und im Mund. Das Blasen-Mikrobiom wurde nicht in die wissenschaftliche Analyse eingeschlossen, weil man davon ausging, dass der Urin steril ist. Erst später wurden die Testverfahren auch auf den Urin angewendet und 2012 erste Daten publiziert (1, 2). Seither wurden 149 verschiedene Bakterien-stämme in der Blase nachgewiesen.
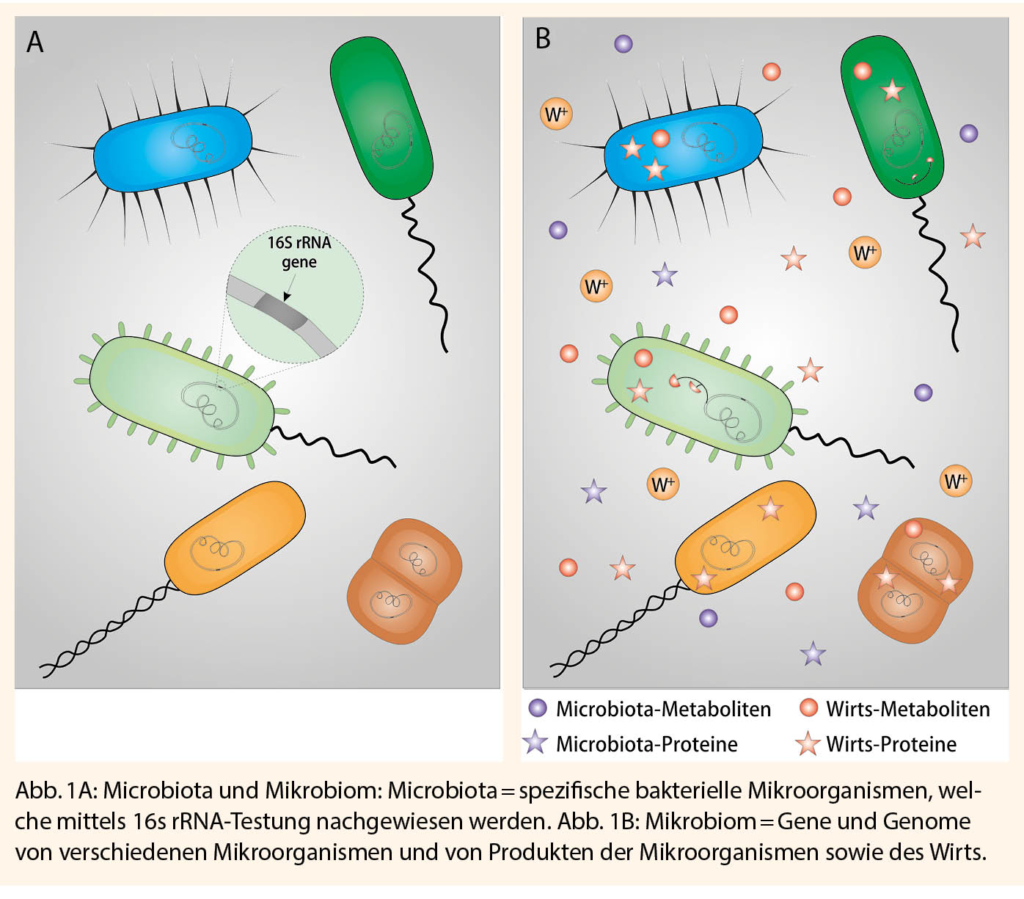
Until 2012, the urine of healthy people was considered sterile. The microscopic or cultural detection of urinary bacteria has been defined as a urinary tract infection. If these bacteria were found in asymptomatic people, this was called an asymptomatic urinary tract infection. DNA sequencing made it possible to detect specific bacterial gene components. 16s rRNA is a base sequence in the gene of bacteria. This gene is not only typical of bacteria, it also varies depending on bacterial species.
To this day, the question largely remains unanswered as to what function bacteria have in the human body. The website of the Human Microbiome Project includes the following tasks:
- Production of vitamins
- Splitting food for nutrient extraction
- Triggering the immune system to respond to dangerous drugs
- Production of beneficial anti-inflammatory substances to combat pathogenic microbes
- Changes in the microbiome seem to be related to various diseases, which fuels the hope of using it therapeutically
Im Vergleich zu anderen Mikrobiomen ist das Darm-Mikrobiom schon recht gut erforscht und therapeutische Ansätze sind geprüft. So wurde zum Beispiel nachgewiesen, dass bei einer Clostridium difficile-Infektion eine Stuhltransplantation von einem gesunden Spender in das Empfänger-Duodenum besser ist als eine Antibiotikatherapie mit Vancomycin (3). In verschiedenen Studien wurde nachgewiesen, dass das Darm-Mikrobiom Gesundheit und Krankheit von verschiedenen Körperregionen mitbestimmt. Die Darm-Dysbiose konnte mit Erkrankungen des Hirns, des Herzens, des muskuloskelettalen Systems und von metabolischen Prozessen in Verbindung gebracht werden (4). Zudem wurde festgestellt, dass das Mikrobiom ein besserer Prädiktor einer zukünftigen Typ II Diabetes-Erkrankung ist als die Zusammensetzung des individuellen Genoms (5).
Definition
Der Unterschied zwischen Mikrobiom und Microbiota kann so erklärt werden: Das Mikrobiom wird als ein Kollektiv von Genen und Genomen von Mikroorganismen in einem Organ, einer Nische, einem Lebensraum bezeichnet. In einem Mikrobiom können somit neben Bakterien auch Eukaryoten (zB. Pilze), Archaeen (z.B. Methanobrevibacter smithii) und Viren vorkommen. Als Microbiota sind im Gegensatz dazu ausschliesslich die bakteriellen Mikroorganismen gemeint, welche durch die Präsenz von 16s rRNA nachgewiesen werden können (Abb. 1).
Ein gesundes Gleichgewicht der Bakterien wird als Eubiose, ein Ungleichgewicht der Flora mit dominanten pathogenen Keimen als Dysbiose bezeichnet.
Die Erkenntnisse aus dem Human Microbiome Project führten dazu, dass die herkömmlichen Definitionen im Zusammenhang mit Harnwegsinfektionen wahrscheinlich in Zukunft revidiert werden müssen. Der Nachweis von 149 Bakterienstämmen im Urin und die Tatsache, dass darunter auch pathogene Keime vorkommen, macht es notwendig, die Begrifflichkeit zu ändern. So macht der Begriff «asymptomatischer Harnwegsinfekt» keinen Sinn mehr. Dies bedeutet, dass potenziell pathogene Keime, welche wir in der Urinkultur finden, bei asymptomatischen Menschen nicht mehr als asymptomatische Infektion betrachtet, sondern als ein normaler Bestandteil im Sinne der Eubiose bezeichnet werden. Es besteht ein Leitlinien-Konsens, dass solche Befunde bei asymptomatischen Frauen nicht behandelt werden müssen.
Das menschliche Mikrobiom besteht somit aus Mikroorganismen wie Bakterien, Viren und Pilzen. Die Bakterien übertreffen die Anzahl der menschlichen Zellen etwa zehn Mal und machen etwa 1-3% des Körpergewichts aus. Diese Mikroben sind im Allgemeinen nicht schädlich, sondern sogar essenziell zur Erhaltung der Gesundheit.
Das Urin-Mikrobiom
Dass sich das Dogma, der Urin sei steril, so lange gehalten hat, liegt daran, dass die Technik der Urinkultur darauf ausgerichtet war, pathogene Keime wie zum Beispiel E. coli für Harnwegsinfektionen zu finden. Die Analyse von mittels Blasenpunktion gewonnenem Urin von gesunden Frauen mittels Gensequenzierung zeigte, dass der normale Urin verschiedenste Bakterien wie Lactobacillen, Gardnerellen, Streptokokken, Staphylokokken und Corynebakterien enthält. Dass diese bisher nicht gefunden wurden, liegt daran, dass die Standardurinkultur die notwendigen Wachstumsbedingungen für diese Keime nicht lieferte.
Erst mit der Anwendung von neuen Untersuchungstechniken wurde es möglich, das Blasenmicrobiota von gesunden und von blasenkranken Frauen zu untersuchen und zu vergleichen. Asymptomatische Frauen weisen eine geringe bakterielle Diversität auf, während zum Beispiel Frauen mit einer überaktiven Blase eine höhere Diversität zeigen. Dabei wurde gefunden, dass bei höherer bakterieller Diversität der Erfolg einer anticholinergen Medikation geringer ist. In der gleichen Studie fand man, dass gewisse Bakterienspezies wie Streptococcus anginosus und Gardnerella vaginalis mit überaktiver Blase assoziiert waren, dass aber Lactobacillus crispatus mit der Abwesenheit von Blasensymptomen assoziiert war (6). Bekannt ist auch, dass die Dominanz von verschiedenen Lactobacillus-Arten im Microbiota einen besseren Schutz vor katheterassoziierten oder postoperativen Harnwegsinfektionen ermöglicht (7).
Krystal Thomas-White et al. publizierten 2018 die Resultate der Zusammensetzung der Blasenmicrobiota von Katheterurin von 77 Frauen (38 asymptomatische und 39 symptomatische) (8). Das Blasenmicrobiota wurde mit dem vaginalen und dem gastrointestinalen Microbiota verglichen. Es zeigten sich Ähnlichkeiten zwischen dem vaginalen und dem Blasenmicrobiota, welche sich aber von dem gastrointestinalen Microbiota unterschieden. Daraus resultierte die Beobachtung, dass ein urogenitales Microbiota existiert welches in der Blase und der Vagina sehr ähnliche Bakterienstämme von E. coli, Streptococcus anginosus, Lactobacillus iners und Lactobacillus crispatus aufweist. Dies weist darauf hin, dass sowohl zwischen den pathogenen wie den gesundheitsunterstützenden (kommensalen) Keimen von Blase und Vagina eine Verbindung besteht. Damit wird die Hypothese widerlegt, dass ein gesundes vaginales Mikrobiom die Aszension von pathogenen Keimen in die Blase verhindert und somit ein Schutz vor Blaseninfektion sein soll. Heute wird angenommen, dass es ein gemeinsames urogenitales Microbiota gibt, in welchem die kommensalen Bakterien wie Lactobacillus iners und Lactobacillus crispatus uropathogene Keime wie zum Beispiel E. coli und Streptococcus anginosus in ihrer pathogenetischen Wirkung hemmen.
Aufgaben der Bakterien in der Blase
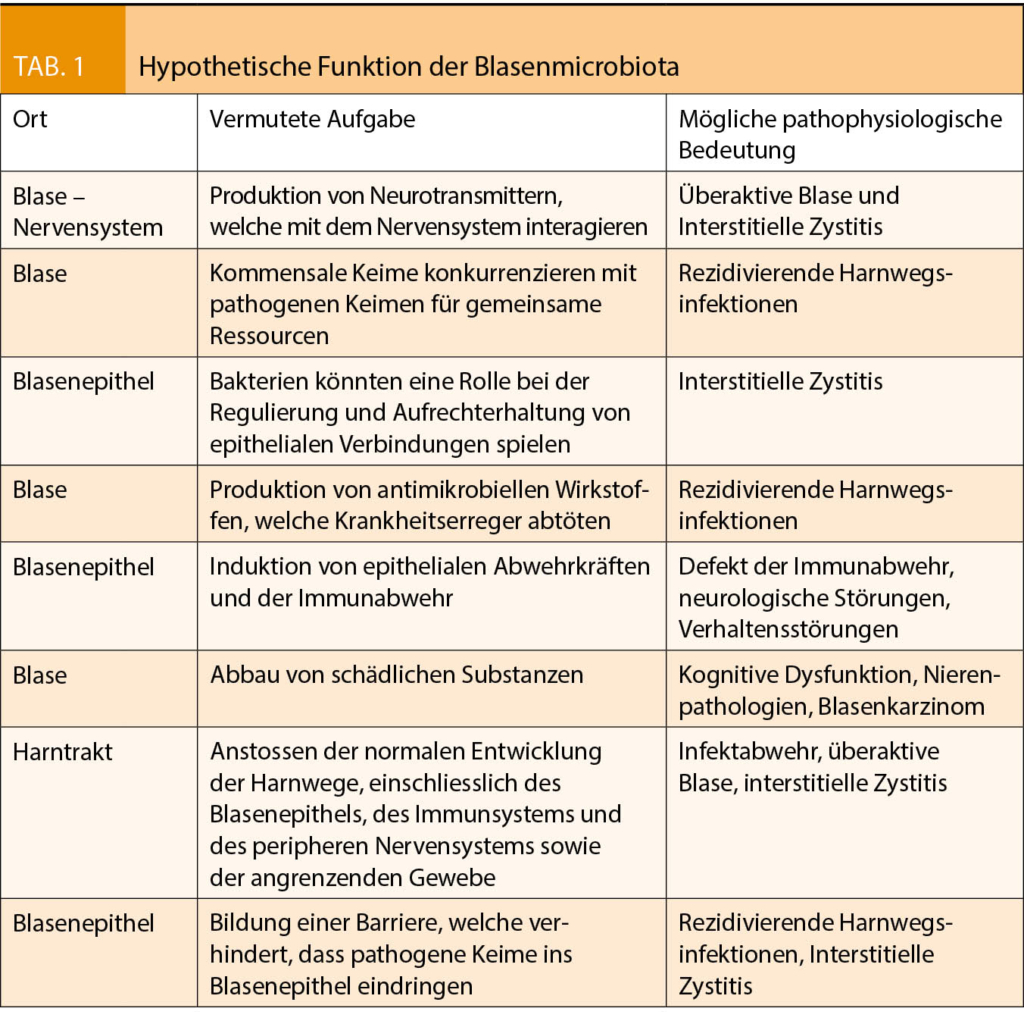
Whiteside et al. formulierten in einem lesenswerten Artikel in Nature Reviews Urology Hypothesen zu den Aufgaben der Blasenmicrobiota (9). Tabelle 1 zeigt diese vermuteten Aufgaben sowie deren mögliche pathophysiologische Bedeutung.
Beeinflussung der urogenitalen Microbiota
Verschiedene Lebensphasen beeinflussen die Microbiota von Darm und Blase. Der Einfluss von Pubertät und Menopause auf die vaginale Lactobacillenpopulation ist seit langem bekannt. Bekannt ist auch, dass sexuelle Aktivität das urethrale und vaginale Microbiota verändert. Bei Männern führt die Aufnahme sexueller Aktivität zu einer Microbiota-Veränderung des koronalen Sulcus und der distalen Urethra mit Nachweis von Bakterien, welche mit bakterieller Vaginosis vergesellschaftet sind. Spermizide Substanzen können sowohl das männliche wie das weibliche Blasenmicrobiota verändern, wie dies auch in der Vagina nachgewiesen wurde (10).
Ernährung und diätetische Massnahmen beeinflussen die Blasenmicrobiota ebenfalls. Hooton et al. wiesen nach, dass die Erhöhung der täglichen Flüssigkeitsaufnahme um 1.5 l die Inzidenz von wiederholten Blaseninfektionen reduziert (11). Andererseits scheint dies zu einer verstärkten Adhärenz von E. coli und E. faecalis an das Silicon von Katheterträgerinnen zu führen, indem ein antiadhäsiver Faktor im Urin verdünnt und damit schlechter wirksam wird (12). Ibuprufen zeigte im Vergleich mit Ciprofloxacin eine vergleichbare Wirkung zur Behandlung einer akuten Blaseninfektion (13). Studien zur Einnahme von Cranberrysaft zeigen uneinheitliche Resultate, während durch den Einsatz eines Präparates aus D-Mannose und Cranberrysaft die Adhäsion von Typ I-Fimbrien an Zelloberflächen verhindert und damit das Verbleiben der pathogenen Keime im Harntrakt erschwert wird (14). In einer randomisierten, placebokontrollierten Studie wurde ein pflanzliches Produkt mit Tropaeoli majoris herba (Kapuzinerkressenkraut) and Armoraciae rusticanae radix (Meerrettichwurzel) untersucht. Die darin enthaltenen Senföle weisen einen direkten antibakteriellen Effekt auf. Die Studie konnte zeigen, dass dieses pflanzliche Produkt wirksam ist in der Verhinderung von wiederholten Harnwegsinfektionen (15).
Optionen für die Zukunft
Im Bestreben, in Zukunft einen deutlich geringeren Einsatz von Antibiotikatherapien zu benötigen, ist das Verständnis des vaginalen und des Blasenmikrobiota von grosser Bedeutung. Empirische Erkenntnisse zur Entstehung und Prophylaxe von wiederholten Harnwegsinfektionen werden durch die Erkenntnisse der Micro-biotaforschung plötzlich in ihren Zusammenhängen verständlich. Die Wirksamkeit der Anwendung probiotischer Therapien bei Frauen mit rezidivierenden Harnwegsinfektionen konnte in ersten Studien mit intravaginaler Anwendung von Lactobacillenstämmen gezeigt werden (16). In Zukunft werden wir, anstatt des destruktiven Antibiotikaansatzes, die Kreation einer normalisierten Blasenmicrobiota anstreben, sei dies durch diätetische Massnahmen, pflanzliche, nicht Resistenz- generierende Wirkstoffe oder die Transplantation von synthetischen Blasenmicrobiota.
Viele Fragen sind noch zu beantworten. Welche Faktoren beeinflussen die ursprüngliche Kolonisation der Harnblase? Wie beeinflusst die wiederholte Anwendung von Antibiotika die Blasenmicrobiota-Zusammensetzung? Wie werden bakterielle Veränderungen angestossen, welche zu einem Anstieg von E-coli führen und Zystitisbeschwerden verursachen? Sollten wir im klinischen Alltag die 16s rRNA-Gensequenzierung anwenden, um das Microbiotaprofil zu identifizieren und wie verändert dies das Management von Blasenerkrankungen?
Aarau
gabriel.schaer@usz.ch
Der Autor hat keine Interessenskonflikte in Zusammenhang mit diesem Artikel deklariert.
- Urin ist nicht steril
- Zum Mikrobiom gehören Bakterien, Eukaryoten (z.B. Pilze), Archaeen (zB. Methanobrevibacter smithii) und Viren
- Mit der Sequenzierung der bakterienspezifischen Basensequenz 16s rRNA können Bakterien identifiziert und deren Spezies nach-gewiesen werden (= Microbiota)
- Das Mikrobiom der Blase besitzt noch nicht komplett geklärte Schutzaufgaben. Eine Dysbiose kann Krankheiten der Blase aber auch von anderen Organen verursachen
- Das zukünftige Therapieziel von Harnwegsinfektionen wird sein, pathogene Bakterien in ihrer Anzahl zu reduzieren und die Eubiose der Microbiota zu schützen
Literatur:
1. Wolfe AJ, Toh E, Shibata N, Rong R, Kenton K, Fitzgerald M, et al. Evidence of uncultivated bacteria in the adult female bladder. J Clin Microbiol. 2012;50(4):1376-83.
2. Fouts DE, Pieper R, Szpakowski S, Pohl H, Knoblach S, Suh MJ, et al. Integrated next-generation sequencing of 16S rDNA and metaproteomics differentiate the healthy urine microbiome from asymptomatic bacteriuria in neuropathic bladder associated with spinal cord injury. J Transl Med. 2012;10:174.
3. van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med. 2013;368(5):407-15.
4. Cryan JF, O’Mahony SM. The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterol Motil. 2011;23(3):187-92.
5. Nicolle LE, Zhanel GG, Harding GK. Microbiological outcomes in women with diabetes and untreated asymptomatic bacteriuria. World J Urol. 2006;24(1):61-5.
6. Pearce MM, Hilt EE, Rosenfeld AB, Zilliox MJ, Thomas-White K, Fok C, et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. MBio. 2014;5(4):e01283-14.
7. Pearce MM, Zilliox MJ, Rosenfeld AB, Thomas-White KJ, Richter HE, Nager CW, et al. The female urinary microbiome in urgency urinary incontinence. Am J Obstet Gynecol. 2015;213(3):347 e1-11.
8. Thomas-White K, Forster SC, Kumar N, Van Kuiken M, Putonti C, Stares MD, et al. Culturing of female bladder bacteria reveals an interconnected urogenital microbiota. Nat Commun. 2018;9(1):1557.
9. Whiteside SA, Razvi H, Dave S, Reid G, Burton JP. The microbiome of the urinary tract–a role beyond infection. Nat Rev Urol. 2015;12(2):81-90.
10. Gupta K, Hillier SL, Hooton TM, Roberts PL, Stamm WE. Effects of contraceptive method on the vaginal microbial flora: a prospective evaluation. J Infect Dis. 2000;181(2):595-601.
11. Hooton TM, Vecchio M, Iroz A, Tack I, Dornic Q, Seksek I, et al. Effect of Increased Daily Water Intake in Premenopausal Women With Recurrent Urinary Tract Infections: A Randomized Clinical Trial. JAMA Intern Med. 2018;178(11):1509-15.
12. Habash MB, Van der Mei HC, Busscher HJ, Reid G. The effect of water, ascorbic acid, and cranberry derived supplementation on human urine and uropathogen adhesion to silicone rubber. Can J Microbiol. 1999;45(8):691-4.
13. Bleidorn J, Gagyor I, Kochen MM, Wegscheider K, Hummers-Pradier E. Symptomatic treatment (ibuprofen) or antibiotics (ciprofloxacin) for uncomplicated urinary tract infection?–results of a randomized controlled pilot trial. BMC Med. 2010;8:30.
14. Scharenberg M, Schwardt O, Rabbani S, Ernst B. Target Selectivity of FimH Antagonists. J Med Chem. 2012;55(22):9810-6.
15. Albrecht U, Goos KH, Schneider B. A randomised, double-blind, placebo-controlled trial of a herbal medicinal product containing Tropaeoli majoris herba (Nasturtium) and Armoraciae rusticanae radix (Horseradish) for the prophylactic treatment of patients with chronically recurrent lower urinary tract infections. Curr Med Res Opin. 2007;23(10):2415-22.
16. Stapleton AE, Au-Yeung M, Hooton ™, Fredricks DN, Roberts PL, Czaja CA, et al. Randomized, placebo-controlled phase 2 trial of a Lactobacillus crispatus probiotic given intravaginally for prevention of recurrent urinary tract infection. Clin Infect Dis. 2011; 52 (10): 1212-7.
info@gynäkologie
- Vol. 9
- Ausgabe 3
- Juni 2019