- Prévention et contrôle des épidémies en EMS
Les épidémies sont malheureusement très fréquentes en EMS en raison de la cohabitation entre les résidents et le personnel de l’ établissement. Cet article passe en revue les épidémies les plus fréquemment retrouvées en EMS et leurs mesures de prise en charge.
Introduction
Les EMS sont un microcosme dans lequel les épidémies peuvent se propager très rapidement. Une épidémie est évoquée lorsqu’ au moins deux résidents présentent des symptômes cliniques évocateurs simultanément et dans la même unité de soin. Les infections respiratoires et les infections gastro-intestinales sont les épidémies les plus représentées dans les EMS (1, 2). En effet, une revue de la littérature publiée en 2010 sur 206 épidémies révèle que le virus influenza et le norovirus sont les deux pathogènes les plus documentés en cas d’ épidémie en EMS (respectivement 23.7 % et 12.1 %). La gale et les épidémies à rotavirus sont moins fréquentes (respectivement 5.3 % et 0.97 %). La promiscuité entre les résidents et les soignants favorise la transmission (2). En préambule, il est bon de rappeler que toutes les épidémies doivent faire l’ objet d’ une déclaration à la santé publique.
Epidémie de gastro-entérite
Les épidémies de diarrhées d’ origine virale sont très fréquentes en EMS et sont à l’ origine d’ une morbidité importante (3-5) avec des taux d’ attaque très élevés (> 60 %) chez les résidents et le personnel (6, 7). Les agents étiologiques les plus souvent incriminés sont des norovirus (souvent le GII.4) et plus rarement des rotavirus (2, 8). Très occasionnellement, une origine bactérienne peut être incriminée, ceci dans le contexte d’ aliments contaminés (9). Elles sont rares en EMS, car les cuisines répondent à des normes strictes en matière de conservation et de préparation des aliments. En dehors d’ épidémie, le C. difficile doit être évoqué lorsqu’ un résident présente des diarrhées. En effet, contrairement à la littérature nord-américaine et britannique, aucune épidémie à C. difficile n’ est documentée dans nos régions (10).
Mesures de prévention et de prise en charge
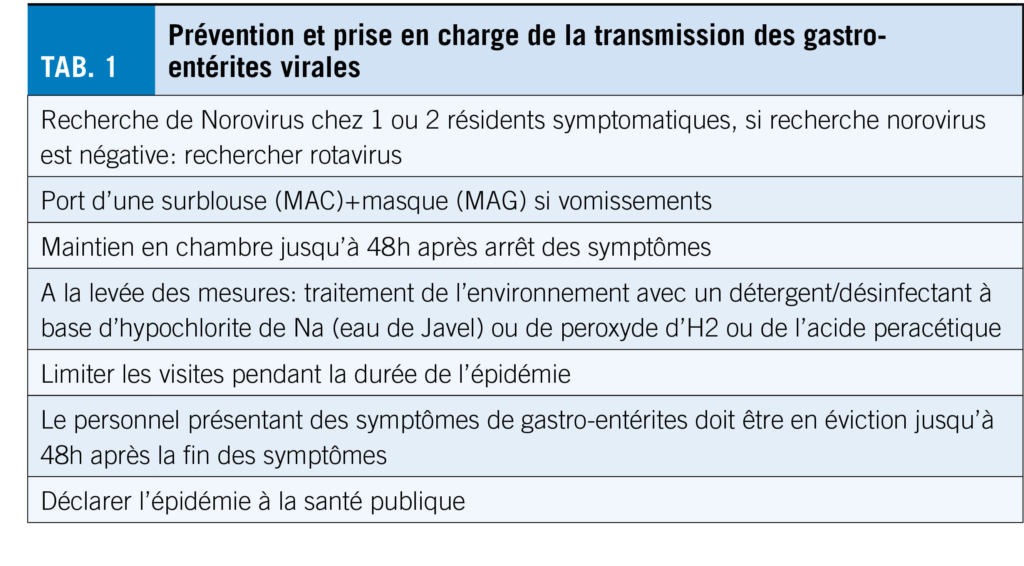
En cas de gastro-entérite, la mise en place rapide de mesures (Mesures Additionnelles Contact (surblouse), voire des Mesures Additionnelles Gouttelettes (surblouse et masque de soins) en cas de vomissements) est essentielle pour limiter la dissémination du micro-organisme (Tab. 1) (4). Il est recommandé de faire confirmer le diagnostic étiologique (recherche de virus dans les selles) (3). L’ hygiène des mains du personnel joue un rôle capital dans le contrôle de la transmission du virus et la majorité des solutions hydro-alcooliques sont efficaces contre les virus (voir les informations du fabricant). Un maintien en chambre et un arrêt des activités de groupe sont recommandés jusqu’ à 48 h après la fin des symptômes. En cas d’ épidémie d’ ampleur, l’ unité concernée doit être fermée et les visites limitées. Après la levée des mesures, l’ environnement doit être traité avec un désinfectant à base d’ hypochlorite de sodium (eau de Javel), de peroxyde d’ hydrogène ou encore d’ acide peracétique (7). Le personnel soignant symptomatique doit être placé en éviction jusqu’ à 48 h après la fin des symptômes.
Epidémie de grippe
La promiscuité des résidents dans les EMS ainsi que leur vulnérabilité sont un terrain propice à la diffusion rapide du virus de la grippe (11). Des taux d’ attaque se situant entre 25-70 % avec une mortalité de 10-55 % sont observés lors d’ épidémies en EMS (12, 13). Ces épidémies surviennent malgré un taux élevé de vaccination contre la grippe chez les résidents (14).
Mesures de prévention et de prise en charge
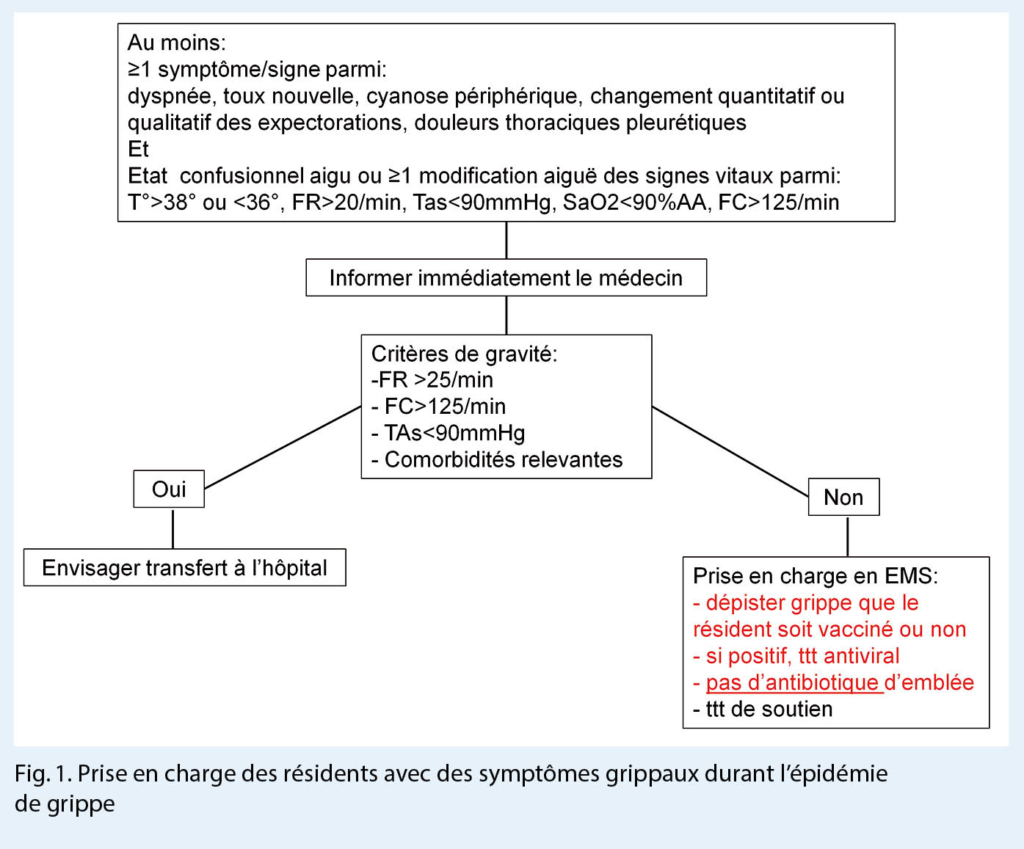
La prévention primaire de la grippe est basée sur la vaccination et le principe de l’ immunité de groupe. En effet, avec un taux de vaccination de > 80 % dans le groupe entier (résidents et personnel participant aux soins), on peut limiter le risque d’ une épidémie dans l’ institution (15). L’ immunité de groupe permet de protéger les résidents qui, en raison de l’ immunosénescence, développent moins d’ anticorps. En cas d’ épidémie de grippe, la prévention et le contrôle de l’ infection sont une tâche ardue (11). En période hivernale, lorsqu’ un résident présente des symptômes grippaux, il est recommandé d’ effectuer une recherche étiologique (PCR grippe sur un frottis naso-pharyngé) en premier lieu (Fig. 1.) En cas de grippe prouvée, la mise en place de Mesures Additionnelles Gouttelettes (port du masque) et l’ instauration d’ un traitement par oseltamivir 75 mg 2 x / j sont recommandés. Lors d’ épidémie documentée dans un EMS, tous les résidents symptomatiques devraient bénéficier d’ un traitement d’ oseltamivir 75 mg 2 x / j pendant 5 jours, sans frottis diagnostic (Tab. 2). L’ utilité du traitement d’ oseltamivir reste controversée (14, 16). Il faut cependant relever que plusieurs études suggèrent que le traitement antiviral aurait un impact sur le risque de propagation du virus dans l’ EMS et pourrait limiter les épidémies. Les données à disposition concernant l’ efficacité de la prophylaxie chez les résidents asymptomatiques sont contradictoires quant à l’ impact sur la durée de l’ épidémie (12, 16) et n’ est donc pas recommandée en l’ absence de facteurs à risque individuels, c’est-à-dire de comorbidités sévères mettant le résident à risque de complications graves. Les Mesures Additionnelles Gouttelettes (port du masque lorsqu’ un résident a une grippe avérée) doivent être respectées par tout le personnel participant aux soins, même par le personnel vacciné. Afin de limiter au maximum la propagation du virus au sein de l’ EMS, il est recommandé que les résidents symptomatiques ne participent pas aux activités de groupe, le temps des symptômes (Tab. 2).
Epidémie de gale
La gale est un parasite qui infecte l’ être humain, en particulier vulnérable, et est l’ une des maladies dermatologiques les plus fréquentes chez la personne âgée (17, 18). Une fois introduite dans l’ EMS, la gale peut causer des épidémies avec des taux d’ attaque élevé (> 30 %) favorisées par les contacts étroits entre soignants et résidents (2). La présentation clinique chez les personnes âgées est parfois paucisymptomatique, ce qui rend le diagnostic difficile et souvent retardé de plusieurs semaines (18, 19). Une étude britannique regroupant 10 épidémies en EMS entre 2014-2015 révèle que plus de 50 % des résidents infectés sont asymptomatiques (19). Il existe deux types cliniques de gale : la gale conventionnelle (scabies vulgaris) et la gale norvégienne (scabies crustosa, plus rare). Cette dernière a une présentation clinique plus bruyante et sa contagiosité est plus grande (20). De nombreuses épidémies ont été rapportées chez des personnes vivant en institution, en particulier avec la gale norvégienne (19, 21). Il faut rappeler qu’ un contact prolongé avec la peau est nécessaire pour la transmission du parasite en cas de gale conventionnelle (22). En cas de gale norvégienne, au vu d’ une contagiosité plus importante, un contact moins prolongé peut conduire à une transmission du parasite.
Mesures de prévention et de prise en charge
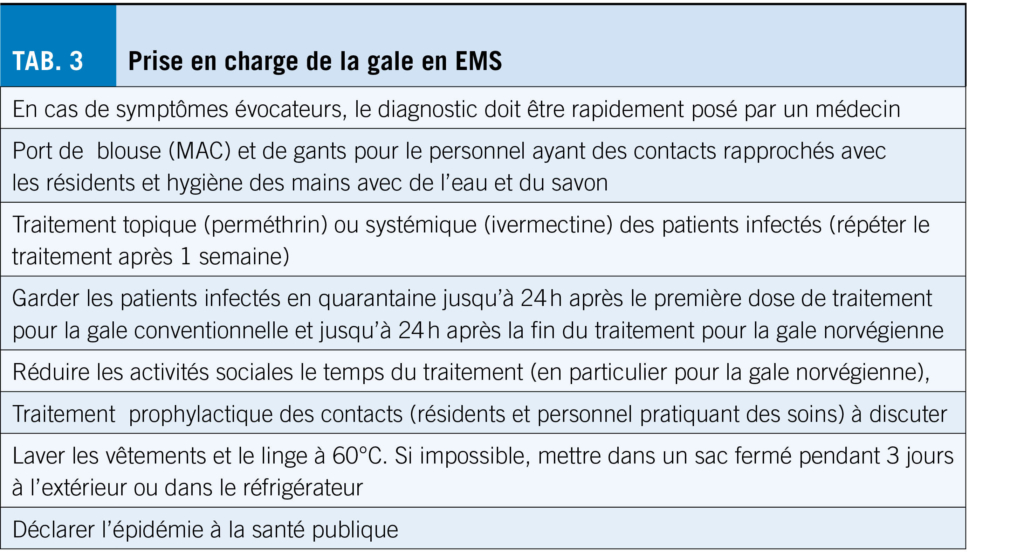
Une prise en charge précoce est primordiale pour limiter la propagation du parasite. Le traitement des personnes infectées peut être soit topique (1er choix) soit systémique (Tab. 3.) (23, 24). Des Mesures Additionnelles Contact (surblouse) et le port de gants sont recommandées lors des soins directs avec le résident pendant 24h après le début du traitement lors de gale conventionnelle, alors que ces mesures seront prolongées jusqu’ à la fin du traitement lors de gale norvégienne. Les parasites étant résistants à l’ alcool, la solution hydro-alcoolique doit être remplacée par un lavage des mains à l’ eau et au savon (25). Après la première dose de traitement et en fin de traitement, les vêtements et la literie doivent être lavés à 60°C. Le linge devant être traité à moins de 60°C est maintenu durant 3 jours à l’ extérieur dans un sac plastique hermétique ou mis au réfrigérateur pendant 24h (23, 26). Lors de gale conventionnelle, un traitement préventif (topique ou systémique) est recommandé pour les personnes ayant eu des contacts peau à peau répétitifs (entourage proche du résident, voisins de chambre et personnel participant aux soins) (27). Une poignée de mains n’ est pas considérée comme un contact prolongé peau à peau. En cas de gale norvégienne, malgré l’ absence d’ évidence dans la littérature, un traitement préventif extensif des contacts est recommandé, c’est-à-dire pour toute personne ayant eu un contact peau à peau (personnel, autres résidents) (24). Pour les contacts (personnel participant aux soins et résidents), la mise en place de traitement est de la responsabilité de la direction médicale et des soins de l’ établissement.
Unité cantonale HPCI
Centre Hospitalier Universitaire Vaudois (CHUV)
Lausanne
delphine.hequet@chuv.ch
Unité cantonale HPCI
Centre Hospitalier Universitaire Vaudois (CHUV)
Lausanne
christiane.petignat@chuv.ch
Les auteures ne déclarent aucun conflit d’ intérêt.
- En raison de la promiscuité entre les résidents et les membres du personnel, les épidémies sont fréquentes en EMS.
- Les systèmes touchés sont divers (système digestif, respiratoire ou cutané) et l’ étendue de l’ épidémie peut être importante en peu de temps.
- Il est donc capital d’ être attentif au moindre signe évocateur dans le but de limiter la survenue et la propagation d’ une épidémie.
1. Jackson MM, Fierer J. Infections and infection risk in residents of long-term care facilities: a review of the literature, 1970-1984. Am J Infect Control. 1985;13(2):63-77.
2. Utsumi M, Makimoto K, Quroshi N, Ashida N. Types of infectious outbreaks and their impact in elderly care facilities: a review of the literature. Age Ageing. 2010;39(3):299-305.
3. Petrignani M, van Beek J, Borsboom G, Richardus JH, Koopmans M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J Hosp Infect. 2015;89(3):163-78.
4. Rajagopalan S, Yoshikawa TT. Norovirus Infections in Long-Term Care Facilities. J Am Geriatr Soc. 2016;64(5):1097-103.
5. Barret AS, Jourdan-da Silva N, Ambert-Balay K, Delmas G, Bone A, Thiolet JM, et al. Surveillance for outbreaks of gastroenteritis in elderly long-term care facilities in France, November 2010 to May 2012. Euro Surveill. 2014;19(29).
6. Matthews JE, Dickey BW, Miller RD, Felzer JR, Dawson BP, Lee AS, et al. The epidemiology of published norovirus outbreaks: a review of risk factors associated with attack rate and genogroup. Epidemiol Infect. 2012;140(7):1161-72.
7. Harris JP, Lopman BA, O’Brien SJ. Infection control measures for norovirus: a systematic review of outbreaks in semi-enclosed settings. J Hosp Infect. 2010;74(1):1-9.
8. Trop Skaza A, Beskovnik L, Zohar Cretnik T. Outbreak of rotavirus gastroenteritis in a nursing home, Slovenia, December 2010. Euro Surveill. 2011;16(14).
9. Layton MC, Calliste SG, Gomez TM, Patton C, Brooks S. A mixed foodborne outbreak with Salmonella heidelberg and Campylobacter jejuni in a nursing home. Infect Control Hosp Epidemiol. 1997;18(2):115-21.
10. Clayton JJ, McHale-Owen J. Outbreak of Clostridium difficile ribotype 027 in a residential home. J Hosp Infect. 2014;88(4):222-5.
11. Lansbury LE, Brown CS, Nguyen-Van-Tam JS. Influenza in long-term care facilities. Influenza Other Respir Viruses. 2017;11(5):356-66.
12. Gorisek Miksic N, Ursic T, Simonovic Z, Lusa L, Lobnik Rojko P, Petrovec M, et al. Oseltamivir prophylaxis in controlling influenza outbreak in nursing homes: a comparison between three different approaches. Infection. 2015;43(1):73-81.
13. Molbak K, Espenhain L, Nielsen J, Tersago K, Bossuyt N, Denissov G, et al. Excess mortality among the elderly in European countries, December 2014 to February 2015. Euro Surveill. 2015;20(11).
14. Monto AS, Rotthoff J, Teich E, Herlocher ML, Truscon R, Yen HL, et al. Detection and control of influenza outbreaks in well-vaccinated nursing home populations. Clin Infect Dis. 2004;39(4):459-64.
15. Kim TH. Seasonal influenza and vaccine herd effect. Clin Exp Vaccine Res. 2014;3(2):128-32.
16. van der Sande MA, Meijer A, Sen-Kerpiclik F, Enserink R, Cools HJ, Overduin P, et al. Effectiveness of post-exposition prophylaxis with oseltamivir in nursing homes: a randomised controlled trial over four seasons. Emerg Themes Epidemiol. 2014;11:13.
17. Suwandhi P, Dharmarajan TS. Scabies in the nursing home. Curr Infect Dis Rep. 2015;17(1):453.
18. Hewitt KA, Nalabanda A, Cassell JA. Scabies outbreaks in residential care homes: factors associated with late recognition, burden and impact. A mixed methods study in England. Epidemiol Infect. 2015;143(7):1542-51.
19. Cassell JA, Middleton J, Nalabanda A, Lanza S, Head MG, Bostock J, et al. Scabies outbreaks in ten care homes for elderly people: a prospective study of clinical features, epidemiology, and treatment outcomes. Lancet Infect Dis. 2018;18(8):894-902.
20. Moberg SA, Lowhagen GB, Hersle KS. An epidemic of scabies with unusual features and treatment resistance in a nursing home. J Am Acad Dermatol. 1984;11(2 Pt 1):242-4.
21. Holness DL, DeKoven JG, Nethercott JR. Scabies in chronic health care institutions. Arch Dermatol. 1992;128(9):1257-60.
22. Savin JA. Mellanby on scabies. Clin Exp Dermatol. 2002;27(1):86-7.
23. Tjioe M, Vissers WH. Scabies outbreaks in nursing homes for the elderly: recognition, treatment options and control of reinfestation. Drugs Aging. 2008;25(4):299-306.
24. FitzGerald D, Grainger RJ, Reid A. Interventions for preventing the spread of infestation in close contacts of people with scabies. The Cochrane database of systematic reviews. 2014(2):CD009943.
25. Hengge UR, Currie BJ, Jager G, Lupi O, Schwartz RA. Scabies: a ubiquitous neglected skin disease. Lancet Infect Dis. 2006;6(12):769-79.
26. Karthikeyan K. Crusted scabies. Indian J Dermatol Venereol Leprol. 2009;75(4):340-7.
27. Scheinfeld N. Controlling scabies in institutional settings: a review of medications, treatment models, and implementation. Am J Clin Dermatol. 2004;5(1):31-7.
la gazette médicale
- Vol. 8
- Ausgabe 4
- Juli 2019