- Maladies cardiovasculaires ischémiques chez les femmes
Eszter Simon, médecin diplômée
PD, MER Dre Judith Bouchardy
PD, MER Dr David Nanchen
PD, MER Dre Carole Clair
Chez les femmes, les maladies cardiovasculaires sont la cause principale de décès. Pourtant, l’ athérosclérose est encore trop souvent considérée comme une maladie de
l’ homme uniquement. Des données récentes ont mis en lumière les différences entre les hommes et les femmes en terme d’ épidémiologie, de prise en charge et de pronostic de la maladie coronarienne notamment. Le but de cet article est de réviser les différences de sexe dans la maladie cardiovasculaire ischémique.
L’ infarctus du myocarde (IM) a été considéré pendant des années comme une «maladie de
l’ homme», une croyance qui a influencé les processus de prise en charge médicale (2). En réalité, bien que la prévalence des maladies cardiovasculaires ischémiques soit plus élevée chez les hommes, la mortalité cardiovasculaire est plus importante chez les femmes (3, 4). Ceci est notamment lié au fait que les femmes sont plus âgées et ont plus de comorbidités au moment de
l’ évènement ischémique. De plus, elles présentent plus fréquemment des symptômes atypiques (5, 6), parfois responsables d’ une banalisation de la situation et de diagnostics erronés ou plus tardifs. La présence de stéréotypes de genre dans la prise en charge des facteurs de risque cardiovasculaires (FRCV) contribue également à expliquer les disparités de pronostic entre les hommes et les femmes.
Spécificités hommes-femmes dans les facteurs de risque cardiovasculaire
Mécanismes physiopathologiques
Des études épidémiologiques suggèrent que l’ incidence de maladies cardiovasculaires (MCV) chez les femmes non ménopausées est inférieure à celle des hommes du même âge, et que l’ incidence et la gravité des MCV augmentent après la ménopause (7). L’ incidence plus faible des MCV chez les femmes en âge de procréer est attribuée au moins en partie aux œstrogènes (7). Les femmes ménopausées perdent l’ effet protecteur relatif des œstrogènes ce qui entraîne une accumulation rapide des FRCV, comme l’ HTA (8), la dyslipidémie (9), les troubles de l’ homéostasie de glucose (10) et l’ obésité viscérale (11). Le manque d’ œstrogène crée un milieu pro-inflammatoire (12), une perturbation de la vasoréactivité coronarienne (13), un dysfonctionnement microvasculaire et endothélial (14) et un remodelage coronarien. Dans un stade avancé, la carence oestrogénique accélère le développement des plaques d’ athérome dans des coronaropathies obstructives (15).
Toutefois, et de façon inquiétante, on observe sur les deux dernières décennies, une tendance vers une augmentation des maladies ischémiques chez les jeunes femmes que ce soit en France ou aux Etats-Unis (16, 17).
Impact des facteurs de risque selon le sexe
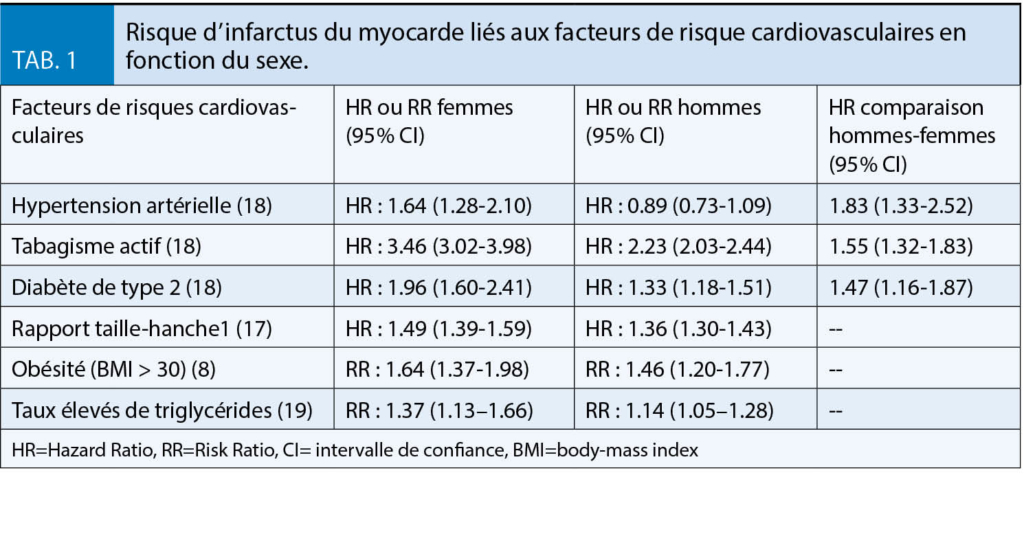
L’ impact selon le sexe des FRCV est représenté dans le Tableau 1. Chez les femmes, l’ hypertension artérielle, le tabagisme, l’ hypertriglycéridémie ainsi que le diabète de type 2 (DM2) sont associés à des risques plus élevés d’ IM par rapport aux hommes (18).
Un rapport de taille-hanche plus élevé est un facteur de risque cardiovasculaire chez les deux sexes, mais le risque est plus important chez les femmes (20).
Les femmes atteintes d’ un DM2 ont un risque plus élevé d’ avoir une maladie coronarienne fatale que les hommes atteints d’ un DM2 (21).
Bien qu’ il y ait, en Suisse, globalement moins de femmes fumeuses dans la population adulte (15 ans et plus), avec 21.1 % de femmes pour 29.5 % d’ hommes selon les statistiques de 2016 (22), le risque de maladie coronarienne chez les femmes fumeuses était de 25 % plus élevé par rapport aux hommes tabagiques selon une méta-analyse publiée en 2011 (23).
En Suisse, 42 % de la population est en surpoids ou obèse, 51 % des hommes et 33 % des femmes selon les statistiques de 2017 (24). La différence entre hommes et femmes est nettement moins prononcée si l’ on ne considère que l’ obésité (12.3 % des hommes contre 10.2 % des femmes) (24). L’ impact de l’ obésité sur les maladies cardiovasculaires semble être plus important chez les femmes. Dans l’ étude de la Framingham Heart Study, l’ obésité augmentait le risque relatif de maladie coronarienne de 64 % chez les femmes, contre 46 % chez les hommes (8).
Les femmes développent une hypertension environ une décennie après les hommes mais
l’ hypertension est plus fréquente chez les femmes âgées que chez les hommes âgés (8). Dans
l’ étude Framingham, parmi les sujets âgés de 65 à 74 ans, les femmes souffrant d’ hypertension artérielle avaient un risque de maladie coronarienne plus élevé que les hommes hypertendus (8).
Les femmes non ménopausées ont un profil lipidique plus favorable que les hommes. Cependant, après 50 ans, les femmes ont tendance à avoir une augmentation des taux de triglycérides et de LDL-cholestérol et une diminution du HDL-cholestérol. L’ hypertriglycéridémie et un faible taux de HDL-cholestérol sont des FRCV plus importants pour les femmes que pour les hommes (19, 25).
On peut donc conclure que la plupart des FRCV sont associés à des risques relatifs plus élevés d’ IM chez les femmes par rapport aux hommes.
Facteurs de risque spécifiques aux femmes
Diabète gestationnel
Les femmes qui ont eu un diabète gestationnel, présentent un risque d’ événements cardiovasculaires post-partum deux fois plus élevé par rapport aux femmes qui n’ ont pas eu de diabète gestationnel. Ce risque ne dépend pas du diabète de type 2 intercurrent et se manifeste dans la première décennie suivant la grossesse. Ainsi, même sans progresser vers le diabète de type 2, les femmes atteintes de diabète gestationnel constituent une population à risque de MCV. Cette augmentation du risque cardiovasculaire nécessite une surveillance et potentiellement un traitement précoce des facteurs de risque (26).
Pré-éclampsie
La pré-éclampsie est une complication hypertensive de la grossesse accompagnée par une protéinurie. Il ne s’ agit pas uniquement d’ une pathologie obstétricale se résolvant après
l’ accouchement. La pré-éclampsie est reconnue actuellement comme un marqueur du risque cardiovasculaire à long terme. Cette augmentation du risque pourrait se manifester déjà en préménopause, mais le mécanisme est encore peu connu (27).
Ménopause précoce ou chirurgicale
La ménopause précoce et l’ ovariectomie bilatérale chez les femmes jeunes sont associées à une incidence accrue de MCV, d’ IM et de mortalité globale (28). Les femmes qui ont subi une ménopause chirurgicale par ovariectomie bilatérale sans substitution oestrogènique auraient un risque de développer ultérieurement une maladie coronarienne deux fois plus élevé que les femmes ayant bénéficié d’ une substitution par œstrogènes (29).
Syndrome des ovaires polykystiques (SOPK)
De nombreuses études cliniques ont mis en évidence un lien entre le SOPK et le profil de risque CV des patientes atteintes, en raison d’ un métabolisme altéré des lipides et du glucose, d’ une hypertension, d’ une affection inflammatoire systémique et de lésions vasculaires. Compte tenu de
l’ apparition précoce de la maladie, le SOPK pourrait être considéré comme un véritable FRCV (30).
Cancer du sein
Les femmes atteintes d’ un cancer du sein ont une probabilité 1,44 fois plus élevée (IC 95 %, 1,00-2,06) d’ avoir des MCV que les femmes sans cancer du sein. Les MCV peuvent être liés aux effets cardiotoxiques ou métaboliques de certains traitements du cancer du sein, tels que le trastuzumab, les schémas à base d’ anthracycline et la radiothérapie (31).
Polyarthrite rhumatoïde
La polyarthrite rhumatoïde (PR) a une prévalence d’ environ 0.5-1 % dans la population européenne, avec une morbidité deux fois plus élevée chez les femmes par rapport aux hommes. La PR est associée à une morbidité et une mortalité CV accrues, vraisemblablement liés à la charge inflammatoire cumulative et la cardiotoxicité des médicaments antirhumatismaux (32).
Lupus érythémateux systémique
Les patient-e-s atteints de lupus érythémateux systémique ont un risque accru d’ événements CV. Des preuves récentes suggèrent que l’ inflammation et une réponse immunologique active sont largement responsables de la plaque d’ athérosclérose (33).
Concernant les facteurs de risque spécifiques au femmes énoncés ci-dessus, lorsqu’ un de ces facteurs de risque est présent, le calcul du risque coronarien avec algorithmes utilisant les facteurs de risque traditionnels, sous-évalue le risque chez les femmes. Pratiquement, nous recommanderions de catégoriser les femmes dans un niveau de risque supérieur à celui donné par le score de risque de l’ AGLA, lorsqu’ un ou plusieurs de ces facteurs de risque spécifique est présent.
Spécificités hommes-femmes dans la présentation et la prise en charge des cardiopathies ischémiques
Prise en charge d’ une maladie coronarienne stable
Les femmes souffrant d’ angor récurrent sans coronaropathie obstructive doivent être diagnostiquées et traitées car elles courent un risque deux fois plus élevé de développer une atteinte coronarienne significative au cours des 5 à 8 prochaines années (4). Les investigations constituent toutefois un challenge puisque selon une étude suédoise jusqu’ à 80 % des femmes qui présentent un angor stable n’ auraient pas de lésions obstructives lors de la coronarographie (34).
Pour ce qui est de la prise en charge en ambulatoire, selon les données d’ une étude de cohorte en Suisse romande, bien que la même proportion de femmes et d’ hommes présente une douleur thoracique d’ origine cardiovasculaire, les hommes sont 2,5 fois plus susceptibles d’ être référés à un ou une cardiologue lors des 12 mois qui suivent une consultation en médecine de premier recours en raison d’ une douleur thoracique que les femmes (35). Ces données suggèrent que des efforts doivent être faits pour assurer une équité entre hommes et femmes dans les soins médicaux.
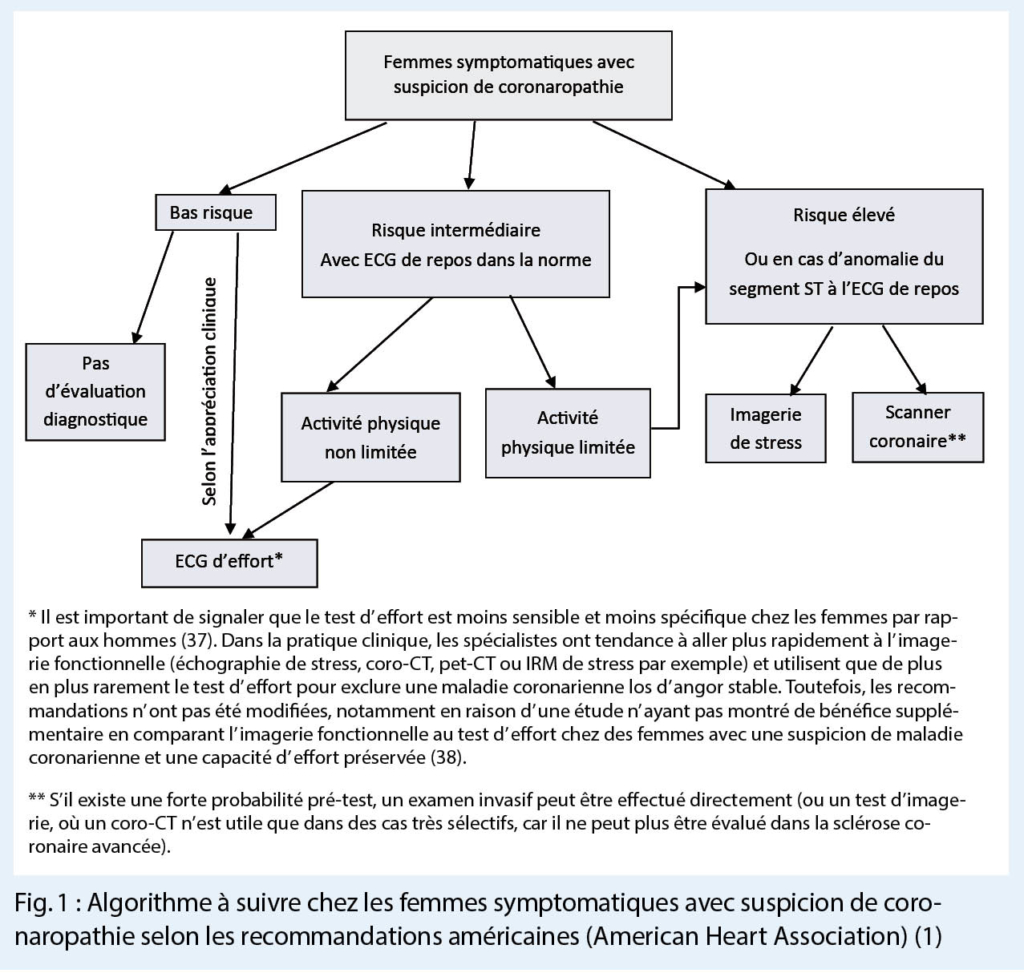
À ce jour, il n’ existe pas de score clinique spécifique pour les femmes, intégrant les signes et les symptômes chez les patientes présentant un diagnostic présumé de maladie coronarienne ischémique. Cependant, les guidelines l’ American Heart Association proposent depuis 2014 un algorithme de diagnostic différent pour les femmes que pour les hommes pour tenir compte de ces spécificités cliniques (1) (Fig. 1).
Les femmes préménopausées sont considérées comme ayant un risque bas (sauf en cas de diabète). Chez elles, aucune évaluation diagnostique n’ est indiquée. En cas de clinique inquiétante, l’ ECG d’ effort reste l’ examen le plus adapté. Les femmes ayants une cinquantaine d’ années sont considérées comme risque bas ou intermédiaire, selon leur limitation fonctionnelle pour les activités de la vie quotidienne. En cas de limitation fonctionnelle, elles doivent être considérées comme à risque intermédiaire. Les femmes ayants la soixantaine sont considérées comme risque intermédiaire. Si elles n’ ont pas de limitation pour une activité physique et elles ont un ECG de repos dans les limites de la norme, un ECG d’ effort est recommandé. En cas de limitation physique, elles doivent être testées comme en cas de risque élevé. Les femmes ayant la septantaine, ou présentant certaines comorbidité (p.ex diabète mal équilibré, artériopathie périphérique etc.) sont considérées comme à risque élevé, ainsi que les patientes avec un ECG de repos anormal (p.ex. élévation du segment ST) et doivent avoir une imagerie fonctionnelle ou un scanner coronarien, dont le choix doit être discuté avec un-e cardiologue (1, 34, 36).
Prise en charge d’ un syndrome coronarien aigu
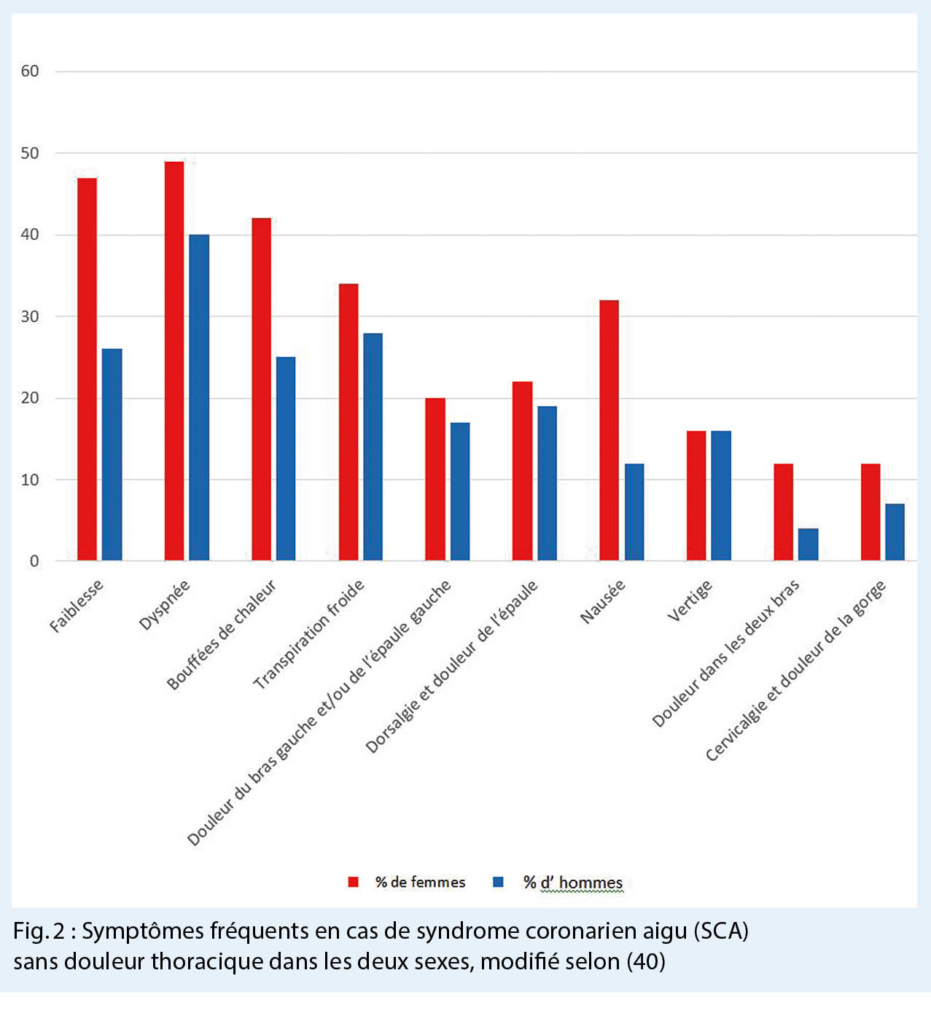
Plusieurs études ont démontré des différences hommes femmes dans les symptômes cliniques lors d’ un syndrome coronarien aigue (SCA). Par exemple, les femmes présentent plus souvent un angor instable et un IM sans élévation du segment ST (NSTEMI) sans douleur thoracique (39). La douleur reste toutefois le symptôme principal lors d’ un SCA, mais les femmes présentent plus souvent que les hommes des douleurs atypiques et des symptômes aspécifiques (40) (Fig. 2). Ce phénomène conduit à une fausse interprétation des plaintes et résulte une présentation plus tardive aux urgences (39).
Les femmes sont moins susceptibles que les hommes de bénéficier d’ investigations complémentaires, invasives ou non, lors d’ un SCA (41, 42). Malgré l’ augmentation de l’ utilisation
d’ interventions cardiaques invasives, les femmes se présentant avec SCA ont encore plus de risque
d’ être traitées de manière conservative, possiblement en raison d’ une sous-estimation du risque (43). Les hommes sont donc plus susceptibles que les femmes de bénéficier une angiographie coronaire et des procédures de revascularisation au cours d’ une hospitalisation pour une maladie coronarienne connue ou soupçonnée (44).
Selon une récente étude effectuée en Suisse, le temps d’ ischémie – calculé comme le temps entre le début des symptômes et la prise en charge en salle de cathétérisme – était supérieur de 41 minutes chez les femmes par rapport aux hommes (45). Ce retard était principalement lié au fait que les femmes attendent plus longtemps avant de demander de l’ aide médicale.
Une cause sous-diagnostiquée du SCA est la dissection spontanée des artères coronaires, qui survient principalement chez les femmes, plus fréquemment entre 45 et 60 ans, de préférence pendant la grossesse ou immédiatement après l’ accouchement et peut être causée par des modifications hormonales (46). Cette pathologie pose des défis diagnostiques et des dilemmes thérapeutiques importants étant donné le manque de recherche pour guider sa prise en charge.
On estime que 8 % des SCA chez les femmes mais moins de 1 % chez les hommes sont associés au syndrome de Takotsubo. Il survient plus souvent chez les femmes âgées et ménopausées, se caractérise par une hypokinésie parfois marquée, principalement de l’ apex du ventricule gauche et est associé à un stress émotionnel ou physique. Les troubles de la cinétique segmentaire apicaux sont généralement transitoires et disparaissent en quelques jours à plusieurs semaines. Son pronostic est généralement bon (47).
Pronostic
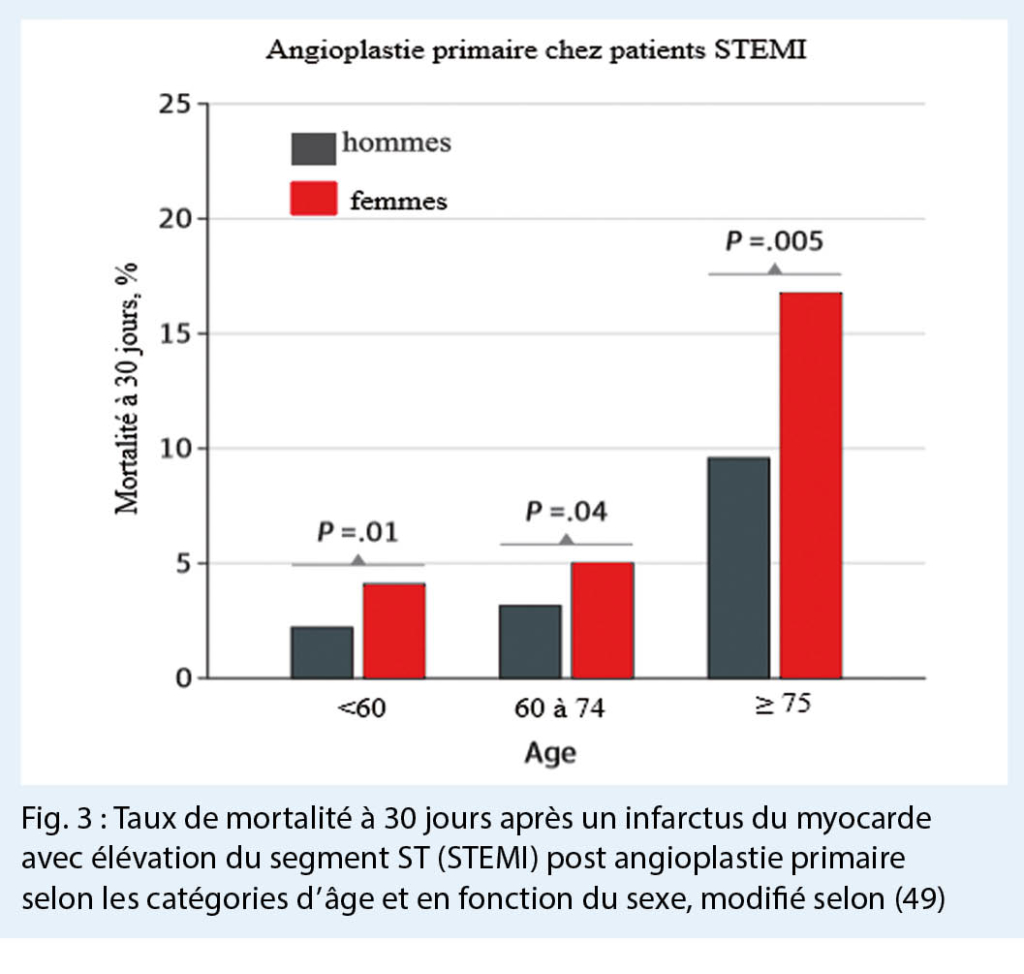
Selon une étude de cohorte rétrospective entre 1992 et 1993, les femmes de moins de 75 ans ont présenté un taux de mortalité deux fois plus élevé que les hommes du même groupe d’ âge après un IM (48). Une étude récente a examiné une population internationale européenne entre 2010 et 2016 (49). Les résultats étaient similaires ; la mortalité était plus élevée à 30 jours après un IM avec élévation du segment ST (STEMI) chez les femmes de moins de 60 ans. La différence n’ était plus significative pour les patientes plus âgées. Lors d’ un STEMI, la mortalité diminuait chez les deux sexes après une angioplastie coronarienne, mais la mortalité restait néanmoins plus élevée chez les femmes, avec 30 % de plus de décès (49) (Fig. 3).
En Suisse, entre 1997 et 2016, le taux de mortalité à l’ hôpital des patientes et des patients atteints d’ IM été réduit de moitié et le gender gap (écart de mortalité hommes-femmes) a également diminué. La réduction de la mortalité était en effet plus prononcée chez les femmes que chez les hommes, en particulier celles âgées de moins de 60 ans. La diminution de la mortalité pourrait en grande partie être expliquée par l’ utilisation accrue du traitement de reperfusion, en particulier des procédures interventionnelles percutanées (PCI), qui ont contribué à atténuer les disparités de genre (50). Cependant, une étude a reporté un taux de complications plus élevé chez les femmes atteintes d’ un SCA qui bénéficiaient une stratégie invasive précoce et une revascularisation coronaire par rapport aux hommes (51).
Les femmes ont une mortalité plus élevée après une chirurgie de pontage coronaire élective, en partie en raison d’ un cumul de comorbidités lié à un âge plus élevé que les hommes (40). De plus, les femmes ont une moins bonne qualité de vie liée à la santé que les hommes, suite à une chirurgie coronaire (40). Ceci est probablement aussi expliqué par le fait qu’ au moment de l’ opération, les femmes sont plus âgées et ont plus de comorbidités. Un autre facteur à prendre en compte est la dépression, dont la prévalence est plus élevée chez les femmes. Une plus grande attention devrait être accordée au diagnostic et au traitement de la dépression chez les patientes subissant un pontage coronaire (52).
Unisanté, Centre Universitaire de médecine générale et santé publique
Rue du Bugnon 44
1011 Lausanne
carole.clair@hospvd.ch
Les auteurs déclarent aucun conflit d’ intérêt en relation avec cet article.
- La plupart des facteurs de risque cardiovasculaires sont associés à des risques relatifs plus élevés d’ IM chez les femmes par rapport aux hommes.
- L’ angor stable et les SCA se manifestent plus fréquemment par des symptômes aspécifiques et des douleurs thoraciques atypiques chez les femmes.
- La lutte pour améliorer la prise en charge et le taux de survie des femmes atteintes de maladie cardiovasculaire doit rester une priorité afin d’ éliminer les disparités de genre en santé.
1. Mieres JH, Gulati M, Bairey Merz N, Berman DS, Gerber TC, Hayes SN, Kramer CM, Min JK, Newby LK, Nixon JV, Srichai MB, Pellikka PA, Redberg RF, Wenger NK, Shaw LJ, American Heart Association Cardiac Imaging Committee of the Council on Clinical C, Cardiovascular I, Intervention Committee of the Council on Cardiovascular R and Intervention. Role of noninvasive testing in the clinical evaluation of women with suspected ischemic heart disease: a consensus statement from the American Heart Association. Circulation. 2014;130:350-79.
2. Wenger NK, Speroff L and Packard B. Cardiovascular health and disease in women. N Engl J Med. 1993;329:247-56.
3. Benjamin EJ, Virani SS, Callaway CW, Chamberlain AM, Chang AR, Cheng S, Chiuve SE, Cushman M, Delling FN, Deo R, de Ferranti SD, Ferguson JF, Fornage M, Gillespie C, Isasi CR, Jimenez MC, Jordan LC, Judd SE, Lackland D, Lichtman JH, Lisabeth L, Liu S, Longenecker CT, Lutsey PL, Mackey JS, Matchar DB, Matsushita K, Mussolino ME, Nasir K, O’ Flaherty M, Palaniappan LP, Pandey A, Pandey DK, Reeves MJ, Ritchey MD, Rodriguez CJ, Roth GA, Rosamond WD, Sampson UKA, Satou GM, Shah SH, Spartano NL, Tirschwell DL, Tsao CW, Voeks JH, Willey JZ, Wilkins JT, Wu JH, Alger HM, Wong SS, Muntner P, American Heart Association Council on E, Prevention Statistics C and Stroke Statistics S. Heart Disease and Stroke Statistics-2018 Update: A Report From the American Heart Association. Circulation. 2018;137:e67-e492.
4. Group EUCCS, Regitz-Zagrosek V, Oertelt-Prigione S, Prescott E, Franconi F, Gerdts E, Foryst-Ludwig A, Maas AH, Kautzky-Willer A, Knappe-Wegner D, Kintscher U, Ladwig KH, Schenck-Gustafsson K and Stangl V. Gender in cardiovascular diseases: impact on clinical manifestations, management, and outcomes. Eur Heart J. 2016;37:24-34.
5. Bosner S, Haasenritter J, Hani MA, Keller H, Sonnichsen AC, Karatolios K, Schaefer JR, Baum E and Donner-Banzhoff N. Gender bias revisited: new insights on the differential management of chest pain. BMC Fam Pract. 2011;12:45.
6. Bosner S, Haasenritter J, Hani MA, Keller H, Sonnichsen AC, Karatolios K, Schaefer JR, Baum E and Donner-Banzhoff N. Gender differences in presentation and diagnosis of chest pain in primary care. BMC Fam Pract. 2009;10:79.
7. Iorga A, Cunningham CM, Moazeni S, Ruffenach G, Umar S and Eghbali M. The protective role of estrogen and estrogen receptors in cardiovascular disease and the controversial use of estrogen therapy. Biol Sex Differ. 2017;8:33.
8. Wilson PW, D’ Agostino RB, Sullivan L, Parise H and Kannel WB. Overweight and obesity as determinants of cardiovascular risk: the Framingham experience. Arch Intern Med. 2002;162:1867-72.
9. Guetta V and Cannon RO, 3rd. Cardiovascular effects of estrogen and lipid-lowering therapies in postmenopausal women. Circulation. 1996;93:1928-37.
10. Mauvais-Jarvis F, Clegg DJ and Hevener AL. The role of estrogens in control of energy balance and glucose homeostasis. Endocr Rev. 2013;34:309-38.
11. Lizcano F and Guzman G. Estrogen Deficiency and the Origin of Obesity during Menopause. BioMed research international. 2014;2014:757461.
12. Stice JP, Lee JS, Pechenino AS and Knowlton AA. Estrogen, aging and the cardiovascular system. Future Cardiol. 2009;5:93-103.
13. Rosano GM, Chierchia SL, Leonardo F, Beale CM and Collins P. Cardioprotective effects of ovarian hormones. Eur Heart J. 1996;17 Suppl D:15-9.
14. Koller A. Perspectives: Microvascular endothelial dysfunction and gender. Eur Heart J Suppl. 2014;16:A16-A19.
15. Dessapt AL and Gourdy P. Ménopause et risque cardiovasculaire. Journal de Gynécologie Obstétrique et Biologie de la Reproduction. 2012;41:7S.
16. Gabet A, Danchin N, Juilliere Y and Olie V. Acute coronary syndrome in women: rising hospitalizations in middle-aged French women, 2004-14. Eur Heart J. 2017;38:1060-1065.
17. Arora S, Stouffer GA, Kucharska-Newton AM, Qamar A, Vaduganathan M, Pandey A, Porterfield D, Blankstein R, Rosamond WD, Bhatt DL and Caughey MC. Twenty Year Trends and Sex Differences in Young Adults Hospitalized With Acute Myocardial Infarction. Circulation. 2019;139:1047-1056.
18. Millett ERC, Peters SAE and Woodward M. Sex differences in risk factors for myocardial infarction: cohort study of UK Biobank participants. BMJ. 2018;363:k4247.
19. Peters SAE, Bots SH and Woodward M. Sex Differences in the Association Between Measures of General and Central Adiposity and the Risk of Myocardial Infarction: Results From the UK Biobank. Journal of the American Heart Association. 2018;7.
20. Juutilainen A, Kortelainen S, Lehto S, Ronnemaa T, Pyorala K and Laakso M. Gender difference in the impact of type 2 diabetes on coronary heart disease risk. Diabetes Care. 2004;27:2898-904.
21. Gmel G, Kuendig H, Notari L and Gmel C. Monitorage suisse des addictions : consommation d’ alcool, tabac et drogues illégales en Suisse en 2016. . 2017.
22. Huxley RR and Woodward M. Cigarette smoking as a risk factor for coronary heart disease in women compared with men: a systematic review and meta-analysis of prospective cohort studies. Lancet. 2011;378:1297-305.
23. Surpoids et obésité en 2017.
24. Pilote L, Dasgupta K, Guru V, Humphries KH, McGrath J, Norris C, Rabi D, Tremblay J, Alamian A, Barnett T, Cox J, Ghali WA, Grace S, Hamet P, Ho T, Kirkland S, Lambert M, Libersan D, O’ Loughlin J, Paradis G, Petrovich M and Tagalakis V. A comprehensive view of sex-specific issues related to cardiovascular disease. CMAJ. 2007;176:S1-44.
25. Hokanson JE and Austin MA. Plasma triglyceride level is a risk factor for cardiovascular disease independent of high-density lipoprotein cholesterol level: a meta-analysis of population-based prospective studies. J Cardiovasc Risk. 1996;3:213-9.
26. Kramer CK, Campbell S and Retnakaran R. Gestational diabetes and the risk of cardiovascular disease in women: a systematic review and meta-analysis. Diabetologia. 2019;62:905-914.
27. Martillotti G, Boulvain M, Landau R and Pechere-Bertschi A. [Is preeclampsia a new cardiovascular and end-stage renal diseases risk marker?]. Revue medicale suisse. 2009;5:1752-4, 1756-7.
28. Archer DF. Premature menopause increases cardiovascular risk. Climacteric. 2009;12 Suppl 1:26-31.
29. Colditz GA, Willett WC, Stampfer MJ, Rosner B, Speizer FE and Hennekens CH. Menopause and the risk of coronary heart disease in women. N Engl J Med. 1987;316:1105-10.
30. Scicchitano P, Dentamaro I, Carbonara R, Bulzis G, Dachille A, Caputo P, Riccardi R, Locorotondo M, Mandurino C and Matteo Ciccone M. Cardiovascular Risk in Women With PCOS. International journal of endocrinology and metabolism. 2012;10:611-8.
31. Gernaat SAM, Boer JMA, van den Bongard DHJ, Maas A, van der Pol CC, Bijlsma RM, Grobbee DE, Verkooijen HM and Peeters PH. The risk of cardiovascular disease following breast cancer by Framingham risk score. Breast Cancer Res Treat. 2018;170:119-127.
32. Zegkos T, Kitas G and Dimitroulas T. Cardiovascular risk in rheumatoid arthritis: assessment, management and next steps. Ther Adv Musculoskelet Dis. 2016;8:86-101.
33. McMahon M, Hahn BH and Skaggs BJ. Systemic lupus erythematosus and cardiovascular disease: prediction and potential for therapeutic intervention. Expert Rev Clin Immunol. 2011;7:227-41.
34. Johnston N, Schenck-Gustafsson K and Lagerqvist B. Are we using cardiovascular medications and coronary angiography appropriately in men and women with chest pain? Eur Heart J. 2011;32:1331-6.
35. Clerc Liaudat C, Vaucher P, De Francesco T, Jaunin-Stalder N, Herzig L, Verdon F, Favrat B, Locatelli I and Clair C. Sex/gender bias in the management of chest pain in ambulatory care. Womens Health (Lond). 2018;14:1745506518805641.
36. Task Force M, Montalescot G, Sechtem U, Achenbach S, Andreotti F, Arden C, Budaj A, Bugiardini R, Crea F, Cuisset T, Di Mario C, Ferreira JR, Gersh BJ, Gitt AK, Hulot JS, Marx N, Opie LH, Pfisterer M, Prescott E, Ruschitzka F, Sabate M, Senior R, Taggart DP, van der Wall EE, Vrints CJ, Guidelines ESCCfP, Zamorano JL, Achenbach S, Baumgartner H, Bax JJ, Bueno H, Dean V, Deaton C, Erol C, Fagard R, Ferrari R, Hasdai D, Hoes AW, Kirchhof P, Knuuti J, Kolh P, Lancellotti P, Linhart A, Nihoyannopoulos P, Piepoli MF, Ponikowski P, Sirnes PA, Tamargo JL, Tendera M, Torbicki A, Wijns W, Windecker S, Document R, Knuuti J, Valgimigli M, Bueno H, Claeys MJ, Donner-Banzhoff N, Erol C, Frank H, Funck-Brentano C, Gaemperli O, Gonzalez-Juanatey JR, Hamilos M, Hasdai D, Husted S, James SK, Kervinen K, Kolh P, Kristensen SD, Lancellotti P, Maggioni AP, Piepoli MF, Pries AR, Romeo F, Ryden L, Simoons ML, Sirnes PA, Steg PG, Timmis A, Wijns W, Windecker S, Yildirir A and Zamorano JL. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 2013;34:2949-3003.
37. Morise AP and Diamond GA. Comparison of the sensitivity and specificity of exercise electrocardiography in biased and unbiased populations of men and women. Am Heart J. 1995;130:741-7.
38. Shaw LJ, Mieres JH, Hendel RH, Boden WE, Gulati M, Veledar E, Hachamovitch R, Arrighi JA, Merz CN, Gibbons RJ, Wenger NK, Heller GV and Investigators WT. Comparative effectiveness of exercise electrocardiography with or without myocardial perfusion single photon emission computed tomography in women with suspected coronary artery disease: results from the What Is the Optimal Method for Ischemia Evaluation in Women (WOMEN) trial. Circulation. 2011;124:1239-49.
39. Crea F, Battipaglia I and Andreotti F. Sex differences in mechanisms, presentation and management of ischaemic heart disease. Atherosclerosis. 2015;241:157-68.
40. Khan NA, Daskalopoulou SS, Karp I, Eisenberg MJ, Pelletier R, Tsadok MA, Dasgupta K, Norris CM, Pilote L and Team GP. Sex differences in acute coronary syndrome symptom presentation in young patients. JAMA Intern Med. 2013;173:1863-71.
41. Chang AM, Mumma B, Sease KL, Robey JL, Shofer FS and Hollander JE. Gender bias in cardiovascular testing persists after adjustment for presenting characteristics and cardiac risk. Acad Emerg Med. 2007;14:599-605.
42. Daly C, Clemens F, Lopez Sendon JL, Tavazzi L, Boersma E, Danchin N, Delahaye F, Gitt A, Julian D, Mulcahy D, Ruzyllo W, Thygesen K, Verheugt F, Fox KM and Euro Heart Survey I. Gender differences in the management and clinical outcome of stable angina. Circulation. 2006;113:490-8.
43. Poon S, Goodman SG, Yan RT, Bugiardini R, Bierman AS, Eagle KA, Johnston N, Huynh T, Grondin FR, Schenck-Gustafsson K and Yan AT. Bridging the gender gap: Insights from a contemporary analysis of sex-related differences in the treatment and outcomes of patients with acute coronary syndromes. Am Heart J. 2012;163:66-73.
44. Ayanian JZ and Epstein AM. Differences in the use of procedures between women and men hospitalized for coronary heart disease. N Engl J Med. 1991;325:221-5.
45. Meyer MR, Bernheim AM, Kurz DJ, O’ Sullivan CJ, Tuller D, Zbinden R, Rosemann T and Eberli FR. Gender differences in patient and system delay for primary percutaneous coronary intervention: current trends in a Swiss ST-segment elevation myocardial infarction population. Eur Heart J Acute Cardiovasc Care. 2019;8:283-290.
46. European Society of G, Association for European Paediatric C, German Society for Gender M, Regitz-Zagrosek V, Blomstrom Lundqvist C, Borghi C, Cifkova R, Ferreira R, Foidart JM, Gibbs JS, Gohlke-Baerwolf C, Gorenek B, Iung B, Kirby M, Maas AH, Morais J, Nihoyannopoulos P, Pieper PG, Presbitero P, Roos-Hesselink JW, Schaufelberger M, Seeland U, Torracca L and Guidelines ESCCfP. ESC Guidelines on the management of cardiovascular diseases during pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J. 2011;32:3147-97.
47. Komamura K, Fukui M, Iwasaku T, Hirotani S and Masuyama T. Takotsubo cardiomyopathy: Pathophysiology, diagnosis and treatment. World J Cardiol. 2014;6:602-9.
48. Vaccarino V, Horwitz RI, Meehan TP, Petrillo MK, Radford MJ and Krumholz HM. Sex differences in mortality after myocardial infarction: evidence for a sex-age interaction. Arch Intern Med. 1998;158:2054-62.
49. Cenko E, Yoon J, Kedev S, Stankovic G, Vasiljevic Z, Krljanac G, Kalpak O, Ricci B, Milicic D, Manfrini O, van der Schaar M, Badimon L and Bugiardini R. Sex Differences in Outcomes After STEMI: Effect Modification by Treatment Strategy and Age. JAMA Intern Med. 2018;178:632-639.
50. Radovanovic D, Seifert B, Roffi M, Urban P, Rickli H, Pedrazzini G and Erne P. Gender differences in the decrease of in-hospital mortality in patients with acute myocardial infarction during the last 20 years in Switzerland. Open Heart. 2017;4:e000689.
51. Udell JA, Koh M, Qiu F, Austin PC, Wijeysundera HC, Bagai A, Yan AT, Goodman SG, Tu JV and Ko DT. Outcomes of Women and Men With Acute Coronary Syndrome Treated With and Without Percutaneous Coronary Revascularization. Journal of the American Heart Association. 2017;6.
52. Kendel F, Dunkel A, Muller-Tasch T, Steinberg K, Lehmkuhl E, Hetzer R and Regitz-Zagrosek V. Gender differences in health-related quality of life after coronary bypass surgery: results from a 1-year follow-up in propensity-matched men and women. Psychosom Med. 2011;73:280-5.
la gazette médicale
- Vol. 8
- Ausgabe 4
- Juli 2019