- Ambulant erworbene Pneumonie des Erwachsenen
Unter einer ambulant erworbenen Pneumonie werden Pneumonien verstanden, welche ausserhalb des Spitals bei einem nicht immunkompromittierten Patienten auftreten. Die Letalität dieser im Verlauf hospitalisierten Patienten ist mit bis zu ca. 10% nicht zu unterschätzen. Bei vielen erkrankten Senioren kommt eine Polymorbidität komplizierend dazu. Sofern und solange ein kuratives Therapieziel besteht, entscheiden Schweregrad und erwartetes Keimspektrum, sowie ob Polymorbidität vorliegt oder nicht, über die Therapie.
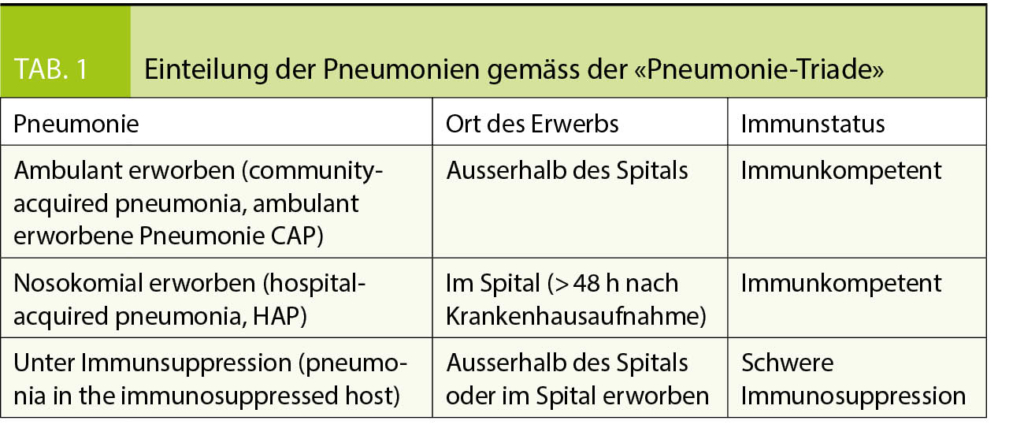
Pneumonien werden in der sogenannten «Pneumonie-Triade» eingeteilt (Tab. 1). Die ambulant erworbene Pneumonie ist definiert als eine Pneumonie, die durch den Ort des Auftretens (ausserhalb des Spitals) sowie die Immunität des Patienten (Immunkompetenz) bestimmt wird.
Die ambulant erworbene Pneumonie (community-acquired pneumonia CAP) steht dabei im Gegensatz zur nosokomialen Pneumonie (HAP), die definiert ist als eine Pneumonie, die > 48h nach Spitaleintritt bzw. bei Patienten mit einer vorbestehenden Hospitalisation bis vor 3 Monaten auftritt. Bei Pneumonie unter schwergradiger Immunsuppression sind opportunistische Keime zu erwarten.
Polymorbide Patienten sind Patienten mit chronischen Lungenerkrankungen wie COPD, Zystische Fibrose und interstitiellen Lungenerkrankungen. Hepatopathie, Diabetes mellitus und Tumor-
erkrankungen ohne Neutropenie (1).
Die Inzidenz der CAP steigt mit dem Lebensalter. Die Pneumonie des älteren Menschen (≥ 65 Jahre) ist mit einer erhöhten Letalität assoziiert. Pneumonien, die im Seniorenheim erworben werden, stellen die grösste Subgruppe der ambulant erworbenen Pneumonie dar. Die höchste Letalität haben Patienten mit vorbestehender längerer Bettlägerigkeit.
Die CAP des jüngeren Menschen < 65 Jahre, ohne Grunderkrankung verläuft meist milder, die Prognose ist deutlich besser. Darüber hinaus besteht ein anderes Erreger-Muster.
Einteilung der ambulant erworbenen Pneumonien
Die Einteilung der CAP erfolgt in die Gruppen 1a, 1b und 2. Die Gruppen definieren sowohl Kriterien für die Hospitalisation als auch den Umfang der mikrobiologischen Diagnostik und Therapiestrategien einschliesslich der initialen antimikrobiellen Therapie. Die Gruppen 1a, 1b und 2 werden unterschieden durch die Kriterien des Allgemeinzustands und des Schweregrads der ambulant erworbenen Pneumonie. Zugehörigkeit zur Gruppe 1a ergibt sich durch einen guten AZ, definiert als Bettlägerigkeit < 50%, Gruppe 1b durch schlechten AZ, definiert als Bettlägerigkeit > 50% des Tages. In der Gruppe 2 besteht eine schwere Komorbidität mit infauster Prognose, somit Palliation als Therapieziel.
Sonderformen der ambulant erworbenen Pneumonie sind die ambulant erworbene Aspirations-Pneumonie, sowie Pneumonien im Zusammenhang mit Auslandreisen oder im Rahmen von Epidemien (z. B. Influenza-Pneumonien) oder Ausbrüchen (z. B. Legionellen). Die Aspirationspneumonie geht mit einem veränderten Erregerspektrum einher. Aspirationspneumonien erfordern eine Abklärung der zugrundeliegenden Ursachen. Bei Pneumonien nach Tropenreisen müssen seltene Ursachen gesucht und ausgeschlossen werden. In Zeiten einer Grippepidemie ist an eine Grippepneumonie zu denken.
Diagnostik bei vermuteter Pneumonie
Zu den klinischen Symptomen einer Pneumonie gehören:
1. Atemwegssymptome wie Husten mit oder ohne Auswurf, Dyspnoe, ev. atemabhängige thorakale Schmerzen.
2. Allgemeinsymptome wie Fieber oder Hypothermie, allgemeines Krankheitsgefühl («malaise») «grippale» Symptome wie Myalgien, Arthralgien, Cephalgien, Palpitationen, Kreislaufbeschwerden, Diarrhoe.
3. Neurologische Symptome wie «Desorientiertheit (confusion)» insbesondere bei älteren Patienten.
Die klinische Abklärung umfasst die Evaluation des Allgemeinzustands inklusive des Ausmasses der vorbestehenden Bettlägerigkeit, welche die Prognose verschlechtert sowie eine Evaluation potentiell instabiler Komorbiditäten (Prognose schlechter). Sodann wird im Einzelnen auf folgende Befunde geachtet: erhöhte Atemfrequenz, Tachykardie, ev. arterielle Hypotonie, ev. abgeschwächte Perkussion über dem Thorax bei Infiltrationen und/oder einem parapneumonischen Pleuraerguss, auskultatorisch inspiratorische Rasselgeräusche bzw. Bronchialatmen. Die beschriebenen Symptome sind nicht spezifisch für die Abgrenzung einer CAP von anderen unteren Atemwegsinfektionen. Die klinische Untersuchung hat jedoch einen hohen negativen prädiktiven Wert (4). Mit steigendem Lebensalter präsentieren sich Patienten mit Pneumonie zunehmend oligosymptomatisch (5). So ist das Vorliegen von Fieber oder Husten mit Auswurf deutlich seltener. Häufiger treten Symptome wie Verwirrtheit und Durchfall auf, ggf. sogar als einzige Symptome.
An Zusatzuntersuchungen sollte eine Röntgen Thoraxaufnahme angefertigt werden. Eine Thorax Sonographie kann für die Detektion pulmonaler Infiltrate zum Einsatz kommen, wenn zeitnah keine Radiologie verfügbar ist. Der radiologische Befund dient zur Erfassung von der Ausdehnung des Befundes (mono-multilobär, uni-bilateral), von Begleiterkrankungen (z. B. Herzinsuffizienz) und von Komplikationen (Pleuraerguss, Abszedierung). Zudem liefert er eine Hilfestellung bei differentialdiagnostischen Überlegungen (Lungentuberkulose, Bronchus-Carcinom) und einen Ausgangsbefund, falls eine Kontrolle im Verlauf der Erkrankung indiziert ist. Sensitivität und Spezifität sowie Zuverlässigkeit des Infiltratnachweises in der Röntgen Thoraxaufnahme sind allerdings begrenzt.
Zuweilen bilden sich erst im Verlauf der Erkrankung Infiltrate. In einer Studie wiesen 21% der Patienten mit einer im Verlauf gesicherten Diagnose einer Pneumonie im initialen Röntgen Thoraxbild kein Infiltrat auf (6). Zudem besteht bei leicht- bis mittelgradigen Pneumonien eine erhebliche Abhängigkeit vom entsprechenden Untersucher hinsichtlich der Beurteilung von Infiltraten. Bei stationären Patienten mit einer im Verlauf bestätigten Pneumonie, die initial kein radiologisches Korrelat hatten, ist die Letalität erhöht.
Entzündungs-Parameter können in dieser Situation weiterhelfen. CRP als Einzelparameter ist relativ unspezifisch und kann verzögert ansteigen. Deshalb kann eine zusätzliche Bestimmung von Procalcitonin (PCT), welches im Verlauf früher ansteigt, sinnvoll sein.
Messung der peripheren O2 Sättigung, ev. arterielle Blutgasanalyse (Hypoxämie mit schlechterer Prognose).
Mikrobiologische Untersuchung beim Pneumonie Patienten?
Bei Patienten mit leichtgradigen, ambulant behandelbaren Pneumonien ist eine mikrobiologische Diagnostik im Normalfall nicht erforderlich.
Bei allen wegen einer mittelschweren bis schweren Pneumonie hospitalisierten Patienten der Gruppen 1a und 1b soll eine Erregerdiagnostik erfolgen. Diese soll umfassen:
1. Mindestens zwei Blutkulturen, je aerob und anaerob
2. Urin-Antigentest auf Legionellen
3. Urin-Antigentest auf Pneumokokken zur Detektion einer Pneumonie durch Pneumokokken
4. Adäquates Sputum, das innerhalb von 2-4 Stunden für eine Gram-Färbung und Kultur verarbeitet werden soll. Ist dies nicht möglich, soll eine Sputum Untersuchung unterlassen werden
5. Molekulare Diagnostik zum gleichzeitigen Nachweis von mehreren bakteriellen (z. B. S. pneumoniae, M. pneumoniae, C. pneumoniae, L. pneumophila) oder viralen Erregern (z. B. Influenza A/B, Parainfluenza, Rhinovirus, Adenovirus) d. h. sogenannte Multiplextests sollen nicht routinemässig eingesetzt werden
6. Bei Vorliegen entsprechender epidemiologischer Hinweise (Saison, Epidemie und Pandemie) sollte ein Nasenabstrich (nuclear acid amplification) auf Influenza A/B durchgeführt werden.
Blutkulturen sind insgesamt nur bei etwa 10% aller mit ambulant erworbener Pneumonie hospitalisierten Patienten positiv; im Falle von Pneumonien mit S. pneumoniae ist mit Raten bis zu 38% zu rechnen. Weiterhin können bakteriämische Pneumonien mit einer schlechteren Prognose verbunden sein, so dass eine positive Blutkultur Anlass für eine intensivierte Überwachung sein kann. Auch bei älteren Patienten und bei einer Pneumonie durch Enterobakterien ist die Blutkultur häufiger positiv. Ausserdem stellt der Erregernachweis in der Blutkultur den sichersten ätiologischen Beweis dar.
Der Urin-Antigentest auf Legionellen detektiert mit einer Sensitivität von etwa 75% und einer Spezifität von 99-100% eine Legionellen-Infektion durch Legionella pneumophila der häufigen Serogruppen. Wenn aufgrund der epidemiologischen Situation auch mit anderen Spezies bzw. Serogruppen gerechnet wird, sollte zusätzlich ein Nukleinsäureamplifikationstest aus respiratorischen Materialien durchgeführt werden sowie ein kultureller Nachweis erfolgen.
Der Urin-Antigentest auf Pneumokokken detektiert eine Infektion mit diesen Mikroorganismen mit einer Sensitivität von 67-82% und einer Spezifität von etwa 97%, wobei allerdings Risikofaktoren für ein falsch positives Ergebnis (vor allem COPD) zu beachten sind. Der Test kann damit Grundlage für eine Fokussierung der Therapie sein.
Obgleich die Wertigkeit der mikroskopischen und kulturellen Untersuchung von Sputum häufiger kritisch beurteilt wurde, zeigen andere Studien, dass bei Einhaltung aller Qualitätskriterien (Vorwiegen von Granulozyten, wenig bis keine Plattenepithelien) die Ergebnisse der Untersuchung für die gezielte Therapie leitend sein können, wobei insbesondere Streptococcus pneumoniae, Haemophilus influenzae und Staphylococcus aureus gut erkannt werden.
Differentialdiagnose der Pneumonie
Bei allen Patienten mit ambulant erworbener Pneumonie sollen Differentialdiagnosen bzw. zusätzliche Diagnosen erwogen werden, insbesondere Konditionen mit Überwässerung (Nierenerkrankungen), Aspirationen und nicht-infektiösen Infiltraten (Lungenembolie, interstitielle Lungenerkrankung, Lungenkarzinom) sowie COPD und Lungenemphysem
Die unspezifische klinische Präsentation, nicht selten auch die Oligosymptomatik machen es erforderlich, eine differentialdiagnostische Abgrenzung zu anderen Erkrankungen mit überlappender Symptomatik zu treffen.
Schweregrad einer ambulant erworbenen Pneumonie
Als einfacher Score mit guter Prädiktion des Letalitätsrisikos hat sich der CRB-65-Index (Tab. 2) etabliert. Er wird über die unkomplizierte Bestimmung von drei klinischen und einem anamnestischen Parameter gebildet und ist auch ambulant gut anwendbar. Der Score wird berechnet durch die Addition eines Punktes für das Vorliegen jeweils eines der in der Tabelle 2 aufgelisteten Kriterien. Der CRB-65-Index wurde in zahlreichen Studien und mehreren aktuellen Metaanalysen validiert und zeigt eine gute Abschätzung der zu erwartenden Letalität.
Therapie der ambulant erworbenen Pneumonie
Initiale antimikrobielle Therapie
Patienten unter 65 Jahren mit leichter Pneumonie ohne Comorbidität sollen als initiale Therapie der Wahl eine Monotherapie mit einem Makrolid erhalten.
Patienten mit leichter Pneumonie und definierten Comorbiditäten sollen eine initiale Therapie mit einem Aminopenicillin/Betalaktamaseinhibitor-Präparat erhalten. Alternativ kann bei Penicillinallergie oder -Unverträglichkeit ein Fluorochinolon (Moxifloxacin, Levofloxacin) eingesetzt werden. Bei schwerer COPD und/oder Bronchiektasien kann eine Therapie mit Amoxicillin/Ciprofloxacin oder Levofloxacin gegeben werden.
Patienten mit mittelschwerer Pneumonie sollen als initiale antimikrobielle Therapie eine Aminopenicillin oder ein Cephalosporin der Klasse 2 oder 3a, und ein Makrolid erhalten. Werden bei klinischer Stabilisierung keine atypischen bakteriellen Erreger nachgewiesen, soll die begonnene Makrolidtherapie nach 3 Tagen beendet werden. Alternativ kann bei Patienten mit moderater ambulant erworbener Pneumonie eine Therapie mit einem Fluorochinolon (Moxifloxacin, Levofloxacin) erfolgen.
Bei hospitalisierten Patienten mit mittelschwerer Pneumonie sollte in den ersten Tagen die Verabreichung der antimikrobiellen Therapie parenteral erfolgen.
Patienten mit schwerer Pneumonie sollen initial eine intravenöse Kombinationstherapie aus einem ß-Laktam mit breitem Spektrum (Piperacillin/Tazobactam, Cefotaxim oder Ceftriaxon) und einem Makrolid erhalten. Bei klinischer Stabilisierung und fehlendem Nachweis eines atypischen bakteriellen Erregers soll die Makrolidtherapie nach 3 Tagen beendet werden. Die Monotherapie mit einem Fluorochinolon (Moxifloxacin, Levofloxacin) ist eine mögliche Alternative, dies gilt jedoch nur für Patienten ohne septischen Schock.
In der Situation einer Influenza-Pandemie oder einer hohen Aktivität einer saisonalen Influenza kann die frühzeitige Gabe von Oseltamivir (Neuraminidase-Hemmer) insbesondere bei hospitalisierten Patienten mit mittelschwerer bzw. schwerer Pneumonie zusätzlich zur antibakteriellen Therapie erfolgen. Bleibt der Influenza-PCR-Nachweis negativ, soll Oseltamivir beendet werden.
Biomarker gesteuerte Therapie
Die Steuerung der Therapiedauer mittels Biomarker (PCT) wurde in mehreren Studien untersucht, meist zusammen mit der Bestimmung der Indikation zur antimikrobiellen Therapie über Biomarker. Voraussetzung für eine solche Strategie ist, dass PCT im Verlauf in einem Protokoll sequentiell bestimmt wird und eindeutige Stopp-Empfehlungen entlang bestimmter Schwellenwerte definiert sind. In allen Studien stand dem Kliniker zudem ein «overruling» offen, d.h. das Übergehen der Stopp-Empfehlungen entsprechend seinem klinischen Urteil.
Alle Studien konnten zeigen, dass eine PCT-gesteuerte antimikrobielle Therapie eine Verkürzung der Therapiedauer erzielen konnte (12), und zwar sowohl bei hospitalisierten Patienten als auch bei Patienten auf Intensivstation, ohne und mit schwerer Sepsis. Ein Unterschied hinsichtlich Therapieversagen bzw. in der Letalität bestand dabei nicht. Dieses Ergebnis wurde in einer Metaanalyse bestätigt, speziell auch bei Patienten mit ambulant erworbener Pneumonie (13, 14).
Verlaufsuntersuchungen
Labor
Die Bestimmung eines Entzündungsparameters (CRP oder PCT) soll im Serum bei Aufnahme und im Verlauf nach 3-4 Tagen durchgeführt werden. Bei Therapieansprechen fallen die Entzündungswerte im Verlauf ab (7). Bei fehlendem Abfall des CRP (< 25-50% des Ausgangswertes) oder des PCT sollte ein Therapieversagen in Betracht gezogen werden (8). Entzündungsparameter sind jedoch immer unter Berücksichtigung des klinischen Bildes und Zustandes des Patienten zu interpretieren. Bei Zeichen einer Organdysfunktion sollte eine Überprüfung der Organfunktion im Verlauf durchgeführt werden, meist durch Kontrolle der Laborchemie
(z.B. Retentionsparameter, Transaminasen bzw. Cholostaseparameter, Laktat, BNP, Troponin, Elektrolyte).
Sonographie der Pleura
Bei hospitalisierten Patienten mit ambulant erworbener Pneumonie mit einem Pleuraerguss sollte eine sonographische Verlaufskontrolle erfolgen, um die Entwicklung eines komplizierten Ergusses bzw. eines Pleuraempyems zu erkennen. Besteht ein solcher Verdacht, sollte eine diagnostische Pleuraerguss-Punktion erfolgen.
Radiologischer Verlauf
Eine Röntgen Thoraxaufnahme zur Kontrolle ist bei adäquatem klinischem Ansprechen auf die Therapie nicht routinemässig indiziert. Bei Vorliegen von Risikofaktoren für eine Tumorerkrankung, aktiven und ehemaligen Rauchern, älteren Patienten (> 65 Jahre) bzw. Patienten mit schweren Begleiterkrankungen sollte eine Computer-Tomographie zum Ausschluss eines Tumors bzw. von nicht-infektiösen Lungeninfiltraten durchgeführt werden. Insbesondere bei älteren Patienten mit Raucher-Anamnese besteht ein erhöhtes Risiko für ein Lungenkarzinom, welches entweder eine Pneumonie imitieren oder aber eine poststenotische Pneumonie verursachen kann. Bei Patienten ≥ 65 Jahre findet sich im Verlauf von im Mittel weniger als einem Jahr eine Inzidenz von 9,2% eines neu diagnostizierten pulmonalen Malignoms, davon nur 27% innerhalb von 90 Tagen nach Entlassung (9). Die Normalisierung des Röntgen-Thoraxbildes kann Wochen bis Monate dauern. Daher sollte ein Kontroll-Röntgen-Thorax bei klinischem Ansprechen im Verlauf frühestens 2 Wochen nach Ende der Antibiotika-Therapie durchgeführt werden.
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
Der Autor hat in Zusammenhang mit dem Artikel keine Interessenskonflikte deklariert
- Die ambulant erworbene Pneumonie hat, v.a. bei Senioren über
65 Jahren und mit Polymorbidität, eine beträchtliche Letalität - Die Untersuchungen und die Therapie leiten sich nach Alter, AZ,
klinischen Parametern, Co-Morbidität und dem erwarteten Erreger-Spektrum - Der CRB-65-Index erlaubt eine Risiko-Abschätzung und hilft in der Entscheidung, ob ambulante oder stationäre Therapie
- Wichtig ist das Abklären der Differentialdiagnosen und ein frühzeitiges Erkennen von möglichen Pneumonie-Komplikationen
1. Di Yacovo S, Garcia-Vidal C, Viasus D et al. Clinical features, etiology and outcomes of community acquired pneumonia in patients with diabetes mellitus.
2. Bauer TT, Ewing S, Marre R et al. CRB-65 predicts death from community acquired pneumonia. J Internal Med. 2006; 260:93-101
3. Ewing S.Beuer T, Richter K et al. Prediction of in-hospital death from community-acquired pneumonia by varying CRB-age groups
4. Liebemann D, Shwartzman P, Korsonsky et al. Diagnosis of ambulatory acquired pneumonia. Comparison of clinical assessment versus chest X-ray. Scand J Prim Health care.2003; 21: 57-60
5. Metlay JP, Schulz R, Li YH et al. Influence of age on symptoms of presentation in patients with community acquired pneumonia. Arch Intern Med. 1997; 157 : 1453-59
6. Hagaman JT, Rouan GW, Shipley RT et al. Admission chest radiograph laks sensitivity in the diagnosis of community-acquired pneumonia. Am J Med Sci. 2009; 337: 236-40
7. Ruiz-Gonzales A, Falguera, Porcel JM et al. C-reactive protein for discriminating treatment failure from slow responding pneumonia. Eur J Internal Med. 2010; 21: 548-552
8. Coelho L, Povoa P, Almeida E et al. Usefulness of c-reactive protein in monitoring the severe community pneumonia clinical course. Crit Care. 2007; 11: R92
9. Mortensen EM, Copeland LA, Pugh MJ et al. Diagnosis of pulmonary malignancy after hospitalization for pneumonia. Am J Med.2010; 123: 66-71
10. Pletz NW, Mc Gee L, Burkhart O et al. Ciprofloxacin treatment failure in a patient with resistant Streptococcus pneumoniae infection following prior ciprofloxacin therapy. Eur J Clin Mikrobiol. Infect. Dis. 2005; 24: 58-60
11. Welte T, Torres A, Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2012; 67: 71-79
12. Long W, Deng X, Zhang Y et al. Procalcitonin guidance for reduction of antibiotic use in low risk outpatients with community acquired pneumonia. Respirology. 2011; 16: 819-824
13. Schnetz P, Müller B, Christ-Crain M et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev. 2012; 9: CD 007498
14. Schuetz P, Wirz Y, Sager R, Christ-Caine M, Stolz D, Tamm M et al, Effects of procalcitonin-guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta-analysis, Lancet V18, 2018, 95-107
Weiterführende Literatur beim Verfasser erhältlich
der informierte @rzt
- Vol. 9
- Ausgabe 7
- Juli 2019