- PPI – Nutzen und Risiken der Langzeitanwendung
Protonenpumpenhemmer (PPI) gehören zu den meist verschriebenen Medikamenten weltweit. In den letzten Jahren kamen immer mehr Bedenken bezüglich übermässigen Einsatzes und Nebenwirkungen auf. Die meisten der postulierten Nebenwirkungen wurden jedoch lediglich in retrospektiven und Beobachtungsstudien evaluiert und zeigen widersprüchliche und schwache Assoziationen mit einem wesentlichen Risiko. Das Risiko von Nebenwirkungen sollte deshalb kein Grund sein, Ihren Patienten PPI vorzuenthalten. Die richtige Indikation sowie deren Evaluation im Langzeit-Verlauf bleibt das Wichtigste. Nutzen und Risiko werden im Folgenden adaptiert nach (1) diskutiert.
Der Magen ist das einzige Organ, das Säure mit einem pH < 2 produziert. Dies ist sowohl wichtig für das Abtöten von Bakterien, die mit der Nahrung aufgenommen werden, als auch für die Verdauung und die Absorption mehrerer Nahrungsbestandteile wie Proteine, Eisen, Kalzium und Vitamin B12.
Vorteile von PPI in der Langzeitanwendung
PPI blockieren die Säuresekretion während des Tages wirkungsvoll. Die Säureblockade steigt nach peroraler Einnahme von PPI in den ersten 3-5 Tagen graduell an, weil immer nur derjenige Teil der Protonenpumpen blockiert wird, der im aktiven, Säure-sezernierenden Status ist. Um sich an die Protonenpumpen binden zu können, brauchen PPI hochkonzentriertes H2 zur Aktivierung. Diejenigen Protonenpumpen, die gerade nicht aktiv Säure sezernieren, können nicht blockiert werden. Anders als bei den H2-Blockern gibt es deshalb kein Toleranzphänomen, auch nicht in der Langzeitanwendung. V.a. tagsüber verliert die Kraft der Säuresuppression Ihre Wirkung auch mit der Zeit nicht. PPI gehören zu den «Marathonläufern», nicht «Kurzstrecken-Sprintern» (1).
PPI werden fast ausschliesslich über die Leber metabolisiert, nicht über die Niere. Eine Niereninsuffizienz beeinflusst ihre Wirkung deshalb nicht.
Für die Erhaltungstherapie bei gastroösophagealer Refluxerkrankung (GERD) und zur Prophylaxe von gastroduodenalen Ulzera unter NSAR und Aspirin ist eine Langzeitanwendung von PPI notwendig (2, 3). Nicht so bei funktioneller Dyspepsie oder hypersensitivem Ösophagus, wo PPI bei Bedarf angewendet werden können. GERD-Patienten klagen oft über postprandiale Refluxsymptome, weil zur Verdauung der Nahrung Säure produziert wird. Da die Säuresuppression einer einzelnen PPI-Morgendosis für den Tag ausreicht, können PPI 1 x / d effektiv eingesetzt werden, um Reflux oder ösophageale Erosionen / Ulzera zu verhindern. Wichtig ist eine Verabreichung 30-60min vor der Mahlzeit, damit der Wirkstoff im Blut ist, bevor die Säure zur Verdauung der Nahrung produziert wird. Wird die Medikation erst nach dem Essen eingenommen, wenn die gesamte Säure bereits produziert wurde, bleibt die Wirkung praktisch aus. Bei kontinuierlicher Anwendung liegt das Wiederauftreten von GERD-Symptomen während 1 Jahres < 15%, im Gegensatz zu > 50% ohne Erhaltungstherapie (4, 5). Verglichen mit H2-Blockern sind PPI wirksamer. Des Weiteren werden PPI eingesetzt, um die neoplastische Transition eines Barrett-Ösophagus zu Dysplasie / Adenokarzinom längerfristig zu verhindern, obwohl dies nicht ganz klar bewiesen ist (6).
Nachteile von PPI in der Langzeitanwendung
Die Nebenwirkungen der PPI können in 2 Gruppen unterteilt werden: die Säure-unabhängigen und die Säure-abhängigen.
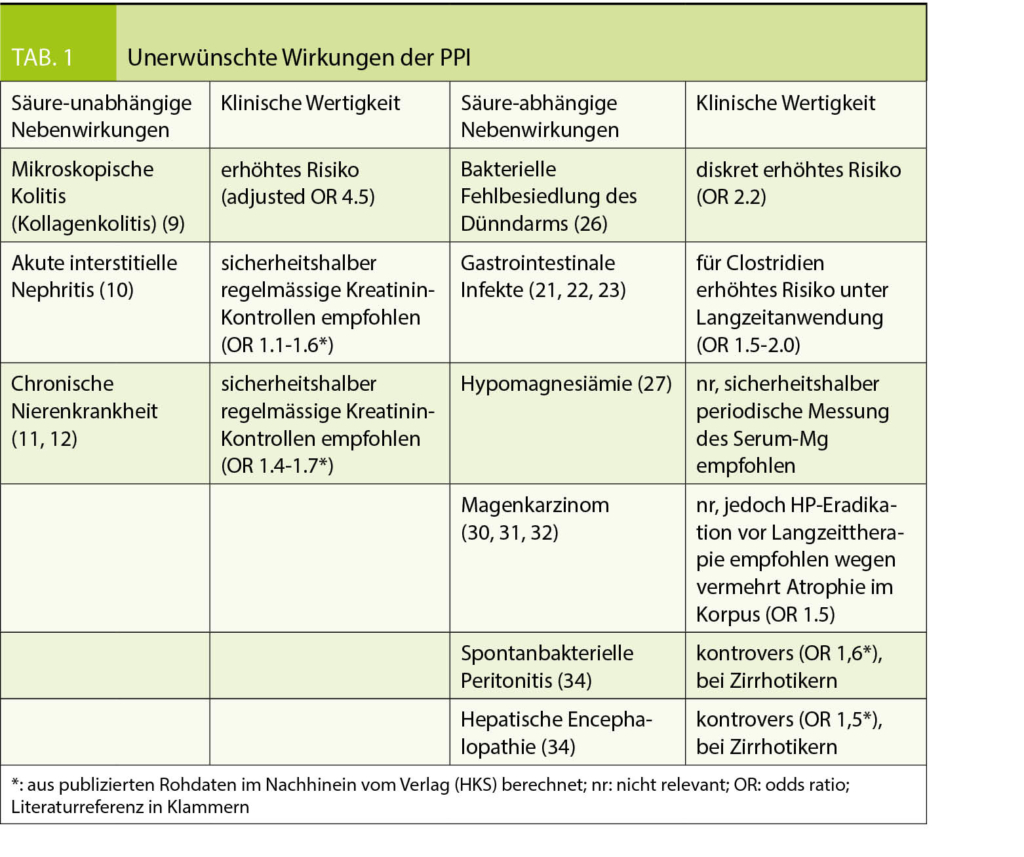
Die meisten Nebenwirkungen der Gruppe, die von der Säureblockade abhängen, treten in der Langzeitanwendung auf. Die von der Säure unabhängigen Nebenwirkungen werden sowohl in der Langzeit- als auch in der Kurzzeitanwendung beobachtet (Tab. 1).
Säure-unabhängige Nebenwirkungen
Mögliche allergische Reaktionen
Anaphylaxie, Panzytopenie, Agranulozytose, Thrombozytopenie, hämolytische Anämie, akuter Leberschaden, Lyell-Syndrom, Stevens-Johnson Syndrom, interstitielle Nephritis und Rhabdomyolyse werden unter PPI selten beschrieben. Dies sind unspezifische allergische Reaktionen, die auch unter anderen Medikamenten auftreten (7, 8). Unerklärte Hautläsionen, Fieber oder generelles Unwohlsein nach Beginn einer PPI-Therapie sollten Ihnen gemeldet werden. Es ist deshalb empfohlen, in den ersten Wochen einer PPI-Therapie wegen möglicher Nebenwirkungen eine Folgekonsultation zu vereinbaren.
Mikroskopische Kolitis (Kollagenkolitis)
Von Patienten unter PPI wird oft über Diarrhoe geklagt. Ein Teil der Fälle kann wahrscheinlich mit einer kollagenen Kolitis erklärt werden, die diagnostiziert wird durch Diarrhoe und histopathologische Veränderungen in der Koloskopie. PPI-Gebrauch ist assoziiert mit erhöhtem Risiko einer kollagenen Kolitis (hazard ratio 4.5) (9). Die PPI-bedingte kollagene Kolitis ist meist selbstlimitierend nach Sistieren der Medikation. Bei Auftreten von Diarrhoe unter neu begonnener PPI-Therapie muss jedoch an eine kollagene Kolitis gedacht werden.
Akute interstitielle Nephritis und chronische Nierenkrankheit
PPI können mit einer interstitiellen Nephritis zusammenhängen, möglicherweise auf Grund einer allergischen Reaktion, wobei der genaue Mechanismus nicht klar ist. In Biopsien wurde von 70% medikamenten-bedingter interstitieller Nephritis berichtet, davon 14% durch PPI (10). Zusätzlich zum akuten Nierenschaden wurde auch von chronischer Nierenkrankheit berichtet, die mit PPI vergesellschaftet sein soll, obwohl die Hazard Ratio bescheiden war (1.1-1.5) und die Resultate nur auf Observationsstudien beruhen (11, 12). Fazit ist, dass Patienten unter PPI sicherheitshalber regelmässig bzgl. Nierenfunktion kontrolliert werden sollten, auch wenn ein Zusammenhang mit PPI nicht klar bewiesen werden konnte.
Medikamenten-Interaktionen
Wie viele andere Medikamente (Diazepam, Phenytoin, Warfarin) werden PPI teilweise durch das Leberenzym CYP2C19 metabolisiert. Die Kapazität dieses Enzyms ist jedoch beschränkt. Deshalb kann die pharmakologische Wirkung anderer Medikamente durch PPI-Gabe beeinflusst werden. Clopidogrel z.B. braucht CYP2C19 zur Aktivierung. Bei Patienten unter Clopidogrel könnten PPI deshalb die anti-thrombotische Wirkung abschwächen und das Risiko für kardiovaskuläre Ereignisse erhöhen. Dies wurde kürzlich postuliert. Zusammenfassend kann aber gesagt werden, dass gemäss aktueller Datenlage (darunter auch die berühmte COGENT-Studie) keine Empfehlung gegen den Gebrauch von PPI bei Patienten mit Clopidogrel besteht (13, 14). Der Evidenzgrad der vorliegenden Studien war nicht adäquat genug, um klinisch relevante Entscheidungen zu fällen.
Demenz
Vor Kurzem wurden 2 retrospektive Publikationen aus deutschen Datenbanken veröffentlicht, in denen bei älteren Patienten unter PPI von einem erhöhten Risiko für Demenz berichtet wurde. Die Hazard Ratio war bescheiden (1.38 und 1.44), es wurde von einem potenziellen cerebralen Schaden durch erhöhte Spiegel von Amyloid-Beta-Peptiden gesprochen. 3 retrospektive Studien in den USA und Europa konnten diese Statistik jedoch nicht bestätigen. Kürzlich widerlegte eine prospektive Populations-Studie diese Aussage sogar eindeutig. PPI sollten nicht vermieden werden wegen Bedenken bezüglich Demenz (15).
Weitere
Kürzlich wurde ein erhöhtes Risiko für zerebrale Ischämie, KHK und sogar verminderte Lebenserwartung im Zusammenhang mit PPI propagiert. Dies waren jedoch retrospektive Studien aus Datenbanken, die für andere Zwecke erstellt worden waren. Es wurde diesbezüglich keine prospektive Untersuchung durchgeführt. Die Verlässlichkeit dieser retrospektiven Studien ist nicht hoch. Nur Odds ratios (OR) von > 2-3 gelten als klinisch relevant. Die OR für diese Krankheiten betrug 1-2 und ist daher klinisch nicht relevant (16).
Säure-abhängige Nebenwirkungen
Pneumonie
Der bakterizide Effekt des Magensaftes ist unter PPI vermindert, weil der Magen-pH erhöht wird. Zusätzlich sollen PPI auch die anti-bakterielle Immunität vermindern, indem sie die lysosomale Enzymaktivität herabsetzen (17). In retrospektiven Studien wurde gezeigt, dass das Pneumonie-Risiko bei GERD-Patienten zwar in den ersten 30 Tagen nach Beginn einer PPI-Therapie, nicht aber im Langzeit-Verlauf anstieg (18). Untersuchungen bei Patienten, die PPI zur Prävention von NSAR-Ulzera bekamen, zeigten kein erhöhtes Risiko für eine Pneumonie (19). Auch eine Meta-Analyse von prospektiven randomisierten Studien ergab kein erhöhtes Pneumonie-Risiko (20).
Gastrointestinale Infekte
Salmonella und Campylobacter sind säure-labile Bakterien und es ist nachvollziehbar, dass sie den Gastrointestinaltrakt allenfalls eher befallen können, wenn die Säureproduktion auf Grund einer PPI-Therapie vermindert ist. Die Datenlage diesbezüglich ist aber kontrovers. Es gibt sowohl Studien, die eine erhöhte Infektanfälligkeit für Salmonella und Campylobacter gezeigt haben, als auch solche, die dies nicht aufzeigen konnten (21, 22).
Die Clostridium difficile-Enteritis ist in westlichen Ländern wegen der ansteigenden Antibiotika-Resistenz ein zunehmendes Problem. Ein erhöhtes Risiko für eine Infektion besteht unter Langzeitanwendung von PPI mit einer OR von 1.5-2.0 (21). Ein Zusammenhang mit komplizierten Krankheitsverläufen oder rezidivierenden C. difficile-Infektionen konnte aber nicht eindeutig festgestellt werden (23).
Neuroendokrine Tumoren des Magens
Nach dem Beginn des weltweiten PPI-Gebrauchs wurden nur vereinzelte Fälle von gastrischen Karzinoid-Tumoren beschrieben. Ein Zusammenhang mit der PPI-Verabreichung ist nicht klar (24). Zusammenfassend kann gesagt werden, dass das Risiko von gastrischen Karzinoid-Tumoren während Langzeitanwendung von PPI klinisch nicht relevant ist.
Mukosale Hypertrophie im Fundus
Eine durch PPI verursachte Hypergastrinämie führt zur mukosalen Hypertrophie im Fundus. Dies ist v.a. bei der Langzeit-Anwendung von PPI der Fall und bei Helicobacter-negativen Patienten. Das abrupte Absetzen einer PPI-Therapie hat deshalb eine Säure-Überproduktion und damit ein Rebound-Phänomen zur Folge (25). Dies macht eine intermittierende PPI-Therapie schwierig.
Veränderungen im Mikrobiom und bakterielle Fehlbesiedlung des Dünndarms
PPI sollen das Mikrobiom verändern und die Zahl der Streptokokken in der Mundhöhle vermehren (26). Die klinische Relevanz einer Mikrobiom-Veränderung durch PPI ist allerdings aktuell nicht klar. Dazu erhöht eine PPI-Therapie die Bakterien-Dichte in Duodenum und Jejunum. Bei > = 100 000 Keimen/ml Dünndarminhalt wird eine bakterielle Fehlbesiedlung des Dünndarms diagnostiziert.
Veränderte Absorption von Mikronährstoffen (Mg, Eisen, Kalzium, Vitamin B12)
Die Hypothese einer Hypomagnesiämie unter PPI basiert auf einer selektiven Malabsorption im Dünndarm, verursacht durch das veränderte Mikro-Milieu bei erhöhtem pH. Die Studienlage ist aber nicht eindeutig (27). Konsequenz davon ist die Empfehlung einer periodischen Messung des Serum-Magnesiums unter Langzeit-Therapie mit PPI.
Einige Mikronährstoffe benötigen die Magensäure für eine effektive Absorption, z.B. Eisen, Kalzium und Vitamin B12. Wenn die Eisenreserven im Körper tief sind, reguliert die duodenale Mukosa automatisch die Eisenabsorption hoch. Deshalb tritt lediglich wegen einer PPI-Therapie selten ein Eisenmangel auf. Bezüglich verminderter Kalzium-Absorption mit daraus resultierender Osteoporose und vermehrten Knochenbrüchen gibt es in verschiedenen Untersuchungen keinen klaren Zusammenhang zur PPI-Gabe (28). Über die Vitamin B12-Absorption unter PPI-Therapie bestehen mehrere Studien, die kontrovers ausfielen und keine klinische Relevanz aufzeigen konnten.
Drüsenkörperzysten
PPI-Therapie bei Helicobacter-negativen Patienten führt gern zur Bildung von multiplen Drüsenkörperzysten. Dies sind kleine, benigne Magenpolypen. Sie verschwinden nach Sistieren der PPI-Therapie wieder. Empfohlen ist eine endoskopische Resektion bei Polypen >1cm, ansonsten haben sie keine klinische Relevanz (29). Bei aussergewöhnlich starkem Auftreten sollte mittels Koloskopie eine familiäre adenomatöse Polyposis (FAP) ausgeschlossen werden, die mit der PPI-Einnahme aber nichts zu tun hat.
Magenkarzinome
Es fehlt die Evidenz, dass eine Langzeitanwendung von PPI zu Magenmukosaatrophie oder Metaplasiebildung führt (30). Patienten mit Helicobacter-Infektion zeigen unter Langzeit-Therapie mit PPI häufiger eine Mukosaatrophie im Korpus als Helicobacter-negative Patienten. Deshalb ist eine Helicobacter-Eradikation vor Langzeit-Therapie mit PPI empfehlenswert. Eine mögliche Folge ist das Fortschreiten der Atrophie und Metaplasie zur Dysplasie. Auch dies kann aber nicht eindeutig belegt werden. Es wurden Magenkarzinome beschrieben, die aber im Zusammenhang mit einer perniziösen Anämie und chronischen Gastritis auftraten, nicht mit einer PPI-Therapie (31, 32).
Kolonkarzinome
Einige Kolonkarzinome haben Gastrinrezeptoren. So könnte eine durch PPI induzierte Hypergastrinämie zu einem erhöhten Kolonkarzinomrisiko führen. Basierend auf mehreren Beobachtungsstudien zeigt sich dafür aber keine Evidenz (33).
Spontanbakterielle Peritonitis und hepatische Encephalopathie
Bei Leberzirrhose und Aszites können wegen erhöhter Permeabilität der intestinalen Mukosa Darmbakterien in den Aszites penetrieren. PPI sollen das Risiko sowohl für eine spontanbakterielle Peritonitis (hazard ratio 1.4-5.0) als auch für das Auftreten einer hepatischen Encephalopathie aus diesem Grund erhöhen. Auch diesbezüglich ist die Datenlage aber kontrovers (34, 35).
Medikamenten-Interaktionen
Die pharmakologische Wirkung von Medikamenten, für welche die Magensäure zur Absorption wichtig ist (z.B. Digoxin), können durch gleichzeitige PPI-Gabe beeinflusst werden. Die Kompatibilität der verschiedenen Medikamente, insbesondere bei Polypharmazie, sollte deshalb auch bei PPI beachtet werden.
Fazit
Am Wichtigsten ist die richtige Indikation vor Verschreibung einer längerfristigen PPI-Therapie. Nebenwirkungen von PPI sind grundsätzlich selten und zeigen eine schlechte Evidenz, treten aber hauptsächlich unter Langzeit-Behandlung auf. Potenzielle Nebenwirkungen sollten die Vorteile der Therapie nicht überragen. Als klinisch relevante Nebenwirkungen können die Kollagenkolitis und bakterielle Fehlbesiedlung des Dünndarms genannt werden. Des Weiteren besteht ein diskret erhöhtes Risiko für gastrointestinale Infekte, v.a. Clostridien. Bei Patienten mit Leberzirrhose sollte wegen möglicher spontanbakterieller Peritonitis und hepatischer Encephalopathie die Indikation für eine PPI-Therapie gut überlegt werden.
Bei der Behandlung von GERD, gastroduodenalen Ulzera oder einer Helicobacter-Eradikation liegen die Vorteile klar auf Seite der PPI-Therapie, während bei funktioneller Dyspepsie oder hypersensitivem Ösophagus die Datenlage für eine erfolgversprechende Therapie limitiert ist. Um lediglich einen geringen therapeutischen Effekt zu erzielen, sollte das Risiko von Nebenwirkungen vermieden werden, auch wenn es klein ist. Wenn der erwartete therapeutische Nutzen hingegen gross ist, kann ein tiefes Nebenwirkungs-Risiko akzeptiert werden.
Klinik für Gastroenterologie/Hepatologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
mirjam.hiestand@kssg.ch
Klinik für Gastroenterologie/Hepatologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Klinik für Gastroenterologie/Hepatologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Die Autoren/innen geben an, keine Interessens-konflikte im Zusammenhang mit dem vorgelegten Manuskript zu haben.
- PPI gehören zu den meistverschriebenen Medikamenten weltweit.
Das Nutzen/Risiko-Profil liegt zu Gunsten der PPI. Nebenwirkungen sind selten und klinisch oft nicht relevant. Die meisten der postulierten Nebenwirkungen wurden in retrospektiven und Beobachtungsstudien evaluiert und zeigen widersprüchliche und schwache Assoziationen mit einem wesentlichen Risiko. - Die beste Evidenz haben die Kollagenkolitis und die bakterielle
Fehlbesiedlung des Dünndarms. Für gastrointestinale Infekte (v.a. Clostridien) besteht ein leicht erhöhtes Risiko. Bei Patienten mit Leberzirrhose sollte wegen möglicher spontanbakterieller Peritonitis und hepatischer Encephalopathie die Indikation für eine PPI-Therapie gut überlegt werden. - Abgewogen werden sollte das Nutzen/Risiko-Profil. Bei geringem therapeutischem Effekt wie funktioneller Dyspepsie sollten PPI möglichst nur bei Bedarf angewendet werden, nicht längerfristig. Bei der Prophylaxe von gastralen Ulzera oder GERD überwiegen jedoch die Vorteile.
1. Yoshikazu Kinoshita, Norihisa Ishimura, and Shunji Ishihara. Advantages and
Disadvantages of Long-term Proton Pump Inhibitor Use. J Neurogastroenterol Motil 2018; 24: 182-196.
2. Labenz J, Armstrong D, Lauritsen K, et al. Esomeprazole 20 mg vs. pantoprazole 20 mg for maintenance therapy of healed erosive oesophagitis: results from the EXPO study. Aliment Pharmacol Ther 2005;22:803-811.
3. Kinoshita Y, Kato M, Fujishiro M, et al. Efficacy and safety of twice- daily rabeprazole maintenance therapy for patients with reflux esophagi- tis refractory to standard once-daily proton pump inhibitor: the Japan- based EXTEND study. J Gastroenterol 2017;28:1-11.
4. Pace F, Annese V, Prada A, et al. Rabeprazole is equivalent to omepra- zole in the treatment of erosive gastro-oesophageal reflux disease. A randomised, double-blind, comparative study of rabeprazole and omeprazole 20 mg in acute treatment of reflux oesophagitis, followed by a maintenance open-label, low-dose therapy with rabeprazole. Dig Liver Dis 2005;37:741-750.
5. Lundell LR, Dent J, Bennett JR, et al. Endoscopic assessment of oe- sophagitis: clinical and functional correlates and further validation of the Los Angeles classification. Gut 1999;45:172-180.
6. Singh S, Garg SK, Singh PP, Iyer PG, El-Serag HB. Acid-suppressive medications and risk of oesophageal adenocarcinoma in patients with Barrett’s oesophagus: a systematic review and meta-analysis. Gut 2014;63:1229-1237.
7. Choi SW, Han JM, Bae YJ, et al. Lessons from two cases of anaphylaxis to proton pump inhibitors. J Clin Pharm Ther 2012;37:614-616.
8. Dury S, Nardi J, Gozalo C, Lebargy F, Deslee G. Agranulocytosis in- duced by
proton pump inhibitors. J Clin Gastroenterol 2012;46:859.
9. Keszthelyi D, Jansen SV, Schouten GA, et al. Proton pump inhibitor use is associated with an increased risk for microscopic colitis: a case-control study. Aliment Pharmacol Ther 2010;32:1124-1128.
10. Muriithi AK, Leung N, Valeri AM, et al. Biopsy-proven acute intersti- tial nephritis, 1993-2011: a case series. Am J Kidney Dis 2014;64:558- 566.
11. Lazarus B, Chen Y, Wilson FP, et al. Proton pump inhibitor use and the risk of chronic kidney disease. JAMA Intern Med 2016;176:238-246.
12. Arora P, Gupta A, Golzy M, Patel N, Carter RL, Jalal K, Lohr JW. Proton pump inhibitors are associated with increased risk of develop- ment of chronic kidney disease. BMC Nephrol 2016;17:112.
13. Gao QP, Sun Y, Sun YX, Wang LF, Fu L. Early use of omeprazole benefits patients with acute myocardial infarction. J Thromb Throm- bolysis 2009;28:282-287.
14. Ren YH, Zhao M, Chen YD, et al. Omeprazole affects clopidogrel ef- ficacy but not ischemic events in patients with acute coronary syndrome undergoing elective percutaneous coronary intervention. Chin Med J 2011;124:856-861.
15. Gray SL, Walker RL, Dublin S, et al. Proton pump inhibitor use and dementia risk: prospective population-based study. J Am Geriatr Soc 2017;66:247-253.
16. Vaezi MF, Yang YX, Howden CW. Complications of proton pump inhibitor therapy. Gastroenterology 2017;153:35-48.
17. Liu W, Baker SS, Trinidad J, et al. Inhibition of lysosomal enzyme activities by proton pump inhibitors. J Gastroenterol 2013;48:1343-1352.
18. Johnstone J, Nerenberg K, Loeb M. Meta-analysis: proton pump
inhibitor use and the risk of community-acquired pneumonia. Aliment
Pharmacol Ther 2010;31:1165-1177.
19. Filion KB, Chateau D, Targownik LE, et al. Proton pump inhibitors and the risk of hospitalisation for community-acquired pneumonia: rep-
licated cohort studies with meta-analysis. Gut 2014;63:552-558.
20. Sultan N, Nazareno J, Gregor J. Association between proton pump in- hibitors and respiratory infections: a systematic review and meta-analysis
of clinical trials. Can J Gastroenterol 2008;22:761-766.
21. Bavishi C, Dupont HL. Systematic review: the use of proton pump inhibitors and increased susceptibility to enteric infection. Aliment Phar-
macol Ther 2011;34:1269-1281.
22. Brophy S, Jones KH, Rahman MA, et al. Incidence of Campylobacter
and
Salmonella infections following first prescription for PPI: a cohort
study using
routine data. Am J Gastroenterol 2013;108:1094-1100.
23. Faleck DM, Salmasian H, Furuya EY, Larson EL, Abrams JA, Freed- berg DE.
Proton Pump Inhibitors Do Not Increase Risk for Clostrid- ium difficile Infection in the Intensive Care Unit. Am J Gastroenterol
2016;111:1641-1648.
24. Haga Y, Nakatsura T, Shibata Y, et al. Human gastric carcinoid detected during long-term antiulcer therapy of H2 receptor antagonist and proton pump inhibitor. Dig Dis Sci 1998;43:253-257.
25. Gillen D, Wirz AA, Ardill JE, McColl KE. Rebound hypersecretion after omeprazole and its relation to on-treatment acid suppression and Helicobacter pylori status. Gastroenterology 1999;116:239-247.
26. Jackson MA, Goodrich JK, Maxan ME, et al. Proton pump inhibitors alter the composition of the gut microbiota. Gut 2016;65:749-756.
27. Biyik M, Solak Y, Ucar R, et al. Hypomagnesemia among outpatient long-term proton pump inhibitor users. Am J Ther 2017;24:e52-e55.
28. Hansen KE, Jones AN, Lindstrom MJ, et al. Do proton pump inhibi-
tors decrease calcium absorption? J Bone Miner Res 2010;25:2786-
2795.
29. Choudhry U, Boyce HW Jr, Coppola D. Proton pump inhibitor- associated gastric polyps: a retrospective analysis of their frequency, and endoscopic, histologic, and ultrastructural characteristics. Am J Clin Pathol 1998;110:615-621.
30. Song H, Zhu J, Lu D. Long-term proton pump inhibitor (PPI) use and the development of gastric pre-malignant lesions. Cochrane Database Syst Rev. 2014;(12):CDO1O623.
31. Lundell L, Vieth M, Gibson F, Nagy P, Kahrilas PJ. Systematic review: the effects of long-term proton pump inhibitor use on serum gastrin levels and gastric histology. Aliment Pharmacol Ther. 2015;42(6):649-63.
32. Ko Y, Tang J, Sanagapalli S, Kim BS, Leong RW. Safety of proton pump inhibitors and risk of gastric cancers: review of literature and pathophysiological mechanisms. Expert Opin Drug Saf. 2016;15(1):53-63.
33. Robertson DJ, Larsson H, Friis S, Pedersen L, Baron JA, Sørensen HT. Proton pump inhibitor use and risk of colorectal cancer: a popula- tion-based, case-control study. Gastroenterology 2007;133:755-760.
34. Dam G, Vilstrup H, Watson H, Jepsen P. Proton pump inhibitors as a risk factor for hepatic encephalopathy and spontaneous bacterial perito- nitis in patients with cirrhosis with ascites. Hepatology 2016;64:1265- 1272.
35. Kim JH, Lim KS, Min YW, et al. Proton pump inhibitors do not in- crease the risk for recurrent spontaneous bacterial peritonitis in patients with cirrhosis. J Gastroenterol Hepatol 2017;32:1064-1070.
der informierte @rzt
- Vol. 9
- Ausgabe 7
- Juli 2019