- Gerinnungsabklärung
Die venöse Thromboembolie (VTE) ist ein multifaktorielles Geschehen. Gemäss Virchow verursacht durch einen beeinträchtigten Blutfluss (Stase), ein Gefässtrauma oder eine Hyperkoagulabilität. Ob und wie eine Gerinnungsabklärung im Management einer VTE hilft, soll im Folgenden beleuchtet werden.
Die Inzidenz der venösen Thromboembolie ist nicht wesentlich anders als jene des Myokardinfarkts 1-2/1000 Personen. Diese steigt deutlich mit dem Alter. Wegen Schwangerschaft, Wochenbett, hormoneller Verhütung und Unfällen sind aber jüngere Personen nicht unwesentlich betroffen. In Europa dürften jährlich 500 000 Todesfälle in Zusammenhang mit venösen Thromboembolien stehen (1). Für über 80% der aufgetretenen Thromboembolien lassen sich Risikofaktoren finden (Tab. 1) (2, 3). Mehr als 2/3 der Ereignisse treten provoziert durch Operationen, Hospitalisation und Tumorleiden auf. Primär gilt es, Thromboembolien durch geeignete prophylaktische Massnahmen zu verhindern. Tritt eine VTE auf müssen Symptome rasch richtig gedeutet, die Diagnose bildgebend gesichert und die Behandlung eingeleitet werden. Mit Ausnahme des Nachweises von Antiphospholipid Antikörpern und Lupus Antikoagulans beeinflusst kein Gerinnungstest die Art der Behandlung. In der akuten Situation einer VTE hat die Behandlung oberste Priorität. Eine streng systematische Herangehensweise mit Anamnese, körperlicher Untersuchung und Übersichtslabors helfen die aufgetretene VTE richtig einzuordnen. Eine Gerinnungsabklärung steht nur bei selektionierten Patienten am Ende dieses Prozesses.
Systematischer Ansatz zur Abklärung venöser Thromboembolie
Anamnese: Nach Risiken wie operativen Eingriffen, Traumata und Hospitalisationen (bis 90 Tage zurück!), Immobilisationen (Reiseanamnese), Schwangerschaften ist zu fragen. Frühere Thromboembolien und Erkrankungen mit erhöhtem Thromboserisiko wie systemischer Lupus erythematodes, myeloproliferative Erkrankungen, nephrotisches Syndrom, entzündliche Darmerkrankungen müssen in Erfahrung gebracht werden. Eingenommene Medikamente, besonders hormonelle Kontrazeptiva, Hormonersatzbehandlungen, Testosteronsubstitution, Tamoxifen und Steroidanwendung sind festzuhalten. Frauen sind nach Aborten zu fragen. Die Familienanamnese ist hinsichtlich Thromboembolien zu erfassen. Nach Symptomen, welche auf eine Neoplasie hinweisen könnten, wie Gewichtsabnahmen, Müdigkeit, Appetitverlust, Husten, Hämoptoe, Stuhlunregelmässigkeiten, Hämaturie ist gezielt zu fragen.
Status: Bei der körperlichen Untersuchung sucht man Veränderungen, welche auf eine maligne Erkrankung hinweisen könnten wie Lymphadenopathie, Verhärtungen der Mamma oder Testes, Aszites, Hepatomegalie, Splenomegalie, Ödeme.
Übersichtslabor: Blutbild mit Ausstrich für mikroskopische Beurteilung, Gerinnungsstatus inkl. Lupus Antikoagulans Test, CRP/BSR, Leber- und Nierenwerte, Urinstatus und allenfalls Hämoccult-Test. Pathologischen Befunden ist nachzugehen.
Bildgebung: Die Bildgebung muss die Diagnose der Thromboembolie sichern und soll die Lokalisation und Ausdehnung der Gerinnsel festhalten.
Thrombophilieabklärung für wen?
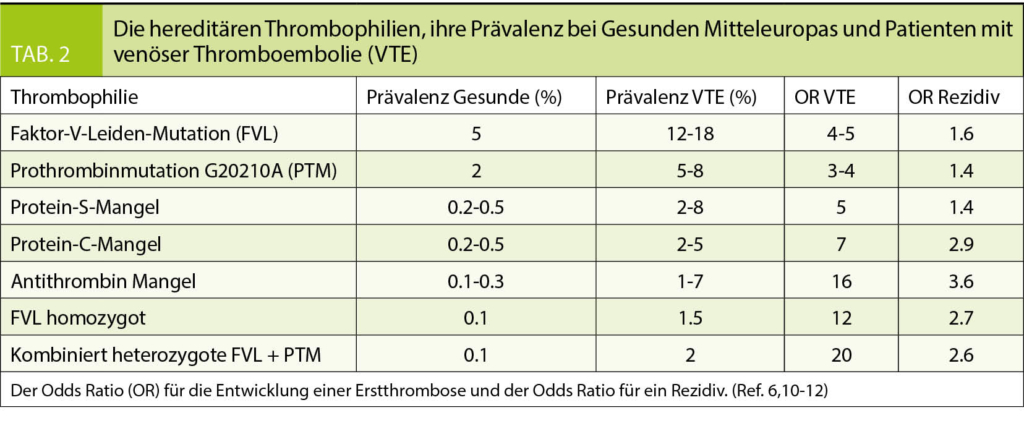
Es besteht allgemeiner Konsens, dass nicht jede Person mit einer durchgemachten Thromboembolie eine Thrombophilieabklärung braucht (4, 5). Denn der Nachweis einer Thrombophilie beeinflusst die Therapie und spätere Prophylaxe kaum. Die Mortalität ändert nicht. Die am häufigsten anzutreffenden Thrombophilien heterozygote Faktor-V-Leiden-Mutation und heterozygote Prothrombinmutation beeinflussen das Rezidiv-
risiko nach Erstthrombose nicht. Die Thrombophilien, welche die Rückfallgefahr und damit die Dauer der Antikoagulation beeinflussen könnten (Antithrombin-, Protein-C-Mangel, homozygote Faktor-V-Leiden-Mutation, kombiniert heterozygote Faktor-V-Leiden plus heterozygote Prothrombinmutation) sind selten (Tab. 2). In folgenden Situationen ist die Gerinnungsuntersuchung aber empfohlen:
Positive Familienanamnese: Hat eine oder haben mehrere direkt verwandte Personen (Eltern, Geschwister, Kinder) im Alter unter 45 Jahre eine Thromboembolie durchgemacht, ist die Wahrscheinlichkeit deutlich erhöht, dass bei der Abklärung eine Thrombophilie gefunden wird (6). Eine hereditäre Thrombophilie ist zu suchen.
Junge Patienten unter 45-50 Jahre: Patienten mit einer Thrombo-
embolie in dieser Altersgruppe haben in bis zur Hälfte der Fälle eine Thrombophilie. Sie sollen auf das Vorliegen einer angeborenen Thrombophilie und ein Antiphospholipid Syndrom untersucht werden.
Patienten mit wiederkehrenden Thromboembolien: Bei wiederkehrenden Thromboembolien in relativ kurzer Folge ist nach einer angeborenen Thrombophilie und einem Antiphospholipid Syndrom zu suchen. Die Schwelle, eine okkulte Neoplasie zu suchen wird niedrig.
Patienten mit atypisch lokalisierten Thrombosen: Patienten mit Pfortader-, Lebervenen-, Mesenterialvenen- und Cerebralvenenthrombosen sind auf eine hereditäre Thrombophilie und ein Antiphospholipid Syndrom zu testen. Bei splanchnischen Thrombosen liegt mit recht hoher Wahrscheinlichkeit ein myeloproliferatives Syndrom (MPS) vor. Man sucht eine JAK-2 V617F Mutation. Daneben ist auch an eine paroxysmale nächtliche Hämoglobinurie (PNH) zu denken. In der Regel ist in diesen speziellen Situationen eine Vorstellung beim Hämatologen ratsam.
Patienten mit arteriellen Thrombosen: Bei arteriellen Thrombosen kann ein Antiphospholipid Syndrom wesentliche Ursache sein und sollte besonders bei jüngeren Patienten gesucht werden. Besteht auch eine Möglichkeit für gekreuzte Embolien (offenes Foramen ovale) ist auch eine hereditäre Thrombophilie zu suchen. Andernfalls sind diese nicht Risiken für arterielle Thrombosen.
Nutzen und potentieller Schaden der Thrombophilieabklärung bei diesen selektionierten Patienten
Der Nachweis einer Thrombophilie kann in zukünftigen Risiko-situationen zu einer personalisierten Thromboseprophylaxe benutzt werden, die dosisintensiviert und verlängert durchgeführt wird. Der Nachweis einer hereditären Thrombophilie kann helfen, Verwandte ersten Grades mit erhöhtem Thromboserisiko zu finden. Alle hereditären Thrombophilien werden autosomal dominant vererbt. Direkt Verwandte haben deshalb eine Vortestwahrscheinlichkeit von 50% die bekannte Thrombophilie auch aufzuweisen. Die Kenntnis, dass eine Gefährdung für Thrombosen vorliegt, kann dazu verwendet werden, Hormone gezielt und restriktiv einzusetzen und Thromboseprophylaxen individualisiert durchzuführen. Das Wissen um einen Antithrombin Mangel z.B. könnte verwendet werden, in Risikosituationen wie z.B. während einer Schwangerschaft eine Thromboseprophylaxe und peripartal eine Antithrombinsubstitution durchzuführen.
Mögliche Nachteile
Da der Nachweis einer Thrombophilie keinen Überlebensvorteil bringt, ist er primär mit Kosten und wenig belegtem Nutzen verbunden. Der Nachweis einer Thrombophilie könnte zu einer unreflektiert langen Antikoagulation führen. Die Diagnose Thrombophilie kann in den Betroffenen Ängste provozieren. Der Patient ist deshalb in den Entscheid eine Abklärung durchzuführen einzubeziehen.
Thrombophilieabklärung, wenn ja, was zu welchem Zeitpunkt?
Abklärung Antiphospholipid Syndrom (erworbene Thrombophilie)
Ein Antiphospholipid Syndrom kann dann diagnostiziert werden wenn klinische Ereignisse wie anderweitig nicht erklärte venöse und arterielle Thromboembolien, wiederholte Aborte, intrauteriner Fruchttod, schwere Präeklampsie oder eine Plazentainsuffizienz mit dem Nachweis von Laborbefunden wie erhöhten IgG/IgM-Titern von Anti-Cardiolipin und/oder Anti-β2-Glykoprotein-1-Antikörpern und/oder einem positiven Lupus-Antikoagulans Test zusammentreffen. Die Laborbefunde müssen im Abstand von mindestens 12 Wochen zweimal positiv ausfallen bevor die Diagnose Antiphospholipid Syndrom gestellt werden darf.
Treten bei jüngeren Patienten venöse und arterielle Thromboembolien ohne anderweitige Risikofaktoren auf, ist die Suche nach Antiphospholipid Antikörpern nebst dem Lupus Antikoagulans Test bereits beim Übersichtslabor mit einzuschliessen. Denn beim hochrisiko Antiphospholipid Syndrom (positiver Lupus Antikoagulans Test, erhöhte Titer Anti-Cardiolipin plus Anti-β2-Glykoprotein-1-Antikörper) ist Rivaroxaban der Behandlung mit Vitamin-K-Antagonisten klar unterlegen (7). Die Behandlung muss mit Vitamin-K-Antagonisten erfolgen.
Abklärung hereditäre Thrombophilie
Zur Abklärung der hereditären Thrombophilien empfehle ich im Setting einer Praxis die funktionelle Bestimmung von Antithrombin und Protein C, die antigenetische Bestimmung des freien Proteins S und die molekulargenetische Suche einer Faktor II (Prothrombinmutation G20210A) und Faktor V (R506Q, Leiden) Mutation. Um pathologische Befunde von Protein C und S interpretieren zu können, ist es unerlässlich zu zeigen, dass zur gleichen Zeit der Bestimmung dieser Inhibitoren die Prothrombinzeit (Quick) normal ist. Ein verminderter Spontanquick könnte ein Hinweis auf einen Vitamin-K-Mangel sein, welcher gleichermassen auch die Vitamin K abhängigen Proteine C und S verringert. Wichtig: Östrogen kann zu einem erworbenen Protein-S-Mangel führen!
Zeitpunkt der Abklärung einer hereditären Thrombophilie
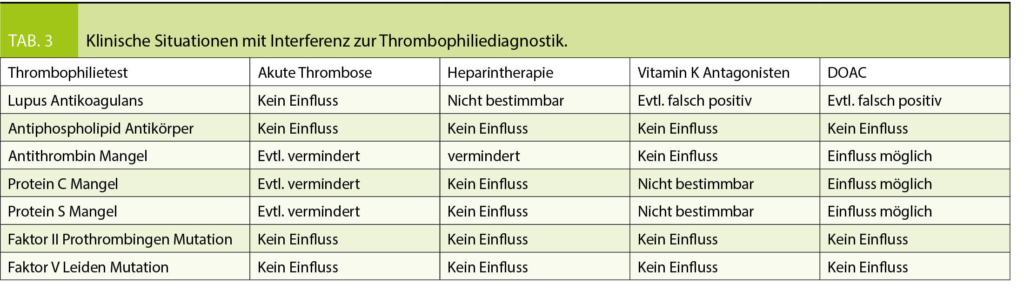
Die Suche einer hereditären Thrombophilie sollte so geplant werden, dass sie unter optimalen Voraussetzungen, d.h. zum richtigen Zeitpunkt erfolgt und eine möglichst abschliessende Beurteilung erlaubt. Diverse Einflüsse können die Thrombophiliediagnostik stören und verfälschen (Tab. 3). Im Idealfall erfolgt die Thrombophilieabklärung 3-4 Wochen nach abgesetzter Antikoagulation. Ist offen, ob eine Indikation für eine Langzeitantikoagulation vorliegt, soll die Abklärung frühestens drei Monate nach dem akuten Ereignis erfolgen. Die Antikoagulation, heute meist ein DOAC, wird 48-72 Std. pausiert und nach erfolgter Blutentnahme fortgesetzt.
Suche nach einer Thrombophilie bei asymptomatischen Patienten
Ob asymptomatische Patienten auf eine Thrombophilie getestet werden sollen bedarf der Abwägung von Vor- und Nachteilen. Kein Nachweis einer Thrombophilie, auch nicht einer solchen mit hohem Risiko für eine Erstthrombose, wie etwa ein Antithrombin Mangel, würde gemäss heutigem Erkenntnisstand prophylaktisch antikoaguliert.
Mögliche Vorteile der Abklärung
Patienten mit bekannter Thrombophilie könnten gezielt instruiert werden die frühen Warnzeichen einer Thromboembolie zu erkennen und beim Auftreten von solchen adäquat zu handeln. Eine gezielte Aufklärung über das erhöhte Risiko bei der Verwendung von Östrogen wird möglich und in Risikosituationen für die Entstehung einer Thromboembolie könnte eine individualisierte Thromboseprophylaxe durchgeführt werden (z.B. niedermolekulares Heparin während der ganzen Schwangerschaft und im Wochenbett bei einem Antithrombin Mangel).
Mögliche Nachteile der Abklärung
Thrombophilien mit hohem Thromboserisiko sind selten und die häufigen Thrombophilien erhöhen das Thromboserisiko wenig (Tab. 2). Thrombophilie Screening Programme würden deshalb teuer. In den USA wurde in einer Kosten-Nutzen-Rechnung geschätzt, dass basierend auf den Zahlen von Todesfällen an Thromboembolien unter kombinierten Kontrazeptiva (3 pro Million Anwenderinnen pro Jahr ohne und 14 pro Million pro Jahr mit heterozygoter Faktor-V-Leiden-Mutation) 92’000 Frauen mit Faktor-V-Leiden-Mutation identifiziert werden müssten, welche anschliessend auf östrogenhaltige Kontrazeptiva verzichten müssten, um einen Todesfall zu verhindern. Um diese Frauen zu identifizieren, müssten über 300 Millionen US$ aufgewendet werden (8). Basierend auf diesen ökonomischen Daten wird davon abgeraten, generell vor der Verschreibung östrogenhaltiger Kontrazeptiva eine hereditäre Thrombophilie zu suchen.
Fazit
Abgesehen vom Nachweis eines Antiphospholipid Syndroms haben Gerinnungsuntersuchungen wenig direkten Einfluss auf den Behandlungspfad einer venösen Thromboembolie. Bei jüngeren Patienten mit unerklärt aufgetretenen venösen und arteriellen Thromboembolien ist rasch nach Antiphospholipid Antikörpern und einem Lupus Antikoagulans zu suchen. Bei Verdacht, dass ein Antiphospholipid Syndrom vorliegt, ist die Antikoagulation überlappend mit niedermolekularem Heparin und einem Vitamin-K-Antagonisten zu starten. Ansonsten hat der Einsatz von Laboruntersuchungen auf der Suche einer Hyperkoagulabilität zurückhaltend und gut überlegt zu erfolgen. Eine angeborene Thrombophilie ist im Kontext einer Thrombose bei jungen Patienten, allen Frauen im gebärfähigen Alter, Personen mit rezidivierenden Thromboembolien und solchen mittleren Alters (45-60 Jahre) mit Kindern und Geschwistern durchzufuhren. Alle hereditären Thrombophilien werden autosomal dominant vererbt. Direkt Verwandte eines lndexpatienten mit Thrombophilie weisen eine solche mit einer Wahrscheinlichkeit von 50% ebenfalls auf. Nur die seltenen hereditären Thrombophilien beeinflussen das Rezidivrisiko (Tab. 2) und somit potentiell die Behandlung. Der Nachweis einer der häufigen hereditären Thrombophilien (Faktor-V-Leiden, Prothrombinmutation) beeinflusst das Rückfallrisiko nicht. Sie erhöhen aber wesentlich das Risiko eine Erstthrombose zu erleiden. Der Nachweis dieser Thrombophilien hilft zwar nicht beim Management des Indexpatienten kann aber helfen, direkt Verwandte mit erhöhtem Risiko für eine Erstthrombose zu identifizieren und diese durch gezielte Beratung und Prophylaxe vor einem solchen Ereignis zu bewahren. Die Suche nach einem Antiphospholipid Syndrom kostet 180, jene nach einer hereditären Thrombophilie rund 430 Franken. Dieser Betrag kann effizient eingesetzt sein, wenn die Befunde helfen, bei direkt Verwandten Untersuchungen zu verhindern oder ganz gezielt durchzuführen. Es ist deshalb wichtig, dass die Befunde dem Patienten mitgeteilt und ausgehändigt werden, so dass er sie mit Angehörigen teilen kann.
FMH/FAMH Hämatologie und FMH Innere Medizin
Abklärungszentrum Blutgerinnung
Bläsistrasse 23
8049 Zürich
j.boesiger@iclot.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Nur der Nachweis eines Antiphospholipid Syndroms (pos. Lupus Antikoagulans Test, erhöhte Titer von Anti-Cardiolipin und Anti-β2-Glyko-protein 1 IgG und IgM Antikörper) beeinflusst die Behandlung einer Thromboembolie (Behandlung primär mit Vitamin-K-Antagonisten).
- Der Nachweis einer hereditären Thrombophilie beeinflusst nur in wenigen Fällen die Behandlung einer Thromboembolie.
- Nutzniesser des Nachweises einer hereditären Thrombophilie sind
primär Verwandte ersten Grades, die nach gezielter Untersuchung von einem erhöhten Thromboserisiko erfahren. - Hereditäre Thrombophilien sollten nur bei selektionierten Patienten mit Merkmalen wie: positive Familienanamnese, junges Alter, wiederkehrende Thromboembolien, atypisch lokalisierte Thrombosen
(abdominal, cerebral) gesucht werden.
1. I. S. C. f. W. T. Day, Thrombosis: a major contributor to the global disease burden. Journal of thrombosis and haemostasis : JTH 12, 1580-1590 (2014).
2. A. D. Blann, G. Y. H. Lip, Venous thromboembolism. Bmj 332, 215-219 (2006).
3. F. A. Spencer et al., The Worcester Venous Thromboembolism study: a population-based study of the clinical epidemiology of venous thromboembolism. J Gen Intern Med 21, 722-727 (2006).
4. T. Baglin et al., Clinical guidelines for testing for heritable thrombophilia. British journal of haematology 149, 209-220 (2010).
5. A. N. Nicolaides et al., Prevention and treatment of venous thromboembolism–International Consensus Statement. International angiology : a journal of the International Union of Angiology 32, 111-260 (2013).
6. J. Mateo, A. Oliver, M. Borrell, N. Sala, J. Fontcuberta, Laboratory evaluation and clinical characteristics of 2,132 consecutive unselected patients with venous thromboembolism–results of the Spanish Multicentric Study on Thrombophilia (EMET-Study). Thrombosis and haemostasis 77, 444-451 (1997).
7. V. Pengo et al., Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome. Blood 132, 1365-1371 (2018).
8. M. D. Creinin, R. Lisman, R. C. Strickler, Screening for factor V Leiden mutation before prescribing combination oral contraceptives. Fertil Steril 72, 646-651 (1999).
9. W. M. Lijfering, F. R. Rosendaal, S. C. Cannegieter, Risk factors for venous thrombosis – current understanding from an epidemiological point of view. British journal of haematology 149, 824-833 (2010).
10. S. Z. Goldhaber, Risk factors for venous thromboembolism. Journal of the American College of Cardiology 56, 1-7 (2010).
11. V. De Stefano et al., The Risk of Recurrent Deep Venous Thrombosis among Heterozygous Carriers of Both Factor V Leiden and the G20210A Prothrombin Mutation. New England Journal of Medicine 341, 801-806 (1999).
12. W. K. Ho, G. J. Hankey, D. J. Quinlan, J. W. Eikelboom, Risk of recurrent venous thromboembolism in patients with common thrombophilia: a systematic review. Archives of internal medicine 166, 729-736 (2006).
13. J. B. Segal et al., Predictive value of factor V Leiden and prothrombin G20210A in adults with venous thromboembolism and in family members of those with a mutation: a systematic review. JAMA : the journal of the American Medical Association 301, 2472-2485 (2009).
der informierte @rzt
- Vol. 9
- Ausgabe 7
- Juli 2019