- Fetale Arrhythmien
Fetale Arrhythmien treten in 1-2% aller Schwangerschaften auf und machen 10-20% aller Zuweisungen zur fetalen Echokardiographie aus (1). Die meisten sind benigne und passager, es können sich aber auch aus primär benignen Rhythmusstörungen therapiebedürftige Arrhythmien entwickeln. Deshalb sollten alle fetalen Rhythmusstörungen mittels fetaler Echokardiographie abgeklärt werden.
Les arythmies du coeur foetal se rencontrent dans 1-2% des grossesses et sont la raison pour 10-20% des consultations en échocardiographie foetale (1). La plupart sont bénignes et passagères. Néanmoins, des arythmies nécessitant un traitement peuvent parfois se développer à partir d’arythmies initialement bénignes. Pour cette raison, toutes les arythmies du coeur foetal devraient être investiguées par échocardiographie foetale.
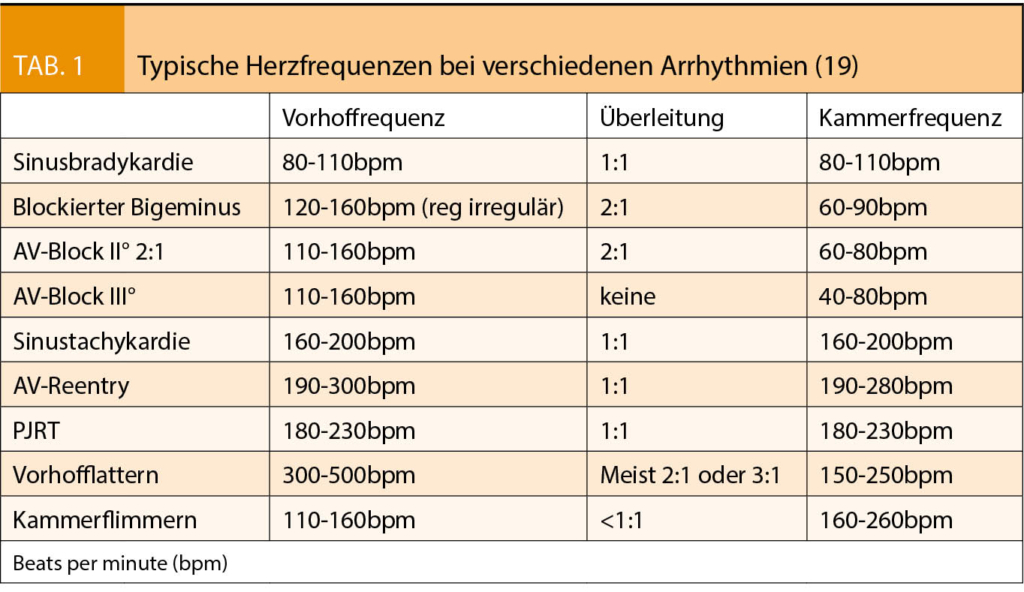
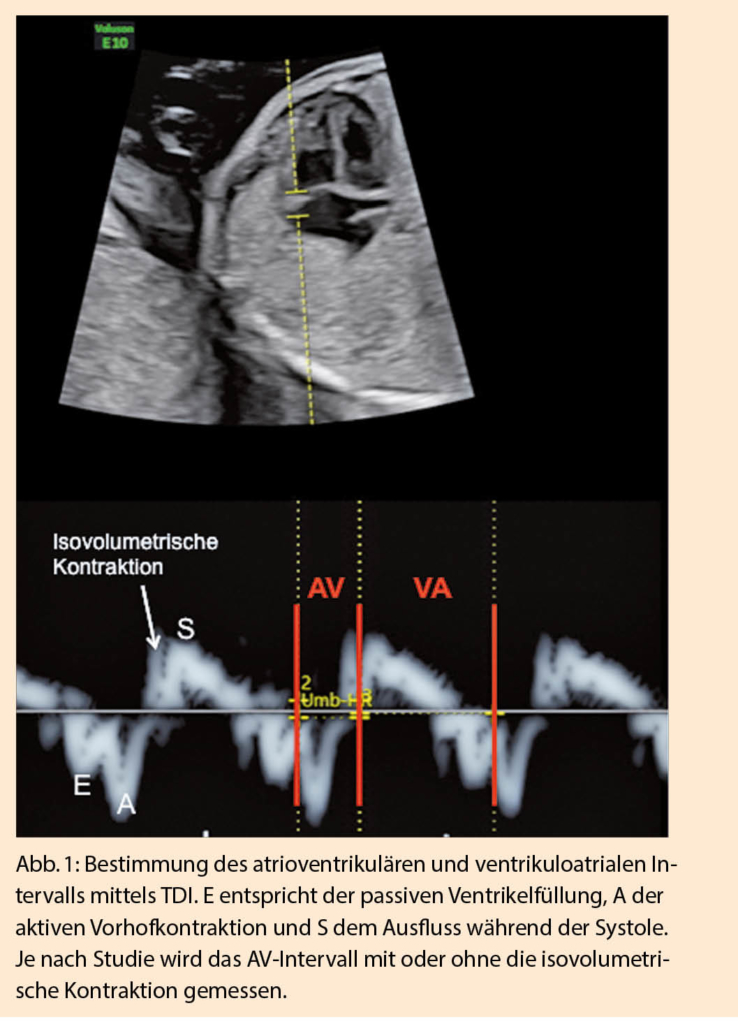
Bei fetalen Rhythmusstörungen unterscheidet man grundsätzlich zwischen Extrasystolen, Bradyarrhythmien und Tachyarrhythmien. Fetale Elektrokardiogramm (EKG)-Untersuchungen sind technisch schwierig durchzuführen und werden nur von wenigen Zentren angeboten. In der Beurteilung fetaler Rhythmusstörungen haben sich deshalb heute vor allem verschiedene Doppleruntersuchungen etabliert. M-Mode und Gewebedoppler (tissue Doppler imaging TDI) ermöglichen die Beurteilung von Vorhof- und Ventrikel-Wandbewegungen in zeitlicher Abhängigkeit (2); dies erlaubt die Messung des mechanischen atrioventrikulären Zeit-Intervalls, welches dem elektrischen PR-Intervall im EKG entspricht (Abb. 1) (3). Die simultane Aufzeichnung von Flussmustern in nahe beieinander liegenden Arterien-Venen Paaren mittels gepulstem Doppler bedient sich desselben Konzepts (3-6). Meist werden die Vena cava superior (VCS) und die aszendierende Aorta für diese Messung zugezogen, man kann aber auch die linke Vena brachiocephalica mit dem Aortenbogen oder die Arterie und Vena renalis kombinieren (7). Auch der Einfluss- und Ausflusstrakt im linken Ventrikel (LV in-out) kann zugezogen werden bei der gepulsten Dopplermessung (Abb. 2). Allen diesen Methoden ist eigen, dass die gemessenen AV-Überleitungszeiten in Relation stehen zur PR-Zeit, dieser jedoch nicht genau entsprechen. Dies konnte auch in postnatal durchgeführten Studien bestätigt werden, in denen eine simultane Aufzeichnung des EKGs möglich ist (8). Entsprechend ist es wichtig, sich je nach Wahl der Methode in der Interpretation an die entsprechenden Normwerte zu halten (9).
Extrasystolen
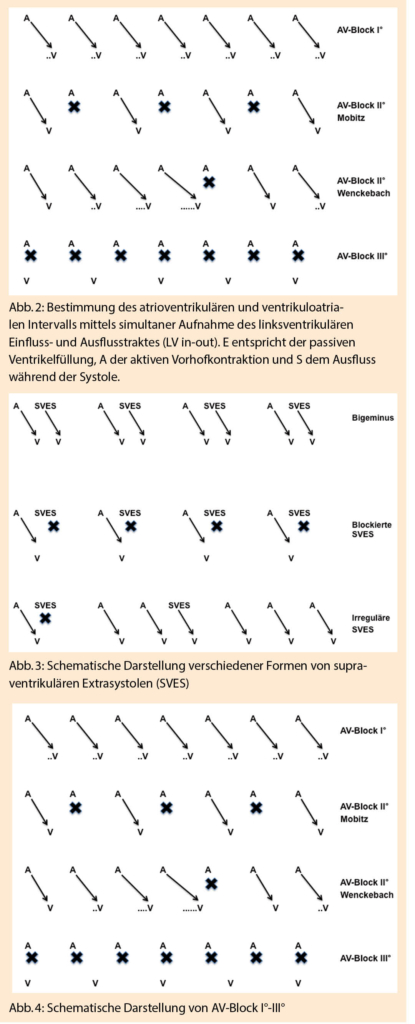
Supraventrikuläre Extrasystolen (SVES) machen 90-95% der fetalen Arrhythmien aus, ventrikuläre Extrasystolen (VES) sind dagegen extrem selten (7, 10). Knapp 2% aller Kinder zwischen 36 und 41 Schwangerschaftswochen haben SVES, dies entspricht auch der Inzidenz von SVES bei Neugeborenen (11). Treten SVES gehäuft und in regelmässigem Abstand zu den normalen Impulsen auf, spricht man von Bigeminus, wenn jeder 2. Schlag von einer SVES gefolgt wird, oder einem Trigeminus bei einem Verhältnis 3:1 (7). SVES werden vom AV-Knoten nur nach der Refraktärzeit in den Ventrikeln übergeleitet; kommt der Impuls zu früh, wird die Überleitung blockiert, dies kann bei einem Bigeminus mit blockierten SVES zu einer Bradykardie führen (Abb. 3). SVES werden gut toleriert und sind nicht behandlungsbedürftig, eine Therapie wäre wegen den pro-arrhythmogenen Eigenschaften der meisten Arrhythmika sogar kontraindiziert. Selten (1-2%) können SVES eine Re-Entry Tachykardie triggern (10). Diese ist im Gegensatz zu SVES behandlungsbedürftig. Entsprechend sollte nach echokardio-graphischer Diagnose von SVES, vor allem im Bi- oder Trigemius, wöchentlich die fetale Herzfrequenz kontrolliert werden, um eine Tachyarrhythmie auszuschliessen. Dazu reicht auch das alleinige Auskultieren der fetalen Herzfrequenz. Übergeleitete SVES muss man von VES unterscheiden, bei denen ein regulärer Vorhofrhythmus besteht. Die Schwierigkeit liegt darin, blockierte SVES von einem atrioventrikulären Block (AV-Block) II° oder III° zu unterscheiden (s.u.) (7).
Bradyarrhythmien
Unter einem bradykarden Herzrhythmus versteht man eine fetale Herzfrequenz von <110bpm (beats per minute). Viele Kardiologen betrachten auch einen fetalen Herzrhythmus von 110-120bpm als Bradykardie, da diese Herzfrequenz unterhalb der 3. Perzentile liegt und sich dahinter auch ein long QT-Syndrom verbergen kann (12). Ursachen fetaler Bradykardie sind Sinus-Bradykardie, AV-Block II° und III° sowie blockierte SVES.
Eine Sinusbradykardie kann im ersten und zweiten Trimenon physiologischerweise auftreten und bis mehrere Minuten anhalten (13). Im Gegensatz zu Sinusbradykardien bei Hypoxie sind dabei die fetalen Bewegungsmuster meist normal. Es besteht eine 1:1-Überleitung zwischen Vorhof und Ventrikel. Im dritten Trimenon werden anhaltende Sinusbradykardien selten gesehen, sie treten auf im Rahmen von Hydrops oder schweren Herzfehlern oder bei Erkrankungen des Sinusknotens (sick sinus).
AV-Blocks werden in 3 Grade eingeteilt. Der Vorhofrhythmus ist unverändert, die Überleitung in die Ventrikel ist unterschiedlich blockiert. Beim AV-Block I° ist das AV-Intervall verlängert, die Überleitung ist 1:1. Die AV-Überleitung wird physiologischerweise länger bei zunehmendem Gestationsalter. In der Diagnostik eines AV-Blocks I° ist die jeweilig angewandte Messmethode relevant. Die PRIDE-Studie hat eine AV-Zeit von > 150ms als AV-Block I° diagnostiziert. Dabei ist zu beachten, dass mittels LV in-out dies zu jedem GA über der 95. Perzentile liegt, jedoch nicht wenn man die AV-Zeit mittels TDI untersucht (9, 14). Es existieren zwei Formen von AV-Blocks II°: Beim Typ nach Wenckebach nimmt die AV-Zeit von Schlag zu Schlag zu, bis schliesslich eine Überleitung ausfällt, beim Typ nach Mobitz besteht eine regelmässige 2:1- oder 3:1-Überleitung (15). Der Ventrikelrhythmus ist unregelmässig und muss von blockierten SVES unterschieden werden. Beim AV-Block III° ist die Überleitung komplett blockiert, die Vorhöfe und Ventrikel kontrahieren unabhängig voneinander (Abb. 4) (15). Der Eigenrhythmus des Ventrikels liegt bei 40-60 Schlägen pro Minute. Fetale AV-Blocks III° treten entweder im Rahmen von maternalen Anti-SSA oder Anti-SSB Antikörpern (Ak) auf, wie sie meist beim Sjögrensyndrom oder bei einem SLE gefunden werden, oder aber bei kongenitalen Herzfehlern, typischerweise bei einem linken Isomerismus, seltener bei einer korrigierten Transposition. Auch wenn bei der Mutter keine rheumatischen Vorerkrankungen bekannt sind, muss nach SSA/SSB-Ak gesucht werden bei einem höhergradigen AV-Block. Die Antikörper schädigen das Reizleitungssystem und führen auch zu einer fetalen Myokarditis und Endokardfibroelastose. Bei bekannten Anti-SSA/SSB-Ak beträgt das Risiko 1-2%, erhöht sich aber in einer konsekutiven Schwangerschaft auf bis 16% (15, 16). Serielle Messungen der AV-Überleitungszeit bei bekanntem Ak-Status der Mutter haben zum Ziel, beim Auftreten eines AV-Blocks I° mittels Dexamethason-Therapie eine Verschlechterung zu einem AV-Block III° zu verhindern. Dies wird immer noch als kontrovers betrachtet, da einerseits höhergradige AV-Blocks auch ohne vorgängige Verlängerung der AV-Überleitung auftreten können und andererseits die Therapie nicht in allen Studien Erfolge zeigt (17, 18). Fällt die fetale Herzfrequenz unter 50bpm, steigt das Risiko eines Hydrops. In einem solchen Fall ist eine Therapie mit Beta-Agonisten zur Erhöhung der fetalen Herzfrequenz indiziert.
Werden sie im Bigeminus blockiert, können SVES auch zu einer Herzfrequenz von 60-80bpm führen. Im Unterschied zum AV-Block III° besteht aber immer ein Zusammenhang zum Vorhofrhythmus (Tab. 1) (Abb. 3, 4).
Tachyarrhythmien
Unter einer fetalen Tachykardie versteht man eine anhaltende fetale Herzfrequenz von >160-180bpm. Sie tritt in ungefähr 1:4’000 Schwangerschaften auf. Man unterscheidet Sinustachykardien von supraventrikulären (SVT), ventrikulären (VT) Tachykardien und von Vorhofflattern (atrial flutter AF). SVTs sind ursächlich für ca. 70% der Tachyarrhythmien verantwortlich, die übrigen 30% werden durch Vorhofflattern verursacht, VT und Sinustachykardien sind selten (7, 15). Bei der Sinustachykardie und bei der SVT besteht eine 1:1-Überleitung, beim Vorhofflattern liegt die Vorhoffrequenz bei 350-500/Min. und die Überleitung ist meist bei 2:1, so dass die Ventrikelfrequenz bei 200-250 liegt. Bei der VT sind die Vorhof- und Ventrikelkontraktion dissoziiert (Tab. 1) (15).
Sinustachykardien treten nach 34 SSW bei starken fetalen Bewegungen, bei Betamimetikagabe, Infektionen oder auch selten bei fetaler Thyreotoxikose auf (15).
Die Ursachen von SVTs sind einerseits die Re-Entry Tachykardie (AV reentry tachycardia AVRT), bei der via AV-Knoten die Reizleitung antegrad fortgeleitet wird und via rasches akzessorisches Reizbündel retrograd zurück, andererseits die PJRT (permanent junctional reciprocating tachycardia) mit langsamem retrogradem Bündel und ektope atriale Reizzentren (AET). Sonographisch unterscheiden sich die AVRT von den andern Formen durch ein VA-Intervall, welches kürzer ist als das AV-Intervall (short VA tachycardia); bei den PJRT und den AET ist das Verhältnis VA:AV-Intervall > 1 (long VA tachycardia) (19). Diese Unterscheidung ist prognostisch und pathophysiologisch von Interesse, hat aber therapeutisch keine Konsequenzen.
Ein Vorhofflattern kann frühestens in der 27. bis 30. Schwangerschaftswoche diagnostiziert werden. Pathophysiologisch kommt es zu einem Macro-Reentry im Vorhof. Dazu bedarf es einer gewissen Vorhofgrösse, die üblicherweise erst im 3. Trimenon erreicht wird (20).
Bei anhaltender Tachykardie von > 210-220bpm kommt es zu einer fetalen Herzinsuffizienz, wahrscheinlich infolge der kritischen Verkürzung der Diastole, und es entwickelt sich innerhalb von Stunden bis Tagen ein fetaler Hydrops (21). Entsprechend gilt es, die fetale Herzfrequenz medikamentös zu therapieren via maternale Gabe von Antiarryhthmika. Dies bedarf einer vorgängigen Abklärung der Mutter (EKG, Elektrolytstatus, Ausschluss einer vorbestehenden maternalen Kardiopathie), da alle Antiarrhythmika auch pro-arrhythmogene Eigenschaften haben. Der Therapiebeginn sollte stationär erfolgen und nur durch Spezialisten verordnet werden. Einige Medikamente benötigen zudem regelmässige Serum-Spiegelkontrollen (21).
Die optimale Medikation für die verschiedenen Formen supraventrikulärer Tachyarryhtmien (SVA) ist weiterhin unklar, bei SVTs liegt die erste Wahl bei Digoxin oder Flecainid, beim Vorhofflattern eher bei Digoxin oder Sotalol. Amiodarone hat eine sehr lange Halbwertszeit und eignet sich deshalb bei Versagen von andern transplazentären Therapien u.a. auch zur direkten fetalen Therapie. Bei bereits vorliegendem Hydrops bedarf es meist eine 2er-Therapie. Eine vor zwei Jahren initiierte internationale Mutizenterstudie (Fetal atrial flutter and supraventricular tachycardia therapy trial FAST) eruiert zur Zeit die optimale Therapieform für die verschiedenen Formen von SVAs (22).
Chefärztin für Geburtshilfe und Pränatalmedizin
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
Die Autorin hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag.
- Fetale Herzrhythmusstörungen sind relativ häufig und meist benigne.
- Trotzdem sollte immer eine echokardiographische Abklärung erfolgen.
- Eine Abklärung sollte erfolgen, da Rhythmusstörungen einerseits gehäuft bei kongenitalen Herzfehlern auftreten und andererseits pathogene Rhythmusstörungen therapiebedürftig sind.
Messages à retenir
- Les arythmies du coeur foetal sont relativement fréquentes et pour la plupart bénignes.
- Toutefois, une investigation par échocardiographie foetale devrait toujours se faire.
- Les investigations se justifient, car d’une part les anomalies du rythme s’accompagnent fréquemment d’une malformation cardiaque et d’autre part, des anomalies du rythme pathogènes nécessitent un traitement adéquat.
1. Hornberger LK, Sahn DJ. Rhythm abnormalities of the fetus. Heart 2007;93:1294-1300.
2. Fouron JC, Proulx F, Miro J et al. Doppler and M-mode ultrasonography to time fetal atrial and ventricular contractions. Obstet Gynecol 2000;96:732-6.
3. Glickstein J, Buyon J, Kim M et al. The fetal Doppler mechanical PR interval: a validation study. Fetal Diagn Ther 2004;19:31-4.
4. Pasquini L, Seale AN, Belmar C et al. PR interval: a comparison of electrical and mechanical methods in the fetus. Early Hum Dev 2007:83:231-7.
5. Carvalho JE, Prefumo F, Ciardelli V et al. Evaluation of fetal arrhythmias from simultaneous pulsed wave Doppler in pulmonary artery and vein Heart 2007;93:1448-53.
6. Andelfinger G, Fouron JC, Sonesson SE et al. Reference values fro time intervals between atrial and ventricular contractions of the fetal heart measured by two Doppler techniques. Am J Cardiol 2001;88:1433-6.
7. Berg C, Gottschalk I, Geipel A, Gembruch U. Diagnosis and therapy of fetal arrhythmias 1 – Methods of rhythm diagnosis, extrasystole and bradyarrhythmias.. Ultrasound Obstet Gynecol 2013;114-27.
8. Bergman G, Jacobsson LA, Wahren-Herlenius M, Sonesson SE. Doppler echocardiographic and electrocardiographic atrioventricular time intervals in newborn infants: evaluation of techniques for surveillance of foetuses at risk for congenital heart block. Ultrasound Obstet Gynecol 2006; 28:57-62.
9. Mosimann B, Arampatzis G, Amylidi-Mohr S, Bessire A, Spinelli M, Koumoutsakos P, Surbek D, Raio L. Reference ranges for fetal atrioventricular and ventriculoatrial time intervals and their ratios during normal pregnancy. Fetal Diagn Ther 2018; 44:228-35.
10. Fouron JC. Fetal arrhythmias: the Saint-Justine hospital al experience. Prenat Diagn 2004; 24: 1068 – 1080
11. Southall DP, Richards J, Hardwick RA, Shinebourne EA, Gibbens GKG, Thelwall-Jones H, De Swiet M, Johnston PGB. Prospective study of fetal heart rate and rhythm patterns. Arch Dis Child 1980; 55: 506 – 511.
12. Mitchell JL, Cuneo BF, Etheridge SP, Horigmoe H, Weng HY, Benson DW. Fetal heart rate predictors of long QT syndrome. Circulation 2012; 126:2688e95.
13. Api O, Carvalho JS. Fetal dysrhythmias. Best Pract Res Clin Obstet Gynaecol 2008; 22:31-48.
14. Nii M, Hamilton RM, Fenwick L, et al. Assessment of fetal atrioventricular time in- tervals by tissue Doppler and pulse Doppler echocardiography: normal values and correlation with fetal electrocardiography. Heart 2006;92(12):1831–7.
15. Carvalho JS. Fetal dysrhythmias. Best Pract Res Clin Obstet Gynaecol 2019; epub ahead of print.
16. Friedman DM, Kim MY, Copel JA, Davis C, Phoon CK, Glickstein JS, Buyon JP. Utility of cardiac monitoring in fetuses at risk for congenital heart block. The PR interval and dexamethason evaluation (PRIDE) prostpective study. Circulation 2008;117:485-93.
17. Cuneo BF, Ambrose SE, Tworetzky W. Detection and successful treatment of emergent anti-SSA-mediated fetal atrioventricular block. AJOG 2016; 215:527e8.
18. Mevorach D, Elchalal U, Rein AJ. Prevention of complete heart block in children of mothers with anti-SSA/Ro and anti-SSB/La autoantibodies: detection and treatment of first-degree atrioventricular block. Cur Opin Rheumatol 2009; 21:478-82.
19. Jaeggi E, Öhman A. Fetal and neonatal arrhythmias. Clin Perinatol 2016;43:99-112.
20. Jaeggi E, Fouron JC, Drblik SP. Fetal atrial flutter: diagnosis, clinical features, treatment, and outcome. J Pediatr 1998; 132:335-9.
21. Jaeggi ET, Carvalho JS, De Groot E, Api O, Clur SA, Rammeloo L, McCrindle BW, Ryan G, Manlhiot C, Blom NA. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicentre study. Circulation 2011; 124:1747-54.
22. https://clinicaltrials.gov/ct2/show/NCT02624765
info@gynäkologie
- Vol. 9
- Ausgabe 4
- August 2019