- Abcès et fistules anales
Les abcès et les fistules ano-rectales entrent dans le groupe des pathologies proctologiques fréquemment rencontrées. Leur incidence est de 2 cas sur 10 000 habitants. Elles doivent être connues du praticien qui est en mesure d’en faire le diagnostic et d’initier la prise en charge sans délais. Cet article aborde le traitement des abcès anaux et des fistules ano-rectales.
Pour la petite histoire
Le roi-soleil Louis XIV souffrait de crises récidivantes de maladie fistuleuse ano-rectale. Les médecins du Roy, à leur tête Antoine Daquin, impuissants à le traiter firent appel au barbier Charles François Félix. Ils étudièrent et planifièrent une section directe de la fistule à l’ aide d’ un fistulotome inspiré de méthodes italiennes. Après une période d’ essais « cliniques» auprès de condamnés de la Bastille et de volontaires, l’ intervention de la fistule royale eut lieu le 18 novembre 1696 et le roi soleil fut débarrassé définitivement de sa maladie fistuleuse. En guise de récompense, outre de riches présents octroyés par Louis XIV, Louis XV son petit fils créa « la royale académie chirurgicale» et donna ainsi ses lettres de noblesse à la confrérie des barbiers, tant décriés par les Médecins du Roy. Pour rendre grâce à cette guérison Lulli composa un hymne « Grand Dieu sauve le Roy » qui fut repris 28 ans plus tard par Haendel et devint le God save the King (Queen) hymne national Anglais actuel.
La fréquence des abcès anaux et des fistules est élevée. Ils surviennent de préférence chez l’ homme jeune. Ces pathologies trouvent leur origine au niveau des glandes anales situées dans l’ espace inter-sphinctérien. Leur classification dépend de leur localisation par rapport aux sphincters de l’ anus. L’ histoire de la maladie et l’ examen clinique du patient suffisent en général à poser le diagnostic et élaborer le traitement chirurgical. Des investigations complémentaires (endoscopie, endosonographie, résonance magnétique) sont utiles en cas d’ abcès ou de fistules complexes. Le but de la chirurgie lors d’ abcès est de drainer l’ infection tout en préservant l’ intégrité anatomique des sphincters. Le risque de récidive de l’ abcès ou son évolution vers une fistule est limité. Il peut résulter d’ un drainage insuffisant. Le traitement de la fistule dans le même temps du drainage de l’ abcès est réservé aux fistules superficielles qui n’ interférent pas avec le sphincter. Il doit être réalisé par un chirurgien expérimenté. Tous les autres types de fistules doivent être traités en un second temps. Le traitement de la fistule est chirurgical il peut être réalisé, en fonction du type de la fistule par les techniques suivantes :
- Drainage par fil de séton, fistulotomie, fistulectomie
- Plastie et reconstruction du sphincter (sphinctéroplastie, lambeau muqueux, LIFT), techniques endo luminales (VAAFT)
- Techniques d’ occlusion (fibrine, plug, clip, laser…).
Seules les fistules dont le trajet est distal peuvent être traitées par fistulotomie ou fistulectomie. Toutes les fistules hautes doivent bénéficier d’ une technique protégeant le sphincter et par la même la continence du patient. Les résultats des différentes techniques de reconstruction et de plastie du sphincter sont superposables. Les techniques d’ occlusions sont grevées d’ un taux de récidive plus élevé. Notre propos s’ attachera à donner les clés du diagnostic et du traitement des abcès et des fistules basé sur notre expérience et la revue de la littérature.
Les abcès ano-rectaux et les fistules anales sont parmi les pathologies les plus fréquemment rencontrées en pratique proctologique. Leur incidence est de 2 cas par 10 000 habitants. Elles doivent être connues du praticien qui est parfaitement à même d’ en initier le traitement (1).
L’ abcès ano-rectal et la fistule anale sont deux entités mentionnées souvent séparément. Elles représentent en fait les phases successives d’ une même pathologie, la maladie fistuleuse ano-rectale (2).
Etiologie
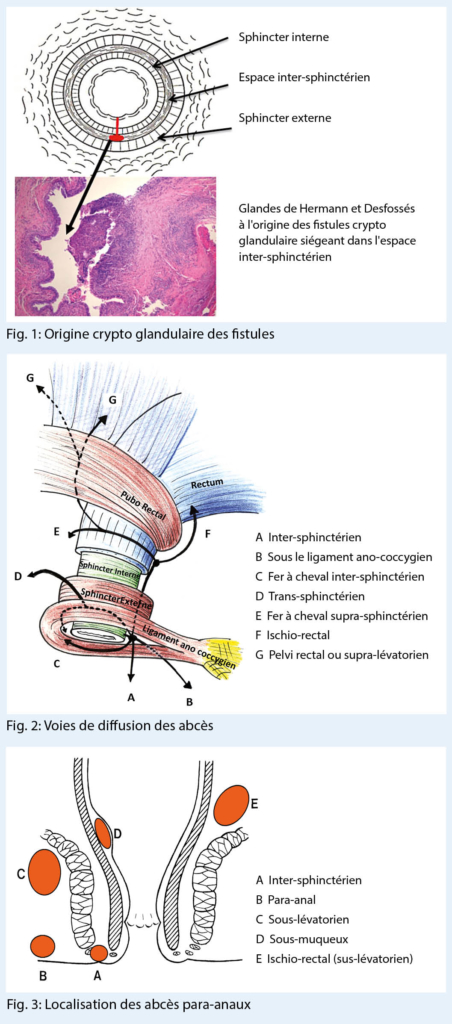
La majorité des abcès et des fistules anales (90 %) sont d’ origine crypto-glandulaire. La maladie débute dans une des glandes lubrificatrices d’ Hermann et Desfossés situées dans l’ espace inter-sphinctérien de l’ appareil sphinctérien, suite à la diminution ou l’ abolition du drainage glandulaire (Fig. 1) (3).
L’ infection glandulaire évolue rapidement en abcès à germes intestinaux et se draine dans les espaces périanaux et périnéaux de moindre résistance. Comme l’ homme a plus de glandes lubrificatrices que la femme la maladie fistulaire est plus fréquente chez l’ homme entre 30 et 50 ans dans un ratio 2/3 – 1/3 (1, 4).
Certains facteurs favorisants la venue de ces abcès ont été décrits comme le diabète, l’ obésité, l’ alcoolisme et le tabagisme (5, 6). De même la station assise prolongée, le sédentarisme, les poussées lors de la défécation et le stress psychosocial sont considérés comme facteur de risques par certains auteurs (7, 8).
Cette phase aiguë de la maladie fistuleuse crypto-glandulaire doit être différenciée d’ un abcès compliquant une maladie sous-jacente. Parmi ces abcédations dites secondaires, il faut mentionner les abcès liés à une fissure, à une hidrosadénite suppurée (maladie des glandes apocrines), à l’ infection d’ une glande sébacée, à un sinus pilonidal proche de l’ anus ou à une infection sexuellement transmise ano-rectale. En présence de récidive ou de trajets fistuleux multiples, la question d’ une maladie de Crohn sous-jacente doit être posée et la maladie inflammatoire recherchée. Finalement, les abcès compliquent fréquemment les plaies traumatiques ano-rectales (lésion sur corps étranger, plaie pénétrante, lésion iatrogène chirurgicale, obstétricale ou endoscopique) et peuvent être difficiles à relier à leur cause, en particulier si celles-ci sont ignorées ou occultées volontairement par le patient à son médecin (Tab. 1).
Voies de dissémination
L’ extension et les voies de drainage spontané des abcès de la région ano-rectale sont régies par les lois des pressions. Aux structures fermes s’ opposent des zones de moindre résistance, créant ainsi des voies de facilitation de la dissémination de l’ infection. Pour mieux le comprendre, l’ image d’ un labyrinthe peut être empruntée. Les cloisons sont le muscle sphincter interne, le muscle sphincter externe, le raphé ano-coccygien et le muscle releveur de l’ anus.
L’ abcès situé à l’ origine dans l’ espace inter-sphinctérien est guidé par les structures à haute résistance et peut diffuser soit distalement dans la région para-anale, soit proximalement dans l’ espace pelvi-rectal, au-dessus des muscles élévateurs de l’ anus, soit à travers le muscle sphinctérien externe en direction de la fosse ischio-rectale ou plus superficiellement vers le périnée (Fig. 2.)
L’ abcès tout d’ abord inter-sphinctérien évolue ainsi respectivement en abcès para-anal, pelvi-rectal, ischio-rectal ou périnéal (Fig. 3).
L’ abcès en fer à cheval se développe postérieurement au-dessus du raphé ano-coccygien. Il diffuse bilatéralement en direction des deux fosses ischio-rectales (9). Les abcès para-anaux et périnéaux représentent environ 50 % des cas, les abcès ischio-rectaux 25 %.
Tableau clinique des abcès ano-rectaux
Les symptômes cardinaux classiques des abcès ano-rectaux sont les mêmes que ceux de toute pathologie infectieuse abcédée. Ils associent douleur, rougeur, tuméfaction et chaleur. Les douleurs sont intenses et pulsatiles, stimulées par la position assise, la marche ou la défécation. Lorsque la collection est périnéale ou péri-anale, une induration palpable de la fesse apparaît. Un certain degré de cellulite d’ accompagnement peut exister. La prise en charge de ces abcès est une urgence chirurgicale.
La fièvre, parfois associée à des frissons est souvent retrouvée et ceci d’ autant plus que la lésion est haut située et donc de diagnostic plus difficile. L’ examen clinique et l’ anuscopie ne permettent d’ identifier l’ orifice interne primaire que dans 30 à 40 % des cas (2).
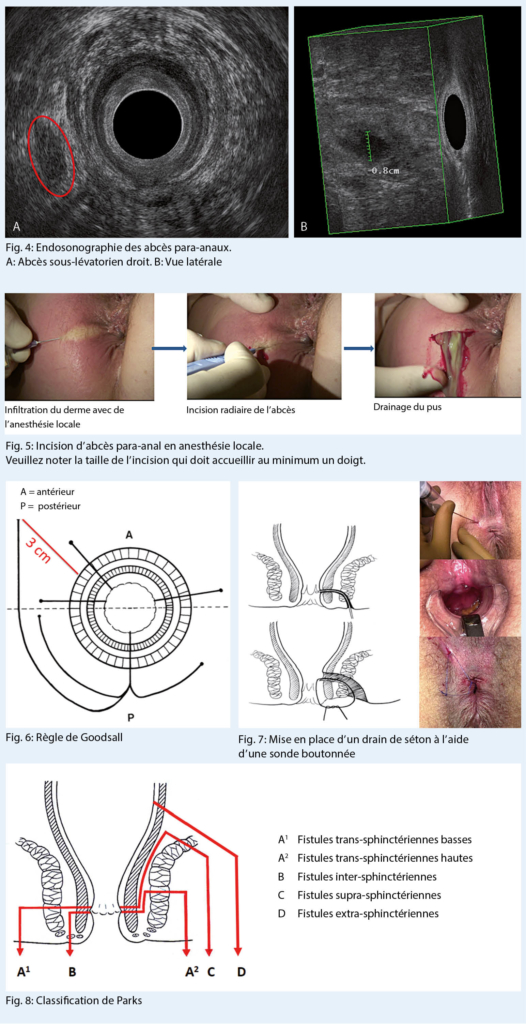
L’ abcès inter-sphinctérien reste un défi diagnostique du fait de l’ absence de signes cliniques extérieurs associé à des douleurs aiguës rendant tout examen anuscopique impossible. Celui-ci peut être réalisé sous anesthésie générale et laissera palper une petite voussure de la taille d’ un grain de riz dans l’ espace inter-sphinctérien. L’ échographie endoanale est une aide diagnostique appréciable dans ces situations, elle permet également de diriger l’ incision de drainage (Fig. 4) (10).
Si l’ abcédation n’ est pas prise en charge rapidement, le tableau clinique peut se compliquer et évoluer vers un sepsis sévère, dont il faut se rappeler l’ importante mortalité chez les patients fragiles (11). Une cellulo-fascéite anaérobie du périnée ou des bourses, nommée alors gangrène de Fournier (12, 13) représente un autre mode de complication septique gravissime, qui nécessitera un débridement agressif en extrême urgence avec parfois nécessité à confectionner une colostomie de décharge temporaire (14). Le spectre de telles complications nous rappelle la nécessité de traiter adéquatement et dans l’ urgence non différée tout abcès de la région ano-rectale.
Traitement de la maladie fistuleuse abcédée
Les abcès de la région périnéale et ano-rectale évoluent lentement et difficilement vers un drainage spontané à l’ issue d’ un trajet plus ou moins complexe. En règle générale, ils ne peuvent pas se résoudre d’ eux-mêmes spontanément. La base du traitement est le drainage chirurgical dirigé de la cavité abcédée. La recherche du trajet fistuleux d’ amont ne doit se faire que dans la deuxième phase lors du traitement de la fistule ano-rectale.
Une antibiothérapie seule est insuffisante à la guérison de l’ abcès, toujours présent dans la maladie fistulaire. Elle tend à chroniciser l’ infection et de ce fait à rendre plus complexe le drainage chirurgical (15).
Principe du drainage de l’ abcès
L’ incision est menée assez largement pour assurer un bon drainage et éviter une rétention du pus dans la poche abcédée (principe du sablier). Ceci aboutirait à un retard de la guérison, une fermeture précoce de la plaie opératoire, une persistance de l’ abcès. Elle est radiaire dans tous les cas. La recherche de tractus fistuleux et de l’ orifice primaire doit être évitée à la phase aiguë en raison du risque de fausses routes, dues à la déliquescence des tissus. Même l’ effondrement des cloisons et le curetage ne sont pas recommandés. Un lavage au sérum physiologique à la seringue est amplement suffisant. Une mèche à but hémostatique sera mise en place pour les premières 12 à 24 heures. Le traitement des abcès ano-rectaux a la particularité de pouvoir être pratiqué en anesthésie locale, sans couverture antibiotique et sans mise en culture du pus.
Nous avons l’ habitude d’ inciser les abcès para-anaux et périnéaux, qui sont les plus fréquents, en anesthésie locale et selon un mode ambulatoire. Une infiltration douce du derme qui contient les terminaisons nerveuses, par un anesthésique local tamponné par du bicarbonate (lidocaïne 0.5 % 10ml plus NaBic 0.8 mmol 1ml) en regard de l’ abcès et une incision radiaire sans pression assurent une antalgie suffisante (Fig. 5).
L’ incision d’ un abcès intersphinctérien sera menée avec prudence et avec le plus grand respect des sphincters. Les abcès sus-lévatoriens, ischio-rectaux haut placés et les abcès en fer à cheval requièrent une anesthésie générale ou péridurale.
L’ utilisation systématique d’ an-tibiotiques n’ est pas recommandée, puisqu’ il ne s’ agit pas d’ un traitement causal, celui-ci reposant sur le vieil adage « ubi pus ibi evacua». L’ introduction d’ un traitement antibactérien doit être discutée cependant, dans les contextes de patients fragilisés, immuno supprimés ou porteurs de valve cardiaque. Les germes habituellement retrouvés en culture sont des souches intestinales classiques. La mise en culture du pus n’ est donc pas utile de routine, elle sera impérative et dirigée lors de suspicion d’ infections sexuellement transmissible.
Les soins locaux
Ils doivent être facilités. La mèche est retirée par le malade lui-même le lendemain de l’ intervention et un rinçage de la plaie opératoire par douche anale pluriquotidienne est prescrit. Des antalgiques à base de paracétamol et d’ anti-inflammatoires à dose dégressive sont prescrits. La plaie est contrôlée à 24-48 heures puis de manière hebdomadaire.
Le bilan intermédiaire
4 à 6 semaines après l’ incision et après guérison de la maladie abcédée, à distance de la phase aiguë sensible, il est important de faire un bilan de la maladie fistuleuse résiduelle. Dans 25 % des cas environ, on constate la fermeture de l’ orifice secondaire, la disparition de la fistule et l’ absence d’ orifice primaire résiduel (16, 17). Dans les autres cas, l’ examen anal et rectal soigneux retrouvent l’ orifice glandulaire primaire, sous la forme d’ une caroncule palpable, de la taille d’ un grain de riz. L’ anuscopie en permettra souvent le repérage visuel. Il est important d’ exclure à ce stade toute autre pathologie du canal anal, en particulier un cancer ano-rectal abcédé.
Tableau clinique des fistules ano-rectales constituées
Les plaintes principales du patient porteur d’ une fistule anale constituée sont des écoulements para-anaux ou mal localisés du siège, salissant régulièrement les sous-vêtements. Un prurit d’ irritation péri-anal est parfois associé. Les écoulements sont classiquement intermittents. Ils sont rythmés par la séquence : occlusion du tractus fistulaire – micro-abcédation douloureuse – libération purulente à l’ orifice secondaire – écoulements et disparition des douleurs. Les problèmes d’ hygiène peuvent devenir handicapants, en particulier lorsque les orifices secondaires se multiplient au cours d’ une maladie fistulaire non traitée ou d’ une maladie de Crohn.
En cas de trajet fistuleux persistant, et à la seule inspection, la règle de Goodsall garde toute sa valeur dans la prédiction de la localisation de l’ orifice primaire situé à la ligne pectinée en fonction de l’ endroit de drainage cutané secondaire. Les tractus fistuleux drainés antérieurement sont plutôt linéaires, tandis que les trajets postérieurs sont curvilignes. Un trajet antérieur à plus de 3 cm de la marge anale peut trouver son origine dans la portion postérieure du canal anal (Fig. 6).
La palpation retrouve souvent un cordon fistuleux entre pouce et index. L’ anuscopie recherche l’ orifice primaire sous forme d’ une ombilication muqueuse ou de la présence de tissu de granulation.
Toute fistule constituée fera l’ objet d’ une tentative de mise en place d’ un drainage de séton constitué d’ un double monofilament de 4.0 ou 5.0.
Une aiguille boutonnée sera conduite dans le canal anal depuis l’ orifice secondaire avec précaution et sans pression afin d’ éviter toute fausse route.
Nous utilisons de l’ air pulsé à la seringue pour ouvrir le trajet et en repérer la perméabilité sous forme de bulles apparaissant à l’ orifice primaire. Les fils de séton lâches permettent un drainage prolongé et renforcent ainsi la fibrose péri-fistulaire. Ils peuvent être laissés en place de manière prolongée de plusieurs mois à plusieurs années, comme dans le cas particulier de la maladie de Crohn (Fig. 7).
Le repérage ultra-sonographique des trajets fistuleux aidé de l’ examen 3D, peut être utile dans le cas particulier des fistules complexes ou récidivantes (18, 19). Il peut éventuellement être associé à une IRM du petit bassin, à la recherche d’ une lésion pelvienne.
Dans des mains expertes, ces 2 examens ont une précision diagnostique comparable (20). Notre préférence va à l’ échographie endoanale 3D que nous considérons comme partie intégrante de l’ examen d’ une fistule avec pour avantage une réponse pendant la consultation et un coût inférieur.
L’ examen clinique aidé de l’ endosonographie 3D ou de l’ IRM permet de classifier les fistules. La classification la plus utile et la plus utilisée est celle de Parks (21) (Fig. 8).
Elle permet d’ associer le type de fistule à un choix de traitement chirurgical en fonction de la quantité de sphincter inclus dans le trajet. Pour l’ école genevoise, les trajets distaux peuvent être traités par l’ ablation de la fistule avec section du sphincter. Les trajets hauts doivent être traités par des techniques respectant le sphincter. Les fistules inter-sphinctériennes et trans-sphinctériennes distales re-
présentent entre 50 et 60 % des cas et les fistules trans-sphinc-tériennes hautes 25 %.
Traitement des fistules ano-rectales
Le but du traitement de la fistule ano-rectale est l’ excision du tractus fistuleux fibreux qui emporte la glande responsable de la fistule, des tractus fistuleux accessoires, la suppression de l’ orifice primaire, la préservation de la fonction anale par protection du capital sensitif et musculaire.
On peut considérer trois groupes de traitement chirurgicaux
Les chirurgies avec section du sphincter
Séton tracteur, séton chimique, Fistulotomie, Fistulectomie
Les chirurgies avec respect des sphincters avec ablation du trajet fistuleux
Fistulectomie et reconstruction du sphincter, Lambeau d’ avancement, LIFT technique
Nouvelles méthodes par occlusion du trajet fistuleux
Laser, VAAFT, OTSC clip, Colle de fibrine, Injection de collagène, Injection de cellules germinale autologues, plug.
Les récidives restent cependant nombreuses malgré le développement récent de nouvelles techniques chirurgicales. Les traitements les plus pratiqués dans notre clinique sont la fistulotomie, la fistulectomie, le lambeau d’ avancement et l’ encollage fistulaire en fonction du type de fistule rencontré.
Les traitements classiques
Séton tracteur ou chimique
Cette technique déjà connue de l’ antiquité et rapportée par Hippocrate (22) a pour but la section progressive du sphincter compris entre la fistule et la peau. Cette section est due soit à la pression du fil soit à une destruction chimique par les composants phytothérapiques du séton (Kshara Sutra).
Si on observe une guérison de la fistule dans 80 à 100 % des cas, le taux d’ incontinence anale rapportée varie de 0 à 92 % ce qui est largement inacceptable (23, 24). Pour cette raison évidente le traitement de fistule par section progressive est abandonnée dans notre service.
Fistulotomie
La fistulotomie consiste en la mise à plat et au curetage du « tunnel fistuleux». Cette technique est réservée aux trajets muco-cutanés ou très distaux qui ne touchent pas les fibres musculaires sphinctériennes. Dans ce cas, la guérison est obtenue dans pratiquement 84 % des cas avec un taux de continence et une qualité de vie comparables à celui de la population générale (25).
Fistulectomie avec ou sans reconstruction du sphincter
Par fistulectomie, on entend l’ excision complète de l’ ensemble du trajet fistuleux et de son orifice primaire. Le revêtement cutané qui couvre la fistule est excisé avec le cordon fistuleux et la guérison se fait per secundam. Le muscle sphincter est sectionné à minima et peut être reconstruit par suture directe en cas de nécessité (26). Cette technique s’ applique aux fistules les plus distales, et de préférence postérieures. C’ est à dire les fistules périnéales, inter-sphinctériennes ou trans-sphinctériennes distales. Cette intervention peut être pratiquée en anesthésie locale parfois sur un mode ambulatoire. Dans notre expérience de 983 cas consécutifs revus de 2010 à 2018, 5.2 % des patients ont récidivé et aucun cas d’ incontinence majeure n’ est à signaler. Notre expérience est superposable aux résultats de la littérature qui démontrent un succès dans 93 % des cas avec 12 % de troubles de la continence mineurs aux gaz occasionnellement (27).
Lambeau d’ abaissement rectal (LAR)
Le traitement des fistules ano-rectales hautes ou antérieures chez la femme représente un risque pour les structures sphinctériennes et par voie de conséquence peut être grevé d’ un taux non négligeable d’ incontinence anale postopératoire.
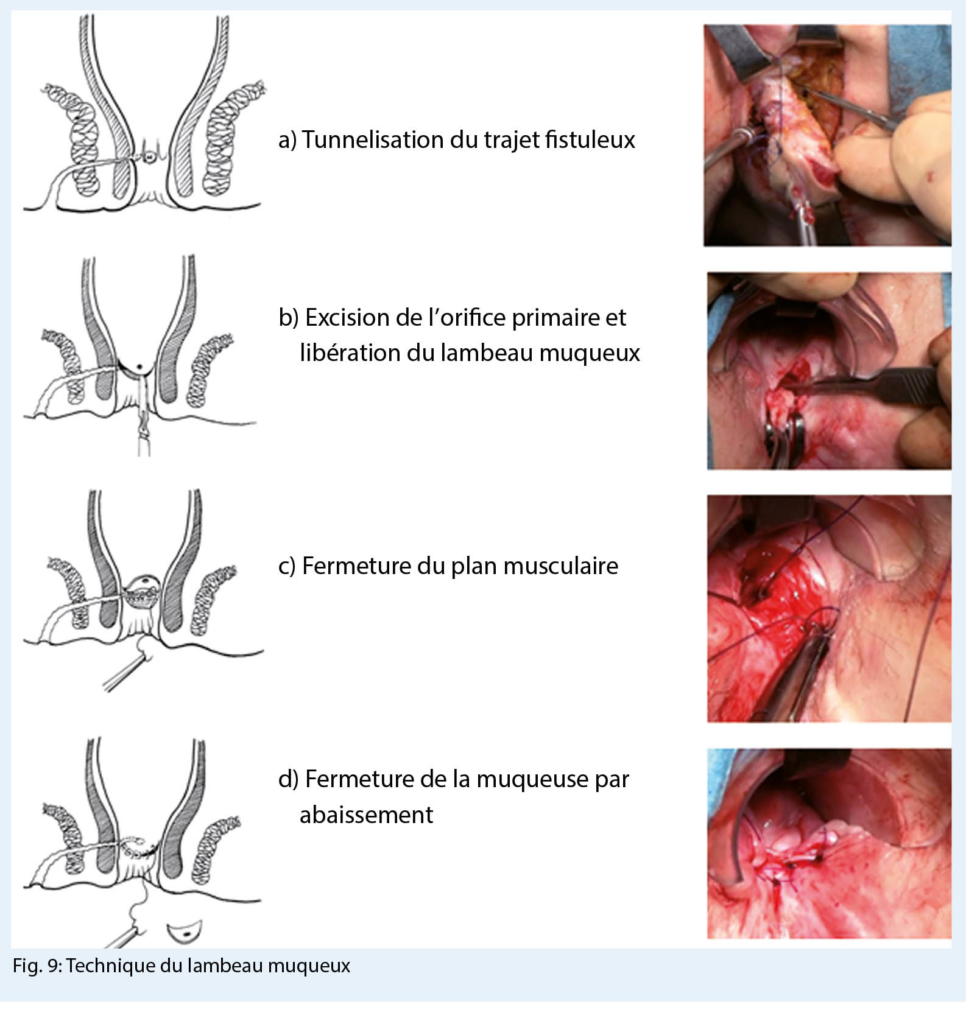
La technique du lambeau d’ abaissement muqueux est une approche chirurgicale élégante pour les cures de fistules hautes situées dans le canal anal. Elle permet de préserver un maximum de tissu de l’ appareil sphinctérien. Elle s’ adresse donc aux fistules trans sphinctériennes hautes et aux fistules supra ou extra-sphinctériennes.
L’ excision des fistules n’ est possible qu’ en terrain calme, en présence de tractus devenus fibreux et si possible drainés par un fil de séton. L’ abaissement muqueux nécessite également un tissu parfaitement sain. Après libération d’ un lambeau de muqueuse, cette dernière est suturée sans tension et sans risque d’ ischémie. Une inflammation aiguë, un terrain post-radique, une maladie de Crohn ou néoplasique, ainsi que des forces de tension sur la ligne de suture sont voués à l’ échec de la technique.
Cette intervention est menée sous antibioprophylaxie sans préparation intestinale, ni rasage préopératoire. Une stomie d’ amont n’ est jamais réalisée.
Le premier temps opératoire consiste en l’ excision complète du trajet fistuleux qui est menée progressivement à partir de l’ orifice secondaire par une dissection au contact du tractus fibreux jusqu’ à l’ orifice interne. Cette dissection réalise alors un « carottage» trans sphinctérien qui vise à n’ emporter idéalement que le tractus fibreux en respectant le tissu musculaire. Une collerette de muqueuse anale autour de l’ orifice primaire est également excisée. Le deuxième temps réalise la fermeture musculaire, par des points séparés d’ un mono filament résorbable. La mobilisation du lambeau proximal muqueux représente le dernier temps opératoire. Celui-ci est abaissé ensuite au-delà de la suture musculaire, telle une persienne protégeant une fenêtre sans chevauchement direct des zones suturées (Fig. 9).
La plaie de l’ orifice secondaire est laissée ouverte afin d’ en assurer le drainage et recouverte d’ une mèche grasse pour 24 à 48 heures (28).
En phase postopératoire, on doit éviter toute constipation, ou diarrhée délétère pour le lambeau abaissé. Les douches pluriquotidiennes, six fois minimum de la plaie cutanée secondaire sont de rigueur. Un contrôle médical hebdomadaire jusqu’ à guérison complète par l’ opérateur, sans examen endo-anal jusqu’ à la 3ème semaine est recommandé. Le taux de récidive de ces fistules en fistules complexes dans notre expérience est de 25 % (29). Chez les patients fumeurs, ce taux peut doubler. Le tabagisme est donc un facteur important à la récidive des fistules anales après traitement chirurgical. Une des grandes questions est que faire en cas de récidive ?
Le lambeau d’avancement rectal (LAR) est une solution thérapeutique reconnue pour traiter des fistules anales complexes. Peu de données existent sur les résultats d’un nouveau lambeau d’avancement sur une fistule récidivante déjà opérée par cette procédure. Nous avons réalisé une étude afin d’évaluer les résultats d’un second lambeau d’avancement comme traitement de la fistule anale complexe récidivante après un premier lambeau.
Cette étude rétrospective, mono centrique porte sur 120 patients opérés par LAR d’une fistule anale crypto-glandulaire. 38 patients ont présenté une récidive de fistule (31,6 %). La récidive était complexe chez 29 patients (24.1 %) et simple chez 9 (7.5 %). Un second LAR a été réalisé chez les 29 ayant une récidive complexe. 83 % (24) de ces patients ont fermé leur fistule, alors que 17 % (5) ont présenté une seconde récidive.
Le LAR est une option intéressante pour la prise en charge d’une récidive de fistule anale complexe. Un premier lambeau n’altère pas les chances de guérison et n’augmente pas la morbidité. Un effet « down-staging », avec en particulier 24 % de fistules simples après un premier LAR, et une transformation des fistules complexes hautes (supra-sphinctériennes ou trans-sphinctériennes hautes) en basses de 16 %, permettent une prise en charge plus aisée de ces récidives (30).
Nouveautés thérapeutiques des fistules anales
LIFT (Ligation inter-sphincterial of fistula tract)
Cette technique LIFT, décrite en 2007 par Rojanasakul (31), a gagné en popularité en raison de sa facilité d’ exécution et de la préservation de la continence. Cette technique consiste à déconnecter l’ orifice primaire de la fistule du trajet au travers de l’ espace inter- sphinctérien en réséquant la zone de la glande infectée. Le taux de succès varie de 40 à 90 %. Les récidives semblent dues au résidu fistuleux laissé en place. Cette technique garanti un succès de 50 % et aucune lésion du sphincter avec seulement 5.5 % de complications post opératoires (32). Contrairement au LAR, le nombre de récidive augmente avec les réinterventions par LIFT (33).
Le grand avantage du LIFT, par rapport à toutes ces nouvelles techniques, est son coût limité.
VAAFT (Video Assisted Anal Fistula Treatment)
Le trajet de la fistule est visionné par un endoscope pédiatrique. Il est rincé, cureté puis, soit brûlé, soit rempli de colle de fibrine. L’ orifice interne est fermé par des fils ou une agrafeuse, ce qui augmente drastiquement le coût. Le taux de guérison se situe entre 58 et 87 % (34, 35).
Techniques d’ occlusion endo luminales
Injection de fibrine et de collagène
L’ utilisation de la colle de fibrine dans le traitement des fistules a été proposée en 1982 (36). Les premiers résultats étaient encourageants. La technique consiste à repérer le trajet fistuleux, le laver, le cureter. L’ encollage se fait ensuite à l’ aide de colle de fibrine, de collagène de colle biologique (37) ou synthétique par canulation du trajet de la fistule. La colle de fibrine, outre son effet occlusif, stimulerait selon les auteurs la cicatrisation du trajet fistuleux. Une étude prospective de Buchana (38) démontre un taux de succès de 14 %, 14 mois après le traitement. Nous avons appliqué la technique de l’ encollage en cas de fistules complexes comme les fistules urétro-rectales ou les fistules de Crohn. Dans ces conditions le taux de récidive est de 60 %, comparable à celui de la chirurgie avec l’ avantage d’ être moins délétère (16).
Injection de cellules germinales autologues
Les cellules mésenchymateuses adultes ont la capacité de se différencier. On peut les utiliser dans la régénération des tissus endommagés et donc dans les fistules. Quelques études toutes issues d’ Espagne prélèvent ces cellules par lipoaspiration du tissu adipeux. Après curetage de la fistule elles sont injectées dans le trajet et l’ orifice primaire est suturé.
Si les résultats sont médiocres (35 % de succès) pour les fistules crypto glandulaires, ils semblent encourageants pour les fistules de Crohn (39, 40). Le facteur limitant reste le coût important de ces techniques.
Plug anal
Le plug anal est un composé lyophilisé issu de tissu porcin dénué de cellules. Ce tissu est placé dans le trajet de la fistule après avoir nettoyé et débridé cette dernière en le tractant à l’ aide d’ un fil. Son extrémité proximale de diamètre supérieur est nouée au sphincter par un nœud en 8. L’ extrémité distale plus fine est sectionnée au niveau de la peau à l’ orifice externe. Les résultats encourageants des premières études n’ ont malheureusement pas pu être reproduits, le taux de succès est de 24 % dans une étude randomisée comparant plug et LAR (29). Notre expérience reflète parfaitement ces résultats puisque nous avons placés 20 plugs avec 1 seul succès.
Laser
L’ application de laser endoluminal a pour but de détruire l’ épithélium résiduel responsable d’ une partie des récidives. Ce laser devrait permettre une oblitération thermique de la fistule Le succès initial reporté chez 11 patient est de 81 % avec un suivi court de
7 mois (41). Une étude menée sur 35 patients porteurs de fistules de Crohn montre une guérison dans 71 % des cas ce qui est très surprenant (42). Le guideline allemand sur les abcès et fistules conclut d’ ailleurs au sujet de ce traitement : Aucune recommandation ne peut être donnée en raison des résultats actuels (15).
A ce jour, il est difficile de se faire une opinion objective sur ces nouvelles techniques. Beaucoup de questions restent sans réponse incluant le bien fondé et surtout les conflits d’ intérêts évidents que génèrent les coûts liés à ces traitements (43).
De toutes ces nouvelles techniques la seule qui échappe à ce raisonnement est le LIFT.
Conclusions
La pathologie abcédée de la région ano-rectale est extrêmement fréquente et doit être prise en charge sans délai. Son traitement consiste en un drainage chirurgical en urgence sous éventuelle couverture antibiotique. Il peut être réalisé dans la majorité des cas sous anesthésie locale.
Lorsque la phase aiguë est passée, le ou les trajets fistuleux sont recherchés. La mise en place d’ un fil de séton permet le drainage et génère la sclérose des fistules.
Après exclusion d’ une maladie sous-jacente ou fistulisante, il est procédé au traitement chirurgical de la fistule. La technique est adaptée à la quantité de muscle sphincter mise en danger par l’ incision chirurgicale. De nombreuses techniques existent pour le traitement des fistules, ce qui démontre la complexité de cette maladie et la non reproductibilité des résultats de ces traitements.
Dans ces conditions, les techniques classiques gardent toute leur valeur. Le LAR reste l’ intervention de référence pour traiter les fistules complexes. Le LIFT de par sa simplicité, son coût limité et ses résultats encourageants pourrait jouer un rôle important dans le futur du traitement des fistules. Les techniques d’ occlusions sont séduisantes mais pour l’ instant les résultats sont insuffisants, surtout si on considère le rapport coût qualité.
Pour toutes ces raisons, il reste important d’ adapter la technique chirurgicale au type de fistule à traiter et non la fistule à la technique chirurgicale.
Dr Karel Skala
Pr Roland Chautems
Dr Guillaume Zufferey
Centre de proctopérinéologie Clinique des Grangettes
chemin des Grangettes 7
1224 Chêne-Bougeries
bruno.roche@grangettes.ch
Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec cet article.
- La plupart des abcès para-anaux sont primaires et proviennent de l’ infection d’ une glande inter-sphinctérienne. L’ abcès situé à l’ origine dans l’ espace inter-sphinctérien se draine en suivant les voies de moindre résistance et constitue ainsi un abcès para-anal, ischio-rectal, en fer à cheval, pelvi-rectal ou inter-sphinctérien. Le diagnostic est plutôt aisé dans les présentations classiques d’ abcès para-anal. Il devient plus difficile lors d’ abcès inter-sphinctérien ou de la fosse ischio-rectale. Le diagnostic peut être précisé par un examen endoscopique, une échographie endo-anale ou IRM du pelvis.
- La pierre angulaire du traitement de l’ abcès ano-rectal est le drainage chirurgical. Il peut être assuré par le praticien formé. Celui-ci peut le réaliser souvent en anesthésie locale, sans couverture antibiotique et les cultures de germes ne s’ imposent pas.
- Le traitement chirurgical est une urgence et ce geste ne doit pas être repoussé. Cette attitude est motivée par le spectre dramatique d’ une évolution vers un sepsis sévère ou une gangrène de Fournier. L’ orifice fistulaire primaire endoanal n’ est pas recherché à la phase aiguë.
- 25% des cas ferment définitivement et spontanément leur trajet fistuleux. Dans les autres cas de figure, on place un drainage préopératoire en séton et l’ option thérapeutique chirurgicale est choisie en fonction de la localisation et de la complexité de la maladie fistulaire.
1. Sainio P. Fistula-in-ano in a defined population. Incidence and epidemiological aspects. Annales chirurgiae et gynaecologiae. 1984;73(4):219-24.
2. Ramanujam PS, Prasad ML, Abcarian H, Tan AB. Perianal abscesses and fistulas. A study of 1023 patients. Diseases of the colon and rectum. 1984;27(9): 593-7.
3. Klosterhalfen B, Offner F, Vogel P, Kirkpatrick CJ. Anatomic nature and surgical significance of anal sinus and anal intramuscular glands. Diseases of the colon and rectum. 1991;34(2):156-60.
4. Zanotti C, Martinez-Puente C, Pascual I, Pascual M, Herreros D, Garcia-Olmo D. An assessment of the incidence of fistula-in-ano in four countries of the European Union. International journal of colorectal disease. 2007;22(12):1459-62.
5. Adamo K, Sandblom G, Brannstrom F, Strigard K. Prevalence and recurrence rate of perianal abscess–a population-based study, Sweden 1997-2009. International journal of colorectal disease. 2016;31(3):669-73.
6. Devaraj B, Khabassi S, Cosman BC. Recent smoking is a risk factor for anal abscess and fistula. Diseases of the colon and rectum. 2011;54(6):681-5.
7. Wang D, Yang G, Qiu J, Song Y, Wang L, Gao J, et al. Risk factors for anal fistula: a case-control study. Techniques in coloproctology. 2014;18(7):635-9.
8. Cioli VM, Gagliardi G, Pescatori M. Psychological stress in patients with anal
fistula. International journal of colorectal disease. 2015;30(8):1123-9.
9. Hamilton CH. Anorectal problems: the deep postanal space–surgical significance in horseshoe fistula and abscess. Diseases of the colon and rectum. 1975;18(8):642-5.
10. Bussen D, Sailer M, Wening S, Fuchs KH, Thiede A. [Usefulness of anal endosonography in the assessment of fistula-in-ano]. Zentralblatt fur Chirurgie. 2004;129(5):404-7.
11. Badrinath K, Jairam N, Ravi HR. Spreading extraperitoneal cellulitis following perirectal sepsis. The British journal of surgery. 1994;81(2):297-8.
12. Yilmazlar T, Ozturk E, Ozguc H, Ercan I, Vuruskan H, Oktay B. Fournier’s gangrene: an analysis of 80 patients and a novel scoring system. Techniques in coloproctology. 2010;14(3):217-23.
13. Di Falco G, Guccione C, D’Annibale A, Ronsisvalle S, Lavezzo P, Fregonese D, et al. Fournier’s gangrene following a perianal abscess. Diseases of the colon and rectum. 1986;29(9):582-5.
14. Ozturk E, Sonmez Y, Yilmazlar T. What are the indications for a stoma in Fournier’s gangrene? Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland. 2011;13(9):1044-7.
15. Ommer A, Herold A, Berg E, Furst A, Post S, Ruppert R, et al. German S3 guidelines: anal abscess and fistula (second revised version). Langenbeck’s archives of surgery. 2017;402(2):191-201.
16. Hamalainen KP, Sainio AP. Incidence of fistulas after drainage of acute anorectal abscesses. Diseases of the colon and rectum. 1998;41(11):1357-61; discussion 61-2.
17. Rizzo JA, Naig AL, Johnson EK. Anorectal abscess and fistula-in-ano: evidence-based management. The Surgical clinics of North America. 2010;90(1):45-68, Table of Contents.
18. Cheong DM, Nogueras JJ, Wexner SD, Jagelman DG. Anal endosonography for recurrent anal fistulas: image enhancement with hydrogen peroxide. Diseases of the colon and rectum. 1993;36(12):1158-60.
19. Kolodziejczak M, Santoro GA, Obcowska A, Lorenc Z, Manczak M, Sudol-Szopinska I. Three-dimensional endoanal ultrasound is accurate and reproducible in determining type and height of anal fistulas. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland. 2017;19(4):378-84.
20. Siddiqui MR, Ashrafian H, Tozer P, Daulatzai N, Burling D, Hart A, et al. A diagnostic accuracy meta-analysis of endoanal ultrasound and MRI for perianal fistula assessment. Diseases of the colon and rectum. 2012;55(5):576-85.
21. Parks AG, Gordon PH, Hardcastle JD. A classification of fistula-in-ano. The British journal of surgery. 1976;63(1):1-12.
22. McCourtney JS, Finlay IG. Setons in the surgical management of fistula in ano. The British journal of surgery. 1995;82(4):448-52.
23. Ritchie RD, Sackier JM, Hodde JP. Incontinence rates after cutting seton treatment for anal fistula. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland. 2009;11(6):564-71.
24. Vial M, Pares D, Pera M, Grande L. Faecal incontinence after seton treatment for anal fistulae with and without surgical division of internal anal sphincter: a systematic review. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland. 2010;12(3):172-8.
25. Gottgens KW, Janssen PT, Heemskerk J, van Dielen FM, Konsten JL, Lettinga T, et al. Long-term outcome of low perianal fistulas treated by fistulotomy: a multicenter study. International journal of colorectal disease. 2015;30(2):213-9.
26. van Tets WF, Kuijpers HC. Continence disorders after anal fistulotomy. Diseases of the colon and rectum. 1994;37(12):1194-7.
27. Ratto C, Litta F, Donisi L, Parello A. Fistulotomy or fistulectomy and primary sphincteroplasty for anal fistula (FIPS): a systematic review. Techniques in coloproctology. 2015;19(7):391-400.
28. Ozuner G, Hull TL, Cartmill J, Fazio VW. Long-term analysis of the use of transanal rectal advancement flaps for complicated anorectal/vaginal fistulas. Diseases of the colon and rectum. 1996;39(1):10-4.
29. Ortiz H, Marzo J, Ciga MA, Oteiza F, Armendariz P, de Miguel M. Randomized clinical trial of anal fistula plug versus endorectal advancement flap for the treatment of high cryptoglandular fistula in ano. The British journal of surgery. 2009;96(6):608-12.
30. Podetta M, Scarpa CR, Zufferey G, Skala K, Ris F, Roche B, et al. Mucosal advancement flap for recurrent complex anal fistula: a repeatable procedure. International journal of colorectal disease. 2019;34(1):197-200.
31. Rojanasakul A, Pattanaarun J, Sahakitrungruang C, Tantiphlachiva K. Total anal sphincter saving technique for fistula-in-ano; the ligation of intersphincteric fistula tract. Journal of the Medical Association of Thailand = Chotmaihet thangphaet. 2007;90(3):581-6.
32. Sirany AM, Nygaard RM, Morken JJ. The ligation of the intersphincteric fistula tract procedure for anal fistula: a mixed bag of results. Diseases of the colon and rectum. 2015;58(6):604-12.
33. Abcarian AM, Estrada JJ, Park J, Corning C, Chaudhry V, Cintron J, et al. Ligation of intersphincteric fistula tract: early results of a pilot study. Diseases of the colon and rectum. 2012;55(7):778-82.
34. Kochhar G, Saha S, Andley M, Kumar A, Saurabh G, Pusuluri R, et al. Video-
assisted anal fistula treatment. JSLS : Journal of the Society of Laparoendoscopic Surgeons. 2014;18(3).
35. Meinero P, Mori L. Video-assisted anal fistula treatment (VAAFT): a novel sphincter-saving procedure for treating complex anal fistulas. Techniques in coloproctology. 2011;15(4):417-22.
36. Hedelin H, Nilson AE, Teger-Nilsson AC, Thorsen G. Fibrin occlusion of fistulas postoperatively. Surgery, gynecology & obstetrics. 1982;154(3):366-8.
37. Giordano P, Sileri P, Buntzen S, Stuto A, Nunoo-Mensah J, Lenisa L, et al. A prospective multicentre observational study of Permacol collagen paste for anorectal fistula: preliminary results. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland. 2016;18(3):286-94.
38. Buchanan GN, Bartram CI, Phillips RK, Gould SW, Halligan S, Rockall TA, et al. Efficacy of fibrin sealant in the management of complex anal fistula: a prospective trial. Diseases of the colon and rectum. 2003;46(9):1167-74.
39. Garcia-Olmo D, Herreros D, Pascual I, Pascual JA, Del-Valle E, Zorrilla J, et al. Expanded adipose-derived stem cells for the treatment of complex perianal fistula: a phase II clinical trial. Diseases of the colon and rectum. 2009;52(1):79-86.
40. Herreros MD, Garcia-Arranz M, Guadalajara H, De-La-Quintana P, Garcia-Olmo D, Group FC. Autologous expanded adipose-derived stem cells for the treatment of complex cryptoglandular perianal fistulas: a phase III randomized clinical trial (FATT 1: fistula Advanced Therapy Trial 1) and long-term evaluation. Diseases of the colon and rectum. 2012;55(7):762-72.
41. Wilhelm A. A new technique for sphincter-preserving anal fistula repair using a novel radial emitting laser probe. Techniques in coloproctology. 2011;15(4): 445-9.
42. Giamundo P, Geraci M, Tibaldi L, Valente M. Closure of fistula-in-ano with laser–FiLaC: an effective novel sphincter-saving procedure for complex disease. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland. 2014;16(2):110-5.
43. Limura E, Giordano P. Modern management of anal fistula. World journal of gastroenterology. 2015;21(1):12-20.
la gazette médicale
- Vol. 8
- Ausgabe 5
- September 2019