- Protonenpumpen-Inhibitoren
Protonenpumpen-Inhibitoren (PPI) sind Arzneimittel, welche die Säuresekretion durch Bindung an die Protonenpumpe in den Belegzellen des Magens hemmen. Sie gehören zu den am häufigsten verordneten Arzneimitteln und werden oft langfristig eingenommen. Viele dieser Patienten bedürfen also im Verlauf einer gastroenterologischen Diagnostik, insbesondere auch um die Indikation zur Fortsetzung der PPI-Behandlung zu überprüfen. Dieser Artikel sollte Ihnen Handlungsempfehlungen an die Hand geben, die PPI-Therapie pro-aktiv zu steuern.
Der klinische Nutzen von PPI ist seit Jahrzehnten bewährt und stellt für die Behandlung von Magen- und Duodenalgeschwüren, die gastroösophageale Refluxerkrankung und die Eradikationstherapie von Helicobacter pylori in Kombination mit Antibiotika evidenzbasiert die effektivste Behandlungsmassnahme dar (1, 2). Vorteilhaft für die Verbreitung der PPI war ihr sehr günstiges Nebenwirkungsprofil und die hohe Akzeptanz bei den Patienten (3). Deswegen zählen PPI zu den wenigen Arzneimitteln, die therapeutisch wie diagnostisch eingesetzt werden können, beispielsweise wenn der Hausarzt den begründeten klinischen Verdacht auf ein typisches Refluxleiden hat (4). Nachdem sich Berichte über mögliche ernsthafte Nebenwirkungen unter PPI-Dauertherapie mehrten, ist im letzten Jahrzehnt eine Flut an Studien zur Langzeitsicherheit von PPI erschienen. Auch wenn sich viele der postulierten Nebenwirkungen nicht haben objektivieren lassen, kann aus Beobachtungsstudien ein erhöhtes Risiko von Wirbelkörper-/Schenkelhals-Frakturen, bakteriellen Infektionen der Atemwege und des Verdauungstrakts einschl. Fehlbesiedlung des Dünndarms, Hypomagnesiämie und möglichen Resorptionsstörungen (wie Vitamin B12- oder Eisenmangel) angenommen werden (5, 6). Die lebhafte Diskussion um die Nebenwirkungen einer Langzeit-PPI-Behandlung unterstreicht die Grundsätze jeder Arzneimitteltherapie: sie sollte nur bei gesicherter Indikation erfolgen und unter ärztlicher Überwachung.
PPI und gesicherte Indikationen
Aus dem oben Gesagten ergeben sich für PPI folgende Schlussfolgerungen: PPI können und sollen frühzeitig ohne spezielle gastroenterologische Diagnostik gegeben werden, aber für das Fortführen dieser Medikation bedarf es einer gesicherten Indikation. Bezüglich der beiden Hauptindikationen «Gastritis/Ulcus» oder «Reflux» sollte sich der behandelnde Arzt immer fragen, ob es einen PPI weiterhin noch bedarf und wenn ja, in welcher Dosis. Dabei lassen sich 2 typische Behandlungsmuster erkennen: (a) nach ausbehandelter Gastritis/Ulcus wird der PPI langfristig nach Beendigung der Helicobacter-Eradikation oder der auslösenden Noxe (wie NSAR, Antikoagulantien, Kortison etc.) fortgeführt, (b) eine vormals gestellte Diagnose einer Refluxerkrankung wird ohne kritisches Hinterfragen wie ein Stigma jahrelang beibehalten, so dass Oberbauchbeschwerden unter Refluxbeschwerden subsummiert und mit PPI behandelt werden – gefolgt von meist unbefriedigendem Ansprechen. Ursächlich hierfür ist oft das Vorliegen einer nur leichtgradigen oder «unbewiesenen» Refluxösophagitis, also sogenannte endoskopische Minimalbefunde («Rötungen an Kardia/Z-Linie») bis zu Erosionen nach Los Angeles-Klassifikationen Grad A und B (oder Savary-Miller Klassifikation Grad 1). Zum Einen finden sich diese endoskopischen Veränderungen zum Teil auch bei gesunden Kontrollpersonen, zum Anderen zeigen Langzeit-Beobachtungsstudien, dass nicht nur sehr wenige dieser Patienten zu höheren Refluxstadien progredient werden, sondern dass nach 10 Jahren sogar die grosse Mehrheit (67%) gar keine Refluxerkrankung mehr aufweist (7).
PPI und Gastroskopie
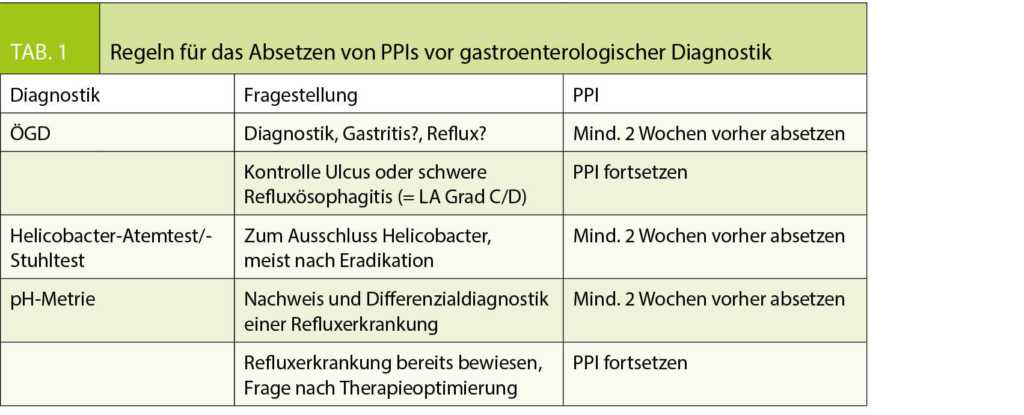
Hauptsächliche Indikationen für die hausärztliche Zuweisung zur Gastroskopie sind also die Fragen nach einer «Gastritis» oder «Refluxerkrankung». Auf beide Erkrankungen haben PPI einen raschen positiven Effekt durch die schnelle und effektive Hemmung der Säuresekretion. PPI beeinflussen somit die Diagnostik der Erkrankungen, die wir abzuklären hoffen. Die klinisch bei weitem wichtigste Gastritisform ist die Helicobacter pylori-assoziierte Gastritis. Die Einnahme von PPI kann in ca. 10-40% der Fälle zu falsch-negativem Nachweis von Helicobacter führen und betrifft sämtliche verfügbare Nachweisverfahren, also Atemtests, Stuhltests und Urease-Schnelltests sowie Histopathologie und Kultur entnommener Magenschleimhautproben (8). Man erklärt sich dies nicht nur durch die Magensäuresuppression, sondern auch durch direkte antimikrobielle Aktivität (9) und direkte Inhibition der Urease-Aktivität (10) (welche für den Atem- und Schnelltest essenziell ist). PPI scheinen auch die Form der Helicobacter-Bakterien und ihre Verteilung auf der Magenschleimhaut zu verändern, so dass sie für den Pathologen schwieriger zu diagnostizieren sind (11, 12). In vitro Daten zeigten, dass sich der negative Effekt von PPI auf das Wachstum und den Urease-Nachweis von Helicobacter erst nach 12-tägigem Absetzen komplett erholt hat (13). Dieser Problematik wurde im Rahmen der europaweiten Leitlinienanpassung zu Helicobacter (Maastricht Consensus Konferenzen) Rechnung getragen und es wird, wenn möglich, eine mindestens 2-wöchige PPI-Pause vor Helicobacter-Diagnostik gefordert, egal welches Helicobacter-Testverfahren man wählt (14). Da Antibiotika das Wachstum und die Verteilung von Helicobacter beeinflussen, sollte jegliche gastroenterologische Diagnostik, die eine Bestimmung von Helicobacter beinhaltet, frühestens 4 Wochen nach einer Antibiotikagabe erfolgen (14). Die amerikanische Fachgesellschaft weist ebenso darauf hin, dass nach Behandlung einer Helicobacter-Gastritis eine Kontrolle frühestens 4 Wochen nach Beendigung der antibiotischen Therapie erfolgen sollte und dass PPI für mind. 1-2 Wochen pausiert sein sollten, unabhängig ob man einen Atemtest, einen Stuhltest oder eine Gastroskopie mit Biopsien durchführt (15). Obwohl international ein ausreichend langes Kontrollintervall (> 4 Wochen) nach Beendigung der Hp-Eradikationstherapie eingehalten wird, werden die Empfehlungen zur PPI-Karenz leider unzureichend eingehalten und dementsprechend sind bis zu 56% aller «unauffälligen/negativen» Ergebnisse unzuverlässig (16).
Antihistaminika haben im Vergleich zu PPI einen viel geringer hemmenden Effekt auf Helicobacter, so dass die Einnahme von H2-Blockern zu weniger falsch-negativen Ergebnissen führt (17). Ein Expertenpanel hält das Absetzen von H2-Blockern vor Gastroskopie oder Atem-/Stuhltest für nicht zwingend notwendig (14).
Für die endoskopische Diagnostik einer Refluxerkrankung empfiehlt sich eine ähnliche PPI-Pause, wobei wir aufgrund der verzögerten Entwicklung von sichtbaren Erosionen eher 4 als 2 Wochen empfehlen. Bei der endoskopischen Kontrolle einer gesicherten schweren Refluxösophagitis sollte der PPI eher nicht pausiert werden, da diese Untersuchung nicht der Diagnose «Reflux» dient, sondern der Kontrolle von Refluxkomplikationen.
PPI und Helicobacter-Atemtest/-Stuhltest
Bei der Gastroskopie werden Biopsien aus der Magenschleimhaut entnommen, in denen man Helicobacter histologisch oder kulturell nachweisen kann. Aus den Biopsien lässt sich Helicobacter auch indirekt durch den sogenannten Urease-Schnelltest innerhalb von 24h nachweisen. Als gleichwertiges nicht-invasives Verfahren steht ein Harnstoff-Atemtest zur Verfügung, der ebenso die spezifische Urease-Aktivität von Helicobacter ausnutzt. Alternativ dazu existiert auch die Möglichkeit, Helicobacter mittels Antigen im Stuhl nachweisen zu können. Beide Tests werden üblicherweise zur Kontrolle 6-8 Wochen nach Eradikation einer unkomplizierten Helicobacter-Gastritis angewendet. Mehr noch als bei der Gastroskopie, wird gerade für diese beiden nicht-invasiven Testverfahren eine PPI-Pause von mind. 2 Wochen empfohlen (14, 15). Hat man aus bestimmten Gründen Bedenken gegen ein frühes Absetzen des PPI, dann würde ich im Zweifelsfall den Kontrolltermin mittels Stuhl-/Atemtest um einige Wochen oder Monate verschieben.
PPI und Langzeit-pH-Metrie
Die ösophageale pH-Metrie ist ein wichtiges Instrumentarium zur Diagnostik einer «unbewiesenen» oder leichten Refluxerkrankung und zur Differenzialdiagnostik von Reflux-Hypersensitivität und funktionellen Symptomen. Experten sind sich in dieser Situation einig, dass die pH-Metrie ohne PPI erfolgen sollte (18, 19). Die Dauer der PPI-Karenz hierzu ist nicht standardisiert, kursiert aber international relativ ähnlich zwischen 7-14 Tagen (20). Wir haben in unserer Institution eine Pause von mind. 2 Wochen festgesetzt, nicht zuletzt, um in Kongruenz zu den Empfehlungen zur Gastritis-Diagnostik zu bleiben. Eine ganz andere Situation besteht, wenn eine Refluxerkrankung gesichert ist (also Grad C/D oder bereits positive pH-Metrie) und die Diagnostik der Therapieoptimierung dient. Dann sollte die pH-Metrie unter laufender PPI-Medikation erfolgen in üblicher Dosierung (also mit 1-2 x täglicher PPI-Gabe, auch am Untersuchungstag einzunehmen!).
Gastroenterologie/Hepatologie
Departement Innere Medizin
Kantonsspital Graubünden
Loëstrasse 170
7000 Chur
danko.batusic@ksgr.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Eine PPI-Langzeit-Behandlung sollte nur bei gesicherter Indikation erfolgen und unter ärztlicher Überwachung
- Der Gastroenterologe sollte über den PPI-Status des Patienten
informiert sein und sollte in seinem Bericht dokumentieren, ob die Untersuchung mit oder ohne PPI erfolgt - Vor jeder diagnostischen Gastroskopie sollten PPI, wenn möglich, mind. 2 Wochen pausiert werden
- Vor einem Helicobacter-Atemtest oder -Stuhltest sollten PPI mind.
2 Wochen pausiert werden - Vor einer pH-Metrie sollten PPI mind. 2 Wochen pausiert werden, wenn eine Refluxerkrankung nachgewiesen oder ausgeschlossen
werden soll - Nur eine schwere Refluxösophagitis (Los Angeles Grad C/D oder
eindeutig positive Langzeit-pH-Metrie) ist eine «bewiesene» Indikation für eine PPI-Dauermedikation, ansonsten sollte die Indikation für einen PPI kritisch hinterfragt werden, dann ggf. ÖGD oder pH-Metrie nach mehrwöchiger (mind. 2-4 Wochen) PPI-Pause wiederholen
1. Leontiadis GI, Howden CW. The Role of Proton Pump Inhibitors in the Management of Upper Gastrointestinal Bleeding. Gastroenterology Clinics of North America. 2009.
2. Laine L, Jensen DM. Management of patients with ulcer bleeding. Am J Gastroenterol. 2012;
3. Sigterman KE, van Pinxteren B, Bonis PA, Lau J, Numans ME. Short-term treatment with proton pump inhibitors, H2-receptor antagonists and prokinetics for gastro-oesophageal reflux disease-like symptoms and endoscopy negative reflux disease. Cochrane Database Syst Rev [Internet]. 2013 May 31 [cited 2019 Feb 28];(5). Available from: http://doi.wiley.com/10.1002/14651858.CD002095.pub5
4. Koop AH, Fuchs KH, Labenz J, Lynen Jansen P, Messmann H, Miehlke S, et al. S2kLeitlinie: Gastroösophageale Refluxkrankheit der DGVS. Z Gastroenterol. 2014;52:12991346.
5. Safety of long-term PPI use. JAMA – J Am Med Assoc. 2017;
6. Reimer C. Safety of long-term PPI therapy. Best Practice and Research: Clinical Gastroenterology. 2013.
7. Ford AC, Forman D, Bailey AG, Axon ATR, Moayyedi P. The natural history of gastro-oesophageal reflux symptoms in the community and its effects on survival: a longitudinal 10-year follow-up study. Aliment Pharmacol Ther. 2013 Feb;37(3):323–31.
8. Levine A, Shevah O, Shabat-Sehayek V, Aeed H, Boaz M, Moss SF, et al. Masking of 13C urea breath test by proton pump inhibitors is dependent on type of medication: comparison between omeprazole, pantoprazole, lansoprazole and esomeprazole. Aliment Pharmacol Ther. 2004 Jul;20(1):117–22.
9. Sjöström JE, Kühler T, Larsson H. Basis for the selective antibacterial activity in vitro of proton pump inhibitors against Helicobacter spp. Antimicrob Agents Chemother. 1997;
10. Graham DY, Opekun AR, Hammoud F, Yamaoka Y, Reddy R, Osato MS, et al. Studies regarding the mechanism of false negative urea breath tests with proton pump inhibitors. Am J Gastroenterol. 2003;
11. Goldstein NS. Chronic inactive gastritis and coccoid Helicobacter pylori in patients treated for gastroesophageal reflux disease or with H pylori eradication therapy. Am J Clin Pathol. 2002 Nov;118(5):719–26.
12. Logan RPH, Walker MM, Misiewicz JJ, Gummett PA, Karim QN, Baron JH.
Changes in the intragastric distribution of Helicobacter pylori during treatment with omeprazole. Gut. 1995;
13. Saniee P, Shahreza S, Siavoshi F. Negative Effect of Proton-pump Inhibitors (PPIs) on Helicobacter pylori Growth, Morphology, and Urease Test and Recovery after PPI Removal – An In vitro Study. Helicobacter. 2016;
14. Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of helicobacter pylori infection-the Maastricht V/Florence consensus report. Gut. 2016;66(1):6–30.
15. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol [Internet]. 2017;112(2):212–38. Available from: http://dx.doi.org/10.1038/ajg.2016.563
16. Shirin D, Matalon S, Avidan B, Broide E, Shirin H. Real-world Helicobacter pylori diagnosis in patients referred for esophagoduodenoscopy: The gap between guidelines and clinical practice. United Eur Gastroenterol J. 2016;
17. Graham DY, Opekun AR, Jogi M, Yamaoka Y, Lu H, Reddy R, et al. False negative urea breath tests with H2-receptor antagonists: interactions between Helicobacter pylori density and pH. Helicobacter. 2004 Feb;9(1):17–27.
18. Katz PO, Gerson LB, Vela MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol. 2013 Mar;108(3):308–28; quiz 329.
19. Pehl C, Keller J, Merio R, Stacher G. [Esophageal 24 hour-pH metry. Recommendations of the German Society of Neurogastroenterology and Motility and the Study Group for Gastrointestinal Functional Disorders and Function Diagnostics of the Austrian Society of Gastroenterology and Hepatology]. Z Gastroenterol. 2003 Jun;41(6):545–56.
20. Juul-Hansen P, Rydning A. Endoscopy-negative reflux disease: what is the value of a proton-pump inhibitor test in everyday clinical practice? Scand J Gastroenterol. 2003 Dec;38(12):1200–3.
der informierte @rzt
- Vol. 9
- Ausgabe 9
- September 2019