- Robotics in der Kardiologie
Dank ihrer Geschwindigkeit, Präzision und Ausdauer prägen Roboter die Massenfertigung in der modernen Industrie. In der Medizin kommen Roboter seit den 1990er Jahren primär im Bereich der Chirurgie und Strahlentherapie zum Einsatz. In der kardiovaskulären Medizin werden robotische Systeme routinemässig in der Herzchirurgie bei Bypassoperationen und Mitralklappenrekonstruktionen eingesetzt. In diesem Beitrag werden die Einsatzmöglichkeiten in der Herzchirurgie und der Kardiologie diskutiert.
Grâce à leur rapidité, leur précision et leur endurance, les robots façonnent la production de masse dans l’ industrie moderne. En médecine, les robots sont principalement utilisés en chirurgie et en radiothérapie depuis les années 1990. En médecine cardiovasculaire, les systèmes robotiques sont couramment utilisés en chirurgie cardiaque pour les pontages et la reconstruction des valves mitrales. Le présent article discute les applications possibles en chirurgie cardiaque et en cardiologie.
Im Jahr 2003 kam in der Rhythmologie ein System zur magnetischen Steuerung von elektrophysiologischen Ablationskathetern auf den Markt, gefolgt von zwei Systemen mit mechanischer Kathetersteuerung. Im Bereich der interventionellen Kardiologie wurde im Jahr 2010 ein erstes System klinisch zugelassen, mit dem perkutane koronare und periphere vaskuläre Interventionen durchgeführt werden können.
Roboter in der Herzchirurgie
Konventionelle chirurgische Eingriffe am offenen Herzen sind mit einem beträchtlichen Risiko, einer grossen Operationsnarbe sowie einem längeren Spitalsaufenthalt mit nachfolgender Rehabilitation verbunden. Mit minimalinvasiven Verfahren kann das chirurgische Trauma, der Schmerzmittelbedarf sowie die Heilungsdauer verkürzt werden.
Das DaVinci System ist seit 1998 erhältlich. Neuere Versionen (da Vinci S und da Vinci Si) bieten eine verbesserte Beweglichkeit und Reichweite der Roboterarme. Die Kamera erlaubt eine 3D Darstellung des Operationsfeldes sowie eine 10-fache Vergrösserung. In einer kürzlich durchgeführten systematischen Analyse wurde der Stellenwert robotischer Verfahren in der Herzchirurgie untersucht (1). Es wurden 28 Studien mit insgesamt 5993 Patienten eingeschlossen. Es handelt sich ausschliesslich um Kohortenstudien. Trotz mittlerweile jahrzehntelangem Einsatz gibt es bis heute keine randomisierten Studien zu Sicherheit und Effektivität der roboterassistierten Herzchirurgie. Am häufigsten kommen Robotersysteme bei endoskopischen Bypassoperationen und Mitralklappenrekonstruktionen zum Einsatz, mit grossem Abstand gefolgt von Verschlüssen des Vorhofseptums (ASD) und der Resektion von Vorhofstumoren. Die roboterassistierte endoskopische Bypassoperation gilt als sicheres und effektives Verfahren. Bei 7% der endoskopischen Bypassoperationen musste sekundär eine Sternotomie durchgeführt werden. Die 30-Tagesmortalität lag bei 0,3%, die Spätmortalität während 36 Monaten Follow-up betrug 3,2%. In einer grossen Registerstudie, in der 5199 Patienten mit robotisch assistierten herzchirurgischen Eingriffen mit 10 331 konventionell operierten Patienten verglichen wurden, konnte eine verminderte Aufenthaltsdauer, Komplikationsrate und Mortalität gezeigt werden (2). Neben einer geringen Mortalität ist die roboterassistierte Bypasschirurgie auch mit einer niedrigen Infektionsrate verbunden. Allerdings muss auch ein Selektionsbias berücksichtigt werden, da der Grossteil der Patienten eine Eingefässerkrankung aufwies, lediglich 24% zeigten eine Mehrgefässerkrankung.
Die erste robotische Mitralklappenrekonstruktion (MKR) wurde im Jahr 1998 durchgeführt. Bei der robotischen MKR ist die Konversionsrate mit 4,7% noch geringer als bei der Bypassoperation. Vorhofflimmern ist die häufigste Komplikation (12 %). 2,6 % der Patienten mussten im Verlauf reoperiert werden. Die 30-Tagesmortalität betrug 0,8%, die Spätmortalität 0,4% (1).
Über andere robotische herzchirurgische Verfahren (ASD Verschluss, Myxomresektion) liegen nur kleinere Fallserien vor, welche gute Ergebnisse ohne perioperative Mortalität aufweisen.
Robotertechnologie in der interventionellen Kardiologie und Angiologie
Interventionelle Kardiologen sind einer beträchtlichen Strahlenbelastung sowie Belastungen der Wirbelsäule durch schwere Bleischürzen ausgesetzt. Durch den Einsatz von robotischen Systemen ist eine räumliche Trennung des Untersuchers vom Patienten und von der Röntgenanlage möglich. Dadurch kann die Belastung des Untersuchers deutlich reduziert werden und es können auch telemedizinische Szenarien mit robotischen Interventionen in abgelegenen Spitälern entwickelt werden. Der Prototyp eines robotischen Systems für perkutane kardiale Interventionen (PCI) wurde ab 2006 getestet, ein kommerzielles System ist seit 2012 erhältlich (CorPath 200; Corindus, Waltham, MA, USA). Es wurden jedoch bislang nur wenige 100 Patienten weltweit behandelt (3, 4). Für Akutbehandlungen und komplexe Mehrgefässerkrankungen ist das System derzeit noch ungeeignet.
Robotische Katheterablation von Herzrhythmusstörungen
Eine grössere Bedeutung spielen robotische Systeme in der Rhythmologie. Die Katheterablation mit Radiofrequenzenergie ist eine etablierte Therapieform zur Behandlung supraventrikulärer und ventrikulärer Tachyarrhythmien. Elektroanatomische Mappingsysteme ermöglichen eine dreidimensionale Darstellung der zu untersuchenden Herzhöhlen durch Abtasten der endokardialen Oberfläche und Registrierung der lokalen Amplitude und Ausbreitung der elektrischen Aktivierung des Myokards («Mapping»). Diese Mappingsysteme haben die konventionelle Untersuchung unter Röntgenkontrolle bei der Behandlung komplexerer Arrhythmien weitgehend ersetzt, wodurch die Strahlenexposition für Patienten und Untersucher deutlich reduziert werden konnte. Die katheterbasierte Behandlung von komplexen atrialen Tachykardien, Vorhofflimmern und ventrikulären Tachykardien erfordert eine hohe Expertise und manuelles Geschick. Die oft lange Interventionsdauer stellt eine Belastung für den Untersucher dar und komplexe Eingriffe sind weiterhin mit längeren Röntgenzeiten verbunden. Systeme zur Fernsteuerung von Ablationskathetern wurden entwickelt um durch eine stabile Katheterführung die Effektivität und Sicherheit der Eingriffe zu optimieren sowie die Strahlenexposition und physische Belastung von Untersuchern zu minimieren. Derzeit werden vorwiegend das magnetische Navigationssystem (MNS) Niobe (Stereotaxis Inc., St. Louis, MO, USA) sowie das mit einem Roboterarm und speziellen elektromechanischen Schleusen arbeitende Navigationssystem (remote navigation system, RNS) Sensei (Hansen Medical Inc., Mountain View, CA, USA) klinisch eingesetzt. Zudem wurde ein mit konventionellen Ablationskathetern kompatibles RCS (Amigo Remote Catheter System, Catheter Precision Inc., Mount Olive, NJ, USA) verfügbar. Bei diesem RCS erfolgt die Steuerung direkt über die im jeweiligen Katheter integrierten Steuergriffe. Ein innovatives System mit direkter Kathetersteuerung mithilfe dynamischer Magnetfelder (Aeon) konnte erfolgreich im Tierversuch und beim Menschen getestet werden, ist jedoch aktuell nicht kommerziell erhältlich.
Magnetische Katheternavigation
Das Niobe MNS ist seit dem Jahr 2003, das Sensei RNS seit 2008 verfügbar. Jedes der beiden Systeme hat technisch bedingt spezifische Vorteile und Einschränkungen.
Das Niobe/EPOCH MNS (Abb. 1) arbeitet mit zwei je 1.8 Tonnen schweren externen statischen Magneten, welche beidseits des Operationstisches positioniert sind und ein Magnetfeld mit einer niedrigen Feldstärke (0.08 oder 0.1 T wählbar) erzeugen. Ein spezieller Ablationskatheter mit drei kleinen an der Spitze eingebauten Magneten wird über ein Computersystem im Herzen durch Veränderung des externen Magnetfelds bewegt. Zudem kann der Katheter über einen Elektromotor vor- und zurückverschoben werden. Es stehen sowohl gekühlte wie auch ungekühlte Katheter von zwei Herstellern zur Verfügung.
Klinische Studien haben konsistent gezeigt, dass Katherablationen mit MNS mit hoher Sicherheit und gegenüber manuellen Verfahren vergleichbarer Effektivität durchgeführt werden können. In einer Metaanalyse von 7 Studien mit insgesamt 779 Patienten konnte gezeigt werden, dass mittels MNS sowohl idiopathische Kammertachykardien als auch Kammertachykardien bei Patienten mit struktureller Herzerkrankung sicher und mit vergleichbarer Effektivität wie mit manuellen Techniken behandelt werden können (5).
Auch die Ablation von Vorhofflimmern kann mittels MNS effektiv und sicher durchgeführt werden. In einer Metaanalyse von 15 Studien mit insgesamt 1647 Patienten konnte eine gleiche Effektivität wie bei manuellen Verfahren gezeigt werden. In dieser Untersuchung war MNS mit einem geringeren Komplikationsrisiko (Perikarderguss und Tamponade) gegenüber manuellen Verfahren verbunden.(6)
Der Katheter des MNS ist so weich, dass eine mechanische Perforation extrem unwahrscheinlich ist. Durch seine Flexibilität und den stabilen Anpressdruck können präzise Ablationsläsionen erzielt werden. Zudem können mit dem flexiblen Katheter anatomisch schwierige Positionen wie akzessorische Bahnen im Bereich der Mitralklappe oder Substrate bei Patienten mit angeborenen Herzfehlern besser erreicht werden. Das Risiko einer mechanischen Terminierung einer klinischen Tachykardie sowie die Häufigkeit einer mechanischen Induktion von Arrhythmien durch den Katheter während des Mappingvorgangs, kann durch Verwendung des MNS verringert werden, beispielsweise bei der Ablation von idiopathischen Kammertachykardien im rechtsventrikulären Ausflusstrakt (7).
Ein Nachteil des MNS besteht in den langen Untersuchungszeiten. Diese sind zum Teil durch den komplexen Aufbau des Systems bedingt, insbesondere wenn eine Integration mit einem elektroanatomischen Mapping System verwendet wird. Zudem kann in erster Linie der Ablationskatheter magnetisch gesteuert werden. Für die Steuerung zusätzlicher Katheter wird ein (zusätzlicher) steriler Untersucher am Tisch benötigt, sofern nicht ein weiteres Steuerungssystem (Vdrive) zum Einsatz kommt.
Weltweit wurden bisher über 100 000 Patienten mit dem MNS behandelt. Mit Genesis RMN wurde im April 2019 die neueste Generation des Systems präsentiert. Die Magnete wurden verkleinert und auf flexiblen Roboterarmen montiert, wodurch eine raschere Ansprechzeit und grössere Flexibilität erreicht werden konnte. In Kombination mit einer angepassten Röntgenanlage soll ein vollintegrierter robotischer Interventionsraum entstehen (8). Ein weiteres MNS der Firma AEON Scientific, einem Spin-off der ETH Zürich, wurde in den Jahren 2012-2015 bis zum Erhalt des CE-Mark entwickelt (Abb. 2). Anstelle von Permanentmagneten werden bei diesem System Katheter durch veränderbare elektromagnetische Felder gesteuert. Ein erstes System konnte erfolgreich bei Patienten verwendet werden. Derzeit laufen an der ETH Zürich Forschungsarbeiten für eine nächste Generation mit verkleinerten Elektromagneten.
Robotische elektromechanische Katheternavigation
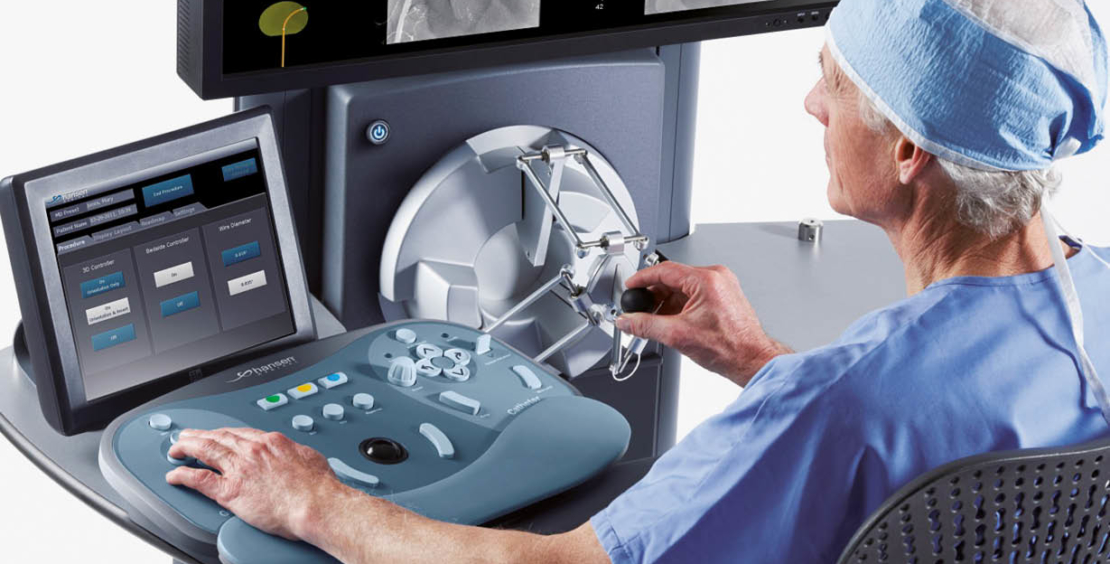
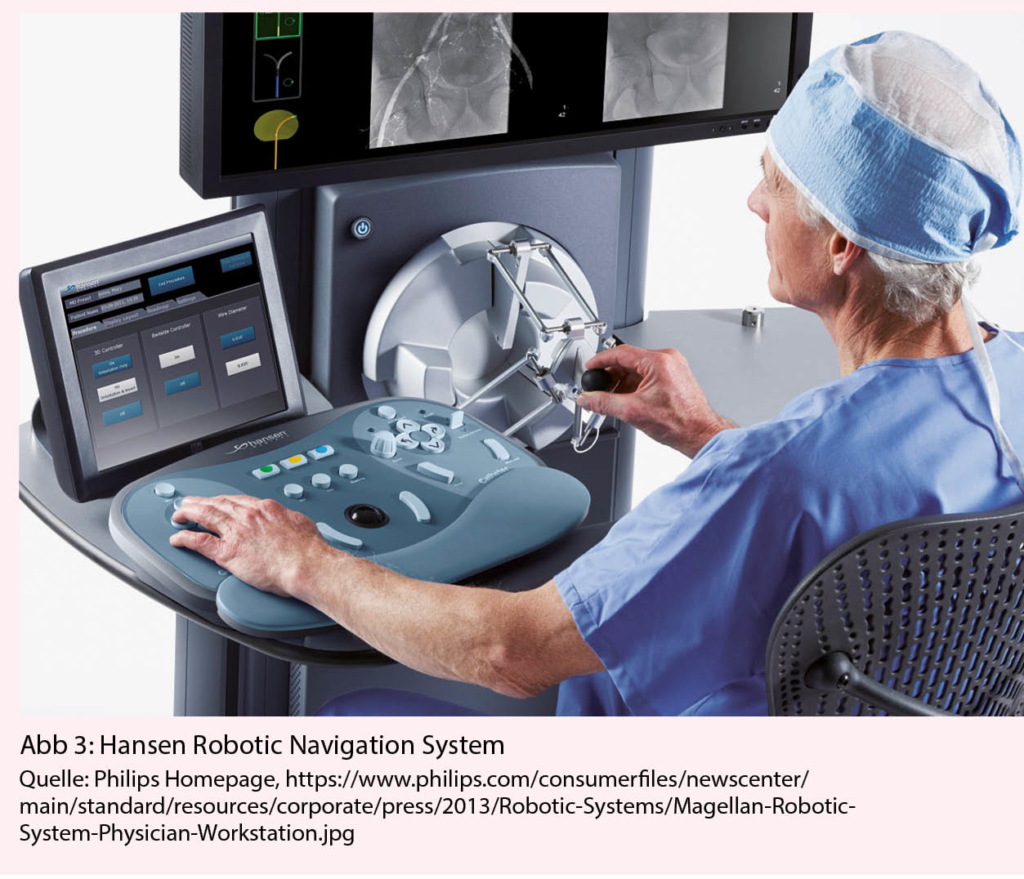
Beim Sensei RNS erfolgt die Steuerung über eine 14 F äussere sowie eine 10.5 F innere Schleuse, welche über Drahtzüge direkt mit einem Roboterarm verbunden ist. Der Roboterarm wiederum wird über einen 3D Joystick im Kontrollraum ferngesteuert (Abb. 3). Das RNS ist mit gängigen elektroanatomischen Mappingsystemen kompatibel. Prinzipiell können sämtliche Standardablationskatheter verwendet werden, die durch die innere Schleuse passen. Praktisch eignen sich Katheter am besten, bei denen die Kurve mittels eines Zugdrahtes erzeugt wird. Katheter mit einem Zugband können nur in eine Richtung gebogen werden, wodurch die Bewegungsfreiheit in Zusammenhang mit der steuerbaren Schleuse eingeschränkt ist.
In verschiedenen Studien wurde die Sicherheit und Effektivität des RNS zu Ablation von supraventrikulären oder ventrikulären Arrhythmien dokumentiert. Es konnte eine Reduktion der Röntgenstrahlenexposition, insbesondere für den Untersucher, gezeigt werden. Einen wesentlichen Fortschritt stellte die Verwendung von Kathetern dar, mit denen der Anpressdruck an das Myokard gemessen werden kann. Hierdurch kann die Sicherheit und Effektivität des Eingriffs verbessert werden. Eine Metaanalyse über robotische Ablationen bei Patienten mit Vorhofflimmern zeigt jedoch eine hohe Heterogenität der Studien und eine ungenügende Evidenz um eine Überlegenheit der Methode gegenüber manuellen Verfahren nachzuweisen (9). In der grössten multizentrischen randomisierten Studie konnte eine äquivalente Effektivität und Komplikationsrate der robotischen Navigation gegenüber manuellen Ablationstechniken gezeigt werden, allerdings mit signifikant längerer Untersuchungsdauer (10).
Im Gegensatz zu den magnetisch gesteuerten Systemen sind dem RNS bezüglich Flexibilität und Erreichbarkeit komplizierter anatomischer Bereiche ähnliche Grenzen gesetzt wie manuell gesteuerten Kathetern. Die Herstellerfirma Hansen Medical wurde 2002 von Dr. Fred Moll, einem Pionier im Bereich medizinischer Roboteranwendungen gegründet. Hansen Inc. wurde im Jahr 2006 von Auris medical übernommen, welches im April 2019 wiederum von Johnson & Johnson aufgekauft wurde (11). Bei Auris medical stand in den letzten Jahren die Entwicklung des endoskopischen Robotersystems Monarch im Vordergrund, welches für Anwendungen der Pneumologie konzipiert ist (12).
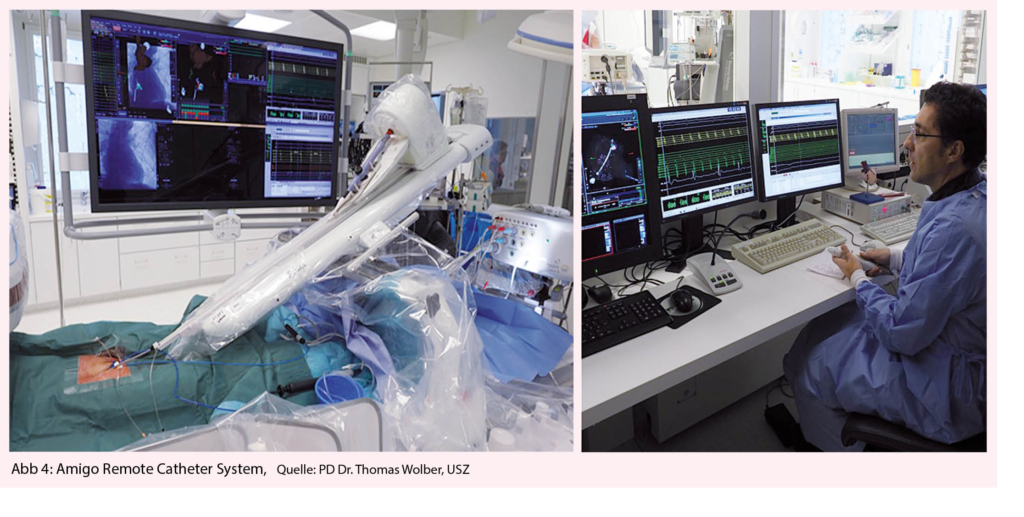
Amigo Remote Catheter System (RCS)
Beide etablierten Systeme sind technisch aufwändig und mit erheblichen Kosten und räumlichen Anforderungen verbunden. Im Jahr 2005 wurde daher der Prototyp eines Systems entwickelt, das kostengünstig und flexibel sein sollte. Es handelt sich um einen transportablen Roboterarm, der in der Lage ist, kommerziell erhältliche Katheter verschiedener Anbieter über deren integrierte Steuergriffe zu navigieren (13). Unter dem Namen Amigo wurde das System von der Firma Catheter Robotics (Mount Olive, NJ, USA; ab 2017 umbenannt in Catheter precision) zur Marktreife entwickelt (Abb. 4). Ab 2010 wurde in verschiedenen Studien gezeigt, dass mit dem Amigo RCS ein präzises Mapping (14) möglich ist verschiedene Arrhythmien inclusive supraventrikulärer Tachykardien, Vorhofflattern (15), Vorhofflimmern (16) und Kammertachykardien möglich ist, mit zu manuellen Verfahren vergleichbaren Langzeitergebnissen (17). Im Vergleich zu anderen robotischen Systemen sind die Kosten für Anschaffung und Verbrauchsmaterial deutlich niedriger als bei anderen Systemen. Auch im klinischen Alltag ist das System flexibel und mit geringem Aufwand einsetzbar (18). Dennoch war dem System kein grösserer kommerzieller Erfolg beschieden und eine geplante Version 2 wurde bislang nicht realisiert.
Robotische Technik im Spannungsfeld zwischen Fortschritt und Ökonomie
Mittelfristig kann sich ein robotische Navigationssystem nur durchsetzen, wenn es im klinischen Alltag einen klaren Mehrwert vermitteln kann. Robotische Navigationssysteme sind im Vergleich zu manuellen Techniken mit höheren Kosten und längeren Interventionsdauern verbunden. Diese lassen sich nur rechtfertigen, wenn entweder bei Routineeingriffen die Langzeitergebnisse besser sind als die von etablierten Verfahren, oder wenn mit robotischer Technik Eingriffe möglich sind, welche manuell nicht durchführbar sind. Eine Überlegenheit bei Routineeingriffen konnte bislang nicht dargelegt werden. Das Argument einer Reduktion der Röntgenexposition für Patient und Untersucher verliert aufgrund der aktuellen technischen Entwicklung an Bedeutung, welche durch den vermehrten Einsatz von dreidimensionalen Mappingsystemen zu einer signifikanten Reduktion der benötigten Röntgenstrahlung geführt hat. Bereits heute werden verschiedene Eingriffe röntgenfrei durchgeführt. Bereiche, in denen magnetische Katheternavigation längerfristig Vorteile bieten sind die Ablation von Kammertachykardien und die Behandlung von Arrhythmien bei Patienten mit kongenitalen Herzerkrankungen, bei denen mit dem MNS Bereiche behandelt werden können, welche ansonsten aufgrund der spezifischen Anatomie nur schwer zugänglich sind (19). Die Entwicklung neuartiger Katheter mit variabler Steifigkeit und mehreren Freiheitsgraden (20, 21) wird neue Impulse vermitteln.
Universitäres Herzzentrum
Universitätsspital Zürich
Raemistrasse 100
8091 Zürich
thomas.wolber@usz.ch
Universitäres Herzzentrum
Universitätsspital Zürich
Raemistrasse 100
8091 Zürich
Die Autoren haben keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
- Aus heutiger Sicht sind robotische Verfahren in der Elektrophysiologie manuellen Verfahren nur in ausgewählten Situationen überlegen.
- Die Entwicklung hat nach anfänglicher Euphorie vorerst an Schwung verloren.
- Mittelfristig sind jedoch durch Integration von neuen Möglichkeiten der Bild- und Signalverarbeitung, künstlicher Intelligenz und Entwicklung neuartiger Katheter mit variabler Steifigkeit und mehreren Freiheits-graden neue Impulse zu erwarten.
Messages à retenir
- De nos jours, les méthodes robotiques en électrophysiologie ne sont supérieures aux méthodes manuelles que dans certaines situations.
- Après l’ euphorie initiale, le développement s’ est pour l’ instant
essoufflé. - A moyen terme, on peut toutefois s’ attendre à de nouvelles impulsions grâce à l’ intégration de nouvelles possibilités de traitement de l’ image et du signal, à l’ intelligence artificielle et au développement de
nouveaux cathéters à rigidité variable et à plusieurs degrés de liberté.
1. Doulamis IP, Spartalis E, Machairas N, Schizas D, Patsouras D, Spartalis M, u. a. The role of robotics in cardiac surgery: a systematic review. J Robot Surg. Februar 2019;13(1):41–52.
2. Yanagawa F, Perez M, Bell T, Grim R, Martin J, Ahuja V. Critical Outcomes in Nonrobotic vs Robotic-Assisted Cardiac Surgery. JAMA Surg. August 2015;150(8):771–7.
3. Mahmud E, Naghi J, Ang L, Harrison J, Behnamfar O, Pourdjabbar A, u. a. Demonstration of the Safety and Feasibility of Robotically Assisted Percutaneous Coronary Intervention in Complex Coronary Lesions: Results of the CORA-PCI Study (Complex Robotically Assisted Percutaneous Coronary Intervention). JACC Cardiovasc Interv. 10 2017;10(13):1320–7.
4. Weisz G, Metzger DC, Caputo RP, Delgado JA, Marshall JJ, Vetrovec GW, u. a. Safety and feasibility of robotic percutaneous coronary intervention: PRECISE (Percutaneous Robotically-Enhanced Coronary Intervention) Study. J Am Coll Cardiol. 16. April 2013;61(15):1596–600.
5. Turagam MK, Atkins D, Tung R, Mansour M, Ruskin J, Cheng J, u. a. A meta-analysis of manual versus remote magnetic navigation for ventricular tachycardia ablation. J Interv Card Electrophysiol. September 2017;49(3):227–35.
6. Shurrab M, Danon A, Lashevsky I, Kiss A, Newman D, Szili-Torok T, u. a. Robotically assisted ablation of atrial fibrillation: a systematic review and meta-analysis. Int J Cardiol. 5. November 2013;169(3):157–65.
7. Konstantinidou M, Koektuerk B, Wissner E, Schmidt B, Zerm T, Ouyang F, u. a. Catheter ablation of right ventricular outflow tract tachycardia: a simplified remote-controlled approach. Europace. Mai 2011;13(5):696–700.
8. Stereotaxis – Investors – Press Release [Internet]. [zitiert 19. Mai 2019]. Verfügbar unter: http://ir.stereotaxis.com/phoenix.zhtml?c=179896&p=irol-newsArticle&ID=2398004
9. Zhang W, Jia N, Su J, Lin J, Peng F, Niu W. The comparison between robotic and manual ablations in the treatment of atrial fibrillation: a systematic review and meta-analysis. PLoS ONE. 2014;9(5):e96331.
10. Rillig A, Schmidt B, Di Biase L, Lin T, Scholz L, Heeger CH, u. a. Manual Versus Robotic Catheter Ablation for the Treatment of Atrial Fibrillation: The Man and Machine Trial. JACC Clin Electrophysiol. August 2017;3(8):875–83.
11. Johnson J&. Johnson & Johnson Announces Completion of Acquisition of Auris Health, Inc. [Internet]. [zitiert 19. Mai 2019]. Verfügbar unter: https://www.prnewswire.com/news-releases/johnson–johnson-announces-completion-of-acquisition-of-auris-health-inc-300822106.html
12. Monarch Platform Technology Recognized For Outstanding Innovation – Auris Health [Internet]. [zitiert 19. Mai 2019]. Verfügbar unter: https://www.aurishealth.com/about/press-releases/Auris-Monarch-Wins-Multiple-Awards-Innovative-Technology-Design.html
13. Shaikh Z, Eilenberg M, Cohen T. The AmigoTM Remote Catheter System: From Concept to Bedside. J Innov Cardiac Rhythm Manage. 9. August 2017;8(8):2795–802.
14. Khan EM, Frumkin W, Ng GA, Neelagaru S, Abi-Samra FM, Lee J, u. a. First experience with a novel robotic remote catheter system: AmigoTM mapping trial. J Interv Card Electrophysiol. August 2013;37(2):121–9.
15. Hoffmayer KS, Krainski F, Shah S, Hunter J, Alegre M, Hsu JC, u. a. Randomized controlled trial of Amigo® robotically controlled versus manually controlled ablation of the cavo-tricuspid isthmus using a contact force ablation catheter. J Interv Card Electrophysiol. März 2018;51(2):125–32.
16. Wutzler A, Wolber T, Parwani AS, Huemer M, Attanasio P, Blaschke F, u. a. Robotic ablation of atrial fibrillation with a new remote catheter system. J Interv Card Electrophysiol. September 2014;40(3):215–9.
17. Datino T, Arenal A, Ruiz-Hernández PM, Pelliza M, Hernández-Hernández J, González-Torrecilla E, u. a. Arrhythmia ablation using the Amigo Robotic Remote Catheter System versus manual ablation: One year follow-up results. Int J Cardiol. 1. Januar 2016;202:877–8.
18. Wutzler A, Wolber T, Haverkamp W, Boldt L-H. Robotic ablation of atrial fibrillation. J Vis Exp. 29. Mai 2015;(99):e52560.
19. Ernst S, Saenen J, Rydman R, Gomez F, Roy K, Mantziari L, u. a. Utility of noninvasive arrhythmia mapping in patients with adult congenital heart disease. Card Electrophysiol Clin. März 2015;7(1):117–23.
20. Chautems C, Nelson BJ. The tethered magnet: Force and 5-DOF pose control for cardiac ablation. In: 2017 IEEE International Conference on Robotics and Automation (ICRA). 2017. S. 4837–42.
21. Chautems C, Tonazzini A, Floreano D, Nelson BJ. A variable stiffness catheter controlled with an external magnetic field. In: 2017 IEEE/RSJ International Conference on Intelligent Robots and Systems (IROS). 2017. S. 181–6.
info@herz+gefäss
- Vol. 9
- Ausgabe 5
- September 2019