- ESMO 2019 Barcelona
EDITORIAL (R)Evolution durch innovative Strategien
In diesem Jahr fand die Tagung der European Society for Medical Oncology (ESMO, 27.9.-1.10.2019) in Barcelona statt. Auch diesmal wurde dem aufmerksamen Publikum eine unüberschaubare Flut an neuen Studienergebnissen präsentiert. Doch insgesamt war der Kongress mehr von Weiterentwicklungen sprich Evolution anstatt von revolutionär Neuem geprägt. Im Mittelpunkt stand, wie nicht anders zu erwarten, die Immuntherapie mit den Checkpoint-Inhibitoren. Ihr Siegeszug durch die Onkologie ist ungebrochen. Für das malige Melanom liegen jetzt die 5-Jahresdaten vor. Nach dieser Zeit ist noch jeder zweite mit einem fortgeschrittenen malignen Melanom am Leben (CheckMate 067-Studie). Vor 10 Jahren war es nur jeder zwanzigste Betroffene (5%). Das ist ein gewaltiger Fortschritt.
Beim NSCLC konnte jetzt wie schon beim malignen Melanom gezeigt werden, dass die duale Checkpoint-Blockade im Vergleich zur Monotherapie das Überleben verbessert. Und auch beim kleinzelligen Bronchialkarzinom, wo sich in den letzten Jahrzehnten wenig getan hat, kann mit einem Checkpoint-Inhibitor, nämlich Atezolizumab, die Lebenszeit verlängert werden (IMpower 133-Studie). Beim fortgeschrittenen Plattenepithel des Ösophagus punktete der Checkpint-Inhibitor Nivolumab im Vergleich zur bisherigen platinbasierten Chemotherapie hinsichtlich PFS und vor allem Verträglichkeit bzw. Lebensqualität (ATTRACTION 3-Studie). Und beim triple-negativen Mammakarzinom kann durch die zusätzliche Gabe von Pembrolizumab die Rate an kompletten pathologischen Remissionen gesteigert werden, was einen Indikator für ein besseres Überleben darstellt (KEYNOTE-522-Studie).
Bei den zielgerichteten Substanzen überzeugt Osimertinib beim NSCLC als First line auch im Langzeitverlauf im Vergleich zu den TKIs der ersten und zweiten Generation (FLAURA-Studie). Sogar das Ansprechen auf die Folgetherapie war nach einer primären Gabe dieser Substanz günstiger.
Beim fortgeschrittenen Ovarialkarzinom drängen die PARP-Inhibitoren in die Frontline. Neben Olaparib (PAOLA-1-/ENGOT-ov25-Studie) hat sich auch Veliparib in der Erhaltungstherapie bewährt (VELIA/GOG-3005-Studie). Auch scheint die Wirksamkeit selbst dann gegeben zu sein, wenn keine genetischen Biomarker wie BRCA1/2mut vorliegen. Beim Prostatakarzinom gibt es ebenfalls eine Reihe von Genmarkern wie BCRA1/2mut. Jetzt konnte erstmals gezeigt werden, dass ein PARP-Inhibitor, nämlich Olaparib auch bei Patienten mit einem BRCA1/2mut wirkt (PROfound-Studie). Dies dürfte der Einstieg in eine individualisierte an Genmarkern orientierte massgeschneiderte Therapie auch beim Prostatakarzinom sein, wie sie beispielsweise heute schon beim NSCLC der Standard ist.
Für Patientinnen mit einem fortgeschrittenen bzw. metastasierten ER+ HER2- Mammakarzinom stellen die CDK4/6-Inhibitoren eine wertvolle Bereicherung dar. In der MONARCH 2-Studie konnte für Abemaciclip, in der MONALEESA-Studie für Ribociclip in Kombination mit Fulvestrant eine Lebensverlängerung im Vergleich zur alleinigen Hormontherapie dokumentiert werden.
Eine individualisierte Therapie beim NSCLC erfordert ein umfassendes Genprofiling, wobei auch ein ALK-Arrangement erfasst werden sollte. Doch die Gewinnung einer Biopsie ist nicht immer einfach und ausserdem für den Patienten belastend. Da bietet die Blutanalyse, aus der Tumor-DNA-Bruchstücke mittels NGS analysiert werden können, einen wesentlichen Fortschritt. Jetzt konnte erstmals im Rahmen einer prospektiven Studie (BFAST) anhand von Therapieergebnissen gezeigt werden, dass mittels einer solchen Liquid Biopsy die ALK-Mutation zuverlässig nachgewiesen werden kann.
Ich hoffe, dieser kleine Ausschnitt hat Ihr Interesse geweckt, sich umfassend über das Neue zu informieren. Die Redaktion von info@onkologie war wieder vor Ort und hat das Wichtigste und Interessanteste für Sie, liebe Leser, zusammengetragen.
Viel Spass bei Lesen der spannenden Inputs!
Eleonore E. Droux,
Verlegerin & Publizistische Leitung
Osimertinib beim NSCLC
Auch das OS wird verlängert
In der FLAURA-Studie konnte gezeigt werden. dass der TKI-Inhibitor der dritten Generation Osimertinib (Tagrisso®) beim EGFR-mutierten NSCLC das PFS im Vergleich zu den TKI-Inhibitoren der ersten Generation (Erlotinib und Gefitinib) signifikant verlängert. Jetzt wurden auch Daten zum OS vorgestellt.
Osimertinib ist ein EGFR-spezifischer Tyrosinkinaseinhibitor der 3. Generation, der nicht nur bei EGFRmut sondern auch bei der EGFR T790M-Resistenzmutation eine Wirksamkeit zeigt. Im Rahmen der FLAURA-Studie wurde Osimertinib (Tagrisso®) mit den TKI-Inhibitoren der 1. Generation Erlotinib und Gefitinib bei Patienten mit einem EGFRmut fortgeschrittenen NSCLC verglichen. Dabei zeigte Osimertinib bzgl. PFS einen signifikanten Vorteil, so dass diese Substanz heute als Standard in der First line bei dieser Indikation gilt. Später zeigte sich, dass die Patienten von Osimertinib in der Erstlinie auch nach einem Progress profitieren und zwar in Form einer deutlich längeren Zeit bis zum Zweitlinienprogress. Hinweise, dass Resistenzen unter Osimertinib zu einer aggressiven Tumorbiologie bzw. vermehrt zu Resistenzen unter einer Zweitlinientherapie führen, ergaben sich nicht.
Die jetzt vorgestellten Daten zum OS bestätigen die Überlegenheit von Osimertinib. Die OS-Rate lag nach einem Jahr bei 89% unter Osimertinib im Vergleich zu 83% unter den Komparatoren. Die Vergleichszahlen nach 2 Jahren waren 74% vs. 59% und nach 3 Jahren 54% vs. 44%. Das mediane PFS betrug unter Osimertinib 38,6 Monate, unter den Komparatoren dagegen nur 31,8 Monate (HR 0,799; p = 0,0462). Die Überlegenheit von Osimertinib fand sich in allen Subgruppen. «Die finalen OS-Daten unterstreichen den Stellenwert von Osimertinib als Standard in der First line beim fortgeschrittenen EGFRmut-NSCLC», so der Studienautor Prof. Suresh Ramalingam, Atlanta.
PS
LBA5_PR , ESMO 2019, 28.9.2019 in Barcelona
Fortgeschrittenes Blasenkarzinom
Kombination Atezolizumab plus Chemotherapie verbessert das PFS
Im Rahmen der IMvigor130-Studie wurde bei Patienten mit einem metastasierten bzw. fortgeschrittenen muskelinvasiven Blasenkarzinom die alleinige Chemotherapie mit der Kombination platinbasierte Chemotherapie plus Immuntherapie (Atezolizumab) verglichen. Die Ergebnisse sprechen für die Kombination mit dem Checkpoint-Inhibitor.
Aufgenommen in diese Studie wurden bisher unbehandelte Patienten mit einem fortgeschrittenen bzw. metastasierten Blasenkarzinom und zwar unabhängig davon, ob sie für eine Cisplatin-Chemotherapie geeignet waren oder nicht. Die PFS-Event-Rate lag unter der Kombination bei 74%, unter der alleinigen Chemotherapie bei 82%. Beim PFS standen 6,3 Monate unter der Chemotherapie 8,2 Monate unter der Kombination gegenüber (HR 0.82; p = 0,007). Bei der intention-to-treat-Interims-Analyse zeigte sich auch eine Verbesserung des OS, allerdings ohne statistische Signifikanz (HR 0,83; medianes OS 16,0 Monate vs. 13,4 Monate). Die Response-Rate betrug bei der Kombination 47,4% im Vergleich zu 43,8% bei der Chemotherapie. Eine komplette Remission erreichten 12,5% in der Kombi-Gruppe und 6,8% in der Chemotherapie-Gruppe «Dies ist die erste Studie, die einen Vorteil der Immuntherapie in Kombination mit einer Chemotherapie bei Patienten mit einem fortgeschrittenen bzw. metastasierten Blasenkarzinom nachgewiesen hat», so der Studienautor Prof. Enrique Grande, Madrid.
PS
LBA14_PR, ESMO 2019, 30.9.2019 in Barcelona
Fortgeschrittenes HR+ HER2- Mammakarzinom
CDK4/6-Inhibitor verlängert das Leben um über 9 Monate
Im Rahmen der MONARCH 2-Studie konnte für den CDK4/6-Inhibitor Abemaciclip (Verzenios®) in Kombination mit Fulvestrant im Vergleich zur alleinigen Gabe von Fulvestrant bei Patientinnen mit einem fortgeschrittenen HR+HER2- Mammakarzinom eine deutliche Lebensverlängerung dokumentiert werden und auch der Beginn einer Chemotherapie konnte um über 2 Jahre verschoben werden.
Die Daten zum OS geben die Antwort auf die Frage, ob die Überlegenheit sich nicht nur beim kurzfristigen PFS sondern auch langfristig beim OS zeigt. Nach 3 Jahren wurde das mediane PFS durch die zusätzliche Gabe von Abemaciclip von 9,3 Monate unter Placebo auf 16,9 Monate verlängert und das PSF-freie Überleben von 10,1% auf 29,9% angehoben. Das OS stieg von 37,3 Monate auf 46,7 Monate, dies bedeutet eine Lebensverlängerung um 9,4 Monate (HR 0,757; p = 0,0137). Die Zeit bis zum Beginn einer Chemotherapie wurde von 22,1 Monate auf 50,2 Monate verlängert. Die Überlegenheit von Abemaciclip fand sich in allen Subgruppen. Auch Patientinnen mit einer ungünstigen Prognose (viszerale Metastasierung, primäre Resistenz gegenüber einer hormonellen Therapie) profitierten in gleichem Mass von dem CDK6/9-Inhibitor. Das Sicherheitsprofil der Substanz entsprach dem in früheren Studien. «Wichtig im Hinblick auf die Lebensqualität der Patientinnen ist, dass der Beginn einer Chemotherapie durch Abemaciclip um über zwei Jahre nach hinten verschoben werden kann», so der Studienautor Prof. George W. Sledge, Stanford.
PS
LBA6_PR, ESMO 2019, 29.9.2019 in Barcelona
Metastasiertes, kastrationsresistentes Prostatakarzinom
Cabazitaxel ist Abirateron bzw. Enzalutamid überlegen
Im Rahmen der CARD-Studie wurde untersucht, welche Strategie bei Patienten mit einem kastrationsresistenten metastasierten Prostatakarzinom nach einer vorangegangenen Therapie mit Docetaxel und einem Androgenrezeptor-Inhibitor die effektivste ist? Cabazitaxel oder der andere Androgenrezeptor-Inhibitor?
Frühere Studien haben gezeigt, dass bei Patienten mit einem metastasierten kastrationsresistenten Prostatakarzinom, welches mit einem Androgenrezeptor-Inhibitor (Abirateron oder Enzalutamid) behandelt wurde, im Falle einer Progression die Umstellung auf die andere Substanz nicht unbedingt sinnvoll ist. Doch bei Patienten, die unter Docetaxel eine Progression zeigen, entfaltet Cabazitaxel noch eine Wirksamkeit.
Im Rahmen der CARD-Studie wurde bei 255 Patienten mit entsprechender Vorbehandlung mit Docetaxel und einem Androgenrezeptor-Inhibitor die Wirksamkeit von Cabazitaxel oder dem anderen Androgenrezeptor-Inhibitor (Abirateron statt Enzalutamid der vice versa) miteinander verglichen. Unter Cabazitaxel war der primäre Endpunkt nämlich das radiografische PFS (rPFS) um 4,3 Monate länger (8,0 Monate vs. 3,7 Monate; HR 0,54; p < 0,0001). Die Überlegenheit des Chemotherapeutikums war in allen Subgruppen nachweisbr und auch unabhängig davon, in welcher Reihenfolge die Androgenrezeptor-Inhibitoren eingesetzt wurden. Beim PFS standen 4,4 Monate unter Cabazitaxel 2,7 Monate unter dem Androgenrezeptor-Inhibitor gegenüber (HR 0,52; p < 0,0001). Aber nicht nur das PFS sondern auch das OS war unter Cabazitaxel länger (13,6 Monate vs. 11,0 Monate; HR 0,64; p = 0,0078). Signifikante Unterschiede zugunsten von Cabazitaxel gab es auch bei der Abnahme des PSA-Wertes (35,7% vs. 13,5%), beim objektiven Tumoransprechen (36,5% vs. 11,5%) und bei der Schmerzkontrolle (45,0% vs. 19,3%). Die Zeit bis zum Auftreten einer ossären Komplikation betrug bei dem Androgenrezeptor-Inhibitor 16,7 Monate und wurde bei Cabazitaxel nicht erreicht. «Diese Daten sprechen eindeutig für Cabazitaxel in dieser Situation», so der Studienautor Prof. Ronald de Wit, Rotterdam.
PS
LBA13_PR, ESMO 2019; 30.9.2019 in Barcelona
Fortgeschrittenes Cholangiokarzinom
IDH1-Inhibitor verlängert das PFS
Ivosidenib (Tibsovo®) ist ein niedermolekularer Inhibitor des IDH1-Enzyms, dessen Gen bei einer Reihe von malignen Erkrankungen wie der AML, aber auch beim Cholangiokarzinom mutiert ist. Im Rahmen der ClarlDHy-Studie wurde die Substanz erstmals bei Patienten mit einem Cholangiokarzinom geprüft.
Aufgenommen in diese Phase-III-Studie wurden 185 Patienten mit einem fortgeschrittenen bzw. metastasierten Cholangiokarzinom, bei denen eine IDH1-Mutation nachgewiesen werden konnte und die bereits mindestens eine Chemotherapie erhalten hatten. Sie erhielten randomisiert Ivosidenib oder Placebo. Das mediane PFS konnte mit dieser Substanz von 1,4 Monate auf 2,7 Monate verlängert werden. Die PFS-Rate lag nach einem Jahr unter dem Medikament bei 22%, unter Placebo bei 0% (HR 0,37; p < 0,001). Auch die Disease Control Rate stieg von 28% unter Placebo auf 53% unter Ivosidenib. «Dies ist die erste Studie, die einen Fortschritt bei diesem sehr aggressiven Tumor durch eine orale Substanz zeigt», so der Studienautor Prof. Ghassan Abou-Alfa, New New York.
PS
LBA10_PR, ESMO 2019, 30.9.2019 in Barcelonan
Fortgeschrittenes kleinzelliges Lungenkarzinom (SCLC)
Atezolizumab verlängert das Leben
Nach 3 Jahrzehnten gibt es erstmals einen Fortschritt beim SCLC. Durch die zusätzliche Gabe des PD-L1-Inhibitors Atezolizumab (Tecentriq®) zusätzlich zur Chemotherapie wird nicht nur das PFS sondern auch das OS relevant verlängert.
15% der Lungenkarzinome sind kleinzellig. Diese Tumoren haben eine sehr schlechte Prognose, d.h. die durchschnittliche Lebenserwartung liegt unter einem Jahr. Und daran hat sich in den letzten 3 Jahrzehnten nichts geändert. Die bisherige Standardtherapie in einem fortgeschrittenen Stadium ist eine platinbasierte Chemotherapie (Cis- oder Carboplatin) plus Etoposid für 4 bis 6 Zyklen. Da das SCLC häufig eine hohe Mutationslast zeigt, die mit der Expression von Neoantigenen assoziiert sind, dürfte eine Immuntherapie eine vielversprechende Therapieoption darstellen.
Im Rahmen der IMpower 133-Studie wurde die Gabe des monoklonalen Anti-PD-L1-Antikörpers Atezolizumab zusätzlich zur Chemotherapie prospektiv und randomisiert mit der alleinigen Chemotherapie verglichen. Eingeschlossen wurden 403 Patienten mit einem fortgeschrittenen SCLC. Als primäre Endpunkte wurden das PFS und das OS definiert. Das mediane PFS wurde durch den Checkpoint-Inhibitor verlängert, nämlich von 4,3 Monate auf 5,2 Monate (HR 0,77: p = 0,02). Das 1-Jahresüberleben lag unter Atezolizumab bei 51,7% im Vergleich zu nur 38,2% bei der alleinigen Chemotherapie und das 1-Jahres-PFS betrug 12,6% in der Atezolizumab-Gruppe und 5,4% unter der alleinigen Chemotherapie.
Jetzt wurden die OS-Daten vorgestellt. Das mediane OS lag bei einem medianen Follow-up von 22,9 Monaten unter der Kombination bei 12,3 Monate im Vergleich zu 10,3 Monate unter der alleinigen Chemotherapie (HR 0,76; p = 0,0154). Nach 1 Jahr lebten noch 51,9% unter der Kombination mit Atezolizumab und 39% unter der alleinigen Chemotherapie, nach 18 Monaten waren es 34% bzw. 21%. «Das ist ein wesentlicher Fortschritt bei diesem Tumor, zumal der Gewinn an Lebenszeit nicht zu Lasten der Lebensqualität ging», so Prof. Martin Reck, Grosshannsdorf.
PS
ESMO 2019, 28.9.2019 in Barcelona
Kombinierte Immuntherapie beim malignen Melanom
Nach fünf Jahren lebt noch jeder zweite Patient
Im Rahmen der CheckMate 067-Studie wurde die kombinierte Immuntherapie (Nivolumab (Opdivo®) + Ipilimumab) mit der Nivolumab-Monotherapie und der Ipilimumab-Monotherapie bei Patienten mit einem fortgeschrittenen malignen Melanom verglichen. Jetzt wurden die 5-Jahresergebnisse vorgestellt.
Aufgenommen in diese Studie wurden 945 Patienten mit einem malignen Melanom im Stadium III oder IV. Sie wurden randomisiert placebokontrolliert entweder mit der Kombination Nivolumab + Ipilimumab oder nur mit Nivolumab oder nur mit Ipilimumab behandelt.
Die 5-Jahresüberlebensrate betrug bei der Kombination 52% im Vergleich zu 44% bei der Nivolumab-Monotherapie bzw. 26% bei der Ipilimumab-Monotherapie. «Das ist der grösste Fortschritt, den wir jemals beim malignen Melanom gesehen haben», so der Studienleiter Professor James Larkin, London. Vor zehn Jahren habe die 5-Jahresüberlebensrate noch bei ca. 5% gelegen. Bei Ipilimumab vergingen 8 Monate, bis die Therapie umgestellt werden musste, aber 25,2 Monate bei der Nivolumab-Monotherapie. Bei der Kombination war dieser Endpunkt noch nicht erreicht. Nach 5 Jahren betrug der Anteil der Patienten ohne Folgetherapie bei Ipilimumab 45% und bei Nivolumab 58%, bei der Kombination aber 74%.
In beiden Nivolumab-Gruppen war die Lebensqualität unter der Therapie nicht beeinträchtigt. Bei Patienten, die wegen Nebenwirkungen die Therapie unterbrechen mussten, wurde durch eine solche Therapiepause der Therapieerfolg nicht beeinträchtigt. «Die Überlegenheit von Nivolumab war unabhängig von der PD-L1-Expression und dem BRAF-Mutationsstatus», so Larkin. Bei der grossen Gruppe von Patienten mit einer BRAF-Mutation lag die 5-Jahresüberlebensrate unter Ipilimumab bei 30%, unter der Nivolumab-Monotherapie bei 46% und unter der Kombination bei 60%.
«Der Vorteil der Nivolumab-Therapie stieg mit jedem Follow-up-Jahr auf zuletzt 8%», so die Kommentatorin Dr. Teresa Amaral, Tübingen. Doch die Frage, ob bei einer BRAF-Mutation primär die kombinierte Immuntherapie oder eine kombinierte Targeted-Therapie eingesetzt werden sollte, könne nur in einer direkten Vergleichsstudie beantwortet werden. In der COMBI-d- und COMBI-v-Studie lag die 5-Jahresüberlebensrate unter der kombinierten zielgerichteten Therapie allerdings nur bei 34%, was für die primäre Gabe von Nivolumab spricht.
PS
ESMO 2019, 27.9.2019 in Barcelona
Fortgeschrittenes ER+ HER2- Mammakarzinom
Ribociclip verbessert signifikant das Überleben
Die Daten der MONALEESA-3-Studie belegen die überzeugende und anhaltende Wirkung des CDK4/6-Inhibitors Ribociclip (Kisqali®) in Kombination mit Fulvestrant bei Frauen mit einem fortgeschrittenen ER+ HER2- Mammakarzinom. Diese ist unabhängig davon, ob der CDK4/6-Inhibitor in der First line oder Second line eingesetzt wird.
Eingeschlossen in diese Studie wurden 726 Patientinnen, die randomisiert entweder Fulvestrant plus Placebo oder Fulvestrant plus Ribociclip erhielten. Bei einer Auswertung nach im Durchschnitt 40 Monaten war das OS in der Ribociclip-Gruppe noch nicht erreicht, in der Placebo-Gruppe betrug dieses 40,0 Monate. Das geschätzte Überleben nach 42 Monaten lag bei 57,8% unter Ribociclip vs. 45,9% unter Placebo. 25% der Patientinnen waren bei der Auswertung nach 42 Monaten noch unter dieser Therapie, aber nur 13% in der Placebo-Gruppe. Die relative Risikoreduktion betrug 28%. Die Überlegenheit von dem CDK4/6-Inhibitor war unabhängig davon, ob die Substanz in der First line oder bei einem frühen Relapse bzw. in der Second line eingesetzt wurde. «Diese Daten unterstreichen den Stellenwert von Ribociclip beim fortgeschrittenen ER+ HER2- Mammakarzinom, d.h. die Substanz führt zu einer signifikanten Lebensverlängerung», so Prof. Denis J. Slamon, Los Angeles.
PS
LBA7_PR, ESMO 2019, 29.9.2019 in Barcelona
Neoadjuvante Therapie beim Triple-negativen Mammakarzinom
Mehr komplette pathologische Remissionen unter Pembrolizumab
Erstmals konnte in einer Studie (KEYNOTE-552) gezeigt werden, dass bei Frauen mit einem triple-negativen Mammakarzinom der neoadjuvante Einsatz eines Checkpoint-Inhibitors, nämlich Pembrolizumab (Keytruda®), die Rate an pathologisch bestätigten kompletten Remissionen erhöht. Dies dürfte von prognostischer Relevanz sein.
Patientinnen mit einem Triple-negativen Mammakarzinom sind eine Problemgruppe bzgl. des therapeutischen Managements. Sie haben auch eine deutlich schlechtere Prognose. In der Regel erhalten diese Patientinnen eine neoadjuvante Chemotherapie mit einem Taxan bzw. Anthracyclin. Darunter erreichen ca. 40% eine komplette, auch patholoisch nachweisbare Remission (pCR). Durch die Hinzunahme eines Platin-Präparates kann diese Rate auf 50 bis 55% gesteigert werden. In mehreren Studien incl. Metaanalysen konnte zweifelsfrei gezeigt werden, dass das Erreichen einer pCR auch längerfristig das EFS und auch das OS deutlich verbessert.
Im Rahmen der KEYNOTE-522-Studie ist man der Frage nachgegangen, ob die neoadjuvante Gabe des Checkpoint-Inhibitors Pembrolizumab (Keytruda®) die Rate an pCR steigern kann. Patientinnen mit einem Triple-negativen Mammakarzinom erhielten nach einer 2 : 1-Randomisierung entweder Chemotherapie plus Placebo oder Chemotherapie plus Pembrolizumab 200 mg alle 3 Wochen. Mit dem Immuntherapeutikum konnte die Rate an pCR von 51,2% auf 64,8% gesteigert werden. Dieser Benefit kam alle Patientinnen unabhängig vom PD-L1-Status zugute. Bei PD-L1-positiven wurde die pCR-Rate sogar von 54,9% auf 68,9%, bei PD-L1-negativen von 30,3% auf 45,3 % erhöht. Und dies war auch prognostisch relevant. Das Event-freie Überleben lag nach 18 Monaten in der Pembrolizumab-Gruppe bei 91,3%, in der Placebo-Gruppe nur bei 85,3%. «Dies bedeutet einen wesentlichen Fortschritt für diese Patientinnen mit ungünstiger Prognose», so der Studienautor Prof. Peter Schmid, London.
PS
LBA8_PR, ESMO 2019, 29.9.2019 in Barcelona
ESMO-Präsentation SAKK-Studie 17/16
Lurbinectedin as second or third line palliative chemotherapy in malignant pleural mesothelioma (MPM): A multi-center, single-arm Phase II trial
Während dem ESMO in Barcelona hatte die Schweizerische Arbeitsgemeinschaft für Klinische Krebsforschung (SAKK) das Privileg die 17/16 Studie in einem mündlichen Vortrag zu präsentieren. In dieser einarmigen, multi-zentrischen, internationalen Phase II Studie wurden insgesamt 42 Patienten mit Mesotheliom, progredient auf einer Erstlinien-Chemotherapie mit Platinum-Pemetrexed, mit dem neuen Molekül Lurbinectedin als Zweitlinie (oder Drittlinie, falls vorher auch Immuntherapie verabreicht worden war) behandelt. Der primäre Endpunkt war auf progressionsfreies Überleben (PFS) nach 12 Wochen gesetzt, und sekundäre Endpunkte waren progressionsfreies Überleben, Gesamtüberleben (OS) und Toxizität. Nach einer medianen Beobachtungszeit von 14.9 Monaten haben insgesamt 22/42 (52.4%) Patienten den primären Endpunkt erreicht und somit konnte die Null-Hypothese abgelehnt werden (p=0.015). Das Gesamtansprechen war 4.8% (1 komplette und 1 partielle Remission) und die Krankheitsstabilisierungsrate betrug 52.4%. Das mediane PFS war 4.1 Monate und 6.6 Monate für diejenigen Patienten, welche zumindest eine Stabilisierung ihrer Erkrankung nach 12 Wochen erreicht hatten. Das mediane OS erreichte 11.1 Monate mit einer 12-Monate Überlebenswahrscheinlichkeit von 44.9%. Der Vergleich von Patienten mit epithelioidem vs. nicht-epithelioidem Mesotheliom oder Patienten mit vorheriger Immuntherapie vs. keine, zeigte keinen Unterschied hinsichtlich der Endpunkte der Studie. Diejenigen Patienten mit einer raschen (innerhalb von 6 Monaten) Progression auf Erstlinien-Chemotherapie zeigten mit Lurbinectedin ein verlängertes medianes OS aber ähnliches PFS gegenüber dem Rest (13.3 vs. 8.8 Monate, p=0.023 für OS; 4.3 vs. 3.0 Monate, p=0.349 für PFS). Alle Patienten hatten an Nebenwirkungen gelitten. Grad 3-4 Toxizität von Lurbinectedin wurde in 20/42 (47.66%) beobachtet, hauptsächlich Neutropenie (23.8%) und Fatigue (16.7%). Die Therapie wurde bei keinem Patienten wegen Toxizität abgebrochen.
Diese Resultate machen Lurbinectedin zu einer vielversprechenden Option für Patienten mit progredientem Mesotheliom und sollen nun in einer grösseren, randomisierten Studie evaluiert werden.
Dr. med. Yannis Metaxas
ENZAMET (ANZUP 1304), eine von ANZUP geleitete, internationale, kooperative Gruppenstudie
Gesundheitsbezogene Lebensqualität (HRQL) in einer randomisierten Phase-III-Studie zu Enzalutamid mit Standard-Erstlinientherapie bei hormonempfindlichem Prostatakrebs (mHSPC) mit Metastasen
Bereits früher wurde berichtet, dass die Behandlung mit Enzalutamid (ENZA) eher zu einem längeren Gesamtüberleben bei mHSPC führt, wenn es zur Standardbehandlung bei der Erstlinienbehandlung hinzugefügt wurde, als die Behandlung mit einem älteren nicht-steroidalen Anti-Androgen (NSAA: Bicalutamid, Nilutamid oder Flutamid), mit oder ohne gleichzeitigem frühem Docetaxel, (Hazard Ratio 0,67, 95% CI 0,52; 0,86, p=0.002, NEJM 2019). Im Folgenden wird über die Auswirkungen auf Gesundheitsbezogene Lebensqualität (HRQL) berichtet.
Die HRQL wurde mit dem EORTC QLQ-C30 und PR25 in den Wochen 0, 4 und 12 gemessen und dann 12-wöchentlich bis zur klinischen Progression. Es wurden gemischte Modelle für wiederholte Messungen zur Berechnung der kleinsten quadratischen mittleren Differenz (LSMD), dem 95% CI und dem p-Wert für Vergleiche der zufällig zugeordneten Gruppen für alle Bewertungen von Woche 4 bis Woche 156 verwendet. Für jede Analyse des verschlechterungsfreien Überlebens wurde der Endpunkt a priori definiert als Endpunkt für frühesten Todesfall, klinischen Verlauf, Beendigung der Studienbehandlung oder ein 10-Punkte-Wert für Verschlechterung gegenüber dem Ausgangswert (minimaler klinisch wichtiger Unterschied in den Skalen von 0 bis 100) erfasst, der in der entsprechenden HRQL-Skala erzielt wurde: physikalische Funktion (PF), globale Gesundheit und Lebensqualität (GHQL), kognitive Funktionen (CF) und Müdigkeit; die p-Werte basieren auf dem Log-Rank-Test.
Resultate
Die Vervollständigung der HRQL-Formulare bei 1016 Männern mit einer Basisbewertung von HRQL (1125 randomisiert) reichten von 94% in Woche 12 bis 78% in Woche 156. Die zufällige Zuordnung zu ENZA vs. NSAA war mit leichten Beeinträchtigungen von Woche 4 bis 156 verbunden (LSMD, 95% CI). Diese umfassten Ermüdung (5.0, 3.3 bis 6.7, p <0.0001), CF (3.9, 2.4 bis 5.4), p <0.0001) und PF (2.5, 1.2 bis 3.8, p=0.0002), aber nicht GHQL (1.1, -0.4 bis 2.6), p=0.16). Verschlechterungsfreie Überlebensraten nach 3 Jahren begünstigten ENZA gegenüber NSAA bei der GHQL (32% vs. 18%, p<0,0001), CF (33% vs. 21%, p=0.0003) und PF (31% vs. 22%), p=0.001), aber nicht Fatigue (26% vs. 18%, p=0.1). Die Auswirkungen von ENZA auf die HRQL waren relativ stabil über die Zeit und unbeeinflusst von der Behandlung mit gleichzeitigem frühem Docetaxel.
Fazit
Die Zugabe von ENZA behielt die globale Gesundheit und Lebensqualität bei und verbesserte das verschlechterungsfreie Überleben, weil frühe Beeinträchtigungen in bestimmten Aspekten der HRQL nicht ausreichen, um die späteren Vorteile einer verzögerten klinischen Progression zu überwiegen.
WFR
Quelle: Stocker MA et al. LBA53 Health-related quality of life (HRQL) in a randomized phase III trial of enzalutamide with standard first-line therapy for metastatic, hormone-sensitive prostate cancer (mHSPC): ENZAMET (ANZUP 1304), an ANZUP-led, international, co-operative group trial. Annals of Oncology 2019; 30: Supplement 5, October 2019
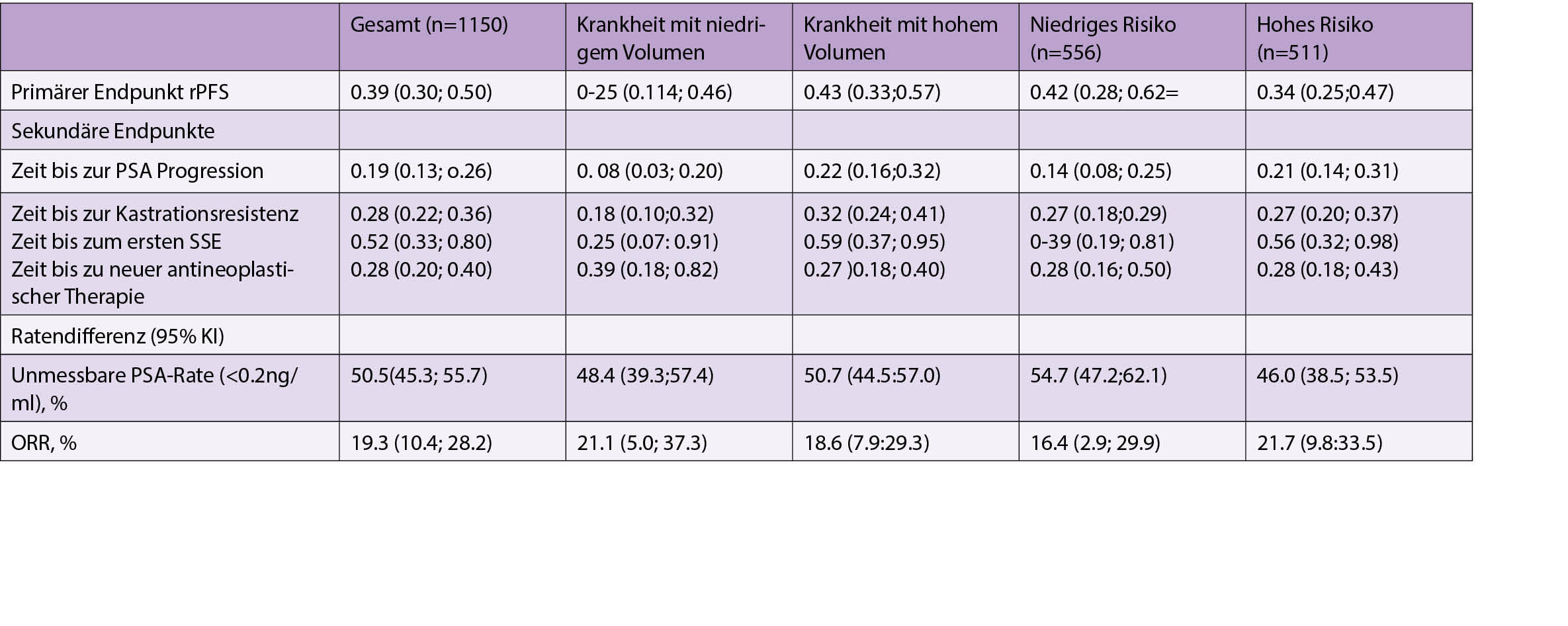
ARCHES – Die Rolle der Androgen-Deprivationstherapie (ADT) mit Enzalutamid (ENZA) oder Placebo (PBO) bei metastatischem hormonsensitivem Prostatakrebs (mHSPC): Post hoc-Analysen von Patienten mit hohem und niedrigem Krankheitsvolumen und Risikogruppen
ENZA, ein potenter Androgenrezeptor-Inhibitor, bietet Vorteile bei Männern mit kastrationsresistentem Prostatakrebs (CRPC). In Post-hoc-Analysen wird die Rolle von ENZA + ADT bei randomisierten mHSPC-Patienten innerhalb der multinationalen, doppelblinden, PBO-kontrollierten Phase-3-Studie ARCHES bestimmt durch Krankheitsvolumen und Stratifizierung der Risikogruppe.
Patienten mit mHSPC wurden im Verhältnis 1:1 nach ENZA (160 mg/Tag) + ADT oder PBO + ADT randomisiert. Der primäre Endpunkt war das radiographische progressionsfreie Überleben (rPFS). Sekundäre Endpunkte waren die Progression des prostataspezifischen Antigens (PSA), das Ansprechen in der radiologischen Untersuchung, Gesamtüberleben (OS) und Lebensqualität (QoL). Die Analysen wurden durch nach CHAARTED definiertes Krankheitsvolumen und LATITUDE definierte Risikogruppen komplettiert.
Es wurden 1150 Patienten randomisiert (ENZA +ADT, n=574; PBO +ADT, n=576).
Die mediane Nachbeobachtung betrug 14,4 Monate. ENZA + ADT verbesserte das rPFS signifikant (HR 0.39 [95% CI] 0,39[0,30, 0,50]; p<0,0001). ENZA+ ADT Patienten profitierten deutlich von verlängerten rPFS in allen Untergruppen (Tabelle 1). Signifikante Behandlungseffekte wurden mit ENZA + ADT in mehreren sekundären klinischen Endpunkten in der Gesamtbevölkerung beobachtet und sowohl bei hohem als auch bei niedrigem Krankheitsvolumen und bei Risikogruppen (Tabelle 1). Hohe QoL bei Beginn wurde im Laufe der Zeit beibehalten. OS-Daten sind noch unfertig. Unerwünschte Ereignisse (AEs) wurden beobachtet bei 85,1% der ENZA + ADT vs. 85,9% der PBO + ADT Patienten, wobei keine unerwarteten AEs eintraten.
Fazit
Die ENZA+ADT-Behandlung zeigte einen Wirksamkeitsvorteil bei allen mHSPC-Patienten, unabhängig von Krankheitsvolumen und Risikogruppe. Ähnliche Verlängerungen traten auf bei rPFS, symptomatischem Skelett. Es wurden ähnliche Verlängerungen in der PSA-Progression, Kastrationsresistenz und Verbesserungen im radiographischen Ansprechen und PSA-Senkungen, bei Aufrechterhaltung einer hohen QoL über die Zeit, beobachtet.
Die vorläufige Sicherheitsanalyse erscheint im Einklang mit dem Sicherheitsprofil von ENZA in früheren klinischen Studien über CRPC.
WFR
Quelle: Stocker MA et al. LBA53 Health-related quality of life (HRQL) in a randomized phase III trial of enzalutamide with standard first-line therapy for metastatic, hormone-sensitive prostate cancer (mHSPC): ENZAMET (ANZUP 1304), an ANZUP-led, international, co-operative group trial. Annals of Oncology 2019; 30: Supplement 5, October 2019
Erhaltungstherapie beim fortgeschrittenen Ovarialkarzinom
Zusätzliche Gabe von Olaparib verlängert das PFS
In der PAOLA-1/ENGOT-ov25-Studie wurde die zusätzliche Gabe von Olaparib (Lynparza®) mit der alleinigen Gabe von Bevacizumab im Rahmen einer Erhaltungstherapie bei Frauen mit einem fortgeschrittenen Ovarialkarzinom untersucht.
Eingeschlossen in diese randomisierte placebokontrollierte Studie wurden 806
Patientinnen mit einem fortgeschrittenen Ovarialkarzinom (FIGO-Stadium III oder IV), wobei im Durchschnitt mit der Erhaltungstherapie 7 Monate nach Beginn der Chemotherapie begonnen wurde. Sie erhielten nach der Operation eine Primärtherapie mit einer platinbasierten Chemotherapie plus mindestens 3 Zyklen Bevacizumab. Anschliessend wurde mit einer zweijährigen Erhaltungstherapie begonnen, wobei Olaparib in einer Dosierung von 300 mg zweimal täglich plus Bevacizumab mit Placebo plus Bevacizumab verglichen wurde.
Durch die zusätzliche Gabe von Olaparib wurde das mediane PFS von 16,6 Monate auf 22,1 Monate verlängert (HR 0,59; p < 0,0001). «Die Überlegenheit der dualen Erhaltungstherapie war unabhängig vom BRCAmut- und HRD-Status», so die Studienautorin Prof. Isabelle Ray-Coquard, Lyon. Auch wurden die Verträglichkeit von Bevacizumab und auch die Lebensqualität durch Olaparib nicht verschlechtert.
PS
LBA_2 ESMO 2019, 28.9.2019 in Barcelona
Metastasiertes Prostatakarzinom
PARP-Inhibitor eröffnet Möglichkeit für eine individualisierte Therapie
Bisher spielen Genmutationen beim therapeutischen Management des fortgeschrittenen Prostatakarzinoms keine Rolle. Doch auch bei diesem Tumor gibt es eine Reihe von genetischen Biomarkern insbesondere HRR (homologous recombination repair) –Genmutationen wie die BRCA1/2-Mutationen. In der PROfound-Studie konnte erstmal gezeigt werden, dass eine gezielt am BRCA-Status orientierte Therapie mit einem PARP-Inhibitor eine bessere Wirkung verspricht als die alleinige Gabe eines Androgen-Rezeptor-Inhibitors. Damit öffnet sich auch beim Prostatakarzinom die Tür für eine individualisierte Therapie.
Im Rahmen dieser randomisierten placebokontrollierten Studie wurden die Patienten mit einem kastrationsresistenten fortgeschrittenen Prostatakarzinom zunächst umfassend genetisch analysiert im Hinblick auf das Vorliegen von HRR-Genmutationen. Die ATM-, BRCA1 oder -2 mutierten Patienten wurden anschliessend randomisiert entweder nur antihormonell mit einem Androgen-Rezeptor-Inhibitor nämlich Abirateron bzw. Enzalutamid behandelt oder sie erhielten zusätzlich den PARP-Inhibitor Olaparib (Lynparza®). Unter Olaparib betrug das mediane PFS 7,39 Monate im Vergleich zu 3,55 Monate unter Placebo (HR 0,34; p 0,0001).Die PFS-Rate lag nach 12 Monaten im Olaparib-Arm bei 28,11% im Vergleich zu 9,40% unter Placebo. Die ORR betrug bei Olaparib 33,3%. Die Interims-OS lag bei 18,50 Monate im Olaparib-Arm und bei 15,11 Monate im Placebo-Arm. “Die Studie ist bahnbrechend; denn sie konnte erstmals zeigen, dass eine an Biomarkern, die ein therapeutisches Target darstellen, orientierte Therapie auch beim fortgeschrittenen Prostatakarzinom ein sinnvolles und vielversprechendes Therapiekonzept darstellt”, so der Studienautor Prof. Maha Hussain, Chicago.
PS
LBA12_PR, ESMO 2019, 30.9.2019 in Barcelona
Erhaltungstherapie beim fortgeschrittenen Ovarialkarzinom
Niraparib bewährt sich in der PRIMA-Studie
Zum ersten Mal konnte in einer Studie für eine Mono-Erhaltungstherapie, nämlich Niraparib bei Frauen mit einem fortgeschrittenen Ovarialkarzinom eine signifikanter Benefit bzgl. PFS dokumentiert werden.
Das Ovarialkarzinom ist der gynäkologische Tumor mit der schlechtesten Prognose. Durch die primäre Therapie mit Operation und platinbasierter Chemotherapie plus Bevacizumab ist nur selten eine Heilung möglich. So entwickelt sich nach der kompletten standardisierten First line-Therapie in über 85% der Fälle ein Rezidiv. Deshalb kommt einer Erhaltungstherapie ein grosser Stellenwert zu. Dafür standen bisher nur Olaparib und Bevacizumab zur Verfügung. Doch Olaparib kann nur bei einer BRCA-Mutation eingesetzt werden. Das betrifft aber nur ca. 20% aller Patientinnen. Bei Bevacizumab ist häufig die Verträglichkeit ein Problem. Deshalb wird nicht selten nach der Primärtherapie ein wachtful waiting, d.h. eine active surveillance praktiziert.
Im Rahmen der PRIMA-Studie wurde der erste oral verfügbare PARP-Inhibitor Niraparib (Tesaro®) in Form einer Mono-Erhaltungstherapie untersucht und zwar sowohl bei Patientinnen mit als auch bei solchen ohne eine BRCA-Mutation. Ausgewertet wurden die Daten von 733 randomisierten Patientinnen, davon 370 (51%) mit einer positiven Testung für HRD (homologous recombination deficiency). «Unter Niraparib kam es in der Gesamtstudienpopulation zu einer Reduktion des kombinierten Endpunktes Relaps oder Tod um 48% im Vergleich zu Placebo», so der Studienleiter Prof. Antonio Gonzalez Martin, Madrid. Das mediane PFS stieg von 10,5 Monaten auf 21,9 Monate (HR 0,62; p < 0,001). Nach 18 Monaten lebten noch 59% der Patientinnen ohne Relaps in der Niraparib-Gruppe, in der Placebo-Gruppe waren es dagegen nur 35%. Die Überlegenheit von Niraparib zeigte sich in allen Biomarker-Subgruppen (BRCAmut, BRCAwt, HR-proficient). In der HR-proficient-Subgruppe betrug die Risikoreduktion bzgl. PFS 32%, bei HRD-Defizienz 57% (HR 0,43; p < 0,001).
Der sekundäre Endpunkt OS wurde nach einer Interimsanalyse nach 2 Jahren durch Niraparib von 77% auf 84% gesteigert, bei Patienten mit HR-Defizienz von 85% auf 91% und bei HR-proficient von 59% auf 81%. Bzgl. unerwünschter Wirkungen bestätigten sich die Daten aus anderen Studien mit einem PARP-Inhibitor. 4,3% mussten Niraparib wegen einer Thrombozytopenie absetzen. Bei der Gesamtabbrech-Quote gab es aber keinen Unterschied zwischen beiden Behandlungsgruppen. «Zum ersten Mal konnte für eine Monotherapie nämlich für Niraparib quer durch alle Biomarker-Subgruppen eine Verlängerung des PFS dokumentiert werden», so Martin.
PS
LBA1_PR ESMO 2019, 28.9.2019 in Barcelona
PARP-Inhibitor Veliparib beim Ovarialkarzinom
Bewährung als Kombinationspartner in der Primärtherapie bestanden
Im Rahmen der VELIA/GOG-3005-Studie wurde erstmals ein PARP-Inhibitor, nämlich Veliparib in Kombination mit der etablierten Chemotherapie eingesetzt und später als Erhaltungstherapie fortgeführt.
Aufgenommen in diese Phase III-Studie wurden 757 Patientinnen mit einem Ovarialkarzinom, davon 26% mit einer BRCA-Mutation. Sie erhielten primär randomisiert nur eine platinbasierte Front line-Chemotherapie (Paclitaxel/Carboplatin) oder zusätzlich zur Chemotherapie den PARP-Inhibitor Veliparib. Nach Ende der Primärtherapie wurde Veliparib als Mono-Erhaltungstherapie fortgeführt. Durch den PARP-Inhibitor wurde das PFS statistisch signifikant von 17,9 Monate auf 23,5 Monate verlängert (HR 0,68; p < 0,001). In der Gruppe mit einer BRCA-Mutation war der Benefit noch ausgeprägter (PFS: 34,7 Monate vs. 22,0 Monate; HR 0,44; p < 0,0001). «Die PARP-Inhibitoren drängen in die Primärtherapie und dies mit Erfolg», so der Studienautor Prof. Robert Coleman, Sheffield.
PS
LBA3_PR, ESMO 2019, 28.9.2019 in Barcelona
Fortgeschrittenes NSCLC
Atezolizumab ist in der First line der Chemotherapie überlegen
Im Rahmen der IMpower 110-Studie wird der PD-L1-Inhibitor Atezolizumab (Tecentriq®) in der First line mit einer platinbasierten Chemotherapie bei Patienten mit einem fortgeschrittenen NSCLC verglichen. Eine Interimsanalyse zeigt eine Überlegenheit der Immuntherapie.
Ausgewertet wurden die Daten von 572 Patienten. Sie erhielten randomisiert Cisplatin/Carboplatin + Pemetrexed oder 1200 mg Atezolizumab (Tecentriq®) alle 3 Wochen. Der primäre Endpunkt ist das OS in der wild-type-Population (WT), also bei Patienten ohne ALK- oder EGFR-Mutation. Eine Interimsanalyse ergab eine Verbesserung des OS um 7,1 Monate (medianes OS unter Atezolizumab 20,2 Monate vs. 13,1 Monate unter der Chemotherapie (HR 0,595; p = 0,0106) und zwar bei Patienten mit einer hohen PD-L1-Expression. Bei den Ansprechraten standen 38,3% unter Atezolizumab 28,6% unter der Chemotherapie gegenüber Dieser überlegene Effekt des PD-L1-Inhibitors war auch bei Patienten mit einem mittleren PD-L1-Spiegel nachweisbar, aber ohne statistische Signifikanz (18,2 Monate vs. 14,9 Monate; HR 0,717; p = 0,0416). In dieser Gruppe lag das 12-Monatsüberleben unter Atezolizumab bei 60,7% im Vergleich zu nur 56% unter der Chemotherapie. «Die Studie wird fortgeführt, um auch die Daten von Patienten mit einer niedrigen PD-L1-Expression auswerten zu können» so der Studienautor Prof. David R. Spigel, Nashville.
PS
ESMO 2019, 27.9.2019 in Barcelona
Duale Immuntherapie beim NSCLC
Eine neue Option statt Chemotherapie
Die beiden Checkpoint-Inhibitoren Ipilimumab und Nivolumab (Opdivo®) haben unterschiedliche Angriffspunkte und können somit komplementär wirken. Das ist die Rationale für die Kombinationstherapie, wie sie im Rahmen der Checkmate 227-Studie als First line im Vergleich zur Chemotherapie beim fortgeschrittenen NSCLC geprüft wurde.
Dabei handelt es sich um eine randomisierte Phase III-Studie, wobei das PFS und das OS bei Patienten mit einer TMB ≥ 10 unabhängig von der PD-L1-Expression und bei einer PD-L1-Expression ≥ 1% als Endpunkte festgelegt wurden. Insgesamt wurde das OS unter der dualen Immuntherapie im Vergleich zur alleinigen Nivolumab-Therapie bzw. einer platinbasierten Chemotherapie analysiert. Nivolumab wurde in der Standarddosierung, Ipilimumab dagegen in einer niedrigeren Dosierung verabreicht. Verglichen wurden insgesamt vier Patientengruppen, nämlich die duale Immuntherapie mit einer alleinigen platinbasierten Chemotherapie und der Kombination Nivolumab + Chemotherapie und einer Nivolumab-Monotherapie. Bei Patienten mit einer PD-L1-Expression ≥ 1% betrugt das mediane OS 17,1 Monate unter Nivo/Ipi im Vergleich zu nur 14,9 Monaten unter der Chemotherapie (HR 0,79; p = 0,007). Nach 2 Jahren lebten noch 40% unter Nivo/Ipi im Vergleich zu 33% unter der Chemotherapie. Bei der alleinigen Nivolumab-Therapie waren es noch 36%. Die Vergleichszahlen bei der DOR nach 2 Jahren betrugen 49% unter Nivo/Ipi vs. 40% unter Nivo vs. 11% unter der Chemotherapie. Bei Patienten mit einer PD-L1-Expression < 1% lag das OS nach 2 Jahren bei 40% unter der Kombination im Vergleich zu nur 23% unter der Chemotherapie. Bei der Kombination Nivo + Chemotherapie betrug das OS nach 2 Jahren 35%, lag also unter dem Wert der dualen Immuntherapie. Wurden alle Patienten unabhängig von ihrem PD-L1-Status ausgewertet, so waren die OS-Raten nach 2 Monaten 40% bei Nivo/Ipi vs. 30% bei alleiniger Chemotherapie. Die Vergleichswerte für das mediane OS waren 17,1 Monate vs. 13,9 Monate (HR 0,73). «Nach diesen Ergebnissen ist die duale Immuntherapie eine neue First line-Option statt Chemotherapie für Patienten mit einem fortgeschrittenen NSCLC», so die Stu-dienautorin Prof. Solange Peters, Lausanne.
PS
LBA4_PR, ESMO 2019, 28.9.2019 in Barcelona
Fortgeschrittenes BRCAmut- HER2neg-Mammakarzinom
PARP-Inhibitor bewährt sich in Kombination mit Chemotherapie
Im Rahmen der BROCADE 3-Studie wurde erstmals bei Patientinnen mit einem fortgeschrittenen BRCA1/2mut, HER2neg – Mammakarzinom die, zusätzliche Gabe eines PARP-Inhibitors, nämlich Veliparib plus Chemotherapie mit der alleinigen Chemotherapie verglichen.
Bei Vorliegen einer BRCA1/2-Mutation zeigt das Mammakarzinom eine erhöhte Sensitivität gegenüber einer platinbasierten Chemotherapie. Gleichzeitig verhalten sich solche Tumore sehr sensibel gegenüber PARP-Inhibitoren. Dies ist die Rationale für die BROCADE3-Studie, in die 513 Patientinnen mit einem fortgeschrittenen BRCA1/2mut HER2neg Mammakarzinom randomisiert placebokontrolliert entweder nur die Carboplatin/Paclitaxel-Chemotherapie oder zusätzlich den PARP-Inhibitor Veliparib erhielten.
Durch die zusätzliche Gabe von Veliparib wurde das mediane PFS von 12,6 Monate auf 14,5 Monate erhöht. Die PFS-Rate lag nach 24 Monaten unter der Kombination bei 34% im Vergleich zu 20% bei alleiniger Chemotherapie. Nach 36 Monaten waren die Vergleichszahlen 26% vs. 11%. Die Überlegenheit der Kombination zeigte sich in allen Subgruppen mit Ausnahme der Gruppe von Patienten mit Hirnmetastasen. Beim medianen OS ergab eine Interimsanalyse 33,5% unter der Kombination vs. 28,2 Monate unter der alleinigen Chemotherapie. Bei der Clinical Benefit Rate und bei der objektiven Response-Rate ergab sich kein signifikanter Unterschied, doch bei der Dauer des Ansprechens (14,7 Monate unter der Kombi vs. 11,0 Monate unter der alleinigen Chemotherapie). Auch beim PFS2, definiert als Zeit von der Randomisierung bis zur Progression unter der Folgetherapie oder Tod, schnitt die Veliparib-Gruppe besser ab (21,3 Monate vs. 17,4 Monate). «Durch die zusätzliche Gabe des PARP-Inhibitors wurde das Toxizitätsprofil der Chemotherapie auch nicht ungünstig beeinflusst», so die Studienautorin Prof. Veronique Dieras, Paris.
PS
LBA 9_PR, ESMO 2019, 29.9.2019 in Barcelona
Fortgeschrittenes Ösophaguskarzinom
Nivolumab verbessert das Gesamtüberleben
Im Vergleich mit der Chemotherapie verbessert Nivolumab (Opdivo®) bei Patienten mit einem fortgeschrittenen Plattenepithelkarzinom des Ösophagus das Gesamtüberleben. Ausserdem ist der Checkpoint-Inhibitor sehr viel verträglicher. Dies sind die Ergebnisse der ATTRACTION-3-Studie.
Das fortgeschrittene Ösophagus-Karzinom hat eine sehr schlechte Prognose. Die 5-Jahresüberlebensrate liegt bei ca. 8%. In über 90% der Fälle handelt es sich um ein Plattenepithelkarzinom. Der bisherige Standard ist eine Chemotherapie, deren Wirksamkeit allerdings sehr schlecht ist und die mit einer hohen Toxizität assoziiert ist. In der Phase II ATTRACTION-2-Studie zeigte Nivolumab bei Patienten, die gegenüber der Chemotherapie refraktär waren oder diese nicht vertrugen, eine antitumoröse Wirksamkeit Im Rahmen der ATTRACTION-3-Studie, einer Phase III-Studie, wurde jetzt die Nivolumab-Immuntherapie mit der Chemotherapie verglichen. Im Vergleich zur Chemotherapie sank das Sterberisiko unter Nivolumab um 23% und das mediane OS nahm um 2,5 Monate zu (10,9 Monate vs. 8,4 Monate; HR 0,77; p = 0,019). Das OS nach 12 Monate betrug unter Nivolumab 47% und nach 18 Monaten 31%, die Vergleichszahlen bei der Chemotherapie lagen bei 34% bzw. bei 21%. Der Überlebensvorteil war unabhängig vom PD-L1-Expressionslevel. Bei der ORR fand sich kein signifikanter Unterschied, doch bei der DoR (6,9 Monate bei Nivolumab vs. 3,9 Monate bei Chemotherapie). Auch erwies sich die Immuntherapie als deutlich verträglicher (Nebenwirkungsrate unter Nivolumab 66% vs. 95% Chemotherapie). «Die Immuntherapie mit Nivolumab stellt einen grossen Fortschritt beim fortgeschrittenen Ösophaguskarzinom dar», so der Studienautor Prof. Chul Co, Yonsei.
PS
LBA11_RP, ESMO 2019, 30.9.2019 in Barcelona
Geschlechterspezifische Medizin in der Onkologie:
Sind wir bereit zu einem Paradigmawechsel?
In der Podiumsdiskussion «Sex- and gender-sensitive medicine: are we ready to switch paradigm?», die am 29. September im Rahmen der ESMO Women for Oncology Initiative stattfand, erkundete das Panel der 4 Expertinnen neue Vorgehensweisen, die in der Patientenbetreuung geschlechtsspezifische Unterschiede berücksichtigen – darunter zwei Onkologinnen und eine Kardiologin aus der Schweiz. Ziel der Veranstaltung war ein Appell, die Qualität der Betreuung aller Patienten zu verbessern und die Auseinandersetzung mit der Frage, wie und bis wann die Genderaspekte in der Onkologie praktisch umgesetzt werden können.
Im Zeitalter der Präzisionsmedizin, die sowohl Männern als auch Frauen eine massgeschneiderte Behandlung anbieten kann, hat die Untersuchung geschlechterspezifischer Unterschiede das Potential, sich als Meilenstein zu erweisen. Das Wissen über Unterschiede zwischen den Geschlechtern wächst stetig und weist darauf hin, dass diese Unterschiede nicht nur die Tumorbiologie, sondern auch die Pharmakokinetik und Pharmakodynamik von Medikamenten beeinflussen können. Dennoch werden biologische Unterschiede zwischen Männern und Frauen in der Krebsforschung und klinischen Praxis auch noch heutzutage selten berücksichtigt. Wie ist diese Diskrepanz zu erklären?
Mit dieser Frage und wie das Thema der Gendermedizin die nötige Aufmerksamkeit erlangen kann, eröffnete das Panel die Diskussion. Die Expertinnen waren Dr. Sabine Oertelt-Prigione, Strategic Chair for Gender in Primary and Transmural Care an der Radboud-Universität, Nijmegen (NL) sowie Prof. Solange Peters, Vorsitzende des ESMO Women for Oncology Committee, welche die Diskussion leitete und Dr. Anna Dorothea Wagner, beide vom Centre Hospitalier Universitaire Vaudois (CHUV), und als dritte Schweizer Ärztin die Kardiologin Dr. Susanna Grego aus Lugano-Paradiso.
«Es gibt häufig Widerstand dagegen, die Debatte über Genderaspekte in der Gesundheitsversorgung in den Vordergrund zu rücken, da sie häufig nur für Frauen und nicht für alle Patienten von Interesse sind», erklärte Dr. Sabine Oertelt-Prigione und verwies auf den Umstand, dass der Umgang mit medizinischen Sachverhalten und politischen Angelegenheiten nicht gleich ist. Sie ergänzte, dass in letzter Zeit die Geldgeber vermehrt verlangen, dass Forscher biologische Unterschiede in die Planung ihrer Forschung einbeziehen, was dem Anliegen helfen könne, voranzukommen.
In der Gesprächsrunde wurde weiter darüber diskutiert, welchen Einfluss Geschlechtsunterschiede auf die Prävention, Diagnose und Behandlung haben können. Die Expertinnen wiesen darauf hin, dass das Wissen über geschlechtsspezifische Unterschiede in der Kardiologie schon früher bestand, wodurch zum Beispiel erkannt wurde, dass – entgegen vormaliger Annahme – auch junge Frauen einen Herzinfarkt erleiden können. «Das war ein Moment des Erwachens, der die Diskussion wirklich in Gang gesetzt hat», bekräftigte Dr. Oertelt-Prigione. In der Onkologie sei dieser Durchbruch trotz diverser bekannter geschlechtsspezifischer Unterschiede leider noch nicht erreicht.
«Was wirklich hinterher hinkt, sind die medizinischen Fachgesellschaften selbst!», sind sich die Expertinnen einig. Arbeitsgruppen und Task Forces existieren zwar über mehrere medizinische Disziplinen hinweg, aber die Unterstützung durch die Fachgesellschaften, indem diese die Führung in diesem Prozess übernehmen, sei im Allgemeinen begrenzt. Das grösste Hindernis sei, dass das vorhandene geschlechtsspezifische Wissen noch nicht in den Leitlinien verankert sei und noch nicht genügend evidenzbasierte Daten vorhanden seien, damit die Richtlinienausschüsse Empfehlungen unterstützen könnten. Um diesen Zustand zu überwinden, ist ein geschärftes Bewusstsein für geschlechtsspezifische Unterschiede erforderlich, so dass bei einer Studie Daten nach Geschlecht gesammelt und analysiert werden, betonen die Expertinnen und fordern dazu auf, diese praktischen Aspekte durch gemeinsame Anstrengungen besser zu unterstützen. Durch die Einbindung von medizinischen Fachgesellschaften, wie z.B. die ESMO, zählen die Expertinnen darauf, dass der Umsetzungsprozess beschleunigt wird. Die neulich gegründete ESMO Gender Medicine Task Force sei ein klares Signal in diese Richtung, schliesst das Panel.
Mit Appell ans Publikum wünschte sich das Gremium der Expertinnen eine Vertiefung der Themen und forderte zum Austausch mit dem Netzwerk der ESMO Women for Oncology auf.
Eleonore E. Droux