- Ein wichtiges Instrument in der nichtinvasiven Ischämiediagnostik
Das PET-CT ist eine relativ junge Modalität und wird zurzeit mehrheitlich an hochspezialisierten Zentren durchgeführt. Dank der rasanten Entwicklung wurde es in den letzten Jahren zu einem bedeutenden Pfeiler in der kardialen Diagnostik, und in mehrere internationale Richtlinien integriert. Neben der ischämischen Herzkrankheit und Viabilitätsdiagnostik spielt das PET-CT eine zentrale Rolle in der Abklärung von mikrovaskulärer Angina, kardialer Sarkoidose und infektiöser Endokarditis.
Le PET-CT est une modalité relativement jeune et se déroule actuellement principalement dans des centres hautement spécialisés. Grâce à son développement rapide, il est devenu ces dernières années un pilier important du diagnostic cardiaque et a été intégré dans plusieurs directives internationales. En plus des cardiopathies ischémiques et du diagnostic de viabilité, le PET-CT joue un rôle central dans le diagnostic de l’ angine microvasculaire, de la sarcoïdose cardiaque et de l’ endocardite infectieuse.
Geschichte
Die erste klinische Anwendung der Positronen-Emissions-Tomographie (PET) geht auf das Jahr 1953 zurück, als die Wissenschaftler Brownell und Sweet mittels Positronen-basierter Bildgebungstechnik einen Hirntumor lokalisieren konnten (1). Der klinische Durchbruch gelang der Technologie aber erst durch die Fusion mit der Computertomographie (CT), welches 2001 weltweit erstmals am Universitätsspital Zürich installiert wurde.
Technische Aspekte
Die Emissions-Bildgebung in der Nuklearmedizin basiert auf der Detektion von radioaktivem Zerfall. Im Fall des PET werden Radionuklide, die Positronen emittieren (β+-Strahlung), intravenös verabreicht. Prallt ein Positron auf ein Elektron, werden bei der Annihilation zwei Photonen in 180°, also genau in entgegengesetzter Richtung, freigesetzt. Die ringförmig angeordneten Detektoren können die Photonen auf je gegenüberliegender Seite registrieren und anhand der zeitlichen und räumlichen Verteilung ein Bild erstellen. Verschiedene Radiopharmaka (z.B. Fluorodesoxyglucose [FDG] oder Ammoniak [NH3]) werden mit einem Radionuklid (z.B. 18F-Fluor oder 13N-Stickstoff) markiert. Da die radioaktiven Isotope von einem Zyklotron produziert werden und/oder eine sehr kurze Halbwertszeit haben, ist ihre Anwendung meistens auf Zentren mit einem Zyklotron vor Ort limitiert. Ausnahmen sind 18F-Fluor, das eine Halbwertszeit von 110 Minuten hat, und 82Rb-Rubidium, das durch den Zerfall eines instabilen Vorläuferisotops in einem Radionuklidgenerator entsteht.
Myokardperfusion
Die am meisten verbreitete Indikation für ein PET-CT in der Kardiologie ist die Ischämiediagnostik bei symptomatischen Patienten mit Verdacht auf oder bekannter koronarer Herzkrankheit (2). Ähnlich wie bei der Myokardperfusions-SPECT (Einzelphotonen-Emissionscomputertomographie) oder dem Herz-MRI (Magnet-Resonanz Imaging) kann im PET-CT mit 13N-NH3 oder mit 82Rb-Rubidium die myokardiale Durchblutung genau beurteilt werden (3). Neben der sehr hohen Sensitivität und Spezifität in der Diagnose einer obstruktiven koronaren Herzkrankheit bietet das PET-CT die Möglichkeit, den myokardialen Blutfluss nichtinvasiv zu quantifizieren und die koronare Flussreserve zu berechnen. Diese Vorteile zahlen sich insbesondere bei adipösen Patienten und bei Patienten mit koronarer Dreigefässerkrankung und einer balancierten Ischämie (d.h. alle drei Koronarien haben hämodynamisch relevante Läsionen) aus. Von noch grösserer Bedeutung ist die Quantifizierung des Blutflusses in der Beurteilung von Patienten mit mikrovaskulärer Angina (4). Dazu gehören Patienten, bei denen kein angiographisches Korrelat als Ursache für ihre Symptome identifiziert werden konnte. Ist die koronare Flussreserve erniedrigt, können die Beschwerden als mikrovaskuläre Angina diagnostiziert werden.
Neben der Diagnostik der ischämischen Herzkrankheit ist das PET-CT ein wertvolles Instrument zur Einschätzung der Prognose der Patienten. Es erlaubt – wie andere nicht-invasive Modalitäten (z.B. Myokardperfusions-SPECT oder Herz-MRI) – anhand des Ausmasses von Ischämie und Narbe eine feinere Risikostratifizierung (5). Diese Erkenntnis hat denn auch direkte Implikationen auf das Patientenmanagement: Patienten mit einer Ischämie, die über 10% des Myokards betrifft, profitieren von einer Revaskularisation (6). Der gegenüber anderen nicht-invasiven Modalitäten zusätzliche prognostische Nutzen des PET-CT widerspiegelt sich in der Bestimmung der koronaren Flussreserve. Sie ist ein bedeutender Risikomarker – und zwar unabhängig von klinischen Faktoren oder dem Vorhandensein einer Ischämie oder Narbe (7). Dieser Zusammenhang ist zentral bei Patienten mit koronarer Herzkrankheit (8), aber konnte inzwischen auch für ein breites Spektrum weiterer Erkrankungen (z.B. dilatative oder hypertrophe Kardiomyopathie, Herzinsuffizienz mit erhaltener Pumpfunktion oder kardiale Amyloidose) bestätigt werden (9-12).
Viabilitätsdiagnostik
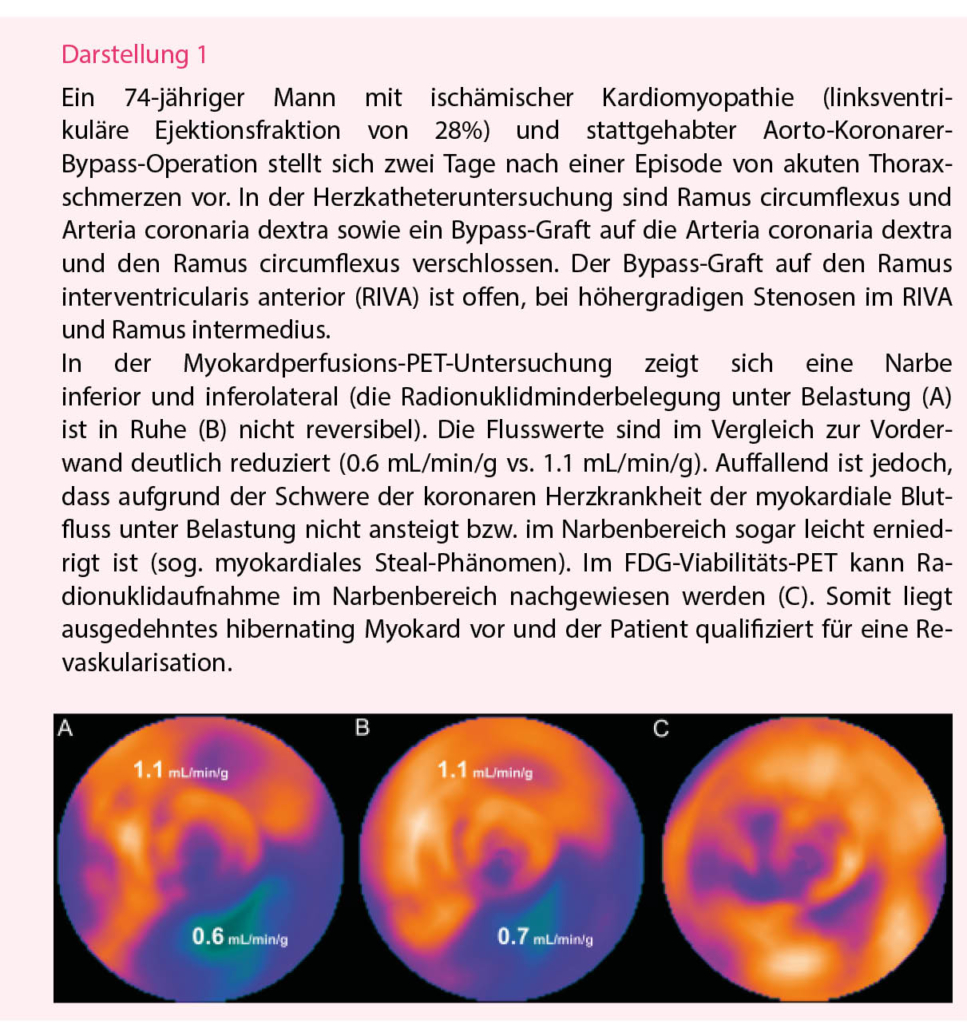
Die Interaktion zwischen Ischämie und linksventrikulärer (LV) Funktion fasziniert die kardiovaskuläre Forschung und die Welt der Kardiologie seit Jahrzehnten (13). Ist das Myokard wiederholten Phasen von myokardialem Stunning ausgesetzt (z.B. durch eine hämodynamisch relevante Stenose) oder kommt es zu einem schleichenden Verschluss einer Koronararterie (z.B. subakuter Myokardinfarkt) können die Myokardzellen in ein Stadium des Winterschlafs gehen – das sogenannte Hibernating Myocardium. Die Funktion und die Ruheperfusion sind zwar eingeschränkt, die Myokardzellen sind aber dank Anpassungen im Glukose-Metabolismus noch vital (14). Klinisch ist dieses Phänomen deshalb relevant, weil sich die Wandbewegungsstörungen erholen können, wenn die Durchblutung wiederhergestellt wird (15). Zur Differenzierung zwischen avitaler Narbe und Hibernating Myocardium können unterschiedliche nicht-invasive Modalitäten angewendet werden. Neben dem Herz-MRI mit Darstellung des Late Gadolinium Enhancement (LGE), ist die Methode mit der höchsten Sensitivität das 18F-FDG-PET-CT (16), welches die Darstellung der Glukose-Speicher von hibernating Myokardzellen erlaubt. Zeigt sich zum Beispiel in der Myokardperfusions-PET mit 13N-NH3 eine hypokinetische Narbe, aber erhaltene Viabilität in der 18F-FDG-PET, sollte eine Revaskularisation zur Reversibilität der regionalen und globalen LV-Dysfunktion sowie zur Verbesserung der Prognose des Patienten angestrebt werden (17) (Darstellung 1). Vorzugsweise wird das 18F-FDG-Viabilitäts-PET-CT bei Patienten mit Herzinsuffizienzsymptomen, bekannter (oder Verdacht auf) koronarer Herzkrankheit und einer LV-Auswurffraktion unter 40% empfohlen (18).
Kardiale Sarkoidose
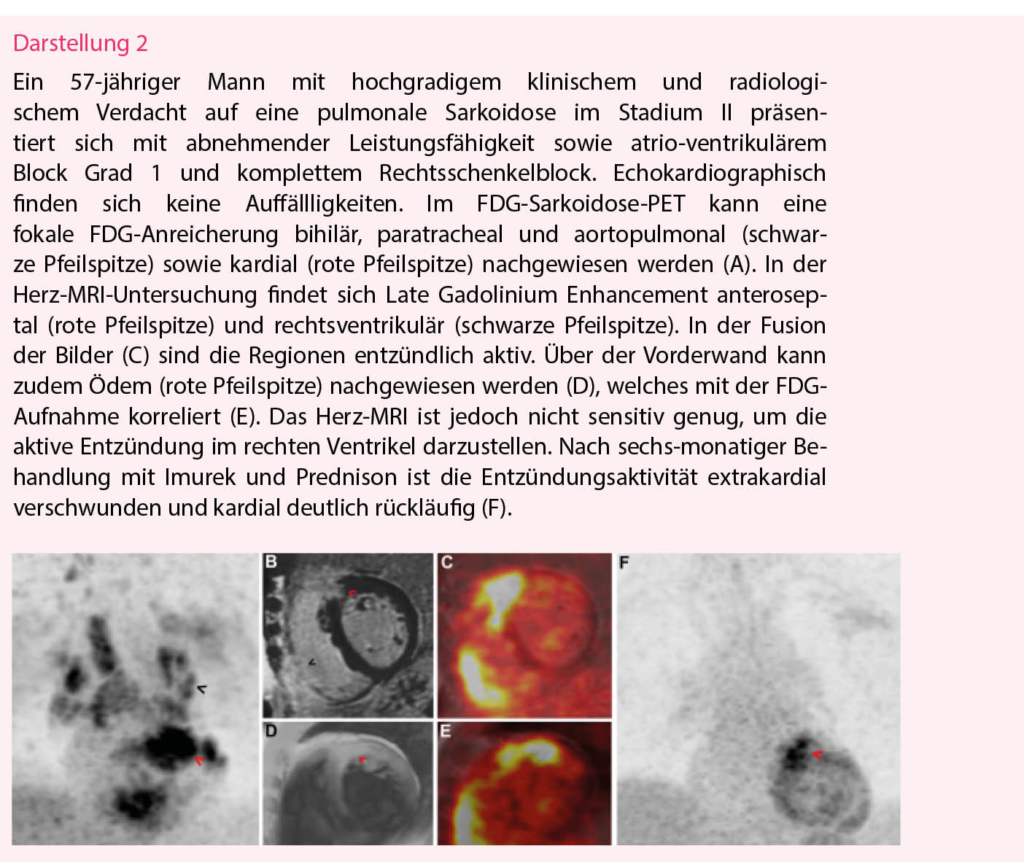
Die Sarkoidose ist eine systemische, granulomatös-entzündliche Erkrankung mit Beteiligung oder isoliertem Befall des Herzens. Da die Sensitivität der Endomyokardbiopsie zur histologischen Dia-gnose einer kardialen Sarkoidose niedrig ist (19), hat unter anderem das Herz-MRI einen zentralen Stellenwert in der klinischen Dia-gnose (20). Im Vordergrund steht dabei die Darstellung von Fibrose, welche oft ein fleckförmiges, epikardiales Verteilungsmuster mit Aussparungen der subendokardialen Wandabschnitte hat. Neben dem Herz-MRI ist das PET-CT eine weitere wertvolle Methode für die Diagnostik und zusätzlich für das Monitoring des Therapieerfolgs. Mittels 18F-FDG kann die Entzündung durch die hohe Entzündungsaktivität in den von Makrophagen infiltrierten, nicht-verkäsenden Granulomen direkt dargestellt werden (21). Zur Minimierung von falsch-positiven Fällen ist es entscheidend, dass die Patienten optimal vorbereitet werden. Um den physiologischen Glukosemetabolismus zu unterdrücken und die 18F-FDG-Aufnahme auf die myokardialen Makrophagen zu beschränken, sollten die Patienten für mindestens 12 Stunden fasten und am Tag vor der Untersuchung eine strenge Kohlenhydrat-arme, Fett-reiche Diät einhalten. Durch die komplementäre Rolle von Herz-MRI und PET-CT hat sich die kardiale Sarkoidose als geeignete Indikation für die Durchführung eines Hybrid PET/MRI herauskristallisiert (Darstellung 2). Obwohl der klinische Nutzen evident ist (22, 23), ist die Verfügbarkeit von Hybrid PET/MRI-Geräten auf wenige hochspezialisierte Zentren limitiert.
Bei Patienten mit einer bekannten extrakardialen Sarkoidose und einem pathologischen kardiologischen Screening sind weiterführende Abklärungen indiziert, um eine kardiale Beteiligung auszuschliessen (24). Bei Patienten unter 60 Jahren ohne extrakardiale Sarkoidose gilt ein höhergradiger atrio-ventrikulärer Block, eine monomorphe ventrikuläre Tachykardie oder eine Kardiomyopathie, die nicht anderweitig erklärt werden können, als ausreichender Verdacht auf eine isolierte, kardiale Sarkoidose, um weiterführende Abklärungen (d.h. Thorax-CT und Hybrid PET/MRI, Herz-MRI oder PET-CT) einzuleiten (25, 26). Da die PET-CT eine exakte Bestimmung der inflammatorischen Aktivität der kardialen Sarkoidose erlaubt, ist sie zum Monitoring der immunosuppressiven Therapie bei Patienten mit bekannter kardialer Sarkoidose indiziert (27).
Infektiöse Endokarditis
Die Duke-Kriterien mit insbesondere mikrobiologischem und/oder echokardiographischem Nachweis einer Bakteriämie bzw. einer Vegetation sind bei klinischem Verdacht für eine Endokarditis massgebend. Ist eine Endokarditis anhand der Duke-Kriterien «möglich» aber noch nicht definitiv, oder sogar «verworfen» (aber der klinische Verdacht ist hoch), wurde das 18F-FDG-PET-CT dank der hohen Sensitivität für eine Klappenprothesen-Endokarditis als Major Kriterium in die aktuellen Richtlinien der Europäischen Gesellschaft für Kardiologie (ESC) aufgenommen (28). Ein vergleichbarer klinischer Nutzen der 18F-FDG-PET wird auch bei Device-Infektionen vermutet; die Erfahrung ist aber bisher auf Fallserien limitiert (29). Wichtig zu erwähnen ist zudem, dass ein 18F-FDG PET-CT mindestens 3 Monate oder länger nach Klappenoperation erfolgen soll, da kurz nach der Operation eine unspezifische metabolische Aktivität im Bereich der Prothese möglich ist. Für den Nachweis einer Endokarditis an einer nativen Klappe ist die 18F-FDG-PET-CT weniger geeignet – die Sensitivität für die kleinen, mobilen Vegetationen ist zurzeit noch ungenügend.
Blick in die Zukunft
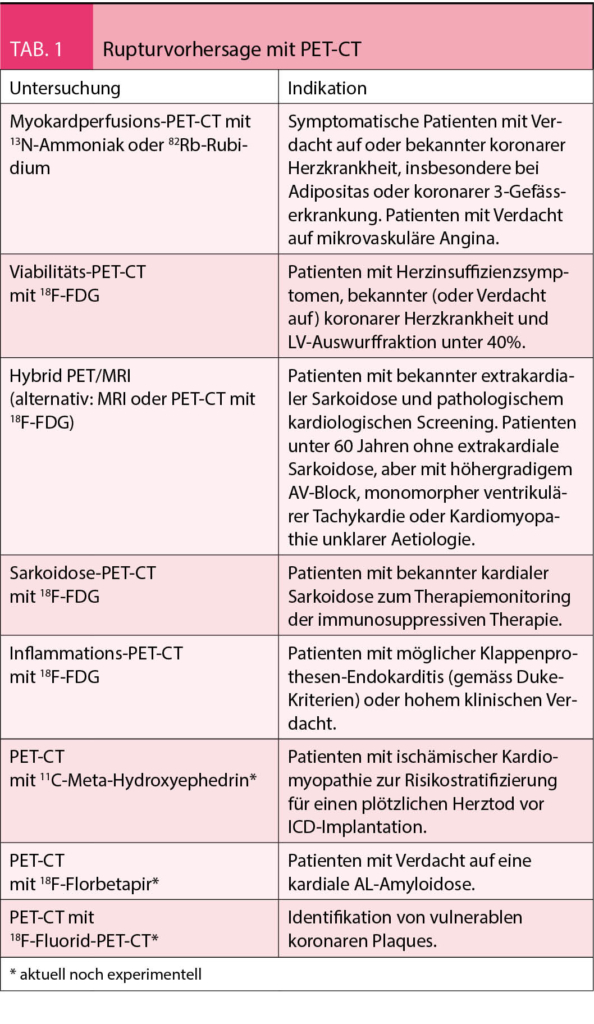
In Anbetracht der rasanten Entwicklung der PET-CT und der zeitnahen Integration in aktuelle Richtlinien, können weitere Indikationen, die aktuell noch experimentell sind, rasch an klinischer Bedeutung gewinnen. Durch die Darstellung der myokardialen sympathischen Denervation (mittels 11C-Meta-Hydroxyephedrin im PET-CT) kann die Risikostratifizierung eines plötzlichen Herztodes und damit der Entscheid für den Einsatz eines implantierbaren Cardioverter Defibrillator bei Patienten mit ischämischer Kardiomyopathie deutlich verbessert werden (30). Die kardiale ATTR-Amyloidose kann heute mittels Skelettszintigraphie dargestellt werden – mit neueren Radiopharmaka wie 18F-Florbetapir wird in Zukunft auch die Darstellung der AL-Amyloidose möglich sein (31). In der Identifikation einer vulnerablen koronaren Plaque und der zuverlässigen Vorhersage ihrer Ruptur konnten erste, vielversprechende Ergebnisse mit 18F-Fluorid-PET-CT erzielt werden (32), siehe auch nachstehende Tabelle.
Assistenzarzt
Klinik für Nuklearmedizin und Klinik für Kardiologie
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
dominik.benz@usz.ch
PhD, FESC, FACC, FSCCT, FSCMR
Leiter kardiale Bildgebung
Universitätsklinik für Kardiologie
Inselspital Bern
Freiburgstrasse 18
3010 Bern
christoph.graeni@insel.ch
Dr. Benz hat ein Forschungsstipendium der Theodor und Ida Herzog-Egli Stiftung erhalten.
- Das Myokardperfusions-PET-CT mit 13N-Ammoniak oder 82Rb-Rubidium ist ein wichtiges Instrument in der nichtinvasiven Ischämiediagnostik, insbesondere bei Patienten bei koronarer 3-Gefässerkrankung und Verdacht auf mikrovaskuläre Angina.
- Das Viabilitäts-PET-CT mit 18F-FDG unterstützt den Entscheid zur Revaskularisation von Patienten mit ischämischer Kardiomyopathie.
- Das Hybrid PET/MRI ist eine geeignete Modalität bei Verdacht auf eine kardiale Sarkoidose.
- In der Abklärung eines Klappenprothesen-Infekts gilt das PET-CT mit 18F-FDG neu als Major Kriterium.
Messages à retenir
- Le PET-CT par perfusion myocardique avec 13N-ammonia ou 82Rb-rubidium est un outil important dans le diagnostic d’ ischémie non invasive, en particulier chez les patients atteints de maladie coronarienne à 3 vaisseaux et d’ angine microvasculaire soupçonnée.
- La viabilité du PET-CT avec 18F-FDG appuie la décision de revasculariser les patients atteints de cardiomyopathie ischémique.
- L’ hybride PET/MRI est une modalité appropriée pour les patients soupçonnés de sarcoïdose cardiaque.
- Dans la clarification d’ une infection d’ une prothèse valvulaire, le TEP-CT au 18F-FDG est désormais considéré comme un critère majeur.
1. GL B, WH S. Localization of brain tumors with positron emitters. Nucleonics, 1953:40-45.
2. Montalescot G, Sechtem U, Achenbach S et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013;34:2949-3003.
3. Danad I, Raijmakers PG, Driessen RS et al. Comparison of Coronary CT Angiography, SPECT, PET, and Hybrid Imaging for Diagnosis of Ischemic Heart Disease Determined by Fractional Flow Reserve. JAMA Cardiol 2017;2:1100-1107.
4. Gould KL, Johnson NP. Coronary Physiology Beyond Coronary Flow Reserve in Microvascular Angina: JACC State-of-the-Art Review. J Am Coll Cardiol 2018;72:2642-2662.
5. Dorbala S, Di Carli MF, Beanlands RS et al. Prognostic value of stress myocardial perfusion positron emission tomography: results from a multicenter observational registry. J Am Coll Cardiol 2013;61:176-84.
6. Hachamovitch R, Hayes SW, Friedman JD, Cohen I, Berman DS. Comparison of the short-term survival benefit associated with revascularization compared with medical therapy in patients with no prior coronary artery disease undergoing stress myocardial perfusion single photon emission computed tomography. Circulation 2003;107:2900-7.
7. Herzog BA, Husmann L, Valenta I et al. Long-term prognostic value of 13N-ammonia myocardial perfusion positron emission tomography added value of coronary flow reserve. J Am Coll Cardiol 2009;54:150-6.
8. Gupta A, Taqueti VR, van de Hoef TP et al. Integrated Noninvasive Physiological Assessment of Coronary Circulatory Function and Impact on Cardiovascular Mortality in Patients With Stable Coronary Artery Disease. Circulation 2017;136:2325-2336.
9. Neglia D, Michelassi C, Trivieri MG et al. Prognostic role of myocardial blood flow impairment in idiopathic left ventricular dysfunction. Circulation 2002;105:186-93.
10. Camici PG, Crea F. Coronary microvascular dysfunction. N Engl J Med 2007;356:830-40.
11. Taqueti VR, Solomon SD, Shah AM et al. Coronary microvascular dysfunction and future risk of heart failure with preserved ejection fraction. Eur Heart J 2018;39:840-849.
12. Dorbala S, Vangala D, Bruyere J et al. Coronary microvascular dysfunction is
related to abnormalities in myocardial structure and function in cardiac amyloidosis. JACC Heart Fail 2014;2:358-67.
13. Benz DC, Gaemperli O. The right timing for post-ischemic stunning. J Nucl
Cardiol 2017;24:1302-1304.
14. Benz DC, Ferro P, Safa N et al. Role of quantitative myocardial blood flow and 13N-ammonia washout for viability assessment in ischemic cardiomyopathy. J Nucl Cardiol 2019.
15. Tillisch J, Brunken R, Marshall R et al. Reversibility of cardiac wall-motion abnormalities predicted by positron tomography. N Engl J Med 1986;314:884-8.
16. Bax JJ, Poldermans D, Elhendy A, Boersma E, Rahimtoola SH. Sensitivity, specificity, and predictive accuracies of various noninvasive techniques for detecting hibernating myocardium. Curr Probl Cardiol 2001;26:147-86.
17. Allman KC, Shaw LJ, Hachamovitch R, Udelson JE. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002;39:1151-8.
18. Lim SP, Mc Ardle BA, Beanlands RS, Hessian RC. Myocardial viability: it is still alive. Semin Nucl Med 2014;44:358-74.
19. Freeman AM, Curran-Everett D, Weinberger HD et al. Predictors of cardiac sarcoidosis using commonly available cardiac studies. Am J Cardiol 2013;112:280-5.
20. Zhang J, Li Y, Xu Q, Xu B, Wang H. Cardiac Magnetic Resonance Imaging for Diagnosis of Cardiac Sarcoidosis: A Meta-Analysis. Can Respir J 2018;2018:7457369.
21. Kim SJ, Pak K, Kim K. Diagnostic performance of F-18 FDG PET for detection of cardiac sarcoidosis; A systematic review and meta-analysis. J Nucl Cardiol 2019.
22. Vita T, Okada DR, Veillet-Chowdhury M et al. Complementary Value of Cardiac Magnetic Resonance Imaging and Positron Emission Tomography/Computed
Tomography in the Assessment of Cardiac Sarcoidosis. Circ Cardiovasc Imaging 2018;11:e007030.
23. Dweck MR, Abgral R, Trivieri MG et al. Hybrid Magnetic Resonance Imaging and Positron Emission Tomography With Fluorodeoxyglucose to Diagnose Active
Cardiac Sarcoidosis. JACC Cardiovasc Imaging 2018;11:94-107.
24. Ramirez R, Trivieri M, Fayad ZA, Ahmadi A, Narula J, Argulian E. Advanced
Imaging in Cardiac Sarcoidosis. J Nucl Med 2019;60:892-898.
25. Birnie DH, Sauer WH, Bogun F et al. HRS expert consensus statement on the
diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm 2014;11:1305-23.
26. Bacanovic S, Steffen C, Benz DC, Kaufmann PA, Pazhenkottil AP. Third-degree atrioventricular block: tip of the iceberg of a systemic disease. Eur Heart J 2017;38:1349.
27. Chareonthaitawee P, Beanlands RS, Chen W et al. Joint SNMMI-ASNC expert consensus document on the role of. J Nucl Cardiol 2017;24:1741-1758.
28. Habib G, Lancellotti P, Antunes MJ et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36:3075-3128.
29. Granados U, Fuster D, Pericas JM et al. Diagnostic Accuracy of 18F-FDG PET/CT in Infective Endocarditis and Implantable Cardiac Electronic Device Infection: A Cross-Sectional Study. J Nucl Med 2016;57:1726-1732.
30. Fallavollita JA, Heavey BM, Luisi AJ, Jr. et al. Regional myocardial sympathetic denervation predicts the risk of sudden cardiac arrest in ischemic cardiomyopathy. J Am Coll Cardiol 2014;63:141-9.
31. Ehman EC, El-Sady MS, Kijewski MF et al. Early Detection of Multiorgan Light Chain (AL) Amyloidosis by Whole Body. J Nucl Med 2019.
32. Joshi NV, Vesey AT, Williams MC et al. 18F-fluoride positron emission tomography for identification of ruptured and high-risk coronary atherosclerotic plaques: a prospective clinical trial. Lancet 2014;383:705-13.
info@herz+gefäss
- Vol. 9
- Ausgabe 6
- November 2019