- Troubles cognitifs chez les personnes âgées
Les troubles cognitifs chez les personnes âgées sont courants et, s’ ils sont diagnostiqués tôt et correctement, ils peuvent être influencés de façon décisive par des mesures médicamenteuses et non médicamenteuses actuellement disponibles. L’ examen clinique ainsi que la thérapie sont adaptés à chaque patient et dépendent dans une large mesure du consentement du patient, de son état de santé et de sa situation sociale.
Nous pouvons être confrontés à des plaintes de patients concernant des troubles cognitifs chez les jeunes adultes, mais surtout chez les gens du 3ème et 4ème âge. Dans tous les cas, ces plaintes doivent être prises au sérieux, car si le diagnostic est correct et que des mesures thérapeutiques sont prises à un stade précoce, l’ évolution de la maladie peut être considérablement influencée. Bien que le terme « démence » n’ existe plus depuis l’ introduction du DSM-5,
ce tableau clinique commun chez les personnes âgées (une personne sur trois âgée de plus de 85 ans !) n’ a bien sûr pas disparu. Bien que l’ incidence de la démence ait chuté de près de 50 % au cours des 20 dernières années grâce à un meilleur traitement des facteurs de risque vasculaire, l’ évolution démographique a pratiquement neutralisé ce progrès médical en termes de nombre. La prise en charge moderne des troubles cognitifs dans le développement de la démence repose sur 4 piliers (fig. 1) : diagnostic précoce et précis, pharmacothérapie, mesures non pharmacothérapeutiques et soutien ciblé des proches et des aidants (1).
Y a-t-il des troubles cognitifs « normaux » chez les personnes âgées ?
Les patients – comme nous les médecins – ont tendance à expliquer l’ oubli progressif et d’ autres « petits » échecs cérébraux par le processus de vieillir ou la vieillesse en général. La réalité est différente. Le vieillissement cérébral normal a été scientifiquement très bien étudié et n’ est associé qu’ à un ralentissement discret des processus de réflexion et de réaction. Donc, si un nom ne peut pas être mémorisé immédiatement, mais avec un certain délai, c’ est toujours « normal ». Si l’ on a toujours eu une mauvaise mémoire des noms, il ne faut pas s’ attendre à une amélioration dans la vieillesse ! Mais si l’ oubli est nouveau et que la pression subjective de souffrance des patients causée par l’ oubli est présente (même avec un examen neuropsychologique avec des résultats normaux), il faut l’ évaluer en fonction des résultats les plus récents comme « Subjective Cognitive Decline », qui conduit à la démence dans 25 % des cas en 6 ans (2). Malheureusement, les troubles cérébraux sont encore principalement réduits à la mémoire et à l’ oubli par de nombreuses personnes. Mais notre cerveau fait beaucoup plus ! De nombreux processus de démence commencent également dans d’ autres domaines de la performance cérébrale, où les détériorations (la capacité mémorielle étant préservée) deviennent visibles principalement à travers différents comportements (par exemple, davantage de problèmes avec des tâches complexes telles que la gestion des affaires financières ou la préparation de repas plus compliqués). De tels changements ne sont pas normaux et doivent être clarifiés !
Distinction entre « normal » et « pathologique »
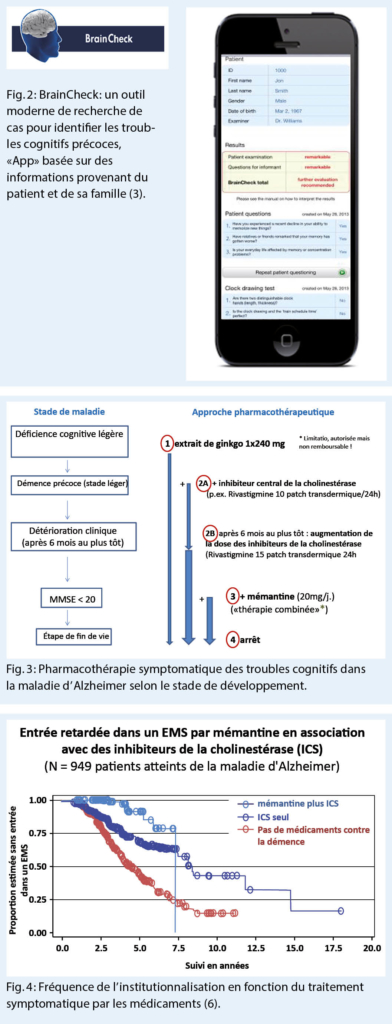
Dans la pratique quotidienne, il doit être possible de décider en peu de temps si les troubles cognitifs doivent être clarifiés plus promptement, si d’ autres observations sont nécessaires ou s’ il n’ est pas nécessaire de prendre des mesures ! Le dépistage précoce (coûteux en temps) des troubles cognitifs à l’ aide du MMSE et du test de l’ horloge a été remplacé ces dernières années par un « dépistage des cas » plus sensible et plus ciblé à l’ aide d’ une « App» (fig. 2). L’ application payante « BrainCheck », développée par les « Swiss Memory Clinics » et les médecins de famille suisses, sépare « normal » et « pathologique » en quelques minutes avec une sélectivité de 90 % (3).
Le patient doit répondre à trois questions simples et passer un test d’ horloge. En même temps, on pose 7 questions brèves à la famille proche du patient ou à son partenaire. Tous les résultats peuvent être enregistrés et évalués immédiatement dans l’ application. La brève évaluation peut être facilement intégrée dans l’ historique médical électronique sous forme de fichier PDF !
Si des clarifications supplémentaires sont nécessaires, une décision doit être prise avec le patient et ses proches sur la manière dont le diagnostic doit être approfondi. Dans un premier temps, l’ exclusion (simple) des causes rapidement traitables est impérative. Un trouble thyroïdien peut être exclu par la détermination du taux de TSH, une dépression par l’ échelle GDS (Geriatric Depression Scale) et une situation de stress psychosocial (stress load) peut être détectée par une anamnèse attentive et, dans le cas positif, traitée par des mesures de prévention appropriées. En cas de suspicion fondée sur l’ anamnèse, il est également possible d’ examiner le statut en vitamine B et de faire une sérologie de la luès. Si l’ on trouve quelque chose dans les domaines mentionnés ci-dessus et que l’ on commence une thérapie, il est recommandé de contrôler la cognition au moyen de BrainCheck environ 6 mois plus tard.
Troubles cognitifs à clarifier
Le type de clarification supplémentaire des troubles cognitifs est très individuel et dépend du consentement du patient, de son état de santé, de son espérance de vie et de sa situation sociale. Les personnes âgées plus jeunes et plus en forme devraient toujours être examinées par un spécialiste de la démence ou en clinique de mémoire. Cela comprend un examen médical en laboratoire et avec des biomarqueurs ainsi qu’ un examen neuropsychologique par imagerie cérébrale (IRM). Chez les patients très âgés et fragiles, une évaluation cognitive raccourcie, par exemple par l’ évaluation MoCa (4) peut également être effectuée. Avec un peu d’ expérience, cela peut être réalisé dans le cabinet du médecin généraliste et être évalué sur le plan diagnostique. Ici aussi, l’ imagerie cérébrale (IRM ou CT) est impérative afin de déterminer la raison neuropathologique la plus probable du développement de la démence. Ceci est décisif pour le type de thérapie à initier.
Troubles cognitifs : Options thérapeutiques
Selon le DSM-5, les troubles cognitifs « légers » se situent dans les deux variations standard d’ un résultat cognitif normal. Sur le plan thérapeutique, outre les mesures médicamenteuses (ginkgo biloba 240 mg/j et vitamine D (24 000 unités par mois), les mesures non médicamenteuses sont particulièrement importantes : activité physique et sociale (cognitive) régulière, alimentation saine et adaptée à l’ âge (protéines régulières et suffisantes (1,2 g / kg par jour ; alimentation méditerranéenne avec une teneur suffisante en acides gras oméga 3) et bonne maîtrise médicale des facteurs de risque vasculaire (hypertension, diabète, hypercholestérolémie). Dans l’ étude finlandaise FINGER (5), ces mesures du mode de vie à elles seules ont permis d’ obtenir des améliorations cognitives significatives après 2 ans !
Options médicamenteuses
Avant d’ utiliser de nouveaux médicaments, toute polypharmacie existante doit faire l’ objet d’ un test de dépistage des substances anticholinergiques provoquant une altération cognitive. Selon le DSM-5, les troubles cognitifs « majeurs » (démence) sont définis par la neuropathologie sous-jacente au processus afin de déterminer la pharmacothérapie (généralement par imagerie et/ou biomarqueurs). S’ il s’ agit d’ un processus neurodégénératif (maladie d’ Alzheimer), le ginkgo, les inhibiteurs de la cholinestérase et la mémantine sont les médicaments de premier choix selon le stade (fig. 3). Lors de ce traitement symptomatique (s’ il est commencé tôt), l’ évolution de la maladie est considérablement améliorée en ce qui concerne le maintien de la fonctionnalité et de l’ indépendance. Ces médicaments agissent très lentement, mais ont un taux de réponse élevé grâce à un « nombre nécessaire à traiter » (NNT) de moins de 10 (pour les trois classes de substances !). Par rapport aux populations témoins non traitées, toutefois, les premières différences cliniques ne surviennent qu’ après un an de traitement ; toutefois, elles deviennent très pertinentes les années suivantes, car le traitement entraîne une réduction impressionnante du nombre d’ admissions dans les foyers de soins (6) (fig. 4). Le traitement combiné de la mémantine et des inhibiteurs de la cholinestérase (avec MMSE < 20) s’ est avéré très efficace. En Suisse, cela n’ est cependant possible que de manière « off-label » et n’ est pas entièrement couvert par l’ assurance de base en raison d’ une limitation. Néanmoins, de nombreux patients (compte tenu de la chute marquée des prix des médicaments antidémences) sont heureux de payer eux-mêmes les quelques centaines de francs par an si cela permet d’ économiser beaucoup plus de frais d’ institutionnalisation. En plus de leur capacité de maintenir la fonctionnalité quotidienne plus longtemps, les médicaments antidémentiels, permettent de réduire considérablement les anomalies comportementales associées à la démence (agressivité, pleurs, agitation motrice, etc.).
Si la pathologie sous-jacente à la démence est purement vasculaire, les médicaments antidémentiels ci-dessus (à l’ exception du ginkgo) ne sont pas efficaces et donc pas indiqués. L’ objectif est de ralentir la progression de la maladie par tous les moyens, avec des mesures de style de vie et le contrôle des facteurs de risque vasculaires. Dans les formes mixtes de démence d’ origine vasculaire et neurodégénérative, des agents anti-démence peuvent être utilisés. Dans les pathologies rares de la démence telles que la maladie de Lewis-Body, la maladie de Parkinson ou la démence fronto-temporale, il est utile de consulter les spécialistes appropriés.
Options non médicamenteuses
Excepté les situations d’ urgence, les interventions non médicamenteuses chez les patients atteints de démence sont recommandées par de grandes associations professionnelles et des groupes d’ experts comme approche primaire dans les symptômes comportementaux et psychologiques de la démence (SCPD) (7). Selon Cohen-Mansfield (8), la plupart des médecins sont formés et instruits pour l’ administration des médicaments lors de SCPD, mais seulement quelques-uns connaissent les thérapies non médicamenteuses et leur efficacité. Les antipsychotiques sont donc fréquemment utilisés avant toute tentative d’ intervention non médicamenteuse.
Contrairement aux capacités cognitives déjà limitées ou perdues au début de la démence, les compétences émotionnelles et psychosociales sont beaucoup moins affectées par ce déclin jusqu’ aux stades avancés de la démence. C’ est là que se situe l’ intervention non médicamenteuse en accédant aux ressources existantes du pouvoir cérébral – abandonnant la focalisation sur le déficit – pour les utiliser et consolider de manière ciblée. L’ activité physique, les activités musicales ainsi qu’ une alimentation riche en protéines et en vitamine D pour maintenir la santé musculaire en cas de démence se sont avérées les plus efficaces (9). L’ effet cérébral des activités motrices associées à la musique, comme la danse et le rythme, est passionnant et fait l’ objet de recherches répétées. Dans l’ étude de cohorte « Einstein Aging », la danse régulière comme activité de loisir a été associée à un risque réduit de démence pouvant
atteindre 80 % (10). Dans une étude d’ intervention utilisant la rythmique Dalcroze, la capacité motrice et cognitive des personnes âgées vivant à domicile a été améliorée et le risque de chute a été réduit de plus de 50 % (11). Aux stades avancés de la démence, la rythmique Dalcroze semble favoriser non seulement l’ influence positive sur les SCPD, mais aussi les aptitudes linguistiques (12). Les interventions non pharmacologiques chez les patients
atteints de démence sont un élément essentiel de la prise en charge moderne de la démence à 4 piliers. Le principal effet attendu de ces mesures est l’ influence positive et sans effet secondaire des SCPD. Les programmes d’ activité physique présentent des avantages supplémentaires pour le fonctionnement quotidien, qui peuvent être maintenus beaucoup plus longtemps, en particulier avec une alimentation riche en protéines et une supplémentation en vitamine D simultanée. La musique et les programmes de mouvements musicaux tels que la danse et le rythme semblent particulièrement qualifiés pour mobiliser les réserves cérébrales et ainsi améliorer significativement la cognition.
Ärztlicher Direktor & Klinischer Professor für Geriatrie
Universitäre Altersmedizin FELIX PLATTER & Universität Basel
Burgfelderstrasse 101
4002 Basel
RetoW.Kressig@felixplatter.ch
L’ auteur n’ a pas déclaré aucun conflit d’ intérêts en relation avec cet article.
- La thérapie symptomatique non médicamenteuse et médicamenteuse lors de troubles cognitifs n’ est qu’ une composante de la prise en charge multifactorielle de la démence à 4 piliers.
- Les approches non médicamenteuses ont des effets cognitifs marginaux à indétectables, mais elles sont efficaces dans les troubles du comportement, les symptômes psychiatriques et le stress du soignant.
- En pharmacothérapie, il est important de réduire autant que possible une polymédication existante et d’ arrêter les substances potentiellement nocives (liste de Priscus).
- Actuellement, il n’ y a aucune justification rationnelle de ne pas utiliser les médicaments antidémentiels symptomatiques disponibles aujourd’ hui (inhibiteurs de la cholinestérase, mémantine et extrait de ginkgo).
- Dans le cas d’ effets cliniques immédiats relativement faibles au début du traitement, les avantages à long terme (institutionnalisation retardée de plusieurs années, troubles du comportement nettement moins fréquents) sont au premier plan.
1. Kressig RW. Aktuelle Pharmakotherapie der Alzheimer Demenz. der informierte Arzt 2015;10:30-33
2. Wolfsgruber S, et al. AgeCoDe Study Group. Differential Risk of Incident Alzheimer’s Disease Dementia in Stable Versus Unstable Patterns of Subjective Cognitive Decline.J Alzheimers Dis. 2016;54:1135-1146
3. Ehrensperger MM, et al. BrainCheck – a very brief tool to detect incipient cognitive decline: optimized case-finding combining patient- and informant-based data. Alzheimers Res Ther. 2014;6:69
4. Nasreddine ZS, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005;53:695-99
5. Kivipelto M et al. The Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER): study design and progress. Alzheimers Dement. 2013;9:657-65.
6. Lopez OL et al. Long-term effects of the concomitant use of memantine with cholinesterase inhibition in Alzheimer disease. J Neurol Neurosurg Psychiatry. 2009 Jun;80(6):600-7
7. Savaskan E et al. Recommendations for diagnosis and therapy of behavioral and psychological symptoms in dementia (BPSD).Praxis (Bern 1994). 2014;103:135-48
8. Cohen-Mansfield J. Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. Am J Geriatr Psychiatry. 2001;9:361-81
9. Kressig RW. Non-pharmacological interventions in dementia. Internistische Praxis 2017;58:1-7
10. Verghese J et al. Leisure activities and the risk of dementia in the elderly. N Engl J Med. 2003;348:2508-16
11. Trombetti A et al. Effect of music-based multitask training on gait, balance, and fall risk in elderly people: a randomized controlled trial. Arch Intern Med. 2011 Mar 28;171:525-33.
12. Winkelmann A et al. La rythmique Jacques-Dalcroze. Une activité physique novatrice pour les personnes agées. Gériatrie Pratique 2005;3:52-55
la gazette médicale
- Vol. 8
- Ausgabe 7
- Dezember 2019