Mitarbeiter der Klinik für Gynäkologie und der Klinik für Infektionskrankheiten und Spitalhygiene des Universitätsspitals Zürich führten unter dem Vorsitz von Prof. Dr. med. Daniel Fink, Direktor der Klinik für Gynäkologie am 4.4.2019 ein Symposium über gynäkologische Infektionen durch.

Symptomatische Infektionen des äusseren und des inneren Genitales gehören zu den häufigsten Gründen, die zu einer ausserplanmässigen Vorstellung in der Praxis führen», stellte Prof. Fink bei der Begrüssung und Einführung zum Symposium fest. Mancher Erreger kann dabei gleich im Nativpräparat festgestellt werden, was die unmittelbare Einleitung einer geeigneten Therapie ermöglicht. Die Untersuchung des Nativpräparates, nicht zwingend behandlungsbedürftige, sowie weniger alltägliche und hartnäckige urogynäkologisch relevante Keime, die korrekte Indikation zur Durchführung laborchemischer Untersuchungen zur Diagnostik und zur Beurteilung des Therapieansprechens, sowie ein Einblick in die neueren Therapie-
möglichkeiten vaginaler Infektionen waren weitere Themen des Symposiums.
Phasenkontrastmikroskopie: «Refresher» Nativpräparat

Die Technik und die Möglichkeiten der Phasenkontrastmikroskopie erläuterte Dr. med. Ioannis Dedes, Klinik für Gynäkologie USZ. In einer 400x Vergrösserung kann man Plattenepithelzellen, sehen, die Zellreife, Zelllyse und Hormonzyklus beurteilen, Nichtepithelzellen, Bakterien, Fremdzellen und Aliens erkennen.
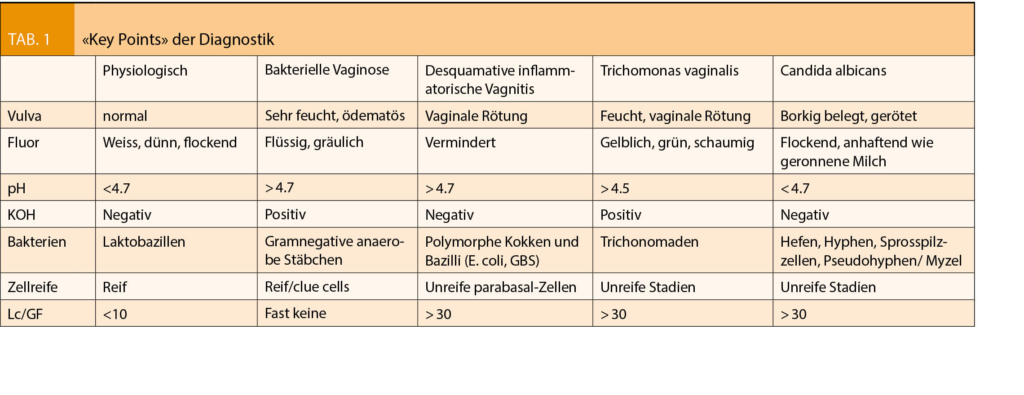
Zu beachten ist in der Phasenkontrastmikroskopie dass die Phasenkontrastblende mit dem Objektiv abgeglichen wird (bei der standardmässigen 400 x Vergrösserung entspricht einem 40 x Objektiv mit der Ph2 Blende) und dünne, ungefärbte Präparate verwendet werden. Die Betrachtung sollte innerhalb von 10 bis max. 20 min nach Ausstreichen des Präparates erfolgen. In der Betrachtung sind stets die 4 Komponenten zu analysieren: Plattenepithelzellen (Zellreife, Zelllyse); Nichtepithelzellen (Leukozyten, Erythrozyten und Zylinderepithel); Bakterien (Clue-cells, Laktobazillen, Kokken/Stäbchen) und Fremdzellen/Aliens (Candida Trichomonas, Sperma, Wurmeier, Fasern etc.) Wir können somit 2/3 der vaginalen Infektionen anhand der Nativ-Mikroskopie (Phasenkontrastmikroskopie inklusive pH- und Amin-Test) der geschilderten Beschwerden und der in der Vaginaluntersuchung erhobenen lokalen Befunden diagnostizieren. (Candidiasis und Bakterielle Vaginose/Desquamative exfoliative Vaginitis, weniger häufig Trichonomaden)
Die Akkuranz der jeweiligen Untersuchungsparameter wurde im JAMA unter derRubrik «The rational clinical examination» 2004 publiziert (Anderson MR, Evaluation of vaginal complaints, JAMA. 2004 Mar 17;291(11):1368-79):
Candidiasis: pH < 4.5: Sensitivität 71%, Spezifität 98%. Amintest negativ. Pilzelemente: Sensitivität 61%, Spezifität 90%.
Bakterielle Vaginose: pH > 5: Sensitivität 77%, Spezifität 35%, Amintest: Sensitivität 67%, Amsel: Sensitivität 92%, Spezifität 77%. (Cave: Bis 37% Begleitinfektionen, dadurch Minderung der Sensitivität).
Trichonomaden: pH > 5.4: Sensitivität 92%, Spezifität 51%. Amintest Sensitivität 67%, Trichom. Sensitivität 50-70%, Spezifität 100%.
Symptom Ausfluss und rezidivierende urogynäkologische Infektionen

Dysurie bei negativem Mittelstrahl, verschiedene Therapien frustran, veränderter Fluor, kein Pilz, Chlamydien und Gonokokken negativ (in 70% der PID, «pelvic inflammatory disease»- Fälle wird kein Erreger gefunden), diffuse Bauchschmerzen sind die Charakteristika von NCNG Infekten (nicht Chlamydien, nicht Gonokokken) stellte PD Dr. med. Cornelia Betschart, Klinik für Gynäkologie USZ, eingangs fest. Der phylogenetische Stammbaum der Mykoplasmataceae umfasst mehr als 200 Mykoplasma Species, davon
6 Humanpathogene: M. genitalium, M. hominis, M. fermentas, M. pneumoniae, Ureaplasma urealyticum, Ureaplasma parvum.
M. genitalium: Nicht-Chlamydien Nicht-Gonokokken genitale Infekte (NCNGU/V/C). Sie sind asymptomatisch (42%), oder begleitet von Dysurie und diffusen Unterbauchschmerzen, vaginalem Jucken und Sterilität. Weitere Keime/Begleitkeime sind Mykoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum.
Mykoplasma genitalium ist das kleinste humanpathogene Bakterium mit 580,070 Basenpaaren (580 kbp). Es besitzt keine Zellwand und ist in der Gram-Färbung nicht sichtbar. Isolate stammen aus Respirationstrakt, Gelenkflüssigkeit oder dem Urogenitaltrakt. Pathogen: Urogenitaltrakt (Urethra/ Vagina), sexuell übertragbar, Toxine, H2O2.
Medizinische Konstellationen zu M. genitalium: In 15% der Frauen mit PID («pelvic inflammatory disease»). Die Inzidenz der post-abruptio PID ist bei den M. genitalium positiven Frauen mit Abruptiones höher (12.2% vs. 2.4%, odds ratio 6.29).
Tubarer Faktor Sterilität: 50% der Erreger sind nicht bekannt. M.genitalium IgG häufiger positiv bei Frauen in Paaren in der Sterilitätsberatung (5.48%) als bei Frauen ohne Sterilität (1.6%).
Soll M. genitalium als Zufallsbefund behandelt werden? Die Bedeutung von M. genitalium bei PID wurde in einer prospektiven Studie an 2246 sexuell aktiven College Studentinnen untersucht. Die Prävalenz betrug 3.3% (alle asymptomatisch). Trägerinnen von M. genitalium hatten im Verlauf eines Jahres knapp dreimal häufiger eine PID.
Die Therapie besteht aus Azithromycin 1 g, Einmaldosis. Heilungsrate 77%. 100-fach höhere Aktivität gegen Mykoplasmen als Tetrazykline (45%), Cindamycin oder Chinolone. Resistenztestung kommerziell nicht möglich. 2. Wahl ist Moxifloxacin. Behandlung der Sexualpartner bis 60 Tage zurückliegend. Penicilline oder Beta-Lactame ohne Wirkung, da keine Zellwand. Zukunft: Solithromycin (Fluoroketolid).
Prävalenz anderer kleiner Keime?
Mykoplasma hominis (sexuell aktive Frauen 20%), Ureaplasma parvum (sexuell aktive Frauen 40%), Ureaplasma urealyticum (sexuell aktive Frauen bis 20 –(90)%). Postpartum sind viele vaginal geborene Kinder bis zum Alter von 3 Monaten kolonalisiert.
Blasenmikrobiom
Das Blasenmikrobiom umfasst 102 – 105 cfu/ml Urin. Es sind 1-12 Species vorhanden: Lactobacillus, Gardnerella, Streptokokken, Staphylokokken, Corynebakterien, aber nicht E. coli. Immuntherapien verändern das Mikrobiom, was zu rezidivierenden Harnwegsinfekten (HWI) führen kann.
Was tun, wenn als Zufallsbefund gefunden?
Das Trägertum ist häufig und die meisten Träger entwickeln keine Pathologie. Mit der Kommerzialisierung von «multiplex PCR» werden häufiger Trägerkeime diagnostiziert. Ureaplasma urealyticum bei Männern mit Urethritis, wahrscheinlich nur bei hoher Erregerlast. Immer sollte auf N. gonorrheae, C. trachomatis, M. genitalium (Doxicyclin) getestet werden. Bei der Behandlung gibt es keine Evidenz für «more good than harm» (Resistenzlage). Es bleibt die Frage nach den Gesundheitskosten bei ungenügender Evidenz.
Schwangerschaft
Mykoplasma und Ureaplasma spp. assoziiert mit Chorioamnionitis. Die Frühgeburtsrate ist erhöht. Falls in Amniocentese entdeckt, stellt sich die Frage nach der Frühgeburtlichkeit. Bei IVF Paaren gibt es keine Unterschiede in der Schwangerschaftsrate. Die Therapie von M. genitalium erfolgt mit Azithromcyin. 1g p.p.. Erythromycin (bei vorzeitigem Blasensprung). Antibiotika haben anti-inflammatorische Wirkung. Die Verbesserung des Schwangerschaftsoutcomes ist grösser als die Wirkung der Erregerirradikation.
Fazit
Sind M. genitalium die «neuen Chlamydien»? kleine Bakterien mit grosser Wirkung: Urethritis, PID, Sterilität, ev. Aborte und Frühgeburten. Symptome: nihil 42% bei M. genitalium, andere species noch höher asymptomatisch. Nicht-spezifische Symptome wie Dysurie, «pelvic dyscomfort», vaginales Jucken.
Therapie bei M. genitalium, inkl. Partnertherapie, Azithromycin 1 g. M. hominis, Ureaplasmen: unklar, ob primäre Pathogenese oder Begleitkeime. Zurückhaltung mit Antibiose – Schwangerschaft ja bei Frühgeburtsbestrebungen Fluomicin/lokale Therapie keine Evidenz.
Rezidivierende und persistierende vulvovaginale Infektionen
Zu Infektionen, die man erkennt und erkennt, Infektionen, die man kennt aber nicht erkennt, Infektionen, die man kennt , aber nie/nur selten sieht, Infektionen, an die man nie denkt , solche, die man nicht mal kennt und solche, die gar keine Infektionen sind, äusserte sich Frau Dr. med. Inessa Diomande, Oberärztin der Klinik für Gynäkologie.
Zu den Infektionen, die man kennt und erkennt zählen die Pilzinfektionen: Candida Die viralen Infektionen: Genitalherpes, Herpes Zoster, HPV-assoziierte Infektionen- Condylomata acuminata
Bakterielle Infektionen: Aminvaginose, aerobe Vaginitis, Follikulitis, Bartholinidrüsen Abszess.
Parasiten: Trichonomaden

Fallvignette 1: 38-jährige Patientin mit Brennen und Juckreiz seit 6 Monaten. Gyneprevaryl, Gynecanestin, Mycolog bereits erfolglos ausprobiert. Auftreten insbesondere prämenstruell.
Von einer rezidivierenden Candida spricht man bei mehr als 4 Infekten pro Jahr. Candida albicans gehört zur normalen mikrobiellen Flora von Epithelzellen. Eine Therapie erfolgt nur bei Symptomatik. Bei chronischer Erkrankung gibt es keine kausale Therapie. Suppressive Therapie wie bei allen chronischen Erkrankungen.
Rezidivierende Candida-Therapie: Initial Fluconazol 150mg alle 72h, Fluconazol 150mg 1 x /Woche oder Imidazol lokal tgl. während 10 Tagen, dann prämenstruell 3-5 Tage. Keine Gefahr von Resistenzen, kein GV-Verbot bei P.O., keine Partnertherapie, zuckerfreie Diät und Probiotika bringen nichts, Komb. OH Stopp für 6 Monate →Wechsel auf POP
Fallvignette 2: Blickdiagnose. Herpes Simplex Virus Sicherung bei primärer Infektion mittels PCR. Kultur ergibt nur 50% Sensitivität.
Genitalherpestherapie: Supportive Care , Lidocain 5%, chronisch suppressive Therapie (1-6 Rezidive/Jahr), sporadische Therapie (bei ersten Prodromi).
Suppressive Therapie: Acyclovir 400mg
1-0-1, Famciclovir 250mg 1-0-1, Vlacyclovir 500mg 1-0-0 (während 6-12 Monaten).
Sporadische Therapie: Acyclovir 5 x 200mg alle 4h während 5 Tagen, Famiciclovir 125mg 1-0-1, 5 Tage, Valacyclovir 500mg 1-0-1, 5 Tage.
Strategien zur Transmissionsreduktion: selektive Abstinenz während Prodromi, selektive Abstinenz während Rezidiven, Kondome (-30%), antivirale Suppression, Transparenz.
Fallvignette 3: 27 jährige Patientin. Zuweisung aufgrund therapieresistenter Infekte seit einem Jahr, übel riechender Fluor. Therapien: lokale Antimykotika, Fluconazol, Fluomizin, Deumavan, Betnovate. Abklärung bezüglich Wurmeier im Stuhl negativ. Schlafstörungen bei psychosozialer Überlastung und Angststörung, in psych. Behandlung (Temesta I.R.).
Bakterielle (anaerobe) Vaginose-Therapie:
Amsel-Kriterien: Dünner, homogener, milchiger Ausfluss, pH >4.5, KOH positiv, Clue Cells (>20%). Präoperativ stets behandeln: Reduktion der postoperativen Infektionen, v.a. bei Aborten und HE bis zu 70%. Abhängig von GV-Häufigkeit.
Metronidazol 2g Tag 1/3, 1g 7 Tage p.o., Flagyl Ovula 500 mg 10 Tage, Clindamycin300 mg 1-0-1- 7 Tage, Dalacin V2%, 7 Tage, kaum Evidenz für Probiotika. Trichonomaden: 0-4% aller Frauen sind infiziert. Es ist anzunehmen, dass dies häufig verpasst wird (30-40%). PCR ist die effizienteste Methode der Diagnostik. Cave Antabuseffekt, Partnertherapie indiziert! Behandlung mit Metronidazol 2 g p.o., Einmaldosis (Rezidive: Tinidazol und Metronidazol während 1 Woche). Während Schwangerschaft kann Metronidazol gegeben werden.
Fallvignette 4: Zuweisung aufgrund von Schmerzen vaginal, Dyspareunie und vermehrt Fluor seit 8 Monaten.
Therapien: Lokale Antimykotika, Deumavan, Betnovate. Kulturergebnisse: Beta-hämol. Streptokokken Gr. A. (Streptococcus pyogenes) reichlich, Beta-hämolyt. Streptokokken Gr. B (Streptococcus agalactiae) reichlich. Rezividierende und persistierende vulvovaginale Infektion.
Aerobe Vaginitis
Erkennen in der Schwangerschaft: Chorioamnionitis, PPROM, Frühgeburt. Assoziation mit Zervixdysplasie. Therapie lokal Clindamycin V 2%, Hydrocortison 10% (Alfacorten Salbe) 4-6 Wochen. Alternativen: Tacrolimus 0.03%, Clobetazol 0.05% 1-0-1.
riesen@medinfo-verlag.ch
Quelle: Symposium «Gynäkologische Infektionen» organisiert durch die Klinik für Gynäkologie am USZ, 4. April 2019.