Die medikamentöse Therapie der chronischen Herzinsuffizienz hat sich in den letzten Jahren durch den Miteinbezug neuer Medikamenten-Klassen in die Behandlungsrichtlinien stark weiterentwickelt. Der vorliegende Artikel fasst die aktuellen Empfehlungen kurz zusammen und geht insbesondere auf neue Erkenntnisse seit der Veröffentlichung der aktuellen Herzinsuffizienz-Leitlinien der europäischen Gesellschaft für Kardiologie (ESC) von 2016 näher ein (1).
Die medikamentöse Therapie der Herzinsuffizienz hängt nach wie vor entscheidend von der linksventrikulären Auswurffraktion (left ventricular ejection fraction, LVEF) ab, auch wenn wir wissen, dass die LVEF kein perfektes Mass für die systolische linksventrikuläre Funktion ist, und deren Bestimmung einer relativ starken Messvariabilität unterworfen ist.
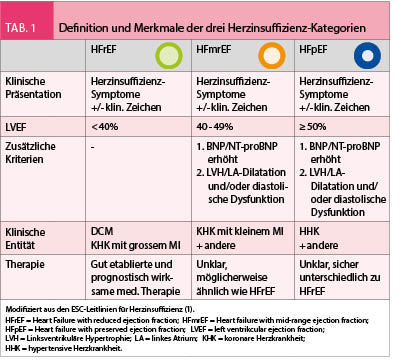
Gemäss den aktuellen ESC-Leitlinien werden drei Herzinsuffizienz-Kategorien unterschieden (Tab. 1): 1) Herzinsuffizienz mit reduzierter LVEF < 40% (Heart Failure with reduced Ejection Fraction, HFrEF), 2) Herzinsuffizienz mit erhaltener LVEF (LVEF ≥ 50%; Heart Failure with preserved Ejection Fraction, HFpEF), und 3) eine seit 2016 definierte Zwischenkategorie der Herzinsuffizienz mit mässig eingeschränkter LVEF (LVEF 40-49%; Heart Failure with mid-range Ejection Fraction, HFmrEF). Im vorliegenden Artikel werden die Neuigkeiten der medikamentösen Therapie in Bezug auf die verschiedenen Herzinsuffizienz-Kategorien getrennt dargestellt.
Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF)
Für die HFrEF existieren mehrere symptomatisch und prognostisch wirksame medikamentöse Therapieoptionen, deren sequentieller Einsatz durch die Datenlage bzw. die aktuellen Leitlinien relativ gut definiert ist (1). Die Basis-Therapie besteht dabei neben einer symptomatischen Therapie mit Schleifendiuretika (soviel wie nötig, so wenig wie möglich) immer aus einer Kombination eines ACE-Hemmers (ACE-I) oder Angiotensin-II Rezeptor-Blocker (ARB; nur bei ACE-I-Unverträglichkeit) und einem Betablocker, wobei die Reihenfolge des Einsatzes der beiden Medikamentenklassen unwesentlich ist, aber beide möglichst maximal dosiert werden sollen. Bleibt die LVEF trotz dieser Basistherapie ≤ 35%, und ist der Patient weiterhin symptomatisch (NYHA ≥ II), kommt zusätzlich ein Mineralokortikoid-Rezeptor-Antagonist (MRA; Spironolacton oder Eplerenon) zum Einsatz. Bei weiterhin persistierender Symptomatik bestehen danach drei weitere Therapie-Optionen, die einzeln oder auch kombiniert (je nach Effekt) zur Anwendung kommen können: 1) Wechsel des ACE-I/ARB auf einen Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI), sofern weiterhin ein erhöhtes B-type natriuretic peptide (BNP) resp. N-terminales proBNP (NT-pro BNP) nachweisbar ist. 2) Einsatz von Ivabradin bei Sinusrhythmus mit HF ≥ 70/min unter maximal tolerierter Betablocker-Dosis. 3) Implantation eines kardialen Resynchronisations-Devices (CRT) insbesondere bei sehr langer QRS-Dauer (≥ 150 ms) und typischer Linksschenkelblock-Morphologie. Bei persistierender Dyspnoe NYHA ≥II kommen individuell weitere, weniger gut etablierte Optionen wie Digoxin und H-ISDN (Hydralazin und Isosorbid-Dinitrat) in Frage.
Neues zur HFrEF-Therapie mit einem Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI)
Kurz vor Erscheinen der aktuellen ESC-Leitlinien von 2016 (1) wurden die Resultate der PARADIGM-HF Studie (2) veröffentlicht. Dabei zeigte sich bei Patienten mit HFrEF und NYHA II-IV unter Therapie mit Sacubitril/Valsartan gegenüber der Therapie mit Enalapril eine 20% Reduktion des primären kombinierten Endpunktes (kardiovaskulärer Tod und Hospitalisierung wegen Herzinsuffizienz). Durch dieses Studienresultat fand die ARNI-Therapie mit einer Klasse IB Indikation Eingang in die Leitlinien.
In der Zwischenzeit konnte in verschiedenen Analysen gezeigt werden, dass der relative Benefit von Sacubitril/Valsartan gegenüber Enalapril auch bei Patienten mit tiefen Ausgangs-Blutdruckwerten (3) und bei nötiger Dosisreduktion (4) bestehen bleibt. Da Patienten mit diesen beiden Eigenschaften eine Population mit fortgeschrittener HFrEF repräsentieren und deshalb auch eine allgemein gesehen höhere Ereignisrate aufweisen, profitieren diese Patientengruppen absolut gesehen am meisten von einer Therapie mit Sacubitril/Valsartan. Andererseits sind das genau die Patienten, bei denen die Installation einer ARNI-Therapie auf Grund der stark hypotensiven Wirkung besonders schwierig ist. Weitere Analysen der PARADIGM-Studie haben folgendes gezeigt:
- Sacubitril / Valsartan verlangsamt gegenüber Enalapril die Verschlechterung der Nierenfunktion, bei Patienten mit chronischer Niereninsuffizienz (5).
- Der Effekt von Sacubitril / Valsartan ist innerhalb des HFrEF-Spektrums unabhängig von der LVEF (6) und
- Sacubitril / Valsartan reduziert im Vergleich zu Enalapril auh das Risiko eines plötzlichen Herztodes (7).
Neues zur Hyperkaliämie und HFrEF-Therapie
Unter einer Kombinationstherapie mit einem ACE-I/ARB und einem MRA besteht vor allem bei niereninsuffizienten sowie bei älteren Patienten (8) die Gefahr einer Hyperkaliämie, was nicht selten zu einer zurückhaltenden Verordnung, respektive einem Absetzen des prognostisch wichtigen MRA führt. In einer Metaanalyse von 2017, welche die grossen Herzinsuffizienzstudien mit MRA eingeschlossen hat (9), zeigte sich eine Hyperkaliämie-Rate unter Herzinsuffizienztherapie mit einem MRA von 9.3% versus 4.3% bei Patienten ohne MRA. Dies unterstreicht zwar die deutlich höhere Hyperkaliämie-Rate unter einem MRA, allerdings entwickeln auch halb so viele Patienten ohne MRA eine Hyperkaliämie, was auf häufige nicht-MRA-bedingte Ursachen der Hyperkaliämie hinweist.
Auf medikamentöser Ebene kann eine ARNI-Therapie verglichen mit einer ACE-I Therapie die Rate schwerer Hyperkaliämien (>v 6mmol/l) in Kombination mit einem MRA reduzieren, auch wenn die mässigen Hyperkaliämien in vergleichbarem Masse auftreten (10). Neben einer Schleifendiuretikum-Gabe und weiteren Allgemeinmassnahmen zur Reduktion des Kaliums, kam in den letzten Jahren eine weitere Möglichkeit auf, um eine ausgebaute Herzinsuffizienztherapie inklusive MRA trotz Hyperkaliämie zu ermöglichen: Nicht-absorbierbare Kaliumbinder wie Patiromer und ZS 9 konnten in klinischen Studien nicht nur ihre Wirksamkeit zur Therapie einer Hyperkaliämie bei chronischer Niereninsuffizienz zeigen (11, 12), sondern waren auch bei Patienten mit ausgebauter Herzinsuffizienztherapie mit ACE-I/ARB und MRA in der Lage eine Normokaliämie zu erhalten und Rezidive zu verhindern (13, 14). Kürzlich wurde ein Expertenkonsensus zur Behandlung der Hyperkaliämie bei kardiovaskulären Patienten unter Therapie mit ACE-I/ARB und MRA veröffentlicht, wobei auch die neuen Substanzen Eingang gefunden haben (15).
Neues zu Diabetes mellitus und HFrEF-Therapie
Die 2016 Leitlinien halten fest, dass Metformin das primäre Medikament zur Behandlung von Patienten mit Herzinsuffizienz und Diabetes ist, da Metformin die einzige perorale Substanz mit zumindest neutralen kardiovaskulären Effekten ist. Eine neuere Klasse antidiabetischer Medikamente hat in letzter Zeit grosses Aufsehen erregt. Die Gruppe der Sodium-Glucose Cotransporter 2-Inhibitoren (SGLT2-Inhibitoren) führen über eine gesteigerte Glucosurie zur Reduktion des Blutglucose-Spiegels. In den grossen, von den Behörden verlangten kardiovaskulären Sicherheitsstudien für Empagliflozin (EMPA-REG-OutcomeTM (16)) und Canagliflozin (CANVAS (17)) zeigte sich das überraschende Resultat einer 35% (EMPA-REG-OutcomeTM) resp. 33% (CANVAS) Reduktion der Hospitalisationen wegen Herzinsuffizienz bei diabetischen Patienten, wovon bei 10% der Patienten (EMPA-REG-OutcomeTM) eine Herzinsuffizienz vorbestehend war. Dies ist die erste Studie, die bezüglich harter klinischer kardiovaskulärer Effekte für ein orales Antidiabetikum positiv ausfiel. Die genauen, diesem Resultat zugrundeliegenden Mechanismen, sind bis anhin unklar. Mitverantwortlich scheint eine diuretische Wirkung zu sein. Nebst der Klärung dieser Wirkmechanismen stellt sich nun insbesondere die Frage, ob die SGLT II-Inhibitoren auch als primäre Herzinsuffizienztherapie bei HFrEF Patienten ohne Diabetes mellitus eine prognostische Wirkung zeigen können. Hierzu laufen aktuell verschiedene gross angelegte Outcome-Studien (u.a. Dapa-HF, EMPEROR-R).
Herzinsuffizienz mit erhaltener Auswurffraktion (HFpEF)
Im Gegensatz zur HFrEF konnte bei HFpEF noch für keine medikamentöse Therapie eine Reduktion der Mortalität nachgewiesen werden. Die Leitlinien (1) halten für das Management von HFpEF fest, dass, a) eine diuretische Therapie bei hypervolämen Patienten indiziert ist und b) dass Komorbiditäten (z.B. Uebergewicht, Lungenerkrankungen, Schlafapnoe) systematisch gesucht und wenn vorhanden rigoros behandelt werden sollen.
Allerdings muss festgehalten werden, dass in den letzten Jahren das Wissen über HFpEF durch zahlreiche Studien zu verschiedenen Therapieansätzen deutlich erweitert werden konnte (18). Zusätzlich ergaben sich wichtige neue Aspekte zur randomisierten, multinationalen TOPCAT Studie (19), welche die Wirkung von Spironolacton bei HFpEF untersucht hat. Vorangegangen waren mechanistische Studien, welche günstige Effekte von Spironolactone auf die diastolische LV-Funktion und die Leistungsfähigkeit dokumentiert hatten. Die TOPCAT-Studie fiel zwar bezüglich des primären kombinierten Endpunkts (kardiovaskulärer Tod, überlebter plötzlicher Herztod, Hospitalisation wegen Herzinsuffizienz) und Mortalität insgesamt neutral aus. Allerdings konnte eine Reduktion der Hospitalisationen wegen Herzinsuffizienz für Spironolacton gezeigt werden, was für die alten und polymorbiden HFpEF-Patienten ein wichtiges Ergebnis ist. Auf Grund einerseits sehr unterschiedlicher Ereignisraten und andererseits unterschiedlicher Therapieeffekten in den USA/Kanada gegenüber Russland wurden im Verlauf verschiedene Analysen durchgeführt, welche suggerieren, dass in Russland ein relevanter Anteil der eingeschlossenen Patienten wahrscheinlich keine HFpEF hatte (viel besserer Outcome als in den USA) und wahrscheinlich keine Spironolacton-Therapie erhielt (kein Nachweis von Spironolactone-Metaboliten im Urin und keine Veränderungen des Serum-Kaliums unter Therapie) (20). Wenn man dies berücksichtigt, könnte TOPCAT doch auf eine günstige Wirkung von Spironolacton bei HFpEF hinweisen.
Grosse Studien untersuchen derzeit die Wirksamkeit von Sacubitril/Valsartan versus Valsartan (PARAGON-HF; bereits günstige Effekte bezüglich NT-proBNP und linksatrialem Remodeling in einer mechanistischen Studie gezeigt (21)) sowie des SGLT2-Inhibitors Empagliflozin (EMPEROR-Preserved, EMPERIAL-Preserved) bei HFpEF.
Herzinsuffizienz mit mässig eingeschränkter Auswurffraktion (HFmrEF)
Bisherige Herzinsuffizienztherapiestudien haben sich auf die zwei Entitäten HFrEF (Einschlusskriterium jeweils meist LVEF <40% oder < 35%) und HFpEF beschränkt, wobei die Einschlusskriterien für HFpEF variabel waren (LVEF > 40% bis LVEF ≥50%). Die in den aktuellen Leitlinien neu geschaffene Kategorie der HFmrEF wurde somit bisher nie allein studiert, sondern nur innerhalb von HFpEF-Studien, und es ist unklar, ob diese Patienten von einer HFrEF-Therapie profitieren oder eher wie HFpEF-Patienten auf die Therapie reagieren.
In einer grossen Metaanalyse (22) zeigten sich bei HFmrEF intermediäre Patienten-Charakteristika bezüglich kardiale und nicht-kardiale Komorbiditäten, Alter und Geschlecht verglichen mit Patienten mit HFrEF und HFpEF. Jedoch war die koronare Herzkrankheit als Ursache der Herzinsuffizienz bei HFmrEF signifikant häufiger als bei HFpEF-Patienten und von der Häufigkeit sogar vergleichbar mit derjenigen der HFrEF Populationen. Dies kann auf gewisse Ähnlichkeiten der HFmrEF Population mit der HFrEF Population hindeuten.
Einige post-hoc Analysen grösserer Herzinsuffizienzstudien suggerieren, dass eine HFrEF-Therapie auch im Setting einer HFmrEF einen Benefit haben könnte. In der TOPCAT Studie (Spironolacton vs Placebo bei HFpEF (19)) wurden Patienten mit LVEF >45% eingeschlossen. Der stärkste therapeutische Benefit von Spironolacton fand sich in der Subgruppe der Patienten mit LVEF 45-50%, was damit wiederum auf einen Nutzen bei HFmrEF Patienten hindeutet (23). Des Weiteren zeigte auch eine Analyse der CHARM-Studie (24), welche alle drei Herzinsuffizienz-Typen eingeschlossen hat, eine vergleichbare signifikante Reduktion des primären Endpunktes (bestehend aus kardiovasulärer Mortalität und Hospitalisation aus Herzinsuffizienz-Gründen) unter Candesartan bei HFmrEF- und HFrEF-Patienten, während bei HFpEF kein Benefit dokumentiert werden konnte. Analog konnte in der TIME-CHF-Studie gezeigt werden, dass HFmrEF-Patienten wie HFrEF-Patienten günstig auf eine NT-proBNP-gesteuerte Therapie ansprechen, während diese bei HFpEF-Patienten nicht effektiv und sogar kontraproduktiv war (25, 26).
Insgesamt gibt es somit gute Hinweise, dass Patienten mit HFmrEF von einer HFrEF-Therapie profitieren könnten. Zukünftig sind prospektive Studien nötig, um diese Daten zu bestätigen.
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
marc.buser@kssg.ch
Bei M. Buser und M. Maeder besteht eine Advisory Board Tätigkeit für Novartis.
Literatur
1. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, Falk V, González-Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GM, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:2129-200.
2. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Solomon SD, Swedberg K, Zile MR; PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004.
3. Böhm M, Young R, Jhund PS, Solomon SD, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Swedberg K, Zile MR, Packer M, McMurray JJV. Systolic blood pressure, cardiovascular outcomes and efficacy and safety of sacubitril/valsartan (LCZ696) in patients with chronic heart failure and reduced ejection fraction: results from PARADIGM-HF. Eur Heart J. 2017 Apr 14;38(15):1132-1143.
4. Vardeny O, Claggett B, Packer M, Zile MR, Rouleau J, Swedberg K, Teerlink JR, Desai AS, Lefkowitz M, Shi V, McMurray JJ, Solomon SD; Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure (PARADIGM-HF) Investigators. Efficacy of sacubitril/valsartan vs. enalapril at lower than target doses in heart failure with reduced ejection fraction: the PARADIGM-HF trial. Eur J Heart Fail. 2016 Oct;18(10):1228-1234.
5. Damman K, Gori M, Claggett B, Jhund PS, Senni M, Lefkowitz MP, Prescott MF, Shi VC, Rouleau JL, Swedberg K, Zile MR, Packer M, Desai AS, Solomon SD, McMurray JJV. Renal Effects and Associated Outcomes During Angiotensin-Neprilysin Inhibition in Heart Failure. JACC Heart Fail. 2018 Jun;6(6):489-498.
6. Solomon SD, Claggett B, Desai AS, Packer M, Zile M, Swedberg K, Rouleau JL, Shi VC, Starling RC, Kozan Ö, Dukat A, Lefkowitz MP, McMurray JJ. Influence of Ejection Fraction on Outcomes and Efficacy of Sacubitril/Valsartan (LCZ696) in Heart Failure with Reduced Ejection Fraction: The Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure (PARADIGM-HF) Trial. Circ Heart Fail. 2016 Mar;9(3):e002744.
7. Desai AS, McMurray JJ, Packer M, Swedberg K, Rouleau JL, Chen F, Gong J, Rizkala AR, Brahimi A, Claggett B, Finn PV, Hartley LH, Liu J, Lefkowitz M, Shi V, Zile MR, Solomon SD. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J. 2015 Aug 7;36(30):1990-7.
8. Muzzarelli S, Maeder MT, Toggweiler S, Rickli H, Nietlispach F, Julius B, Burkard T, Pfisterer ME, Brunner-La Rocca HP; TIME-CHF Investigators. Frequency and predictors of hyperkalemia in patients ≥60 years of age with heart failure undergoing intense medical therapy. Am J Cardiol. 2012 Mar 1;109(5):693-8.
9. Vukadinović D, Lavall D, Vukadinović AN, Pitt B, Wagenpfeil S, Böhm M. True rate of mineralocorticoid receptor antagonists-related hyperkalemia in placebo-controlled trials: A meta-analysis. Am Heart J. 2017 Jun;188:99-108.
10. Desai AS, Vardeny O, Claggett B, McMurray JJ, Packer M, Swedberg K, Rouleau JL, Zile MR, Lefkowitz M, Shi V, Solomon SD. Reduced Risk of Hyperkalemia During Treatment of Heart Failure With Mineralocorticoid Receptor Antagonists by Use of Sacubitril/Valsartan Compared With Enalapril: A Secondary Analysis of the PARADIGM-HF Trial. JAMA Cardiol. 2017 Jan 1;2(1):79-85.
11. Weir MR, Bakris GL, Bushinsky DA, Mayo MR, Garza D, Stasiv Y, Wittes J, Christ-Schmidt H, Berman L, Pitt B; OPAL-HK Investigators. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med. 2015 Jan 15;372(3):211-21.
12. Kosiborod M, Rasmussen HS, Lavin P, Qunibi WY, Spinowitz B, Packham D, Roger SD, Yang A, Lerma E, Singh B. Effect of sodium zirconium cyclosilicate on potassium lowering for 28 days among outpatients with hyperkalemia: the HARMONIZE randomized clinical trial. JAMA. 2014 Dec 3;312(21):2223-33.
13. Pitt B, Anker SD, Bushinsky DA, Kitzman DW, Zannad F, Huang IZ; PEARL-HF Investigators. Evaluation of the efficacy and safety of RLY5016, a polymeric potassium binder, in a double-blind, placebo-controlled study in patients with chronic heart failure (the PEARL-HF) trial. Eur Heart J. 2011 Apr;32(7):820-8.
14. Anker SD, Kosiborod M, Zannad F, Piña IL, McCullough PA, Filippatos G, van der Meer P, Ponikowski P, Rasmussen HS, Lavin PT, Singh B, Yang A, Deedwania P. Maintenance of serum potassium with sodium zirconium cyclosilicate (ZS-9) in heart failure patients: results from a phase 3 randomized, double-blind, placebo-controlled trial. Eur J Heart Fail. 2015 Oct;17(10):1050-6.
15. Rosano GMC, Tamargo J, Kjeldsen KP, Lainscak M, Agewall S, Anker SD, Ceconi C, Coats AJS, Drexel H, Filippatos G, Kaski JC, Lund L, Niessner A, Ponikowski P, Savarese G, Schmidt TA, Seferovic P, Wassmann S, Walther T, Lewis BS. Expert consensus document on the management of hyperkalaemia in patients with cardiovascular disease treated with renin angiotensin aldosterone system inhibitors: coordinated by the Working Group on Cardiovascular Pharmacotherapy of the European Society of Cardiology. Eur Heart J Cardiovasc Pharmacother. 2018 Jul 1;4(3):180-188.
16. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ, Broedl UC, Inzucchi SE; EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015 Nov 26;373(22):2117-28.
17. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR; CANVAS Program Collaborative Group. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017 Aug 17;377(7):644-657.
18. Maeder MT, Buser M, Brenner R, Rickli H. Heart failure with preserved ejection fraction (HFpEF).Ther Umsch. 2018 Sep;75(3):161-169.
19. Pitt B, Pfeffer MA, Assmann SF, Boineau R, Anand IS, Claggett B, Clausell N, Desai AS, Diaz R, Fleg JL, Gordeev I, Harty B et al for the TOPCAT Investigators. Spironolactone for Heart Failure with Preserved Ejection Fraction. N Engl J Med 2014; 370:1383-1392.
20. De Denus S, O’Meara E, Desai AS, Claggett B, Lewis EF, Leclair G, Jutras M, Lavoie J, Solomon SD, Pitt B, Pfeffer MA, Rouleau JL. Spironolactone Metabolites in TOPCAT – New Insights into Regional Variation. N Engl J Med. 2017 Apr 27;376(17):1690-1692.
21. Solomon SD, Zile M, Pieske B, Voors A, Shah A, Kraigher-Krainer E, Shi V, Bransford T, Takeuchi M, Gong J, Lefkowitz M, Packer M, McMurray JJ; Prospective comparison of ARNI with ARB on Management Of heart failUre with preserved ejectioN fracTion (PARAMOUNT) Investigators. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Lancet. 2012 Oct 20;380(9851):1387-95.
22. Lauritsen J, Gustafsson F, Abdulla J. Characteristics and long-term prognosis of patients with heart failure and mid-range ejection fraction compared with reduced and preserved ejection fraction: a systematic review and meta-analysis. ESC Heart Fail. 2018 Aug;5(4):685-694.
23. Solomon SD, Claggett B, Lewis EF, Desai A, Anand I, Sweitzer NK, O’Meara E, Shah SJ, McKinlay S, Fleg JL, Sopko G, Pitt B, Pfeffer MA; TOPCAT Investigators. Influence of ejection fraction on outcomes and efficacy of spironolactone in patients with heart failure with preserved ejection fraction. Eur Heart J. 2016 Feb 1;37(5):455-62.
24. Lund LH, Claggett B, Liu J, Lam CS, Jhund PS, Rosano GM, Swedberg K, Yusuf S, Granger CB, Pfeffer MA, McMurray JJV, Solomon SD. Heart failure with mid-range ejection fraction in CHARM: characteristics, outcomes and effect of candesartan across the entire ejection fraction spectrum. Eur J Heart Fail. 2018 Aug;20(8):1230-1239.
25. Rickenbacher P, Kaufmann BA, Maeder MT, Bernheim A, Goetschalckx K, Pfister O, Pfisterer M, Brunner-La Rocca HP; TIME-CHF Investigators. Heart failure with mid-range ejection fraction: a distinct clinical entity? Insights from the Trial of Intensified versus Standard Medical Therapy in Elderly Congestive Heart Failure (TIME-CHF). Eur J Heart Fail. 2017 Dec; 19 (12): 1586-1596.
26. Rickenbacher P. Heart failure with “midrange” ejection fraction: a new clinical entity? Ther Umsch. 2018 Sep; 75 (3): 170-173.








 Das Prinzip der Inhibition von PCSK9 wurde von der Industrie aufgenommen und innerhalb von 10 Jahren konnten 2 Medikamente auf der Basis von monoklonalen Antikörpern gegen PCSK9 entwickelt werden (Alirocumab von Sanofi-Aventis und Evolocumab von Amgen). Prof. Mach erinnerte an die im letzten Jahr veröffentlichte FOURIER-Studie mit Evolocumab, eine Studie mit mehr als 27 000 Patienten, die randomisiert mit der höchsten verträglichen Statindosis mit oder ohne Zusatz von Evolocumab behandelt wurden. Nach 36 Monaten Behandlungsdauer wurde der primäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall, Hospitalisierung wegen instabiler Angina oder koronare Revaskularisierung) in der Evolocumabgruppe um relative 15% gesenkt (absolute Risikosenkung 2%). Der sekundäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) wurde um 20% gesenkt. 1400 Patienten erreichten LDL-Werte unterhalb 0.4mmol/l. Diese Patienten hatten sogar eine grössere Risikosenkung (LDL-C ≥ 2.6 mmol / l: HR 0.69, LDL <0.26 mmol / l: HR 0.59). Die Sicherheit unterschied sich unter den 2 Patientengruppen nicht. Der Referent zeigte zusätzlich Daten zur kognitiven Funktion mit Statinen und mit Evolocumab. In beiden Fällen zeigte sich kein Unterschied zur Placebogruppe. Prof. Mach erinnerte auch an die SPIRE-Studie mit Bococizumab, einem humanisierten, nicht vollhumanen Antikörper. In SPIRE 1 mit LDL-C-Ausgangswerten > 70 mg / dl wurde kein Unterschied im primären Endpunkt beobachtet, in PIRE-2 bei Ausgangswerten > 100mg / dl eine 21%- ige Reduktion. Die Behandlung mit Bococizumab ging aber mit dem Auftreten von Anti-Medikamenten-Antikörpern einher, die zu einer Einschränkung der LDL-Senkung führten.
Das Prinzip der Inhibition von PCSK9 wurde von der Industrie aufgenommen und innerhalb von 10 Jahren konnten 2 Medikamente auf der Basis von monoklonalen Antikörpern gegen PCSK9 entwickelt werden (Alirocumab von Sanofi-Aventis und Evolocumab von Amgen). Prof. Mach erinnerte an die im letzten Jahr veröffentlichte FOURIER-Studie mit Evolocumab, eine Studie mit mehr als 27 000 Patienten, die randomisiert mit der höchsten verträglichen Statindosis mit oder ohne Zusatz von Evolocumab behandelt wurden. Nach 36 Monaten Behandlungsdauer wurde der primäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall, Hospitalisierung wegen instabiler Angina oder koronare Revaskularisierung) in der Evolocumabgruppe um relative 15% gesenkt (absolute Risikosenkung 2%). Der sekundäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) wurde um 20% gesenkt. 1400 Patienten erreichten LDL-Werte unterhalb 0.4mmol/l. Diese Patienten hatten sogar eine grössere Risikosenkung (LDL-C ≥ 2.6 mmol / l: HR 0.69, LDL <0.26 mmol / l: HR 0.59). Die Sicherheit unterschied sich unter den 2 Patientengruppen nicht. Der Referent zeigte zusätzlich Daten zur kognitiven Funktion mit Statinen und mit Evolocumab. In beiden Fällen zeigte sich kein Unterschied zur Placebogruppe. Prof. Mach erinnerte auch an die SPIRE-Studie mit Bococizumab, einem humanisierten, nicht vollhumanen Antikörper. In SPIRE 1 mit LDL-C-Ausgangswerten > 70 mg / dl wurde kein Unterschied im primären Endpunkt beobachtet, in PIRE-2 bei Ausgangswerten > 100mg / dl eine 21%- ige Reduktion. Die Behandlung mit Bococizumab ging aber mit dem Auftreten von Anti-Medikamenten-Antikörpern einher, die zu einer Einschränkung der LDL-Senkung führten. Die Ablehnung erfolgte beispielsweise weil die Dosierung von Atorvastatin nur 40 mg statt der Maximaldosis von 80 mg (schlecht ertragen wegen Muskelproblemen) entsprach oder weil das LDL-Cholesterin 3.44 mmol / l statt der geforderten 3.5 mmol / l betrug.
Die Ablehnung erfolgte beispielsweise weil die Dosierung von Atorvastatin nur 40 mg statt der Maximaldosis von 80 mg (schlecht ertragen wegen Muskelproblemen) entsprach oder weil das LDL-Cholesterin 3.44 mmol / l statt der geforderten 3.5 mmol / l betrug. Die RNAs, die man auch als Therapie entwickelt hat, sind die sogenannten SiRNAs, interference RNAs, die mit sehr kleinen Mengen ein Protein praktisch ausschalten können, so der Referent. Um diese RNAs in den Körper zu bringen muss man sie so verändern, dass sie nicht gleich von den RNAs abgebaut werden können. Man muss zudem das RNA Molekül derart verändern, dass keine Immunreaktion stattfindet. Ferner muss die RNA in die Zelle kommen. Der entsprechende Mechanismus erfolgt über Rezeptoren die präferentiell ein Protein, das sich GalNac nennt erkennen. Entsprechend wurde GalNac an die RNA gekoppelt. Dadurch wird das Konjugat RNA-GalNac spezifisch anerkannt und in die Leberzelle aufgenommen. Der Referent wandte sich nun dem ORION-Programm zu, einem Programm, das zum Ziel die Blockierung der PCSK9-Synthese hat, das bislang am weitesten in der Medizin fortgeschritten ist. Das entsprechende Molekül umfasst ein 23 Basenpaare langes Stück, welches ein kleines GalNac Molekül vorne dran hat, welches die Aufnahme in die Leberzelle ermöglicht. Dieses RNA-Molekül bindet dann in der Zelle an einen sogenannten RISC Komplex (RNA –induced silencing complex), der die mRNA degradiert, sodass das PCSK9 Protein nicht mehr entstehen kann. Das kleine modifizierte RNA-GalNac Molekül bleibt immer aktiv, was die lange Wirkungsdauer dieser Therapie erklärt und sie entsprechend attraktiv macht. Prof. Landmesser zeigte erste Phase-I-Studien mit dem PCSK9-siRNA Inclisiran. Mit einer Injektion von Inclisiran konnte der LDL-Spiegel am 180. Tag um 35.5–52.6 % gesenkt werden. In einer Phase-II-Studie wurde die Wirkung von 2 Startdosen von Inclisiran 300 mg untersucht. Dabei zeigte sich nach 270 Tagen eine LDL-Senkung von 40%, die mittlere Senkung über 6 Monate betrug 51%. Inclisiran wird nun im ORION Programm in insgesamt 12 Studien an verschiedenen Populationen weiter untersucht.
Die RNAs, die man auch als Therapie entwickelt hat, sind die sogenannten SiRNAs, interference RNAs, die mit sehr kleinen Mengen ein Protein praktisch ausschalten können, so der Referent. Um diese RNAs in den Körper zu bringen muss man sie so verändern, dass sie nicht gleich von den RNAs abgebaut werden können. Man muss zudem das RNA Molekül derart verändern, dass keine Immunreaktion stattfindet. Ferner muss die RNA in die Zelle kommen. Der entsprechende Mechanismus erfolgt über Rezeptoren die präferentiell ein Protein, das sich GalNac nennt erkennen. Entsprechend wurde GalNac an die RNA gekoppelt. Dadurch wird das Konjugat RNA-GalNac spezifisch anerkannt und in die Leberzelle aufgenommen. Der Referent wandte sich nun dem ORION-Programm zu, einem Programm, das zum Ziel die Blockierung der PCSK9-Synthese hat, das bislang am weitesten in der Medizin fortgeschritten ist. Das entsprechende Molekül umfasst ein 23 Basenpaare langes Stück, welches ein kleines GalNac Molekül vorne dran hat, welches die Aufnahme in die Leberzelle ermöglicht. Dieses RNA-Molekül bindet dann in der Zelle an einen sogenannten RISC Komplex (RNA –induced silencing complex), der die mRNA degradiert, sodass das PCSK9 Protein nicht mehr entstehen kann. Das kleine modifizierte RNA-GalNac Molekül bleibt immer aktiv, was die lange Wirkungsdauer dieser Therapie erklärt und sie entsprechend attraktiv macht. Prof. Landmesser zeigte erste Phase-I-Studien mit dem PCSK9-siRNA Inclisiran. Mit einer Injektion von Inclisiran konnte der LDL-Spiegel am 180. Tag um 35.5–52.6 % gesenkt werden. In einer Phase-II-Studie wurde die Wirkung von 2 Startdosen von Inclisiran 300 mg untersucht. Dabei zeigte sich nach 270 Tagen eine LDL-Senkung von 40%, die mittlere Senkung über 6 Monate betrug 51%. Inclisiran wird nun im ORION Programm in insgesamt 12 Studien an verschiedenen Populationen weiter untersucht. Heute erfolgt die Standardtherapie der Antikoagulation mit NOAKs. Dies aufgrund der Megatrials mit Rivaroxaban, Dabigatran und Apixaban. Dabei sind 3 Punkte für den Referenten wichtig: einmal haben wir eine bessere Wirkung. Sie ist nicht massiv aber relevant besser. Wir haben aber vor allem eine deutlich bessere Sicherheit. Das dritte geht in Richtung Gesamtbenefit: Wir haben auch eine Reduktion der Gesamtmortalität. Frühe Erfahrungen mit Stents haben gezeigt, dass Aspirin zur Prävention der Stentthrombosen nicht genügt. Die zusätzliche Antikoagulation zeigte, dass damit auch im arteriellen Bereich eine positive Wirkung erzielt wird. In den 90iger Jahren kam das Konzept der dualen Plättchenhemmung mit Aspirin und Ticlopidin. Ticlopidin wurde etwas später durch Clopidogrel ersetzt. Clopidogrel ergab eine deutliche Reduktion der kardiovaskulären Ereignisse gegenüber Aspirin allein. Danach kamen die besseren Plättchenhemmer, beginnend mit Prasugrel und fast gleichzeitig Ticagrelor, welche gegenüber Aspirin deutlich weniger kardiovaskuläre Ereignisse zeigten. Prasugrel hatte gewisse Blutungskomplikationen, weshalb es heute nicht mehr so häufig eingesetzt wird. Die zusätzliche Gabe von NOAKs beim akuten Koronarsyndrom ergab aber in der APPRAISE-Studie mit Apixaban, welches zusätzlich zu Clopidogrel und Aspirin gegeben (oder nicht gegeben) wurde, keinen Unterschied bezüglich Wirksamkeit, aber massiv mehr Blutungen. Die Studie wurde vorzeitig abgebrochen. Der zweite Versuch wurde mit Rivaroxaban in tiefer Dosierung (5 mg) oder sehr tiefer Dosierung (2.5 mg), allerdings 2 x täglich in der ATLAS ACS 2 - TIMI 51-Studie unternommen. Die Rivaroxaban-Gruppe hatte ein tieferes kardiovaskuläres Risiko, vergleichbar mit den früheren Daten der Plättchenhemmer. Die Antikoagulation «später» nach Infarkt ergab ein signifikant längeres ereignisloses Überleben unter Warfarin plus Aspirin vs. Warfarin allein, wobei Warfarin allein besser war als Aspirin allein. Es gab massiv mehr Blutungen, aber der INR Zielwert lag zwischen 2.8 und 4.2 und man weiss, dass Blutungen ab INR 3. 4 exponentiell zunehmen. Die Studie hat aber gezeigt, dass grundsätzlich auch im arteriellen System die Prävention mit Antikoagulation funktioniert. Dies führte zur Anwendung von Rixaroxaban 2. 5 mg bid + Aspirin 100 mg od vs. Rivaroxaban 5 mg bid vs. Aspirin 100 mg od in der COMPASS Studie bei stabiler KHK bzw. PAVK. Die Studie wurde wegen der überlegenen Wirksamkeit von Rivaroxaban + Aspirin gegenüber den beiden anderen Armen vorzeitig abgebrochen. Der Effekt war dabei vor allem auf Schlaganfall. Es wurden in dieser Studie etwas mehr Blutungen in der Kombinationsgruppe aber auch in der Warfaringruppe gegenüber Aspirin beobachtet. Der Ort der Blutungen war vor allem gastrointestinal. Der netto klinische Benefit dieser Kombinationstherapie bei stabiler KHK ist indessen eine relative Risikoreduktion des Komposit-Endpunkts kardiovaskulärer Tod, Schlaganfall, tödliche Blutung oder symptomatische Blutungen in kritische Organe beträgt 20% (p < 0.001). Das Risiko für Gesamtmortalität wurde um 18% gesenkt (p 0.01). Die Autoren hatten aber eine präspezifizierte Signifikanz von 0.025 gefordert.
Heute erfolgt die Standardtherapie der Antikoagulation mit NOAKs. Dies aufgrund der Megatrials mit Rivaroxaban, Dabigatran und Apixaban. Dabei sind 3 Punkte für den Referenten wichtig: einmal haben wir eine bessere Wirkung. Sie ist nicht massiv aber relevant besser. Wir haben aber vor allem eine deutlich bessere Sicherheit. Das dritte geht in Richtung Gesamtbenefit: Wir haben auch eine Reduktion der Gesamtmortalität. Frühe Erfahrungen mit Stents haben gezeigt, dass Aspirin zur Prävention der Stentthrombosen nicht genügt. Die zusätzliche Antikoagulation zeigte, dass damit auch im arteriellen Bereich eine positive Wirkung erzielt wird. In den 90iger Jahren kam das Konzept der dualen Plättchenhemmung mit Aspirin und Ticlopidin. Ticlopidin wurde etwas später durch Clopidogrel ersetzt. Clopidogrel ergab eine deutliche Reduktion der kardiovaskulären Ereignisse gegenüber Aspirin allein. Danach kamen die besseren Plättchenhemmer, beginnend mit Prasugrel und fast gleichzeitig Ticagrelor, welche gegenüber Aspirin deutlich weniger kardiovaskuläre Ereignisse zeigten. Prasugrel hatte gewisse Blutungskomplikationen, weshalb es heute nicht mehr so häufig eingesetzt wird. Die zusätzliche Gabe von NOAKs beim akuten Koronarsyndrom ergab aber in der APPRAISE-Studie mit Apixaban, welches zusätzlich zu Clopidogrel und Aspirin gegeben (oder nicht gegeben) wurde, keinen Unterschied bezüglich Wirksamkeit, aber massiv mehr Blutungen. Die Studie wurde vorzeitig abgebrochen. Der zweite Versuch wurde mit Rivaroxaban in tiefer Dosierung (5 mg) oder sehr tiefer Dosierung (2.5 mg), allerdings 2 x täglich in der ATLAS ACS 2 - TIMI 51-Studie unternommen. Die Rivaroxaban-Gruppe hatte ein tieferes kardiovaskuläres Risiko, vergleichbar mit den früheren Daten der Plättchenhemmer. Die Antikoagulation «später» nach Infarkt ergab ein signifikant längeres ereignisloses Überleben unter Warfarin plus Aspirin vs. Warfarin allein, wobei Warfarin allein besser war als Aspirin allein. Es gab massiv mehr Blutungen, aber der INR Zielwert lag zwischen 2.8 und 4.2 und man weiss, dass Blutungen ab INR 3. 4 exponentiell zunehmen. Die Studie hat aber gezeigt, dass grundsätzlich auch im arteriellen System die Prävention mit Antikoagulation funktioniert. Dies führte zur Anwendung von Rixaroxaban 2. 5 mg bid + Aspirin 100 mg od vs. Rivaroxaban 5 mg bid vs. Aspirin 100 mg od in der COMPASS Studie bei stabiler KHK bzw. PAVK. Die Studie wurde wegen der überlegenen Wirksamkeit von Rivaroxaban + Aspirin gegenüber den beiden anderen Armen vorzeitig abgebrochen. Der Effekt war dabei vor allem auf Schlaganfall. Es wurden in dieser Studie etwas mehr Blutungen in der Kombinationsgruppe aber auch in der Warfaringruppe gegenüber Aspirin beobachtet. Der Ort der Blutungen war vor allem gastrointestinal. Der netto klinische Benefit dieser Kombinationstherapie bei stabiler KHK ist indessen eine relative Risikoreduktion des Komposit-Endpunkts kardiovaskulärer Tod, Schlaganfall, tödliche Blutung oder symptomatische Blutungen in kritische Organe beträgt 20% (p < 0.001). Das Risiko für Gesamtmortalität wurde um 18% gesenkt (p 0.01). Die Autoren hatten aber eine präspezifizierte Signifikanz von 0.025 gefordert. Dies führt zu 2 Mechanismen, einerseits zu einer Fibrinaktivierung also eine Aktivierung des Thrombinmechanismus und andrerseits der Aktivierung der Plättchen und diese beiden Mechanismen verstärken sich gegenseitig und führen dann zur Bildung des Thrombus, hielt Prof. Dr. med. Stephan Windecker, Bern, fest. Die Hemmung der Blutplättchenaggregation kann klassischerweise durch Aspirin geschehen, welches zu einer milden Aggregation führt oder durch die neueren P2Y12 Inhibitoren Clopidogrel, Prasugrel und Ticagrelor. Zwischen diesen Medikamenten bestehen wichtige Unterschiede im Wirkmechanismus. Clopidogrel braucht typischerweise 4-6 Stunden bis es seine volle therapeutische Wirkung entfaltet, während Prasugrel und Ticagrelor wesentlich schneller anfluten. Ein weiterer wichtiger Unterschied ist die Irreversibilität bei Prasugrel und Clopidogrel, während Ticagrelor reversibel ist. Die Geschichte der dualen Plättchenhemmung (DAPT) umfasst mittlerweile 2 Jahrzehnte, ihr Einsatz ist in Leitlinien festgelegt. In verschiedenen kleineren Studien hat sich gezeigt, dass diese Medikamente in der Risikosenkung für einen Mykoardinfarkt gegenüber dem damaligen Stand der dualen Antikoagulation und gegenüber der Monotherapie mit Aspirin effizienter sind.
Dies führt zu 2 Mechanismen, einerseits zu einer Fibrinaktivierung also eine Aktivierung des Thrombinmechanismus und andrerseits der Aktivierung der Plättchen und diese beiden Mechanismen verstärken sich gegenseitig und führen dann zur Bildung des Thrombus, hielt Prof. Dr. med. Stephan Windecker, Bern, fest. Die Hemmung der Blutplättchenaggregation kann klassischerweise durch Aspirin geschehen, welches zu einer milden Aggregation führt oder durch die neueren P2Y12 Inhibitoren Clopidogrel, Prasugrel und Ticagrelor. Zwischen diesen Medikamenten bestehen wichtige Unterschiede im Wirkmechanismus. Clopidogrel braucht typischerweise 4-6 Stunden bis es seine volle therapeutische Wirkung entfaltet, während Prasugrel und Ticagrelor wesentlich schneller anfluten. Ein weiterer wichtiger Unterschied ist die Irreversibilität bei Prasugrel und Clopidogrel, während Ticagrelor reversibel ist. Die Geschichte der dualen Plättchenhemmung (DAPT) umfasst mittlerweile 2 Jahrzehnte, ihr Einsatz ist in Leitlinien festgelegt. In verschiedenen kleineren Studien hat sich gezeigt, dass diese Medikamente in der Risikosenkung für einen Mykoardinfarkt gegenüber dem damaligen Stand der dualen Antikoagulation und gegenüber der Monotherapie mit Aspirin effizienter sind.