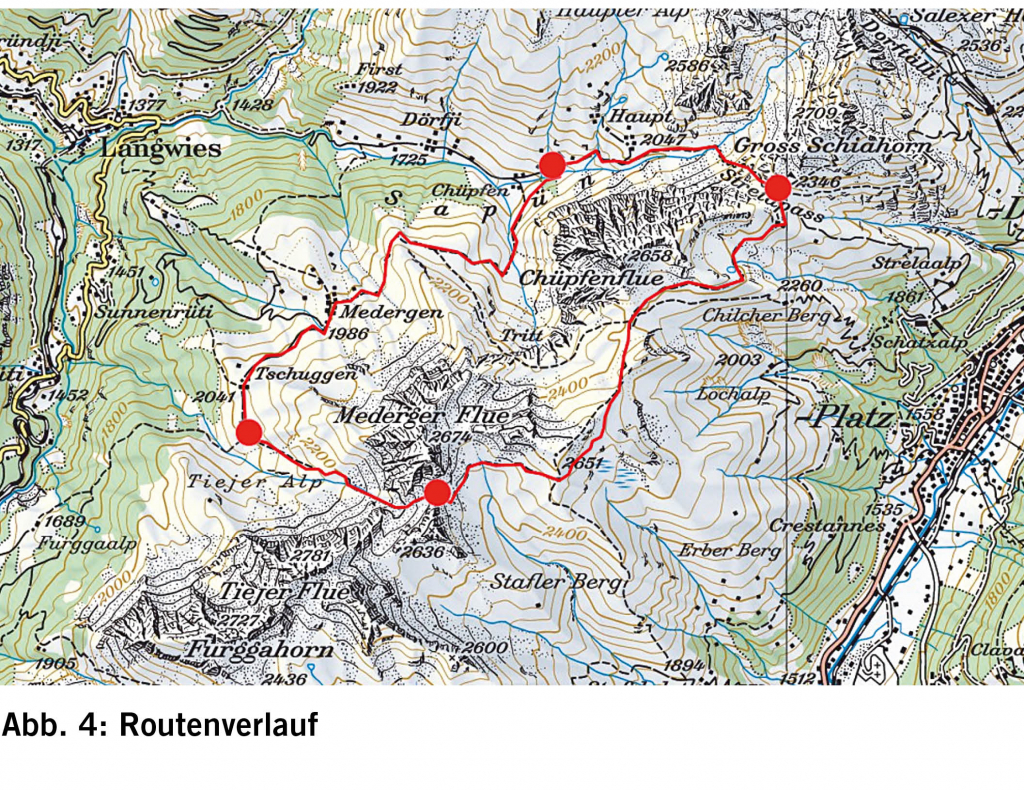
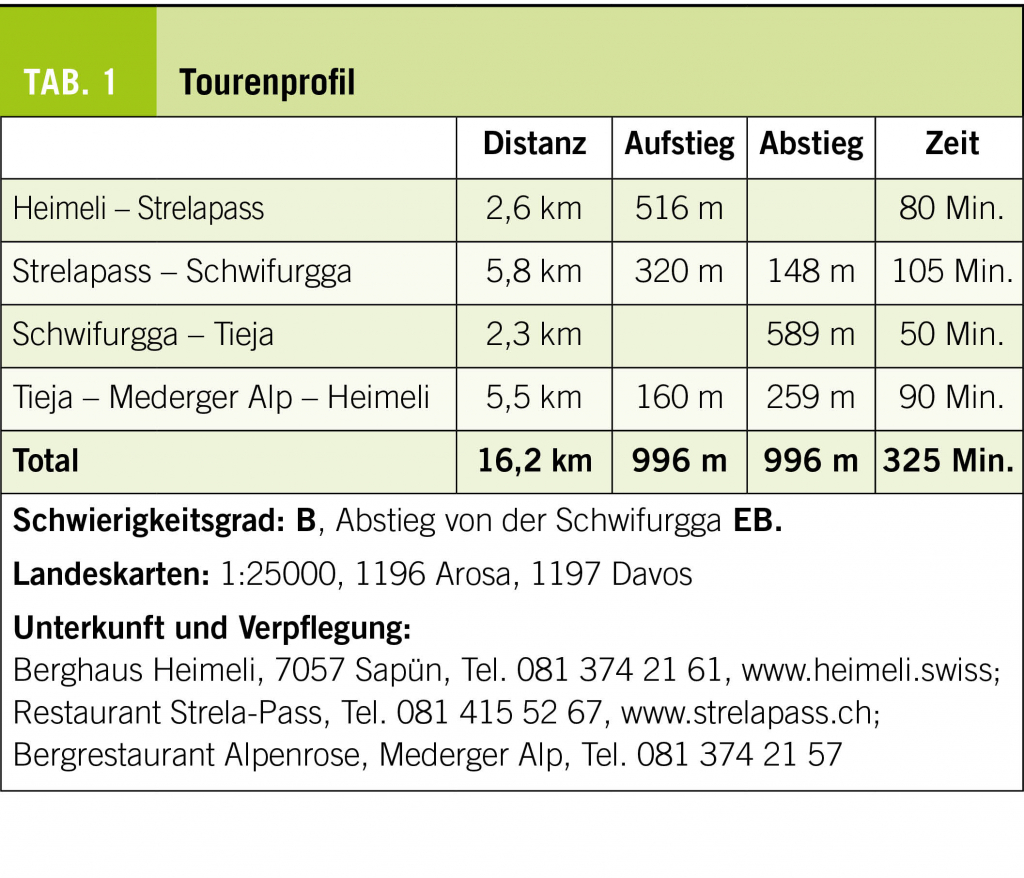
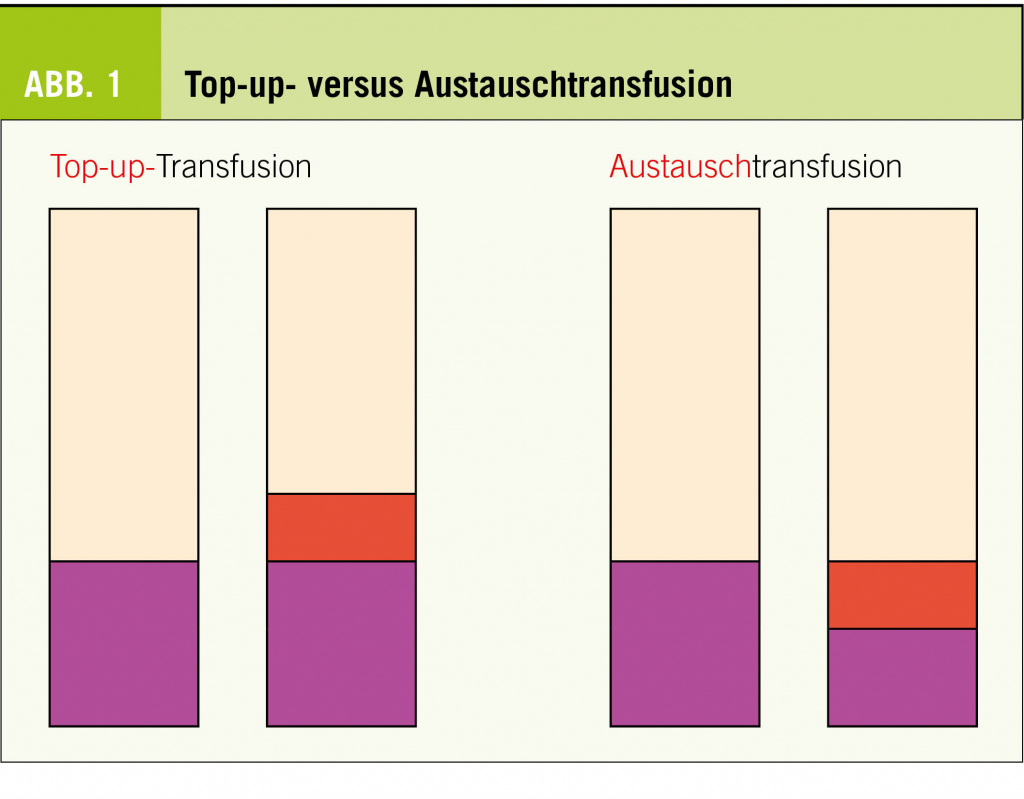
Eine stabile Kreatininerhöhung, die länger als 3 Monaten besteht, wird als chronische Niereninsuffizienz («chronic kidney disease, CKD») definiert. Die genaue Stadieneinteilung sowie Prognoseabschätzung erfolgt anhand der mittels Formel geschätzten glomerulären Filtrationsrate («estimated glomerular f iltration rate, eGFR») sowie der Albuminurie. In diesem zweiten Teil des Artikels werden spezifische Befunde und ihre Behandlungsmöglichkeiten sowie unter dem Aspekt, dass jede Nierenersatztherapie mit erhöhter Morbidität und Mortalität sowie enormen gesundheitsökonomischen Kosten verbunden ist, die Möglichkeiten der Nephroprotektion und der Progressionsverlangsamung diskutiert.
Metabolische Azidose
Gemäss den KDIGO Richtlinien ist eine metabolische Azidose bei CKD als ein Serum-Bikarbonat < 22 mmol/l definiert. Bereits eine milde metabolische Azidose ist mit Komplikationen wie z. B. vermehrtem Eiweiss-Abbau und Muskelverlust bis hin zu einer erhöhten Mortalität assoziiert. Interessanterweise gibt es in den letzten Jahren zunehmend Daten, dass eine metabolische Azidose die Progression einer chronischen Niereninsuffizienz verstärken kann. Wiederum konnte in mehreren klinischen Studien gezeigt werden, dass eine Alkalitherapie bei CKD Patienten zu einem geringeren Abfall der GFR führt (11–13). Allerdings benötigt es weiterhin multizentrische randomisierte Interventionsstudien, die noch offene Fragen wie z.B. die Bestimmung des optimalen Bikarbonat-Zielwerts oder den optimalen Zeitpunkt für den Beginn der Therapie in Zukunft klären werden. Bis zur Vorlage der fehlenden Daten gelten die bisherigen Therapieempfehlungen für CKD Patienten: Beginn der Alkalitherapie mit 0.5 mEq /kg KG / Tag bei einem Serum-Bikarbonat ≤ 22 mmol/l (1). Dies kann z. B. durch die orale Gabe von Natriumhydrogencarbonat (z. B. Nephrotrans®) erfolgen, was leider nicht auf der Spezialitätenliste aufgeführt ist und somit für die Vergütung durch die Krankenkasse eine Kostengutsprache benötigt.
Renale Anämie
Die Anämie bei CKD ist oft multifaktoriell bedingt, eine rein renale (d. h. durch Erythropoietinmangel bedingte) Anämie stellt eine Ausschlussdiagnose dar. Auch im Kontext der CKD ist die Anämie definiert als eine Hämoglobin Konzentration von < 130 g/l bei Männern und < 120 g/l bei Frauen. Bei der Erstdiagnose einer Anämie bei Patienten mit CKD wird eine Anämieabklärung empfohlen. Nach Bestätigung der Diagnose einer renalen Anämie richten sich das Monitoring sowie die Therapie nach den Zielwerten. Gemäss der KDIGO Richtlinien wird für die Therapie der renalen Anämie die Gabe von Eisenpräparaten sowie Erythropoese-stimulierende Substanzen (ESA) empfohlen (1). Eine Therapie mit intravenöser Gabe von Eisen (oder oraler Eisengabe im Falle einer nicht-dialysepflichtigen CKD) wird bei einem Ferritin von ≤ 500 μg/l und einer Transferrinsättigung von ≤ 30% empfohlen. Die Gabe von ESA sollte bei einem Hämoglobin < 100 g/l begonnen werden. Mehrere Studien konnten zeigen, dass eine Normalisierung des Hämoglobinwerts bei CKD Patienten mit einem erhöhten Risiko für Schlaganfall, Hypertonie sowie Probleme mit dem Gefässzugang für die Dialyse einhergeht, weshalb ein Anstieg des Hämoglobins auf einen Wert > 130 g/l gemieden werden sollte. Des Weiteren wird die adjuvante Gabe von Androgenen, Vitamin C, Vitamin D, Folsäure, Vitamin E, L-Carnitin und Pentoxifyllin zur Behandlung einer renalen Anämie nicht empfohlen. Die Gabe von Erythrozyten-Konzentraten sollte ebenfalls – insbesondere bei Patienten, die für eine Transplantation vorgesehen sind – möglichst gemieden werden (Gefahr der Immunisierung mit Bildung von Antikörpern).
Renal bedingte Knochenstoffwechselerkrankung
In den letzten Jahren konnte mit der Entdeckung neuer Parameter wie z. B. Fibroblast growth factor-23 (FGF-23) sowie neuen Studiendaten die Pathophysiologie der renal bedingten Knochenstoffwechselkrankheit besser verstanden werden, was wiederum dazu geführt hat, dass die internationalen Richtlinien aus dem Jahre 2009 kürzlich (Juli 2017) überarbeitet wurden (14). Entsprechend wird die Bestimmung von Calcium, Phosphat, intaktem Parathormon, alkalischer Phosphatase und 25-OH-Vitamin D3 ab CKD Stadium G3 empfohlen. Im Stadium CKD G3a-b sollte dies 1–2 x jährlich und im Stadium CKD G4 2–3 x jährlich durchgeführt werden. Bei CKD Patienten im Stadium G5 sollten Calcium und Phosphat 1- bis 3-monatlich und Parathormon 3- bis 6-monatlich untersucht werden. Die Bestimmung der alkalischen Phosphatase wird bei CKD Stadium G4 und G5 1x jährlich empfohlen. Die 25-OH-Vitamin D3 Bestimmung soll ebenfalls bei CKD Stadium G3a bis G5 regelmässig durchgeführt werden. Das Ziel der Therapie ist die Normalisierung des Phosphatwerts im Serum ohne Veränderungen des Serumcalciums (Hypercalciämie vermeiden). Als erste therapeutische Massnahme wird eine diätetische Phosphatrestriktion empfohlen, die im Verlauf mit Phosphatbindern ergänzt werden kann. Die früher noch häufig eingesetzten Aluminium-haltigen Phosphatbinder werden aufgrund der Gefahr einer Aluminiumintoxikation heute nicht mehr eingesetzt. Zur Auswahl stehen heute sowohl Calcium-haltige als auch Nicht-Calcium-haltige Phosphatbinder. Da jedoch durch die Gabe von Calcium Gefässverkalkungen zunehmen können, sollen diese insbesondere bei längerer Therapie- dauer bei Dialysepatienten nur limitiert eingesetzt werden. Bezüglich der Zielwerte für intaktes Parathormon im Stadium CKD G3 bis G5 gibt es zurzeit keine Empfehlungen. Bei Dialysepatienten sollte das Parathormon im Bereich des 2- bis 9-fachen des oberen Grenzwerts liegen. Falls die Indikation für eine PTH-senkende Therapie besteht, kommen Calcitriol (aktives Vitamin D3) oder Vitamin D Analoga zum Einsatz. Calcimimetika werden bisher nur bei dialysepflichtigen Patienten empfohlen. Bei Versagen der medikamentösen Therapie kann eine Parathyreoidektomie durchgeführt werden. Des Weiteren gibt es Hinweise, dass die Senkung von FGF-23 für CKD Patienten von Vorteil wäre. Somit werden mit Spannung zurzeit Studienergebnisse erwartet, die speziell den Effekt von Calcitriol und Calcimimetika auf FGF-23 untersuchen, da beide Medikamente einen unterschiedlichen Einfluss auf FGF-23 aufweisen (14).
Lipidprofil
Bei allen CKD Patienten wird eine Untersuchung des Lipidstatus empfohlen (15). Eine lipidsenkende Therapie ist gemäss den KDIGO Richtlinien bei allen ≥ 50-Jährigen CKD Patienten im Stadium G1 bis G5, die nicht dialysepflichtig sind, indiziert. Bei Dialysepatienten wiederum soll eine Therapie nicht begonnen werden, kann jedoch − falls vorbestehend − auch nach Dialysebeginn fortgeführt werden. Bei 18- bis 49-jährigen CKD Patienten (nicht-dialysepflichtig) wird ebenfalls bei Vorhandensein von folgenden Risikofaktoren eine lipidsenkende Therapie empfohlen:
1. Koronare Herzkrankheit
2. Diabetes mellitus
3. Schlaganfall
4. Geschätztes 10-Jahres-Risiko für kardiovaskulärem Tod oder Myokardinfarkt von > 10%
Bei Vorliegen einer Hypertriglyceridämie werden bei CKD Patienten (inkl. Dialysepatienten) Lebensstil-verändernde Massnahmen empfohlen (15).
Nephroprotektion und Progressionsverlangsamung
Der natürliche Verlauf einer chronischen Nierenerkrankung beinhaltet das langsame Fortschreiten mit einem kontinuierlichen GFR-Verlust über die Jahre, welches unabhängig von der zugrundeliegenden Nierenerkrankung ist. Daher ist eine optimale Einstellung der Progressionsfaktoren wie z. B. der Hypertonie oder Proteinurie für die Progressionsverlangsamung von grösster Bedeutung und bilden somit die Basis der nephroprotektiven Therapie (1). Weitere wichtige Progressionsfaktoren sind Alter, Geschlecht, ethnische Herkunft, Hyperglykämie, Dyslipidämie, Nikotinabusus, Adipositas, kardiovaskuläre Erkrankungen, chronische Einnahme von nephrotoxischen Medikamenten und weitere.
Blutdruckeinstellung
Die am besten untersuchte und somit wichtigste Massnahme zur Progressionsverlangsamung einer chronischen Niereninsuffizienz ist die Blutdruckeinstellung. Dabei ist der Nutzen unabhängig von der Wahl des antihypertensiven Medikaments (16). Allerdings können bestimmte Medikamente sowohl den Blutdruck senken als auch die Proteinurie signifikant reduzieren (durch Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)), weshalb diese – falls möglich – als das Medikament erster Wahl gegeben werden sollen. Durch die RAAS-Blockade wird der intraglomeruläre Druck gesenkt, was in der Folge zur Reduktion der GFR aber auch der Proteinurie führt.
Es sollte jedoch nicht unerwähnt bleiben, dass auch Anpassungen des Lebensstils (Gewichtsreduktion, geringe Salzzufuhr, regelmässige körperliche Aktivität etc.) auch bei CKD Patienten sich günstig auf den Blutdruck auswirken können.
Der optimale Ziel-Blutdruck sollte dabei individuell anhand von Alter, Begleiterkrankungen, Progressionsrisiko, Vorhandensein einer diabetischen Retinopathie sowie Therapietoleranz festgelegt werden. Beispielsweise sollte gerade bei älteren CKD Patienten auf orthostatische Nebenwirkungen der antihypertensiven Behandlung geachtet werden. Bei CKD Patienten mit einer Albuminurie von < 30 mg/Tag und einem Office-Blutdruck von > 140 mm Hg systolisch oder > 90 mm Hg diastolisch wird ein Ziel-Blutdruck von < 140/90 mm Hg empfohlen. Im Falle einer Albuminurie von > 30 mg/Tag sowie einem Office-Blutdruck von > 130 mm Hg systolisch oder > 80 mm Hg diastolisch sollte der Ziel-Blutdruck < 130/80 mm Hg betragen. Bei Diabetikern mit CKD sowie einer Albuminurie von 30–300 mg / Tag wird der Einsatz von ACE (Angiotensin-Converting-Enzym)-Hemmern bzw. ARB (Angiotensin-Rezeptor-Blocker) empfohlen. Des Weiteren sollten ACE-Hemmer sowie ARB bei allen CKD Patienten mit einer Albuminurie von > 300 mg / Tag eingesetzt werden. Nach Therapiebeginn mit einem ACE-Hemmer oder ARB kann das Kreatinin stabil bleiben, leicht ansteigen (< 30%) oder um mehr als 30% ansteigen (17). Daher sollte das Kreatinin nach 1 bis 2 Wochen kontrolliert werden. Falls es zu einem Kreatininanstieg von > 30% kommen sollte und keine sonstigen nephrotoxischen Medikamente eingenommen werden, sollte ein Wechsel des Antihypertensivums (z. B. auf einen Calciumantagonisten) vorgenommen werden. Des Weiteren kann eine zusätzliche Gabe von Diuretika, NSAR sowie ein Volumenmangel den Effekt einer RAAS-Blockade verstärken und somit bei CKD-Patienten zum raschen Abfall der GFR führen. Von einer kombinierten ACE-Hemmer und ARB Therapie wird aufgrund von fehlender Evidenz eher abgeraten (16). Die Diskussion um optimale Zielwerte ist allerdings noch nicht abgeschlossen und auch die viel zitierte SPRINT-Studie (19) konnte diese Frage bisher nicht abschliessend beantworten.
Vermeidung nephrotoxischer Medikamente
Die Gabe von Medikamenten bei CKD Patienten sollte sehr sorgfältig erfolgen, um die Nieren nicht weiter zu schädigen. Hierbei gibt es verschiedene Medikamentengruppen wie z. B. Aminoglykoside, nicht-steroidale Antirheumatika (NSAR), Virustatika, Antimykotika (Imidazole, Amphotericin B) und andere wie phosphathaltige Abführmittel die bei CKD Patienten möglichst gemieden werden sollten bzw. mit grosser Vorsicht eingesetzt werden sollten. Für viele Jahre galten auch die jodhaltigen intravenös applizierten Kontrastmittel als potentiell nephrotoxisch. Allerdings gab es in den letzten Jahren mehrere Studien, die einen kausalen Zusammenhang vermehrt in Frage stellen (18). Gemäss den Richtlinien ist jedoch weiterhin beim Einsatz dieser Kontrastmittel bei einer eGFR < 60 ml/min auf folgende Punkte zu achten (1):
1. Keine hoch-osmolare Kontrastmittel verwenden
2. Die geringste Menge Kontrastmittel benutzen
3. Vor und nach der Prozedur keine anderen nephrotoxischen Substanzen einsetzen
4. Empfehlung zur Hydrierung mit NaCl-Lösung vor, während und nach der Untersuchung
5. eGFR-Kontrolle 48–96 Stunden nach dem Einsatz von Kontrastmittel
Auch der Einsatz von Gadolinium-haltigem Kontrastmittel (MRI-Untersuchung) muss bei Patienten mit CKD mit Vorsicht erfolgen. Bei Patienten mit einer eGFR von < 15 ml/min sollten diese Kontrastmittel aufgrund der Gefahr einer nephrogenen systemischen Fibrose nicht eingesetzt werden. Falls bei Patienten mit einer eGFR < 30 ml/min die Gabe von Gadolinium-haltigen Kontrastmittel indiziert ist sollten möglichst makrozyklische Präparationen ausgewählt werden (19). Ebenfalls zu erwähnen ist der potentiell nephrotoxische Effekt von Phosphat-haltigen oralen Präparationen für die Koloskopie-Vorbereitung. Bei CKD Patienten mit einer eGFR < 60 ml/min sollten diese aufgrund des hohen Risikos für eine Phosphat-Nephropathie nicht eingesetzt werden. Nicht zuletzt sollte bei allen CKD Patienten darauf geachtet werden, dass – falls indiziert – eine Dosisanpassung aller Medikamente an die Nierenfunktion erfolgt.
Danksagung: Ich danke Prof. Dr. R. P. Wüthrich für die kritische Durchsicht des Manuskripts und die wertvollen Kommentare.
Klinik für Nephrologie
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Praxis und Dialysezentrum Zürich-City AG
Stockerstrasse 50
8002 Zürich
Nilufar.Mohebbi@usz.ch
Die Autorin hat keine Interessenskonflikte in Zusammenhang mit diesem Beitrag.
Literatur:
1. Group KDIGOKCW. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International Suppl. 2013;3(1):150.
2. T W. Kreatin Supplementation und Nierenfunktion: Reines Kreatin ist nicht schädlich für die Nieren! Swiss medical forum. 2013;13(42):3.
3. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16(1):31-41. Epub 1976/01/01.
4. Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Annals of internal medicine. 1999;130(6):461-70. Epub 1999/03/13.
5. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. American journal of kidney diseases : the official journal of the National Kidney Foundation. 2002;39(2 Suppl 1):S1-266. Epub 2002/03/21.
6. Inker LA, Schmid CH, Tighiouart H, Eckfeldt JH, Feldman HI, Greene T, et al. Estimating glomerular filtration rate from serum creatinine and cystatin C. The New England journal of medicine. 2012;367(1):20-9. Epub 2012/07/06.
7. Coresh J, Turin TC, Matsushita K, Sang Y, Ballew SH, Appel LJ, et al. Decline in estimated glomerular filtration rate and subsequent risk of end-stage renal disease and mortality. Jama. 2014;311(24):2518-31. Epub 2014/06/04.
8. Gansevoort RT, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney international. 2011;80(1):93-104. Epub 2011/02/04.
9. Astor BC, Matsushita K, Gansevoort RT, van der Velde M, Woodward M, Levey AS, et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with mortality and end-stage renal disease. A collaborative meta-analysis of kidney disease population cohorts. Kidney international. 2011;79(12):1331-40. Epub 2011/02/04.
10. Wetzels JF, Kiemeney LA, Swinkels DW, Willems HL, den Heijer M. Age- and gender-specific reference values of estimated GFR in Caucasians: the Nijmegen Biomedical Study. Kidney international. 2007;72(5):632-7. Epub 2007/06/15.
11. de Brito-Ashurst I, Varagunam M, Raftery MJ, Yaqoob MM. Bicarbonate supplementation slows progression of CKD and improves nutritional status. Journal of the American Society of Nephrology : JASN. 2009;20(9):2075-84. Epub 2009/07/18.
12. Phisitkul S, Khanna A, Simoni J, Broglio K, Sheather S, Rajab MH, et al. Amelioration of metabolic acidosis in patients with low GFR reduced kidney endothelin production and kidney injury, and better preserved GFR. Kidney international. 2010;77(7):617-23. Epub 2010/01/15.
13. Mahajan A, Simoni J, Sheather SJ, Broglio KR, Rajab MH, Wesson DE. Daily oral sodium bicarbonate preserves glomerular filtration rate by slowing its decline in early hypertensive nephropathy. Kidney international. 2010;78(3):303-9. Epub 2010/05/07.
14. KDIGO 2017 CLINICAL PRACTICE GUIDELINE UPDATE FOR THE DIAGNOSIS, EVALUATION, PREVENTION, AND TREATMENT OF CHRONIC KIDNEY DISEASE–MINERAL AND BONE DISORDER (CKD-MBD). Kidney International Suppl. 2017;7(1):60.
15. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Kidney International Suppl. 2013;3(3):47.
16. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease Kidney International Suppl. 2012;2(5):77.
17. Wenzel UO. Angiotensin-converting enzyme inhibitors and progression of renal disease: evidence from clinical studies. Contributions to nephrology. 2001(135):200-11. Epub 2001/11/14.
18. Wilhelm-Leen E, Montez-Rath ME, Chertow G. Estimating the Risk of Radiocontrast-Associated Nephropathy. Journal of the American Society of Nephrology : JASN. 2017;28(2):653-9. Epub 2016/10/01.
19. Perazella MA. Current status of gadolinium toxicity in patients with kidney disease. Clinical journal of the American Society of Nephrology : CJASN. 2009;4(2):461-9. Epub 2009/02/10.