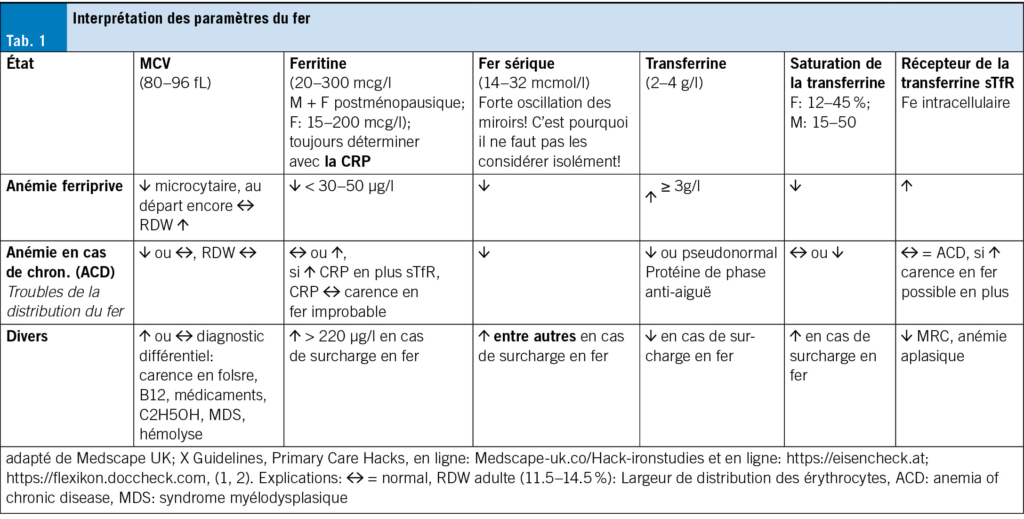
Die ESMO 2024 präsentierte bedeutende Fortschritte in der Nuklearmedizin mit einem Fokus auf innovative Ansätze zur Behandlung des Prostatakarzinoms. Besonders hervorgehoben wurde die Rolle von PSMA-gerichteten Radioligandentherapien (RLT) in Kombination mit Chemotherapie, die vielversprechende Ergebnisse in der Verbesserung der PSA-Kontrolle und Progressionsfreiheit zeigten. Die UpFrontPSMA- und SPLASH-Studien demonstrierten das Potenzial von Lutetium-177 PSMA-617 in verschiedenen klinischen Szenarien, während die PEACE-3-Studie die Kombination von Enzalutamid mit Radium-223 als vielversprechende Strategie für Patienten mit Knochenmetastasen evaluierte. Ergänzend untersuchte die RAPSON-Studie die Sequenzierung von Radium-223 und Docetaxel, um toxische Nebenwirkungen zu minimieren und die Lebensqualität zu verbessern. Die vorgestellten Ergebnisse unterstreichen die Bedeutung einer präzisen Patientenselektion, optimaler Dosierung und Sequenzierung, um Therapieeffekte zu maximieren. Diese Entwicklungen markieren einen weiteren Schritt hin zu personalisierten Behandlungsansätzen und bieten neue Perspektiven für die klinische Praxis und zukünftige Forschung.
ESMO 2024 presented significant advances in nuclear medicine with a focus on innovative approaches for the treatment of prostate cancer. The role of PSMA-targeted radioligand therapies (RLT) in combination with chemotherapy was particularly emphasized, showing promising results in improving PSA control and freedom from progression. The UpFrontPSMA and SPLASH trials demonstrated the potential of lutetium-177 PSMA-617 in different clinical scenarios, while the PEACE-3 trial evaluated the combination of enzalutamide with radium-223 as a promising strategy for patients with bone metastases. In addition, the RAPSON study investigated the sequencing of radium-223 and docetaxel to minimize toxic side effects and improve quality of life. The results presented underline the importance of precise patient selection, optimal dosing and sequencing to maximize treatment effects. These developments mark a further step towards personalized treatment approaches and offer new perspectives for clinical practice and future research.
Key words: Nuclear medicine, prostate cancer, radioligand therapies, PET/CT imaging
Einleitung
Die diesjährige Jahrestagung der European Society for Medical Oncology (ESMO) brachte eine Vielzahl neuer Daten und Erkenntnisse im Bereich der Onkologie, insbesondere beim Prostatakarzinom. Besonders im Fokus stand die Nuklearmedizin, die in den letzten Jahren durch gezielte Radioligandentherapien (RLT) und funktionelle Positronen Emission Tomographie (PET) basierte Bildgebungsverfahren bedeutende Fortschritte gemacht hat. Insbesondere die PSMA (Prostata-spezifisches Membranantigen) gerichtete Therapie gewinnt zunehmend an Bedeutun
g in der Behandlung dieser Tumore, vor allem bei Patienten mit fortgeschrittenem, metastasiertem Prostatakarzinom.
Auf der ESMO 2024 wurden mehrere interessante RLT-Studien präsentiert, die das Potenzial von PSMA-gerichteten Radioliganden-Therapien in Kombination mit anderen systemischen Ansätzen, wie der Chemotherapie, untersuchten. Diese Studien heben die wachsende Bedeutung der RLT in der Krebsbehandlung hervor, bei der Patienten gezielt anhand von Bildgebungsverfahren, wie der PSMA PET/CT, ausgewählt werden, um die bestmöglichen Therapieergebnisse zu erzielen.
Ein zentrales Thema war die Kombination von PSMA-gerichteten Therapien mit Chemotherapie. Die am EMSO 2024 vorgestellte UpFrontPSMA-Studie hat erste Ergebnisse zur Wirksamkeit von Lutetium-177 PSMA-617 in Kombination mit Docetaxel beim Hormon-Sensitiven Prostatakarzinom gezeigt. Diese Kombination könnte in Zukunft eine bedeutende Rolle bei der Behandlung von Patienten mit hohem Tumorvolumen und PSMA-positiven Metastasen spielen, wobei erste Ergebnisse auf eine verbesserte PSA-Kontrolle und längere Progressionsfreiheit hindeuten.
Zusätzlich zu den PSMA-basierten Therapien wurde auch die Rolle von Radium-223 bei der Behandlung von Knochenmetastasen erneut untersucht. Die PEACE-3-Studie präsentierte neue Daten zur Kombination von Enzalutamid und Radium-223, die das Potenzial dieser Kombinationstherapie bei der palliativen Behandlung von Patienten mit metastasiertem kastrationsresistentem Prostatakarzinom (mCRPC) verdeutlichen.
Insgesamt präsentierte die ESMO 2024 spannende neue Entwicklungen in der onkologischen Nuklearmedizin, die das Potenzial besitzen, die klinische Praxis bei der zukünftigen Behandlung von Prostatakarzinomen zu verändern.
UpFrontPSMA-Studie: PSMA und Chemotherapie in der Erstlinienbehandlung
Die UpFrontPSMA-Studie ist eine multizentrische, randomisierte Phase-II-Studie, die sich auf die Behandlung von Patienten mit metastasiertem, hormonsensitivem Prostatakrebs (mHSPC) konzentriert. Ziel der Studie war es, die Wirksamkeit einer Kombinationstherapie aus Lutetium-177 PSMA-617 und Chemotherapie (Docetaxel) im Vergleich zur alleinigen Chemotherapie zu untersuchen. Die Studie umfasste Patienten mit PSMA-positiven Tumoren, die mittels PSMA-PET/CT und FDG-PET/CT charakterisiert wurden. Patienten mit hoher PSMA-Aufnahme (SUVmax > 15) und hohem Tumorvolumen (einschliesslich viszeraler Metastasen und mindestens vier Knochenmetastasen) wurden in die Studie eingeschlossen. Patienten mit umfangreichen FDG-positiven, PSMA-negativen Läsionen wurden ausgeschlossen, um eine möglichst homogene Gruppe zu schaffen, die von der PSMA-Therapie profitieren könnte. Ein zentrales Ergebnis der UpFrontPSMA-Studie war die signifikante Verbesserung der PSA-Kontrolle bei den Patienten, die zwei Zyklen PSMA-617 gefolgt von sechs Zyklen Docetaxel erhielten, im Vergleich zur alleinigen Gabe von sechs Zyklen Docetaxel. Nach 48 Wochen zeigten diese Patienten eine deutlich höhere Rate an PSA-Kontrolle im Vergleich zur Gruppe, die nur mit Docetaxel behandelt wurde. Dies unterstreicht den potenziellen synergistischen Effekt der PSMA-Therapie in Kombination mit Chemotherapie bei ausgewählten Patienten mit mHSPC. Die Überlebensanalysen zeigten ebenfalls vielversprechende erste Ergebnisse. Die radiographische progressionsfreie Überlebenszeit (rPFS) war bei Patienten, die PSMA-617 in Kombination mit Docetaxel erhielten, in der ersten Interimsanalyse im Trend bereits deutlich besser, signifikant länger als in der reinen Chemotherapie-Gruppe (HR 0.58, CI 0.32 – 1.05, p = 0.067). Das Gesamtüberleben (OS) ist noch nicht vollständig ausgewertet, jedoch gibt es Hinweise, dass die hohe Crossover-Rate der Patienten die Analyse der Studie erschweren könnte. Ein weiterer wichtiger Aspekt der Studie war die Bewertung der Lebensqualität und der Nebenwirkungen, wobei sich Lebensqualität in beiden Gruppen trotz der Kombination nicht unterschied. Die Kombination von Lutetium-177 PSMA-617 und Docetaxel führte zu keiner signifikanten Zunahme schwerwiegender Toxizitäten, abgesehen von leichter Mundtrockenheit (Grad 1–2) in der PSMA Gruppe und die Lebensqualität der Patienten blieb in beiden Gruppen der Studie weitgehend stabil.
Die UpFrontPSMA-Studie hat gezeigt, dass die Kombination von PSMA-617 und Docetaxel bei sorgfältig ausgewählten Patienten mit mHSPC eine effektive und gut verträgliche Behandlungsoption darstellt. Die Kombinationstherapie zeigt eine bessere Kontrolle des PSA-Werts, und ein erstes Signal zeigt, dass die untersuchte Kombination das Fortschreiten der Krankheit verlangsamen könnte. Die Ergebnisse deuten darauf hin, dass PSMA-gerichtete Kombinationstherapien möglicherweise eine wichtige Ergänzung zur etablierten Chemotherapie darstellen, insbesondere bei Patienten mit hoher PSMA-Aufnahme und Tumorlast. Eine offene Frage bleibt jedoch, ob die zusätzlichen zwei Zyklen PSMA-617 eine echte synergistische Wirkung haben oder lediglich eine intensivere Therapie darstellen. Zukünftige Studien müssen klären, ob die Kombination von PSMA mit anderen Behandlungsmodalitäten, wie Immuntherapien (REF 1), möglicherweise noch bessere Ergebnisse liefert.
SPLASH-Studie: Untersuchung von Lutetium-177 PSMA I&T bei mCRPC-Patienten nach Progression Androgenrezeptor-gerichteten Therapie (ARPI)
Die SPLASH-Studie untersuchte Lutetium-177 PSMA I&T bei Patienten mit metastasiertem kastrationsresistentem Prostatakrebs (mCRPC), die nach einer Androgenrezeptor-gerichteten Therapie (ARPI) eine neue Behandlungsoption benötigten. Diese offene Phase-II-Studie hatte das Ziel, die Wirksamkeit und Sicherheit der PSMA-gerichteten Radioligandentherapie zu evaluieren und zu vergleichen. In die SPLASH-Studie wurden Patienten aufgenommen, die nach der Behandlung mit ARPI (wie Abirateron oder Enzalutamid) eine Progression zeigten und deren Tumore eine hohe PSMA-Expression aufwiesen. Die Studie wurde als randomisierte, offene Phase-II-Studie durchgeführt, wobei die Patienten entweder Lutetium-177 PSMA I&T erhielten oder in die Kontrollgruppe mit einer anderen ARPI (switch) eingeteilt wurden. Das Hauptziel der Studie war es, das progressionsfreie Überleben (PFS) zu untersuchen und zusätzliche Parameter wie die PSA-Ansprechrate sowie die allgemeine Lebensqualität der Patienten zu bewerten. Die SPLASH-Studie bestätigte die Wirksamkeit der PSMA-Therapie, jedoch schien die Effektivität im Vergleich zu früheren Studien, wie der PSMAfore-Studie, welche am ESMO 2023 vorgestellt wurde, weniger ausgeprägt zu sein (REF 2). Bei der Analyse des primären Endpunkts, dem bildgebend progressionsfreien Überleben (rPFS), zeigte sich eine Verlängerung der rPFS-Zeiten in der Lutetium-177 PSMA I&T-Gruppe im Vergleich zur Kontrollgruppe (9.5 Monate versus 6 Monate, HR 0.71, p = 0.0088). Die PSA-Ansprechrate war in der PSMA-Behandlungsgruppe ebenfalls höher, mit einer deutlichen Reduktion des PSA-Wertes um mehr als 50 % bei einem signifikanten Anteil der Patienten und einer Verlängerung der Zeit bis zum Wiederanstieg des PSA (7.0 versus 3.9 Monate, HR 0.58, p < 0.0001). Der Unterschied zwischen der PSMA-Therapie und den Kontrolltherapien war jedoch weniger ausgeprägt als in der PSMAfore Studie (12.0 Monate versus 5.6 Monate, HR 0.43, p<0.0001). Dies könnte teilweise auf die Wahl einer etwas geringeren Dosis (6,8 GBq in der SPLASH-Studie im Vergleich zu 7,4 GBq in der PSMAfore-Studie) und ein längeres Intervall (8 Wochen in der SPLASH-Studie im Vergleich zu 6 Wochen in der PSMAfore-Studie) zwischen den Zyklen zurückzuführen sein. Ein erheblicher Anteil der Patienten wechselte nach Progression in die PSMA-Behandlungsgruppe, was ebenfalls die Interpretation des Gesamtüberlebens (OS) erschwert. Statistische Anpassungsmethoden wie das rank-preserving structural failure time (RPSFT) Modell und die inverse probability of censoring weighted (IPCW) werden angewendet, um den Effekt des Crossovers zu korrigieren. Diese Analysen könnten helfen, den tatsächlichen Überlebensvorteil der PSMA-Therapie besser zu verstehen.
Die Behandlung mit Lutetium-177 PSMA I&T erwies sich insgesamt als gut verträglich. Die häufigsten Nebenwirkungen umfassten leichte gastrointestinale Symptome und hämatologische Toxizitäten. Schwere Nebenwirkungen traten nur bei einem geringen Anteil der Patienten auf, und es wurden keine neuen Sicherheitssignale im Vergleich zu früheren Studien beobachtet. Dies unterstreicht das günstige Nebenwirkungsprofil der PSMA-Therapie. Die SPLASH-Studie bestätigte die Wirksamkeit von Lutetium-177 PSMA I&T bei der Behandlung von Patienten mit metastasiertem kastrationsresistentem Prostatakrebs nach Progression unter einem ARPI. Obwohl die Ergebnisse im Vergleich zu früheren Studien weniger ausgeprägt erscheinen, bleibt die PSMA-Therapie eine vielversprechende Option für diese Patientenpopulation.
Zukünftige Studien sollten die optimale Dosis und das beste Behandlungsintervall der PSMA-Therapie untersuchen, da die Ergebnisse darauf hindeuten, dass diese Faktoren einen erheblichen Einfluss auf die Wirksamkeit haben könnten. Zudem sollte die Wahl des Kontrollarms in solchen Studien überdacht werden, um eine realistischere Vergleichsbasis für die Analyse der Überlebensvorteile zu schaffen.
PEACE-3-Studie: Enzalutamid und Radium-223 bei metastasiertem kastrationsresistentem
Prostatakrebs (mCRPC)
Die PEACE-3-Studie untersucht die Wirksamkeit und Sicherheit der Kombination von Enzalutamid und Radium-223 bei Patienten mit metastasiertem kastrationsresistentem Prostatakrebs (mCRPC) und fortgeschrittenen Knochenmetastasen. Ziel der Studie war es, herauszufinden, ob diese Kombinationstherapie im Vergleich zur alleinigen Gabe von Enzalutamid Vorteile bietet, insbesondere in Bezug auf das Überleben und die Lebensqualität der Patienten. Die PEACE-3-Studie ist eine randomisierte, offene Phase-III-Studie, in der Patienten mit mCRPC und Knochenmetastasen entweder Enzalutamid allein oder in Kombination mit Radium-223 erhielten. Die Patienten in der Radium-223-Gruppe erhielten zudem bone-protecting-agents wie Denosumab oder Bisphosphonate, um das Risiko von Frakturen zu minimieren, ein Problem, das in früheren Studien (z.B. ERA-223 (Ref 3)) aufgetreten war. Die Ergebnisse der PEACE-3-Studie zeigen, dass die Kombination von Enzalutamid und Radium-223 eine vielversprechende neue Behandlungsstrategie für Patienten mit Knochenmetastasen bei mCRPC darstellt. In Bezug auf das progressionsfreie Überleben (PFS 19.4 Monate versus 16.4 Monate, HR 0.69 (CI 0.54 – 0.87), p = 0.009) und das Gesamtüberleben (OS 42.3 Monate versus 35 Monate, HR 0.69, p = 0.0034) ergab sich ein deutlicher Vorteil für die Kombinationstherapie im Vergleich zu Enzalutamid allein. Auch die Zeit bis zur nächsten systemischen Therapie sowie die Zeit bis zum Fortschreiten der Knochenschmerzen wurden durch die Kombinationstherapie verlängert (50.9 Monate versus 29.9 Monate, HR 0.57, p < 0.001). Allerdings war der Effekt auf die Schmerzprogression in der Kombination geringer als erwartet. Trotz der Zugabe von Radium-223, das besonders bei der Linderung von knochenbedingten Schmerzen in der Palliation sehr effektiv ist, gab es keinen signifikanten Unterschied in der Zeit bis zur Schmerzentwicklung zwischen den beiden Gruppen. Dies deutet darauf hin, dass die Rolle von Radium-223 möglicherweise auch in der direkt zytotoxischen Aktivität als nur in der akuten Schmerzlinderung liegt. Ein zentrales Thema der PEACE-3-Studie war die Frakturrate, die in der vorherigen ERA-223-Studie, in der Radium-223 mit Abirateron kombiniert wurde, zu einem erheblichen Sicherheitsproblem und zuletzt zum Studienabbruch führte. In der PEACE-3-Studie konnte dieses Risiko jedoch durch die gleichzeitige Verabreichung von insbesondere Denosumab, deutlich verringert werden. Die Frakturrate in der Radium-223-Gruppe war vergleichbar mit der Enzalutamid-Monotherapie, was auf die Wirksamkeit, der dieser Strategien hinweist. Insgesamt zeigte die Kombinationstherapie kein erhöhtes Risiko für andere schwerwiegende Nebenwirkungen im Vergleich zur Enzalutamid-Monotherapie. Radium-223 wurde gut vertragen, und es traten keine neuen Sicherheitssignale auf.
Die Ergebnisse der PEACE-3-Studie legen nahe, dass die Kombination von Enzalutamid und Radium-223 eine vielversprechende Behandlungsoption für Patienten mit mCRPC und Knochenmetastasen darstellen könnte, insbesondere für jene, die von einer knochengezielten Therapie profitieren könnten. Der signifikante Vorteil in Bezug auf das radiografisch progressionsfreie Überleben zeigt das Potenzial dieser Kombination zur Verzögerung der Tumorprogression. Die Integration von knochenschützenden Mitteln war offensichtlich ein entscheidender Faktor, um die Frakturrate zu senken, was die Sicherheit der Therapie erheblich verbessert hat.
Zukünftige Studien könnten sich darauf konzentrieren, die Rolle von Radium-223 weiter zu untersuchen, insbesondere in Kombination mit anderen systemischen Therapien oder in verschiedenen Krankheitsstadien. Zudem bleibt die Frage, warum die Kombinationstherapie nicht zu einer signifikanten Verbesserung der Schmerzlinderung geführt hat, obwohl Radium-223 bekanntlich in der palliativen Behandlung sehr wirksam ist.
RAPSON-Studie: Untersuchung der Sequenzierung von Radium-223 und Docetaxel bei mCRPC-Patienten
Die RAPSON-Studie, die auf dem ESMO 2024 präsentiert wurde, untersucht die Sequenzierung von Radium-223 und Docetaxel bei Patienten mit metastasiertem kastrationsresistentem Prostatakrebs (mCRPC) und Knochenmetastasen. Ziel dieser Studie war es, herauszufinden, ob es Unterschiede in der Wirksamkeit und Verträglichkeit gibt, je nachdem, ob Radium-223 vor oder nach Docetaxel verabreicht wird. In dieser Phase-II-Studie wurden Patienten mit mCRPC und Knochenmetastasen randomisiert, um entweder zunächst mit Radium-223 behandelt zu werden, gefolgt von Docetaxel, oder umgekehrt. Der Hauptfokus der RAPSON-Studie lag auf der Bewertung des progressionsfreien Überlebens (PFS) und der Gesamtüberlebensrate (OS) sowie der Lebensqualität und Toxizität, abhängig von der Reihenfolge der Therapien. Zum Zeitpunkt der vorgestellten Zwischenanalyse waren die Daten noch nicht ausreichend, um endgültige Schlussfolgerungen über die Überlegenheit einer Sequenz gegenüber der anderen zu ziehen. Die vorläufigen Ergebnisse zeigten jedoch, dass es zwischen den beiden Sequenzierungsansätzen hinsichtlich PFS und OS keine signifikanten Unterschiede gab. Es stellte sich aber heraus, dass die Sequenzierung eine Rolle bei der Hämatotoxizität spielte: Patienten, die zuerst Docetaxel und danach Radium-223 erhielten, hatten häufiger schwere Thrombozytopenien. Das deutet darauf hin, dass die Kombination dieser beiden Therapieformen eine sorgfältige Überwachung und möglicherweise angepasste Dosierungen erfordert, um Nebenwirkungen zu minimieren. Die RAPSON-Studie bewertete auch die Auswirkungen der beiden Therapiestrategien auf die Lebensqualität der Patienten mithilfe des FACT-P (Functional Assessment of Cancer Therapy-Prostate)-Fragebogens. Die Patienten, die zuerst Radium-223 erhielten, berichteten von einer geringeren Verschlechterung der Lebensqualität im Vergleich zu denen, die zuerst Docetaxel erhielten. Das könnte darauf hindeuten, dass Radium-223 eine vorteilhafte Erstbehandlung für Patienten mit symptomatischen Knochenmetastasen sein könnte, da es die Symptome besser kontrollieren kann, bevor eine systemische Chemotherapie verabreicht wird. Obwohl die RAPSON-Studie noch nicht genügend ausgereifte Daten vorlegen konnte, um eine klare Empfehlung zur idealen Sequenzierung von Radium-223 und Docetaxel abzugeben, deutet sie darauf hin, dass die Reihenfolge der Verabreichung insbesondere in Bezug auf die Toxizität wichtig ist. Die erhöhten Fälle von Thrombozytopenie in der Gruppe, die Docetaxel vor Radium-223 erhielt, lassen vermuten, dass eine umgekehrte Reihenfolge in einigen Fällen vorteilhaft sein könnte, um Nebenwirkungen zu reduzieren. Die endgültigen Ergebnisse der RAPSON-Studie könnten wichtige Hinweise darauf geben, wie mCRPC-Patienten mit Knochenmetastasen am besten behandelt werden, insbesondere hinsichtlich der Vermeidung von Nebenwirkungen und der Verbesserung der Lebensqualität. Zukünftige Studien, wie die DORA-Studie (NCT03574571), die ebenfalls die Sequenzierung von Docetaxel und Radium-223 untersucht, könnten zusätzliche Klarheit bringen und helfen, die Behandlung zu optimieren.
Copyright Aerzteverlag medinfo AG
Universitätsspital Lausanne – CHUV
Service de médecine nucléaire et imagerie moléculaire
Rue du Bugnon 46
1011 Lausanne
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. 1. Aggarwal, R., Starzinski, S., de Kouchkovsky, I., Koshkin, V., Bose, R., Chou, J., Desai, A., Kwon, D., Kaushal, S., Trihy, L., Rastogi, M., Ippisch, R., Aslam, M., Friedlander, T., Feng, F., Oh, D., Cheung, A., Small, E., Evans, M., … Hope, T. A. (2023). Single-dose 177Lu-PSMA-617 followed by maintenance pembrolizumab in patients with metastatic castration-resistant prostate cancer: an open-label, dose-expansion, phase 1 trial. In The Lancet Oncology (Vol. 24, Issue 11, pp. 1266–1276). Elsevier BV.
2. 177Lu-PSMA-617 versus a change of androgen receptor pathway inhibitor therapy for taxane-naive patients with progressive metastatic castration-resistant prostate cancer (PSMAfore): a phase 3, randomised, controlled trial. Morris, Michael J et al. The Lancet, Volume 404, Issue 10459, 1227 – 1239
3. ERA 223: A phase III trial of radium-223 (Ra-223) in combination with abiraterone acetate and prednisone/prednisolone for the treatment of asymptomatic or mildly symptomatic chemotherapy-naïve patients (pts) with bone-predominant metastatic castration-resistant prostate cancer (mCRPC). Smith, M.R. et al. Annals of Oncology, Volume 29, viii723
4. A phase III trial of docetaxel versus docetaxel and radium-223 (Ra-223) in patients with metastatic castration-resistant prostate cancer (mCRPC): DORA. Meeting Abstract: 2021 ASCO Annual Meeting. Morris, Michael J et al.