Résumé: La visite à domicile occupe une place importante dans la pratique médicale en Suisse et contribue à limiter le recours aux centres d’ urgences. Afin d’ assurer une prestation de qualité, le contenu de la trousse d’ urgence doit être adapté à la pratique à domicile : suffisant pour faire face à diverses s ituations cliniques sans être excessif pour rester transportable. Nous proposons ici un contenu de la trousse d’ urgence actualisé, ciblé sur les moyens nécessaires au diagnostic et au traitement. Nous distinguons les éléments de base des moyens complémentaires qui permettent d’ étendre la prise en charge, en particulier dans des régions ne disposant pas de moyens sanitaires de proximité.
Mots-clés: Visite à domicile – Trousse d’ urgence – Médecine de premier recours – Urgences
1. Introduction
La visite médicale à domicile (VAD) est couramment pratiquée et contribue à limiter le recours aux services d’ urgences (1, 2). Une étude dans le canton de Vaud a montré que les VAD représentent environ 2.5% des consultations médicales, s’ adressent principalement aux personnes de plus de 65 ans et constituent pour 20% des consultations urgentes (3). Environ 70% des VAD sont réalisées en raison d’ une mobilité réduite des patients (4). Les problématiques musculo-squelettiques, circulatoires, respiratoires, neurologiques et psychiatriques sont les plus rencontrées (5).
En raison du vieillissement de la population et des stratégies favorisant le maintien des personnes âgées à domicile, les VAD devraient garder une place importante dans l’ activité des médecins de premier recours, voire se développer, comme en témoigne l’ apparition récente en Suisse romande d’ entreprises spécialisées dans les visites médicales à domicile («Docadom» à Lausanne, «Médecins à domicile» ou «Médecins Genève» à Genève, «SOSmed» sur la Côte, «Médecins du Léman» sur la Riviera et le Chablais, etc.).
Afin d’ assurer une prestation de qualité, le contenu de la trousse d’ urgence utilisée lors des VAD doit être suffisant pour faire face à des situations cliniques diverses. Certains éléments peuvent être mutualisés avec l’ équipement du cabinet, en particulier pour le matériel onéreux. Il n’ existe pas de recommandation validée dans la littérature du contenu de la trousse d’ urgence, cependant quelques publications (6,7,8) ont émis des propositions.
Cet article est une proposition actualisée du contenu de la trousse d’ urgence médicale, basée sur la littérature lorsqu’ elle existe, avec un contenu de base qui peut être complété par des dispositifs et traitements supplémentaires, en fonction du type et du lieu de la pratique (gardes domiciliaires, région plus excentrée, etc.) et de l’ expérience des médecins.
2. Outils diagnostics
2.1.1 Outils de bases
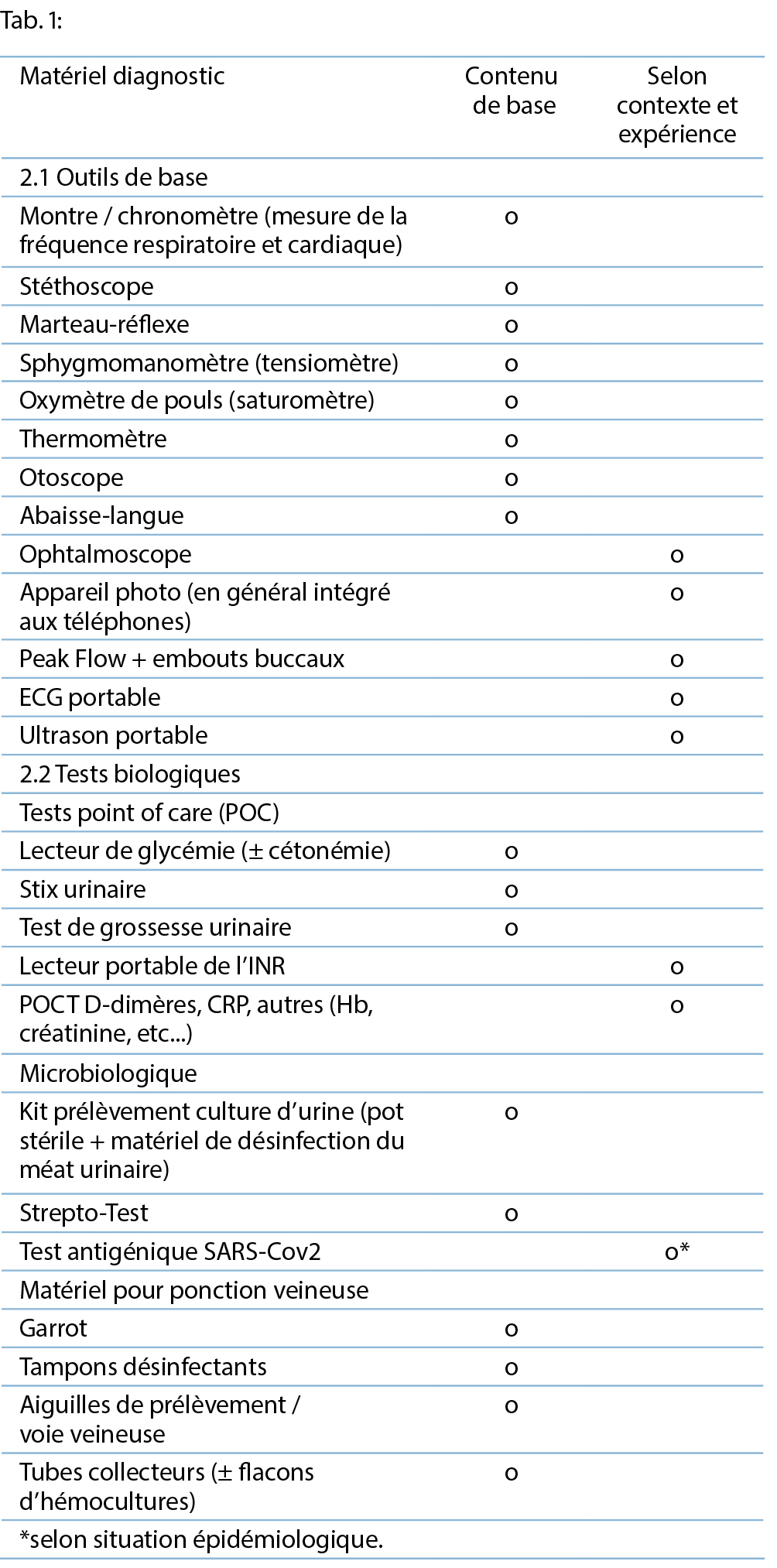
La trousse d’ urgence devrait comprendre des outils diagnostics de bases, listés dans le tableau 1.
2.1.2 Appareil à électrocardiogramme (ECG)
Un appareil à ECG est utile pour diagnostiquer une pathologie cardiaque. Il existe de nombreux modèles portables convenant pour un double usage au cabinet et pour les VAD. En cas de suspicion de syndrome coronarien aigu (SCA), un ECG devrait être fait dans les 10 minutes après le premier contact médical, idéalement déjà en préhospitalier, pour détecter un infarctus de type STEMI et activer une filière de prise en charge rapide. En cas d’ infarctus de type non STEMI ou d’ angor instable, l’ ECG peut être normal et ne permet pas d’ exclure un SCA (9).
2.1.3 Appareil à ultrasons
Le développement de l’ échographie clinique au lit du malade pour les médecins de premier recours, ou point-of-care ultrasound (POCUS), l’ apparition d’ appareils ultraportables à prix abordables, et la possibilité de facturer l’ examen une fois la formation certifiée, rend cet outil intéressant dans le contexte des VAD. Soulignons qu’ une formation complète est indispensable afin de réaliser et interpréter correctement les images*. L‘utilité du POCUS est démontrée avec une forte évidence pour la recherche d’ une thrombose veineuse profonde, l’ évaluation d’ une dyspnée aiguë, la distinction d’ une dermo-hypodermite ou d’ un abcès, et avec une évidence modérée pour rechercher des signes de colique néphrétique (hydronéphrose, calcul) ou de cholécystite (10). Il est également utile pour mettre en évidence une rétention urinaire aiguë. Le POCUS a ainsi le potentiel d’ étendre les possibilités diagnostiques, de réduire l’ incertitude et d’ administrer un traitement plus ciblé.
2.2 Tests biologiques
Les analyses de type «point-of-care» (POC) se développent et sont en partie réalisables au domicile des patients. Les plus fréquemment utilisées sont la mesure de la glycémie, le stix urinaire ou encore les tests antigéniques à SARS-Cov2, les strepto-Tests et éventuellement l’ INR. L’ utilisation de tests POC plus avancés devient possible grâce à l’ apparition de dispositifs portables fournissant des résultats en quelques minutes et peut s’ avérer utile pour des situations urgentes ou des VAD en dehors des heures ouvrables (11). À titre d’ exemple, plusieurs examens sont intéressants, comme la mesure de la CRP pour limiter le recours aux antibiotiques lors d’ infection des voies aériennes dans le contexte ambulatoire (12), la mesure des D-dimères pour exclure une thrombose veineuse profonde ou une embolie pulmonaire (13) et la mesure de la créatinine pour guider le dosage d’ un traitement. Cependant les études décrivant ces tests ont été faites majoritairement dans un contexte de consultation au cabinet ou à l’ hôpital et ne sont pas formellement validées pour les VAD. La mesure de troponine ultra-sensible de type POC («POC hs-Troponin») pourrait également s’ avérer utile à domicile, mais le cadre de son utilisation doit également être précisé et validé par des études portant sur ce type de population.
3. Therapeutiques
3.1 Pharmacologiques (Tableau 2)
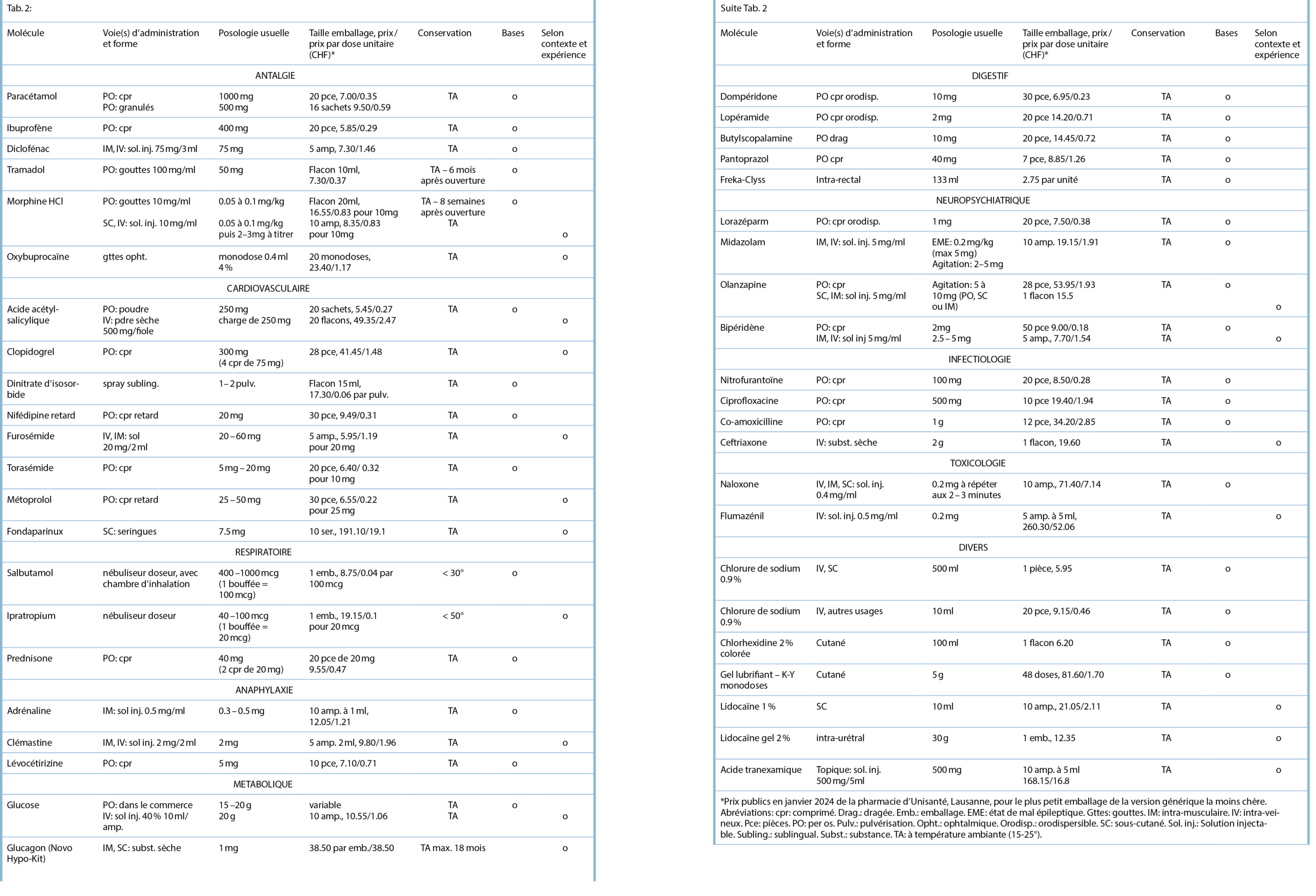
Les traitements recommandés ci-après concernent les situations les plus à même d’ être rencontrées lors de consultations urgentes à domicile. Nous avons sélectionné des médicaments pouvant être conservés à température ambiante (les fabricants spécifient généralement une température comprise entre 15 et 25°C). La trousse devra être conservée en général dans un lieu sec et à l’ abri de la lumière. Pour garantir la qualité des médicaments, il faudra éviter de la laisser pour une durée prolongée dans une voiture, où la température peut atteindre des valeurs extrêmes. La liste distingue les éléments de base de ceux nécessitant une expérience et des connaissances spécifiques ou utiles selon le contexte de la pratique. L’ inclusion de médicaments chers est à faire selon le contexte de la pratique et de la probabilité de leur usage.
3.1.1 Antalgie
Les douleurs légères peuvent être traitées par du paracétamol ou un AINS. En cas de douleurs modérées, le paracétamol et un AINS peuvent être combinés, et un opioïde faible ajouté (tramadol ou codéine). Les douleurs sévères nécessitent un opioïde. La voie d’ administration se fera selon la configuration et le degré de douleur, et le choix de la molécule selon les compétences du médecin et les caractéristiques du patient (14). Une administration parentérale d’ opioïde nécessite une surveillance, en raison du risque de dépression respiratoire ou d’ autres effets secondaires. Elle s’ avérera utile en cas de soins palliatifs ou dans l’ attente d’ un transfert hospitalier. Son utilisation nécessite de disposer d’ un antidote (naloxone).
3.1.2 Cardiovasculaire
En cas de suspicion de SCA, il est recommandé d’ administrer 150 à 300mg d’ aspirine PO sous forme non gastro-résistante (ou 75 à 250 mg IV), avec un probable bénéfice sur la mortalité d’ une administration précoce en préhospitalier (9,15). En cas d’ allergie, une dose de charge de clopidogrel (300-600 mg PO) peut être administrée (16). Une double anti-agrégation n’ est pas recommandée avant la coronarographie (9). Un traitement par nitré est utile en cas de douleurs thoraciques d’ origine ischémique.
En cas de crise hypertensive (sans atteinte d’ organe), la tension peut être abaissée – en évitant une chute brusque – en ajustant le traitement habituel et par l’ ajout d’ une molécule. Nous proposons la nifédipine retard (17). L’ insuffisance cardiaque symptomatique nécessite un traitement par diurétique, IV ou PO, et des dérivés nitrés en cas d’ œdème aigu des poumons (18). En cas de tachyarythmie (fibrillation auriculaire, extrasystoles symptomatiques), nous proposons un béta-bloqueur, sous réserve d’ une insuffisance cardiaque associée.
En cas de survenue d’ un arrêt cardio-respiratoire (ACR), la priorité reste le Basic Life Support (BLS) comprenant la réanimation cardio-pulmonaire (massage cardiaque et ventilation) et la défibrillation. La poursuite de la réanimation impliquera l’ administration d’ adrénaline et en cas de rythme choquable résistant à la défibrillation, de l’ amiodarone. Dans la plupart des situations, ce traitement pourra probablement attendre l’ arrivée de l’ ambulance et/ou du SMUR.
En cas de probabilité pré-test intermédiaire ou élevée d’ une embolie pulmonaire, une anticoagulation thérapeutique devrait être débutée en attendant les résultats de tests diagnostiques (19). En cas de délai supérieur à 4 heures pour obtenir les D-dimères ou obtenir un ultrason des membres inférieurs pour rechercher une thrombose veineuse profonde, une anticoagulation thérapeutique devrait être débutée (20). Nous proposons le fondaparinux 7.5mg en inj. sc qui s’ administre 1x/j et convient pour les poids de 50 à 100 kg.
3.1.3 Respiratoire
En cas d’ exacerbation d’ asthme légère à modérée, il est recommandé d’ administrer 4-10 push (400-1000 mcg) de salbutamol en aérosol doseur, si possible avec une chambre d’ inhalation, aux 20 minutes sur la première heure , à adapter selon la réponse par la suite, d’augmenter la dose du traitement de fond et d’administrer de la prednisone 20 à 40mg PO. En cas de péjoration ou d’ exacerbation sévère, de l’ ipratropium bromide devrait être ajouté en attendant une hospitalisation urgente (21). L’exacerbation légère à modérée de BPCO doit être traitée par bêta-agoniste à courte durée d’action ± associée à de l’ipratropium bromide, en maintenant le traitement de fond, d’une corticothérapie de 5 jours par prednisone 40mg en cas de sévérité, et d’une antibiothérapie en cas de suspicion d’infection associée (22).
En cas de désaturation en oxygène, une oxygénothérapie est souvent nécessaire et impliquera une réflexion sur un éventuel transfert en milieu hospitalier, mais les avantages et inconvénients du transfert doivent être bien mesurés, en particulier pour les patients en EMS. En raison du coût élevé d’ un appareil d’ oxygénothérapie (plusieurs milliers de francs pour un concentrateur portable), nous ne proposons pas cet équipement dans la trousse. Il pourra toutefois être envisagé selon le type de pratique et la probabilité d’ occurrence d’ urgences vitales.
3.1.4 Anaphylaxie
En cas d’ anaphylaxie avec atteinte cardiovasculaire ou respiratoire, il est primordial d’ administrer précocement de l’ adrénaline IM (sur la face antéro-latérale de la cuisse) à une dose de 0.5mg à répéter au besoin après 5 minutes. En cas d’ angioœdème ou d’ atteinte cutanée uniquement, un traitement anti-histaminique s’ avère généralement suffisant (23). Les glucocorticoïdes sont souvent utilisés dans le but de réduire le risque de réaction biphasique, mais il n’ existe pas d’ évidence de leur efficacité et leur administration systématique n’ est plus recommandée (24).
3.1.5 Métabolique
En cas d’ hypoglycémie chez une personne diabétique, le traitement repose sur l’ administration de glucose 15-20g PO suivie d’ une collation ou un repas. Si l’ administration PO n’ est pas possible, le traitement implique l’ administration de glucose 20-25g IV ou de glucagon 1mg SC ou IM (25). En cas d’ hypoglycémie et de suspicion de déficit en thiamine ou de syndrome de Gayet-Wernicke avéré, la correction immédiate de l’ hypoglycémie est prioritaire et la substitution en thiamine peut être faite dans un second temps, dans les plus brefs délais (26).
3.1.6 Digestif
En cas de symptomatologie digestive, nous proposons comme antiémétique la dompéridone (ne pas administrer en cas d’ hypokaliémie probable ou de QT long en raison du risque de prolongation du QT), comme anti-diarrhéique le lopéramide, comme antispasmodique la butylscopalamine, et comme inhibiteur de la pompe à proton le lansoprazole. Il convient de disposer également de l’ équipement pour pouvoir effectuer un lavement.
3.1.7 Neuropsychiatrique
Nous proposons comme traitement antiépileptique, administrable de manière IV ou IM, le midazolam, dont une formulation intra-nasale proposée par certaines pharmacies peut également être utile. Le diazépam est une alternative, mais le délai d’ atteinte du pic de concentration des formes IM et IN est plus long (27). Le lorazepam en solution injectable doit se conserver au frigo et n’ est donc pas adapté à une trousse d’ urgence. La dystonie aiguë secondaire à un traitement avec propriétés anti-dopaminergique (typiquement un neuroleptique) nécessite l’ administration d’ un anticholinergique, tel que le bipéridène (Akineton®) en PO ou IV (28).
En cas d’ agitation aiguë, si les mesures non pharmacologiques ont échoué, un traitement par benzodiazépine (p.e. lorazépam 2.5mg en PO, midazolam en IM ou IV) ou antipsychotique peut être nécessaire. L’ olanzapine présente moins de risque d’ allongement du QT et de troubles extrapyramidaux que les neuroleptiques de 1ère génération. Cependant l’ halopéridol, un antipsychotique de 1ère génération, a l’ avantage d’ un coût bien moindre (29). Les benzodiazépines seront utiles également en cas d’ anxiété.
3.1.8 Infectiologie
Nous proposons des antibiotiques pour un traitement empirique des infections courantes susceptibles d’ être prises en charge de manière ambulatoire selon les recommandations de la Société Suisse d’ Infectiologie (30). Le traitement devra être adapté selon les résultats microbiologiques lorsqu’ ils ont été réalisés.
Nous proposons la nitrofurantoïne pour l’ infection urinaire simple. Pour l’ infection urinaire sans fièvre chez l’ homme (ne pouvant attendre les résultats d’ une culture), ou la pyélonéphrite chez la femme, nous proposons, après prélèvement microbiologique d’ urine, la ciprofloxacine (à noter que la Food and Drug Administration a émis un «Boxed Warning» en raison du risque de tendinopathie). Pour la prostatite, la ceftriaxone est actuellement recommandée en IV, l’ alternative orale étant la ciprofloxacine, après culture également. Nous proposons la co-amoxicilline pour une pneumonie traitée ambulatoirement chez un patient avec des comorbidités, et en cas d’ allergie aux pénicillines, une quinolone telle que la lévofloxacine. La SSI n’ a pas publié de recommandation sur la dermo-hypodermite, mais la co-amoxicilline couvrira les germes fréquemment responsables. La ceftriaxone peut compléter la trousse pour être administrée en IM ou IV en cas de suspicion de méningite avec une méningococcémie ou en présence d’ un état de choc (31).
3.1.9 Toxicologie
Vu le recours fréquent aux opiacées, nous recommandons d’ avoir à disposition son antidote, la naloxone. L’ antidote aux benzodiazépines, le flumazénil, peut être utile en cas de mono-intoxication, mais il existe un risque de crise d’ épilepsie s’ il est utilisé notamment lors d’ une poly-intoxication, d’ une dépendance aux benzodiazépines ou d’ une épilepsie sous-jacente. Concernant les autres intoxications, la prise en charge consistera essentiellement en un traitement de soutien en attente d’ un transfert en milieu hospitalier.
3.1.10 Divers
Des poches de cristalloïdes (sodium chlorure 0.9% 500ml ou Ringer-Lactate 500ml) seront utiles comme solution de remplissage, des fioles de NaCl 0.9% pour le rinçage des voies veineuses, une solution désinfectante cutanée pour la désinfection des plaies et petits gestes, une solution anesthésique locale en cas de suture et du gel anesthésiant pour la pose de sonde vésicale. L’ acide tranexamique peut être utile en application locale pour une hémostase.
3.2 Matériel
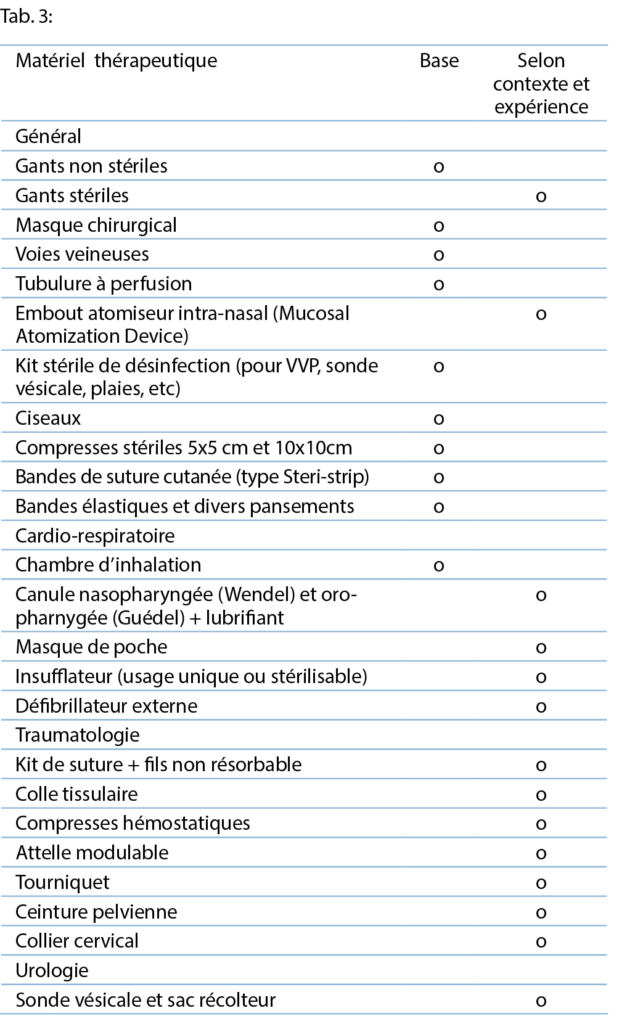
3.2.1 Base
Du matériel de base sera nécessaire dans toutes les trousses et est listé dans le tableau 3. Le matériel plus avancé dépendra du contexte de la pratique et de l’ expérience du médecin. Un embout atomiseur pour application de médicament par voie intra-nasale (Mucosal Atomization Device) peut-être utile pour l’ administration d’ un sédatif ou anti-épileptique (p.e. midazolam).
3.2.2 Cardio-respiratoire
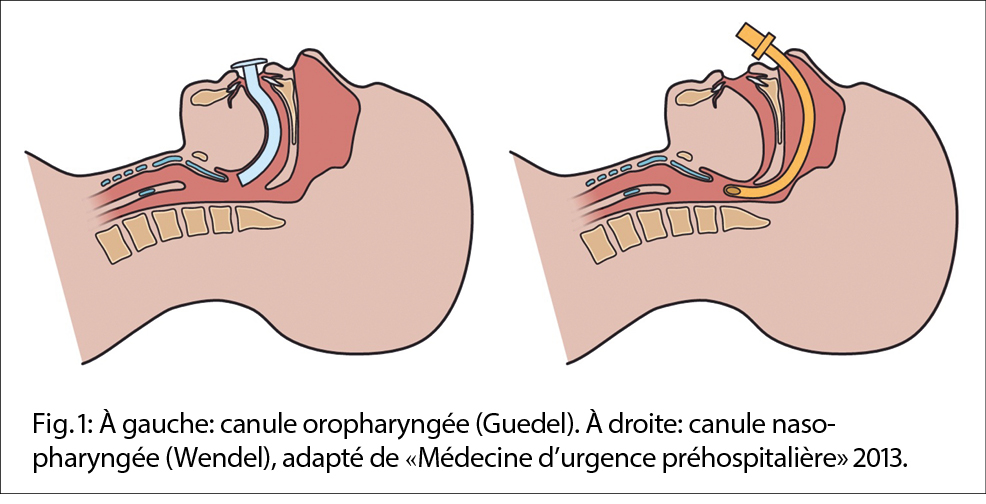
Une canule nasopharyngée (Wendel) ou une canule oropharyngée (Guedel) (illustration 1) permettent de maintenir les voies aériennes perméables en cas de trouble de l’ état de conscience. Un masque de poche et un insufflateur sont utiles en cas de réanimation. En cas de recours à des bronchodilatateurs dans un contexte de dyspnée aiguë, il est recommandé d’ utiliser une chambre d’ inhalation.
Bien que l’ ACR d’ un patient soit un évènement rare au cabinet des médecins (32), les médecins de premier recours sont potentiellement exposés à une population à risque. La pratique d’ une réanimation cardio-pulmonaire par les médecins de premiers recours améliore les chances de survie des patients (33) et la défibrillation effectuée par les témoins d’ un ACR avec un rythme choquable hors hôpital améliore la survie avec un bon status neurologique par rapport à la défibrillation effectuée par les services de secours, et ce dès un délai de 4 minutes entre l’ appel des secours et leur arrivée (34). S’ équiper d’ un défibrillateur peut être pertinent pour un cabinet plus à risque d’ urgence vitale (région reculée, procédure à risque, cabinet de groupe), et être approprié lors des gardes domiciliaires, surtout pour des gardes réalisées sans triage téléphonique en amont, en zone difficile d’ accès pour des moyens d’ urgence pré-hospitalier, ou en zone de faible densité de défibrillateur externe automatique disponibles. Des consultations en milieu carcéral ou dans des postes de police exposent à un risque également un peu plus important.
3.2.3 Traumatologie
Il peut être utile de réaliser une petite suture au domicile du patient, afin d’ éviter le recours à un service d’ urgence. La colle tissulaire peut remplacer une suture en cas de petite plaie, linéaire, propre et sans tension (35). En cas d’ hémorragie externe, des compresses hémostatiques (de type Tabotamp ou Quik Clot) peuvent être utiles. Si des situations de polytraumatisme peuvent être rencontrées (médicalisation de rencontres sportives par exemple), une attelle provisoire, une ceinture pelvienne ou encore un tourniquet seront utiles. Un collier cervical peut être utile mais la pertinence de son utilisation dans ce contexte reste débattue (36).
3.2.4 Divers
Nous proposons d’ avoir à disposition de quoi poser une voie veineuse périphérique, administrer une perfusion et mettre en place une sonde vésicale en cas de rétention urinaire. Selon le contexte local, en cas de décès avec présence d’ un pacemaker, il peut être nécessaire de disposer de l’ équipement pour l’ extraire et réaliser une suture.
4. Administratif
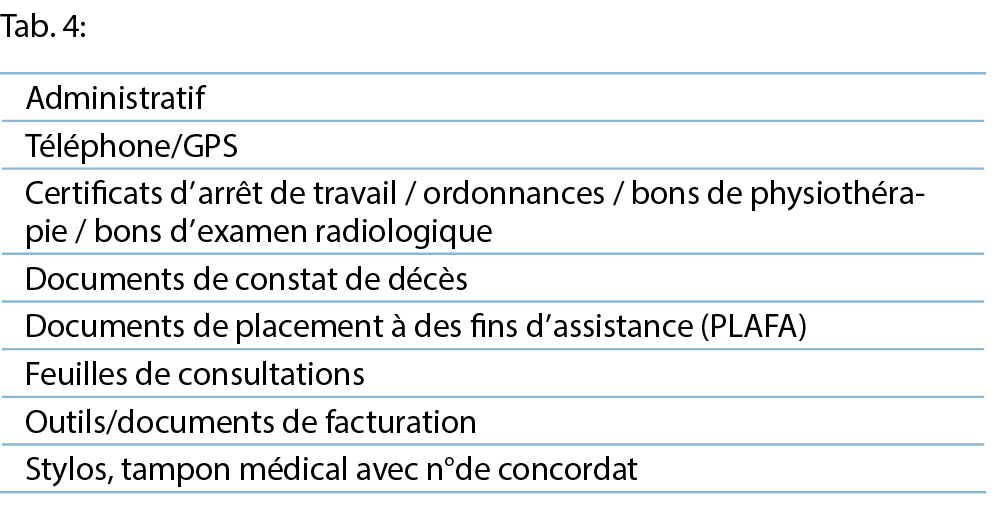
Le tableau 4 liste une proposition de matériel et contenu administratif. En cas de décès, les formulaires d’ attestation de décès sont indispensables.
5. Conclusions
Le contenu de la trousse d’ urgence devrait contenir du matériel diagnostique et thérapeutique de base, à compléter par du matériel plus complet, en fonction du contexte dans lequel se fait la pratique et de l’ expérience du médecin. Un équipement plus exhaustif permettra de répondre à davantage de situations et d’ éviter potentiellement des transferts dans des structures médicales, en particulier pour des patients âgés à domicile ou en EMS.
L’ utilisation de l’ utrasonographie portable peut permettre d’ étendre les possibilités diagnostiques et de mieux cibler le traitement. Le développement de tests Point-of-Care réalisables en quelques minutes sur des appareils portatifs est intéressant et mérite d’ être réévalué régulièrement. L’ intégration d’ un défibrillateur dans l’ équipement permet de réaliser une réanimation en cas d’ arrêt cardio-circulatoire et augmente les chances de survie avec un bon état neurologique en cas de rythme défibrillable. Ce type de dispositif peut être pertinent selon le type de pratique ou l’ éloignement des services de secours préhospitaliers.
* https://sgum-ssum.ch/faehigkeitsausweise/#FA_POCUS
Remerciements :
Nous remercions la Dre Simona Agostini-Ferrier et Mme Véronique Kälin de la pharmacie d’ Unisanté pour leur relecture et leur aide à la réalisation de la liste des médicaments.
Abréviations :
ACR arrêt cardio-respiratoire
ECG électrocardiogramme
IM intra-musculaire
INR International normalized ratio
IV intra-veineux
PO per os
POC Point Of Care
POCUS Point Of Care Ultrasound
RCP réanimation cardio-pulmonaire
SC sous-cutané
SCA syndrome coronarien aigu
VAD visite à domicile
Historie :
Manuscrit soumis: 25.01.2024
Accepté après revision: 11.03.2024
GHOL – Hôpital de Nyon
Notfalldienst
Chemin Monastier 10
1260 Nyon
othorens@protonmail.com
Unisanté – Département des policliniques
Rue du Bugnon 44
1011 Lausanne
CHUV – Notaufnahme
Abteilung für interdisziplinäre Zentren
Rue du Bugnon 44
1005 Lausanne
Les auteurs n’ ont pas declaré de conflits d’ interêt en relation avec cet article.
1. Efstathopoulou, A., et al. Visite à domicile par le médecin de famille: état des lieux en Europe et en Suisse. Rev Med Suisse. 2016;(537): 1874–1878.
2. Ifediora CO, Rogers GD. Patient-reported impact of after-hours house-call services on the utilization of emergency department services in Australia. Family Practice. 2017;34(5):593 8.
3. Mueller Y, David S, Cohidon C, Locatelli I, Senn N. Home visits made by general practitioners in the canton of Vaud between 2006 and 2015. Swiss Med Wkly. 2019
4. Fritz RD, Merlo C, Essig S. How time consuming are general practitioners’ home visits? Insights from a cross-sectional study in Switzerland. Swiss Med Wkly. 2023;153(2):40038.
5. Meuli N, Jungo KT, Merlo C, Streit S, Essig S. Frequency of home visits where general practitioners are exposed to a problem different from that foreseen – a Swiss cross-sectional study. Swiss Med Wkly. 2021;151(39 40).
6. Drugs for the doctor‘s bag: 1–adults. Drug and Therapeutics Bulletin 2015; 53:56-60.
7. Murtagh J. The doctor’ s bag. What do you really need? Aust Fam Physician. 2000;29(1):25 9.
8. Auer S, Berger J, Staeger P. La trousse du médecin de garde: propositions. Praxis. 2016;105(19):1125-1131.
9. Byrne RA, Rossello X, Coughlan JJ, Barbato E, Berry C, Chieffo A, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. European Heart Journal. 2023;44(38):3720 826.
10. Arnold MJ, Jonas CE, Carter RE. Point-of-Care Ultrasonography. Am Fam Physician. 2020;101(5):275 85.
11. Dixon S, Glogowska M, Garland S, Hunt H, Lasserson D, Hayward G. Clinician perspectives on having point of care tests made available to them during out of hours home visiting. BMC Fam Pract. 2021;22(1):246.
12. Smedemark SA, Aabenhus R, Llor C, Fournaise A, Olsen O, Jørgensen KJ. Biomarkers as point-of-care tests to guide prescription of antibiotics in people with acute respiratory infections in primary care. Cochrane Acute Respiratory Infections Group, éditeur. Cochrane Database of Systematic Reviews. 2022.
13. Price CP, Fay M, Hopstaken RM. Point-of-Care Testing for D-Dimer in the Diagnosis of Venous Thromboembolism in Primary Care: A Narrative Review. Cardiol Ther. 2021;10(1):27 40.
14. Hachimi-Idrissi S, Dobias V, Hautz WE, Leach R, Sauter TC, Sforzi I, et al. Approaching acute pain in emergency settings; European Society for Emergency Medicine (EUSEM) guidelines—part 2: management and recommendations. Intern Emerg Med. 2020;15(7):1141‑55.15. Djarv T, Swain JM, Chang WT, Zideman DA, Singletary E. Early or First Aid Administration Versus Late or In-hospital Administration of Aspirin for Non-traumatic Adult Chest Pain: A Systematic Review. Cureus. 2020
16. Amsterdam EA, Wenger NK, Brindis RG, Casey DE, Ganiats TG, Holmes DR, et al. 2014 AHA/ACC Guideline for the Management of Patients With Non–ST-Elevation Acute Coronary Syndromes: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014 130(25).
17. Van Den Born BJH, Lip GYH, Brguljan-Hitij J, Cremer A, Segura J, Morales E, et al. ESC Council on hypertension position document on the management of hypertensive emergencies. European Heart Journal – Cardiovascular Pharmacotherapy. 2019;5(1):37 46.
18. Mebazaa A, Yilmaz MB, Levy P, Ponikowski P, Peacock WF, Laribi S, et al. Recommendations on pre-hospital & early hospital management of acute heart failure: a consensus paper from the Heart Failure Association of the European Society of Cardiology, the European Society of Emergency Medicine and the Society of Academic Emergenc: Recommendations on pre-hospital & early hospital management of acute heart failure. Eur J Heart Fail. 2015;17(6):544 58.
19. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). European Heart Journal. 2020;41(4):543 603.
20. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. London: National Institute for Health and Care Excellence (NICE); 2020.
21. Levy ML, Bacharier LB, Bateman E, Boulet LP, Brightling C, Buhl R, et al. Key recommendations for primary care from the 2022 Global Initiative for Asthma (GINA) update. NPJ Prim Care Respir Med. 2023;33(1):7.
22. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for Prevention, Diagnosis and Management of COPD: 2023 Report.
23. Muraro A, Roberts G, Worm M, Bilò MB, Brockow K, Fernández Rivas M, et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014;69(8):1026 45.
24. Shaker MS, Wallace DV, Golden DBK, Oppenheimer J, Bernstein JA, Campbell RL, et al. Anaphylaxis—a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. Journal of Allergy and Clinical Immunology. 2020;145(4):1082 123.
25. Cryer PE, Axelrod L, Grossman AB, Heller SR, Montori VM, Seaquist ER, et al. Evaluation and Management of Adult Hypoglycemic Disorders: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 2009;94(3):709 28.
26. Donnino MW, Vega J, Miller J, Walsh M. Myths and Misconceptions of Wernicke’ s Encephalopathy: What Every Emergency Physician Should Know. Annals of Emergency Medicine. 2007;50(6):715 21.
27. Kienitz R, Kay L, Beuchat I, Gelhard S, Von Brauchitsch S, Mann C, et al. Benzodiazepines in the Management of Seizures and Status Epilepticus: A Review of Routes of Delivery, Pharmacokinetics, Efficacy, and Tolerability. CNS Drugs. 2022;36(9):951 75.
28. Munhoz RP, Scorr LM, Factor SA. Movement disorders emergencies. Current Opinion in Neurology. 2015;28(4):406 12.
29. Gottlieb M, Long B, Koyfman A. Approach to the Agitated Emergency Department Patient. The Journal of Emergency Medicine. 2018;54(4):447 57.
30. https://ssi.guidelines.ch/, dernière consultation le 19.01.2024.
31. McGill F, Heyderman RS, Michael BD, Defres S, Beeching NJ, Borrow R, et al. The UK joint specialist societies guideline on the diagnosis and management of acute meningitis and meningococcal sepsis in immunocompetent adults. Journal of Infection. avr 2016;72(4):405 38.
32. Potin M, Pittet V, Staeger P, Vallotton L, Burnand B, Yersin B. (Life-threatening emergencies at the office: implications for medical education and equipment of the primary care physician).. Rev Med Suisse. 2008;4(167):1768 72.
33. Barry T, Bury G. Cardiac arrest resuscitation and its relevance to general practice. Br J Gen Pract. 2019;69(687):481 2.
34. Pollack RA, Brown SP, Rea T, Aufderheide T, Barbic D, Buick JE, et al. Impact of Bystander Automated External Defibrillator Use on Survival and Functional Outcomes in Shockable Observed Public Cardiac Arrests. Circulation. 2018;137(20):2104 13.
35. Forsch RT, Little SH, Williams C. Laceration Repair: A Practical Approach. Am Fam Physician. 2017;95(10):628 36.
36. Moureaux R, Piaget S, Della Santa V. Cervical spine trauma in the era of choosing wisely: less immobilization and no cervical collars. Rev Med Suisse. 2021;17(746):1352 6.