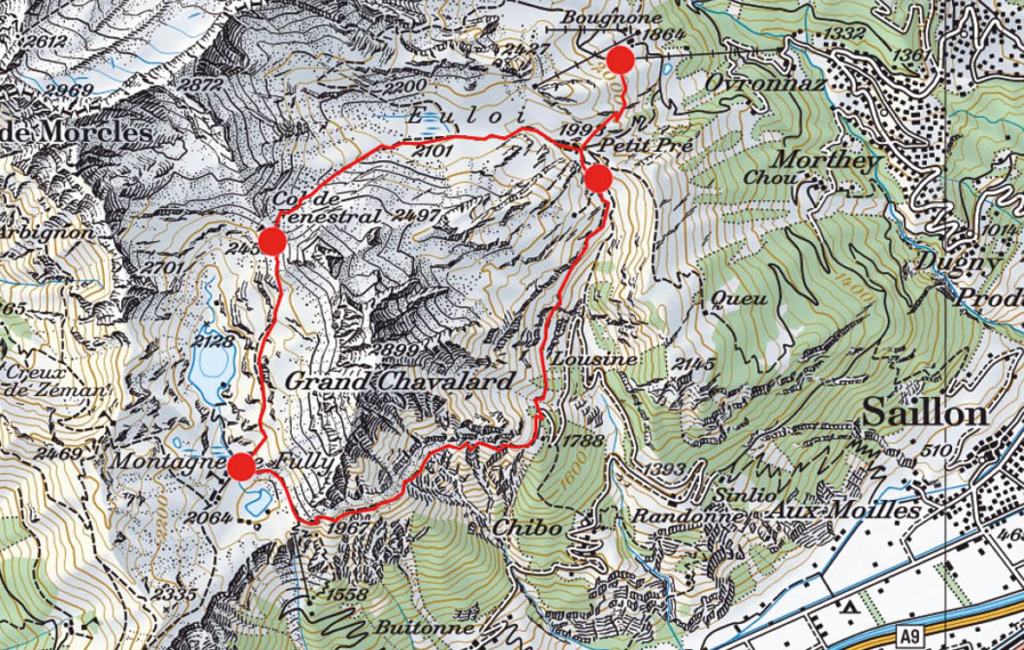
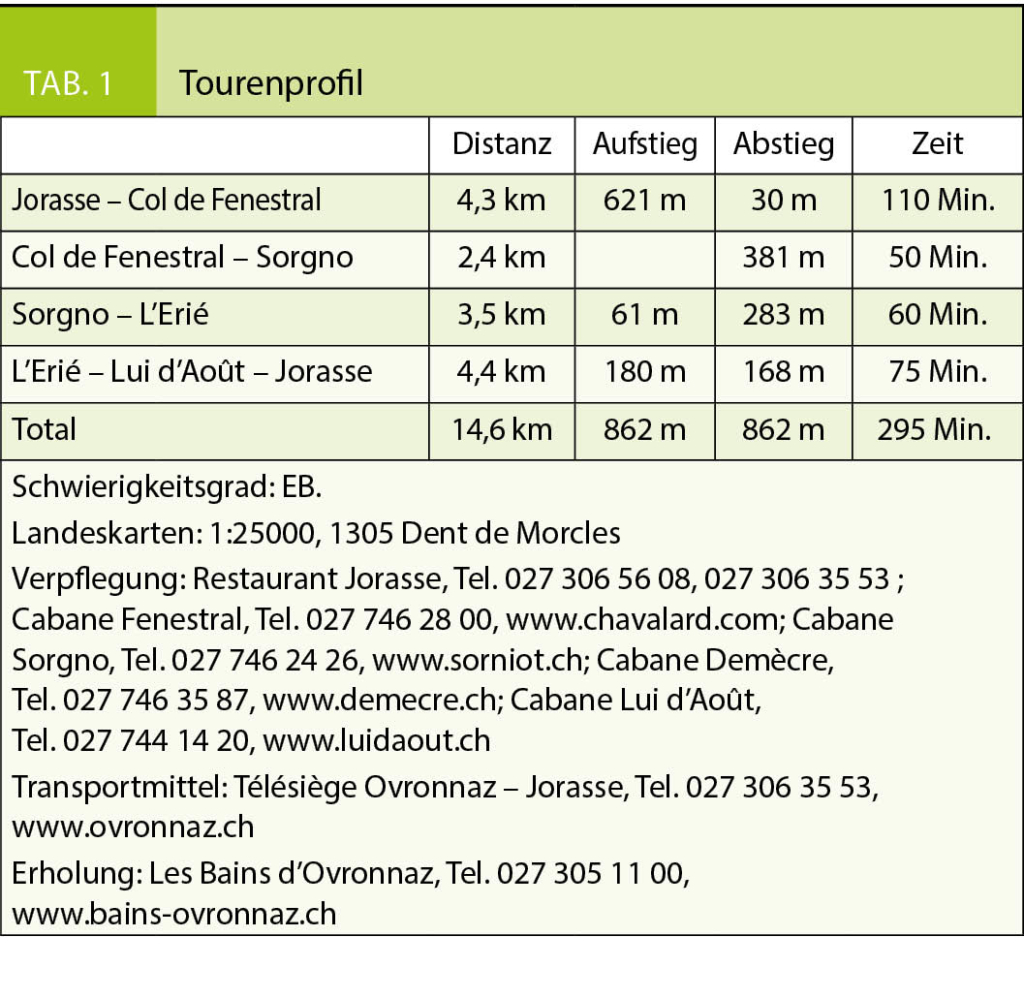
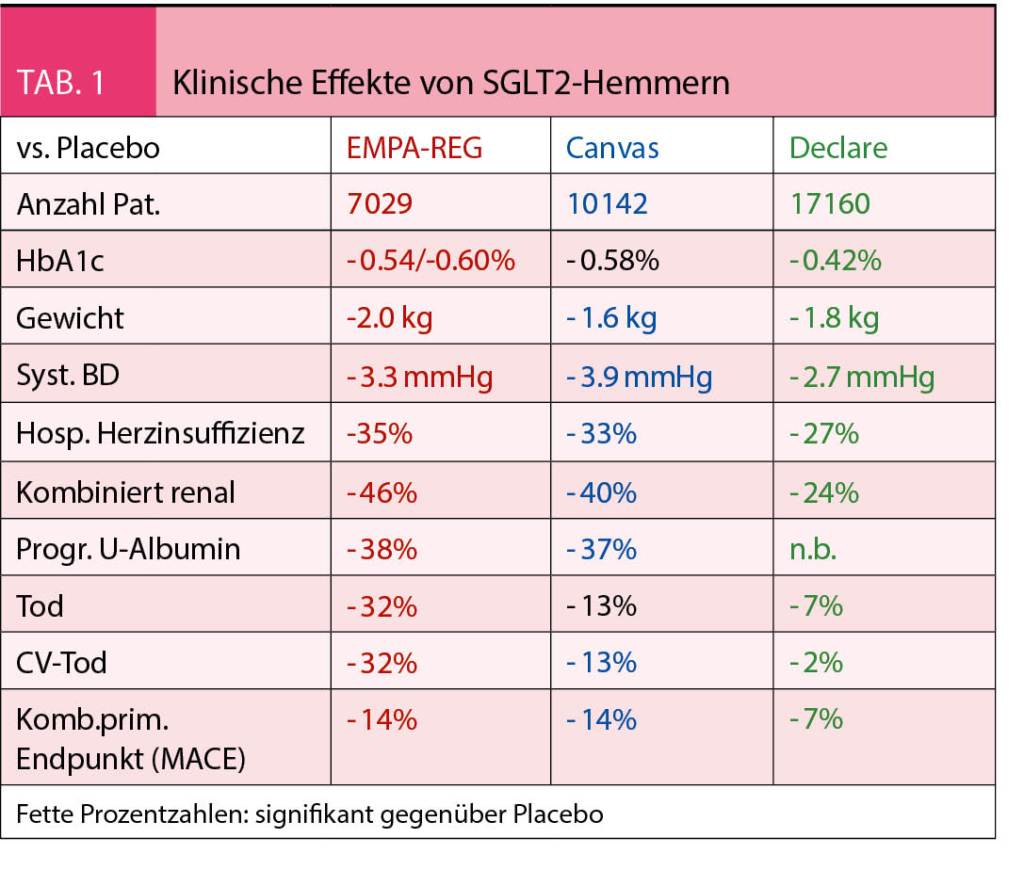
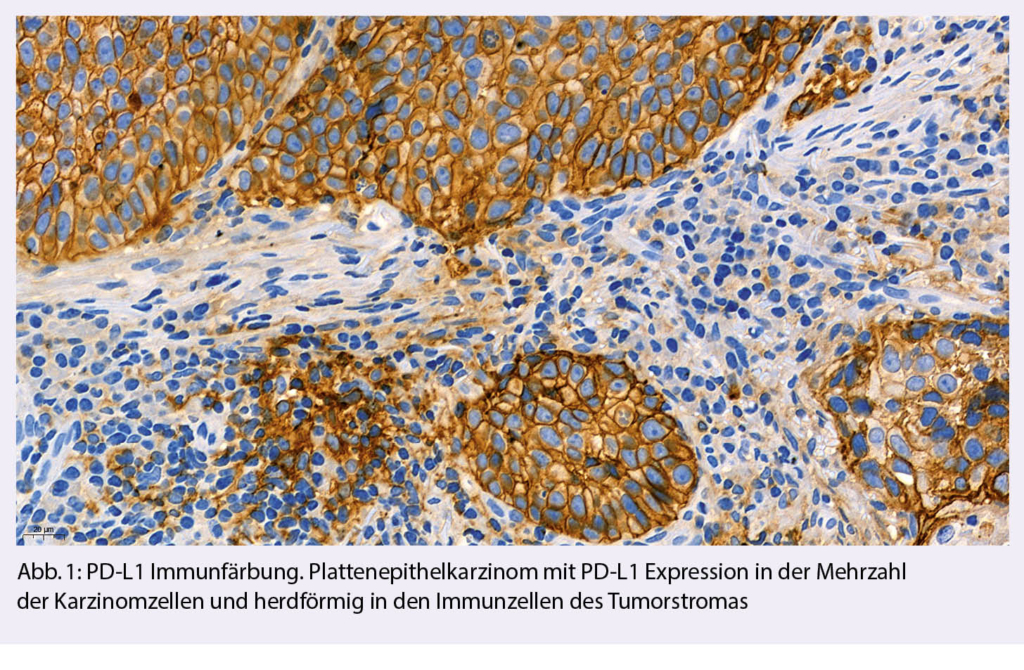
Nach einem stärkenden Kaffee wenden wir uns oberhalb des Restaurants nach Süden und erreichen über einen breiten Weg schon nach kurzer Zeit die Alp Petit Pré, kleine Wiese. Gegen Westen gelangen wir über einen schmaleren Pfad zum Grand Pré, der grossen Alpwiese, wo früher, eingebettet zwischen Grand Chavalard und Dent Favre ein glazialer Restsee gelegen haben dürfte, der mittlerweile verlandet ist. Nun ist es nicht mehr weit bis zum Col de Fenestral und der gleichnamigen Berghütte, die sich jenseits der Passhöhe befindet (Abb. 1). Die grossen Panoramafenster der modernen Hütte ermöglichen es auch bei stürmischen Wind, den herrlichenBlick auf das Mont Blanc-Massiv und die Walliser Alpen zu geniessen.
Die gesamte Rundwanderung verläuft in einem geologisch äusserst interessanten Gebiet, sind hier doch, ähnlich wie in Derborence, die Deckenschichten des Jura, der Kreide und des Tertiärs aufgeschlüsselt. Die obersten, über dem Flysch des Tertiärs liegenden Felswände bilden den Verkehrtschenkel der Morcles-Decke und stammen aus der älteren Kreidezeit. Entsprechend sollten sie eigentlich unter den Gesteinsmassen des Tertiärs liegen, wären sie nicht als Deckenfalte überschoben worden. Die zahlreichen Faltenbildungen und Verdoppelungen der Schichten lassen unschwer und auch ohne geologisches Kartenmaterial nicht nur die Komplexität, sondern auch die Gewalt der alpinen Gebirgsbildung erahnen.
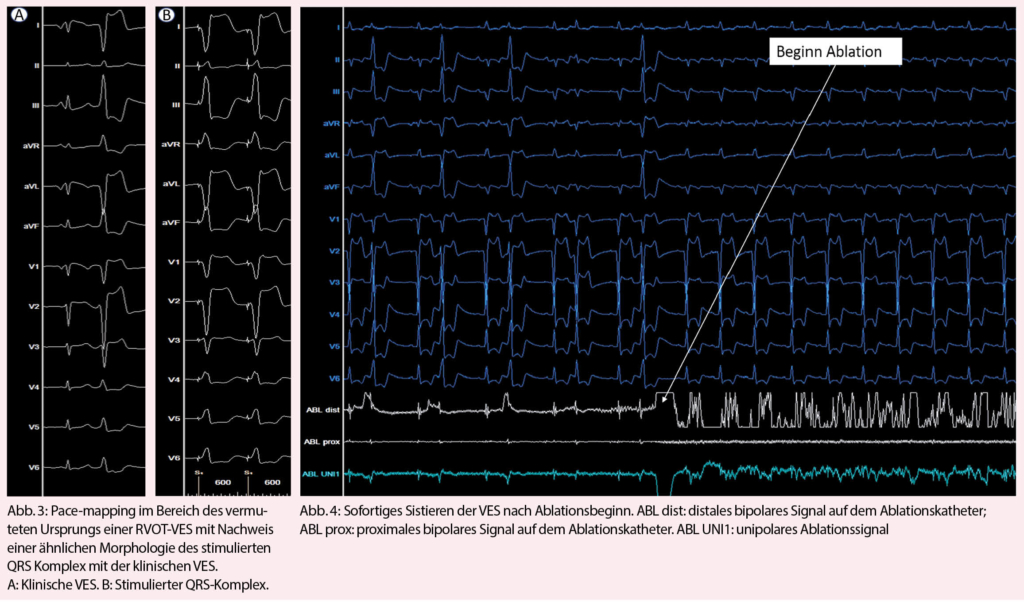
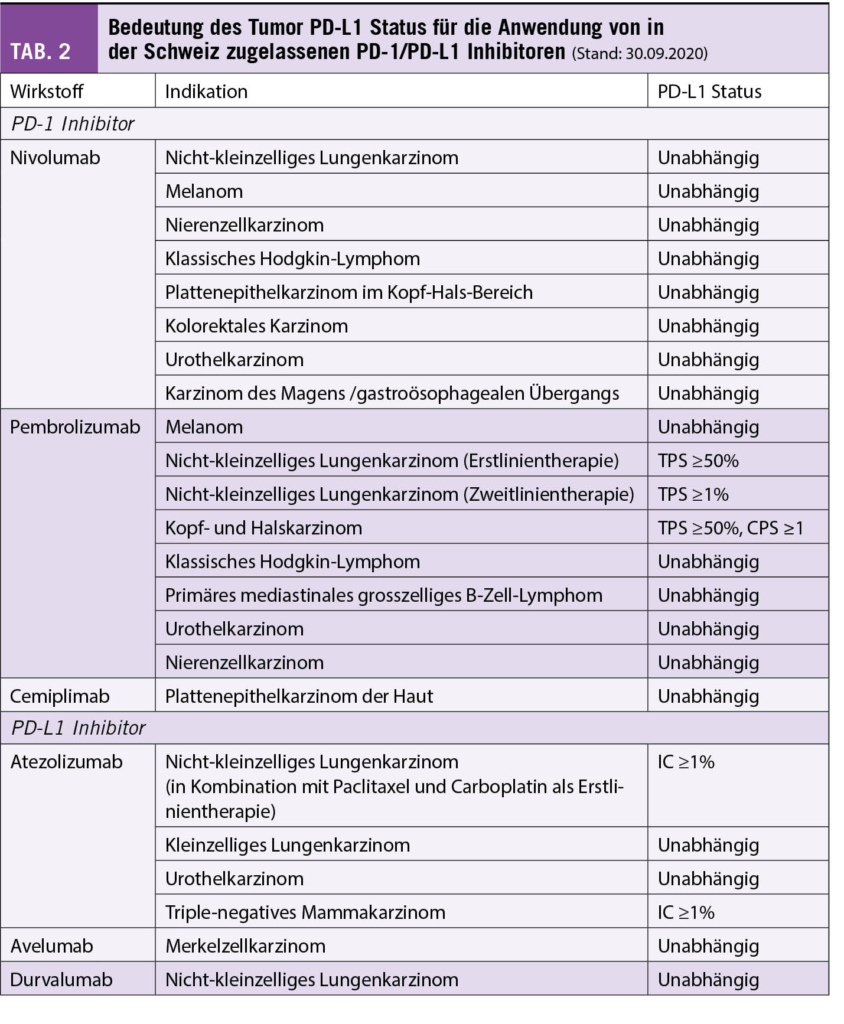
Für den Abstieg nach Sorgno und den Lac Inférieur de Fully lohnt es sich, den Bergpfad entlang der Westflanke des Grand Chavalard und nicht denjenigen durch den Talgrund und entlang des Lac Supérieur de Fully zu wählen. Er ist nicht nur kürzer, sondern auch aussichtsreicher. Anfangs Juli durchwandert man hier einen prächtigen Blumenrasen mit gelbem punktierten sowie Purpurenzian, Männertreu und Türkenbund, um nur einige wenige der vielen Pflanzen zu nennen (Abb. 3). Wer bereits wieder durstig ist, findet in der Alpwirtschaft von Sorgno genügend Tranksame. Von hier aus bietet sich für Nimmermüde die Möglichkeit einer kleinen Rundtour über den Col du Demècre, wo sich ebenfalls eine Schutzhütte befindet, und um den Diabley sowie die Tête du Portail.
Wir lassen es gemütlich angehen und folgen dem Fahrsträsschen über dem Ostufer des
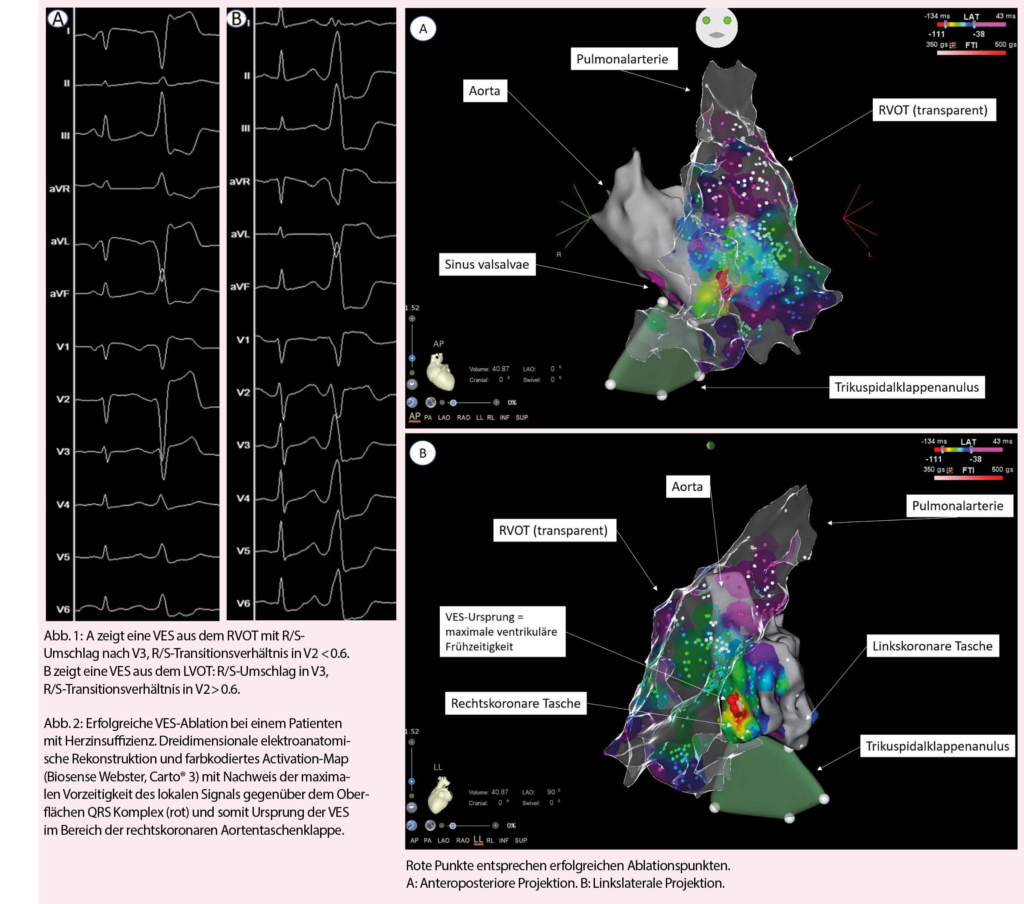
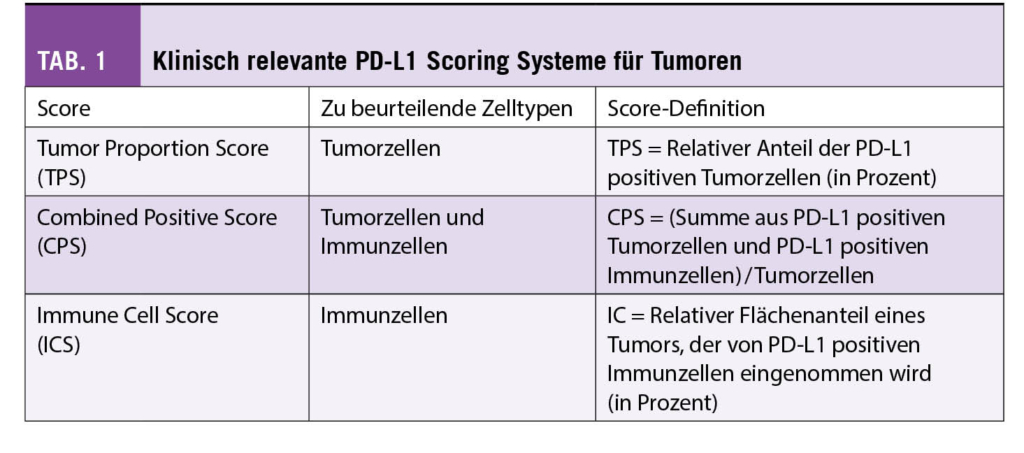
Lac Inférieur de Fully bis zum breiten, nach Osten abzweigenden Bergweg, der in wenigen Kehren in die steile Südostwand des Grand Chavalard hinaufführt. Hier erwartet uns ein gut ausgebauter, aber luftiger Höhenweg 1700 Meter über dem Rhonetal (Abb. 2). Der schwindelerregende Tiefblick auf das Flechtwerk der Felder und Plantagen sowie die Stadt Martigny, aber auch die Weitsicht auf die Walliser Riesen Grand Combin und Mont Vélan sowie das bereits erwähnte Mont Blanc-Massiv mit Aiguille du Tour, Aiguille du Chardonet, Aiguille d’Argentière und Tour Noir, um nur einige der zahlreichen Gipfel aufzuführen, ist einmalig und atemberaubend. Sie brauchen keinen Vergleich mit irgend einem anderen Höhenweg der Schweizer Alpen zu scheuen. Immer wieder bleiben wir stehen und können uns trotz der vielen Wolken am heutigen Tag nicht genug satt sehen.
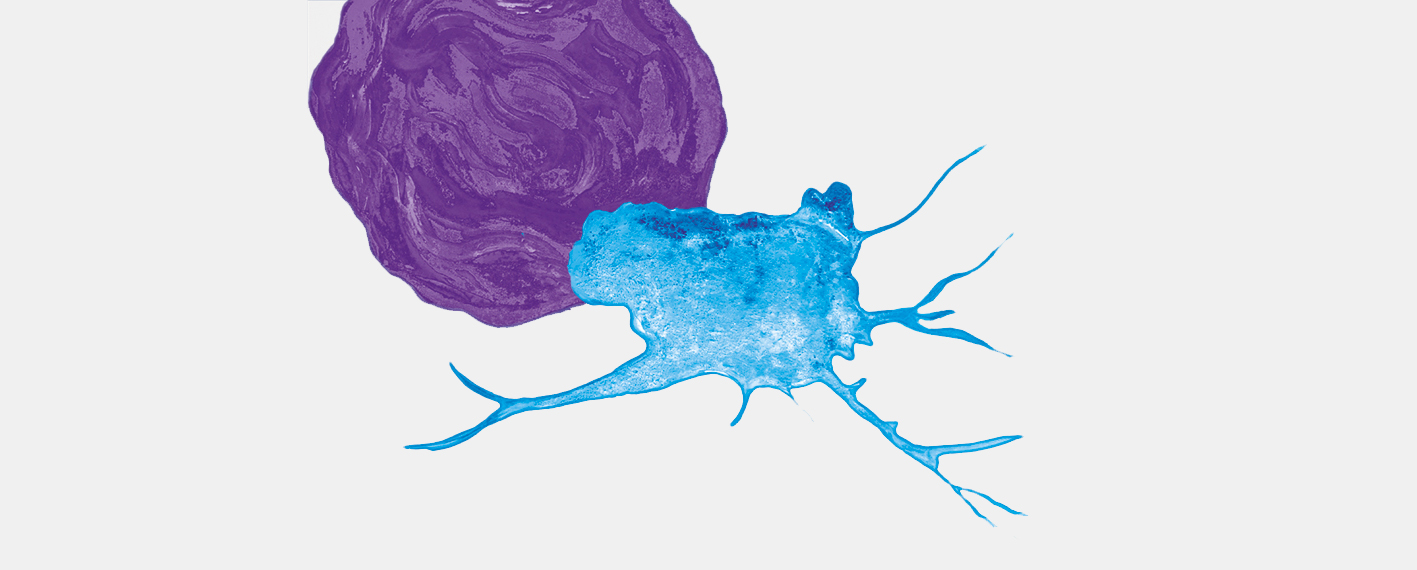
Auf der Alp Erié erreichen wir die Fahrstrasse, die vom Rhonetal in ungezählten und abenteuerlichen Kehren bis auf 1850 Meter hinaufführt. Hier stehen zwar viele Autos, uns ist aber kaum eine Menschenseele begegnet. Wenige Schritte unterhalb des Parkplatzes zweigt in der ersten Strassenkehre ein schmaler Pfad nach Norden ab, der geschickt die Gras- und Waldabsätze zwischen den untersten Felsbändern der Ostwand des Grand Chavalard nutzt und über den wir leicht ansteigend die lang gezogene Alphütte von Lui d’Août erreichen, wo erneut die Möglichkeit zur Einkehr besteht. Verdursten braucht man auf dieser Rundwanderung wahrlich nicht. Von hier aus schliesst sich auf kurzem Weg der Kreis auf der Alp Petit Pré, von wo wir auf dem zu Beginn benutzten Weg zur Bergstation der Sesselbahn zurückkehren (Abb. 4). Wer sich von den Anstrengungen dieser Rundwanderung erholen möchte, dem sei das Thermalbad in Ovronnaz empfohlen.
Riedstrasse 9
6430 Schwyz
christian.besimo@bluewin.ch