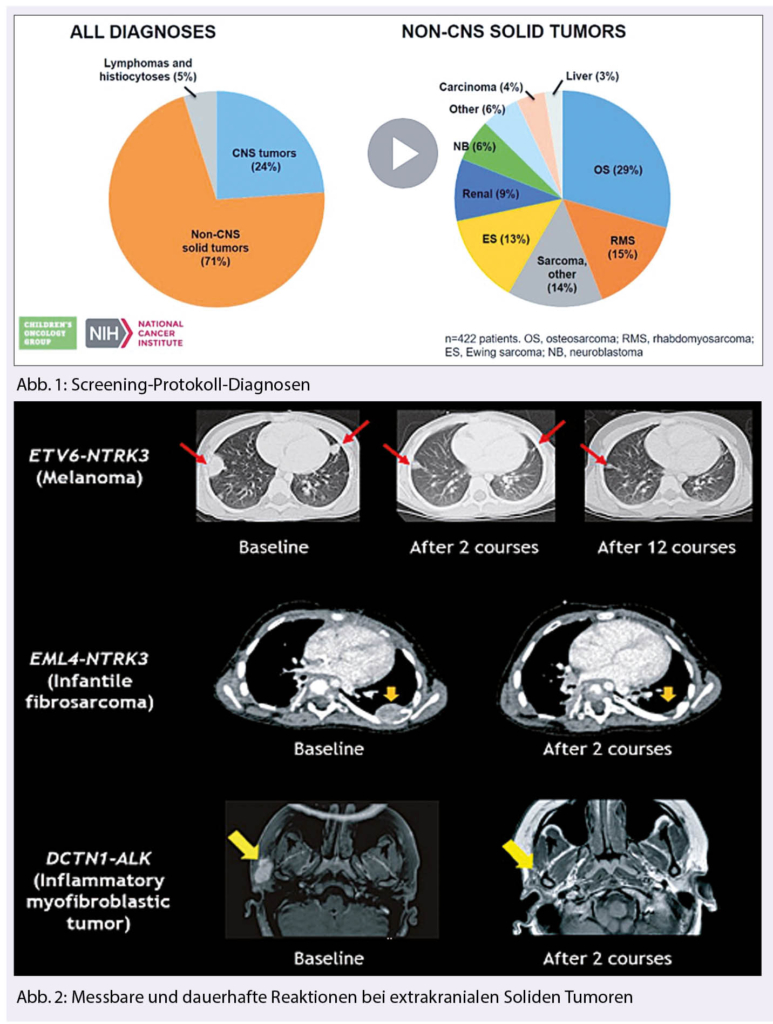
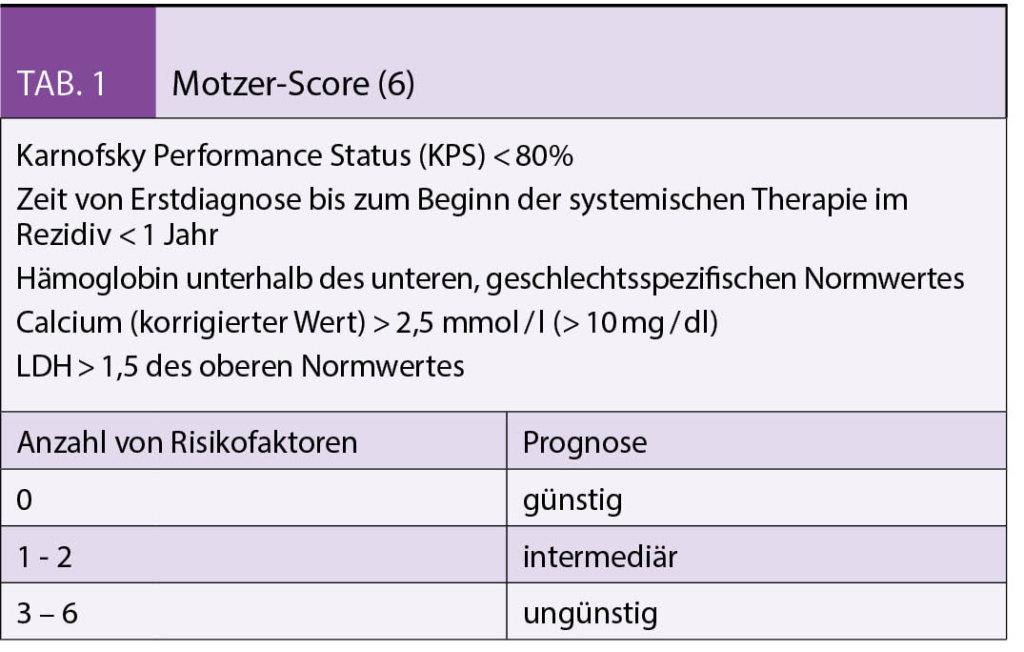
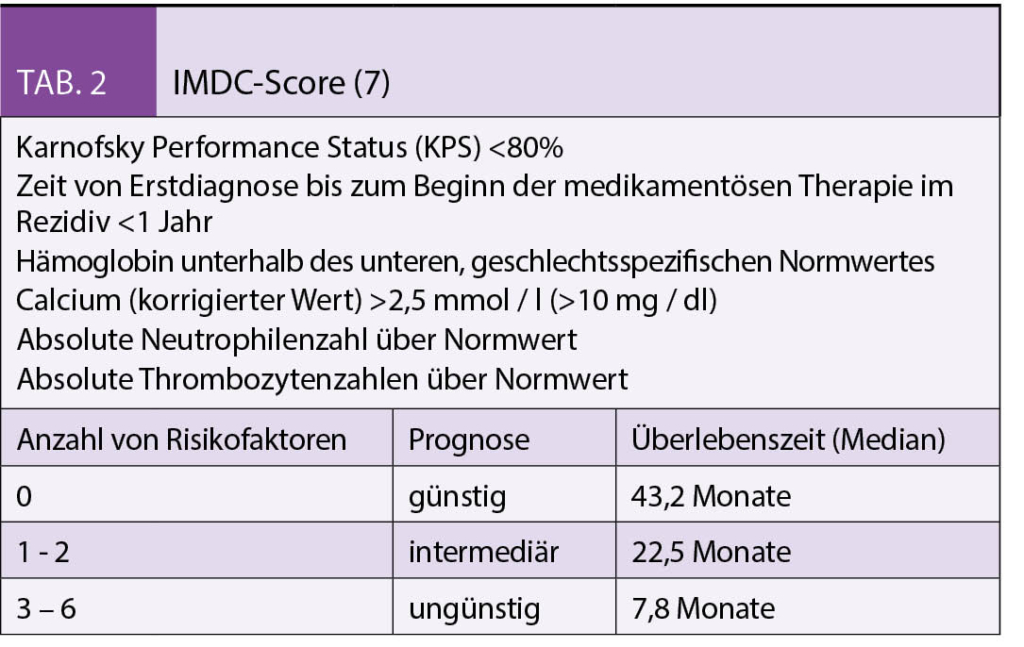
Brustkrebspatientinnen wünschen sich eine Integration von Komplementärmedizin in die ärztliche Versorgung. Dieser Artikel gibt Antworten auf eine häufig gestellte Frage: «Was kann ich noch tun, um meinen Krankheitsverlauf positiv zu beeinflussen oder Nebenwirkungen der Therapie zu reduzieren?» Es gibt evidenzbasierte supportive Massnahmen aus der Komplementärmedizin, die laut Praxis-Leitlinien für bestimmte Symptome oder zur Besserung der Lebensqualität empfohlen werden können.
Die Situation
Im Juli 2021 wurde die erste S3-Leitlinie zu komplementären Therapien im deutschen Leitlinienprogramm Onkologie publiziert. Ein grosser Teil der dort zusammengestellten Studien wurde mit Brustkrebspatientinnen durchgeführt und je nach Umfrage ist mindestens jede zweite Patientin eine Nutzerin (1). Die Beweggründe der Patientinnen für das Interesse an Komplementärmedizin sind vielfältig. Es ist wichtig, diese zu erfragen, um auch passende Informationen und Empfehlungen geben zu können. Wenn die Erwartungen der Patientin und der Ärztin, des Arztes an die Inhalte des Gesprächs und an die Frage, was Komplementärmedizin leisten kann, nicht abgeglichen werden, kann dies zu Missverständnissen oder gar zu Unzufriedenheit führen.
Der Fokus dieses Artikels liegt auf der supportiven Anwendung von komplementären Therapien im Sinne einer integrativen Onkologie. Diese wurde von der internationalen Society for Integrative Oncology definiert (2) (Definition s. Box 1).
Drei Aspekte aus dieser Definition – Patientenzentrierung, Evidenz und Patientinnen als aktive Teilnehmerinnen in der Krebsbehandlung – sollen in diesem Artikel näher ausgeführt werden.
Ziel ist es auch, das Thema Komplementärmedizin in den Kontext der alltäglichen Praxis zu setzen.
Evidenz aus Leitlinien
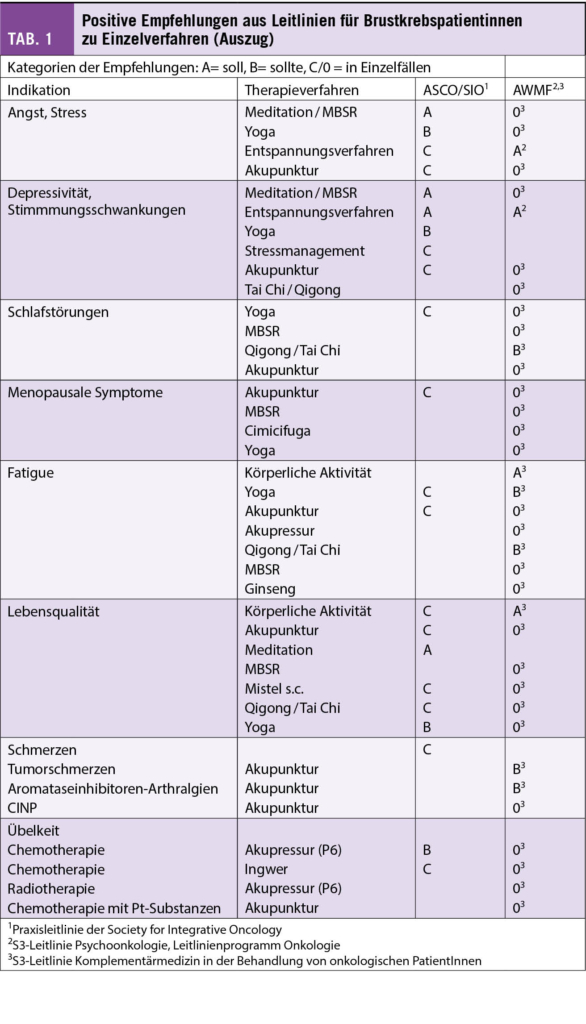
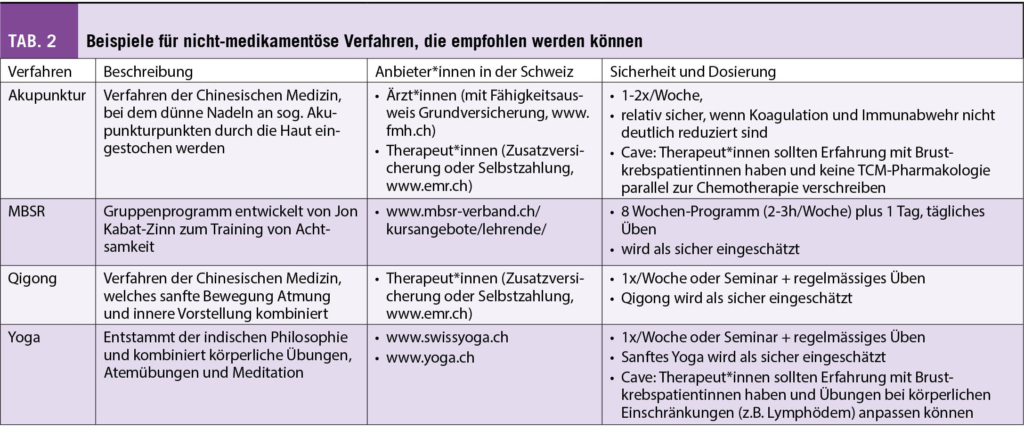
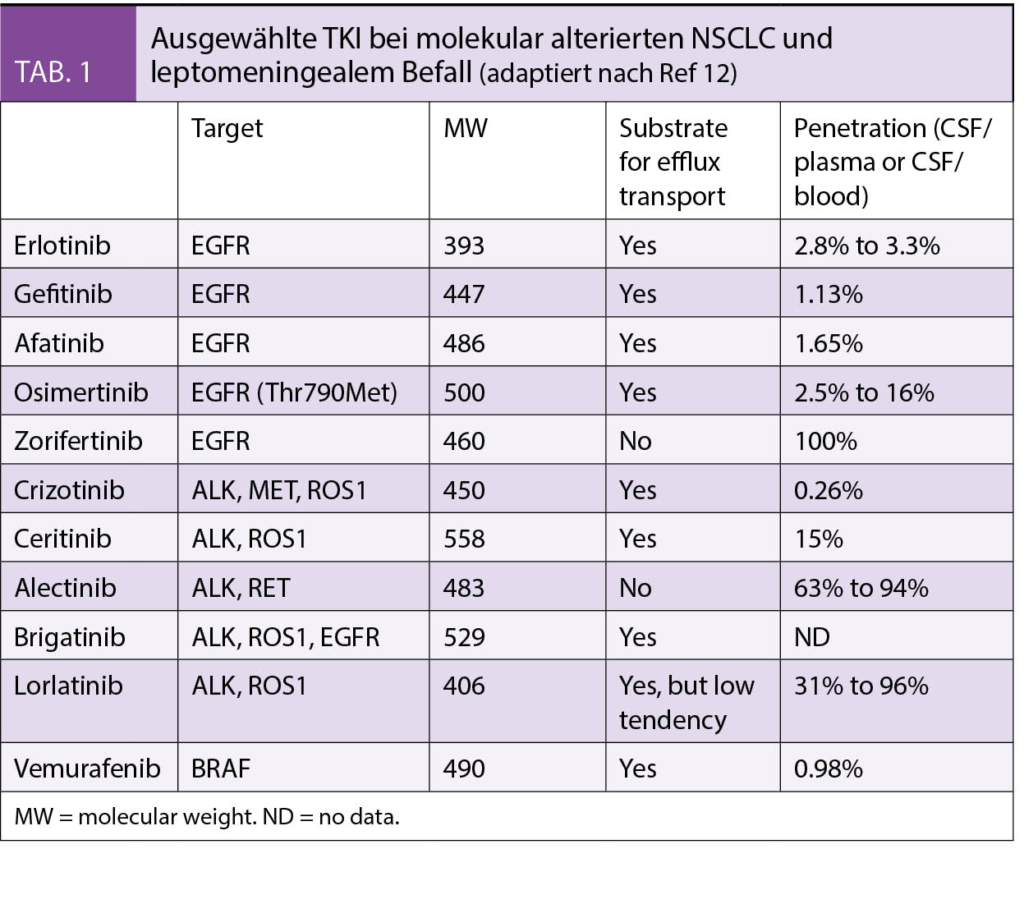
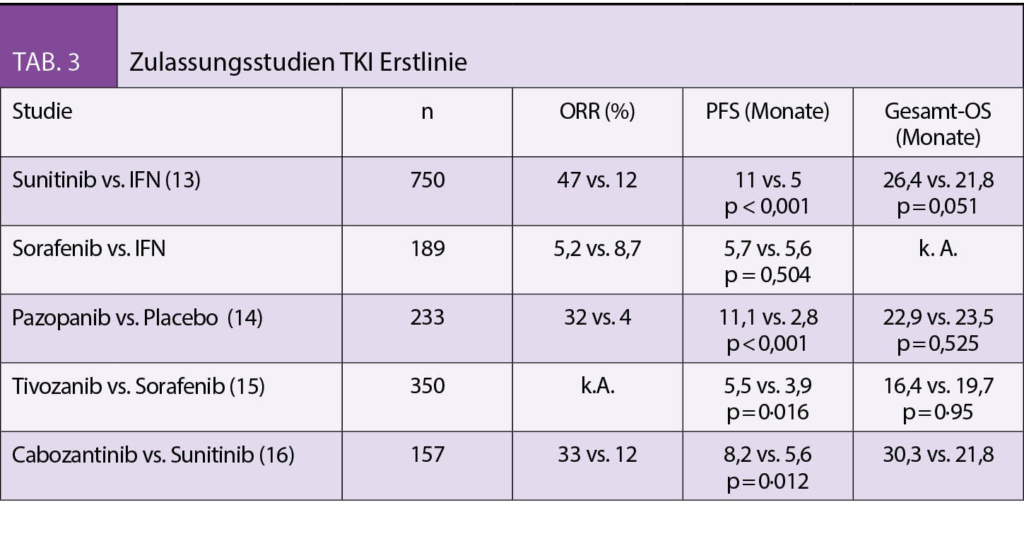
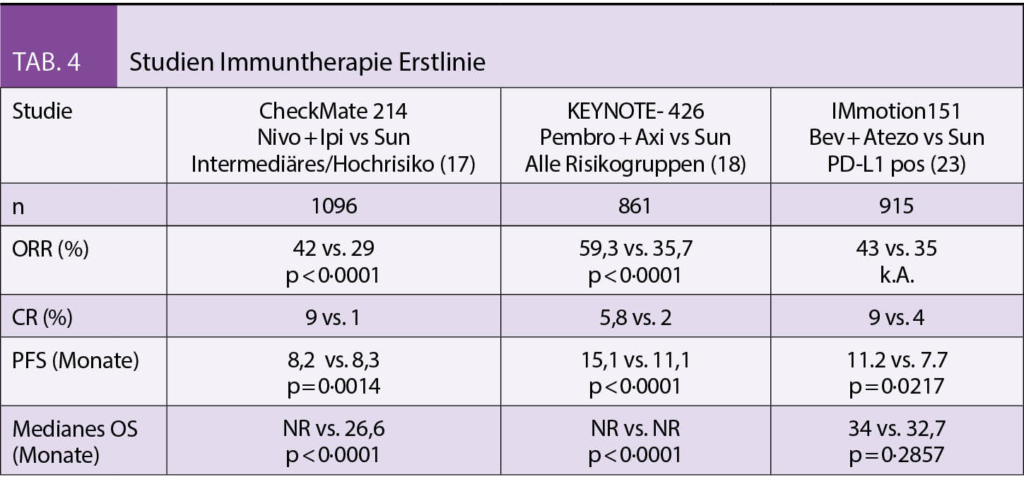
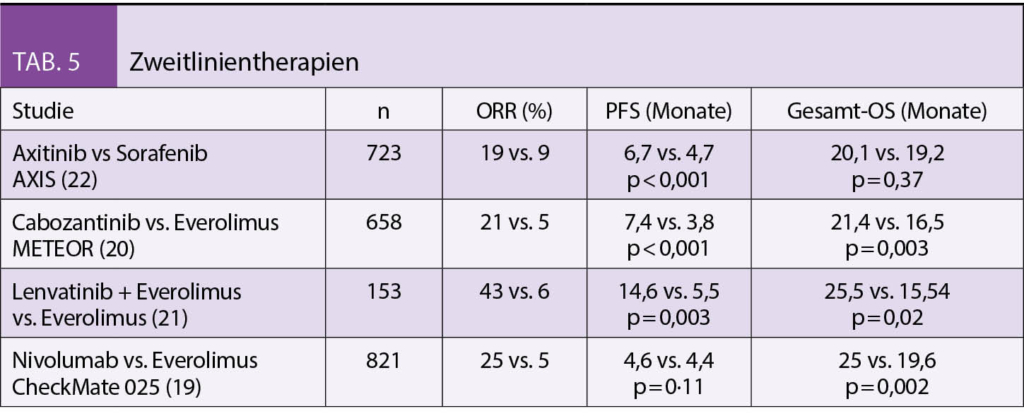
Seit einiger Zeit liegt bereits die Praxisleitlinie der Society for Integrative Oncology (SIO) zur Komplementärmedizin bei Brustkrebs vor, die von der American Society for Clinical Oncology (ASCO) (3) anerkannt wurde. Diese wird nun durch die deutlich umfangreichere S3-Leitlinie zu Komplementärmedizin in der Behandlung von onkologischen PatientInnen der AWMF ergänzt (4). Ein Auszug wichtiger Empfehlungen aus beiden Leitlinien ist in Tab. 1 dargestellt. Bei den beiden Leitlinien wird deutlich, dass hauptsächlich die nicht-pharmakologischen Therapien, wie z.B. Yoga, Achtsamkeitstraining oder Akupunktur/Akupressur empfohlen werden. Diese werden in Tab. 2 etwas näher ausgeführt. Diese Verfahren berücksichtigen zumeist den Wunsch vieler Frauen mit Brustkrebs, selber etwas aktiv tun zu können. Neben der positiven Evidenz aus wissenschaftlichen Studien haben sie auch den Vorteil, dass sie sich zumeist gut mit der antitumoralen Therapie kombinieren lassen, ohne dass man auf Interaktionen achten muss.
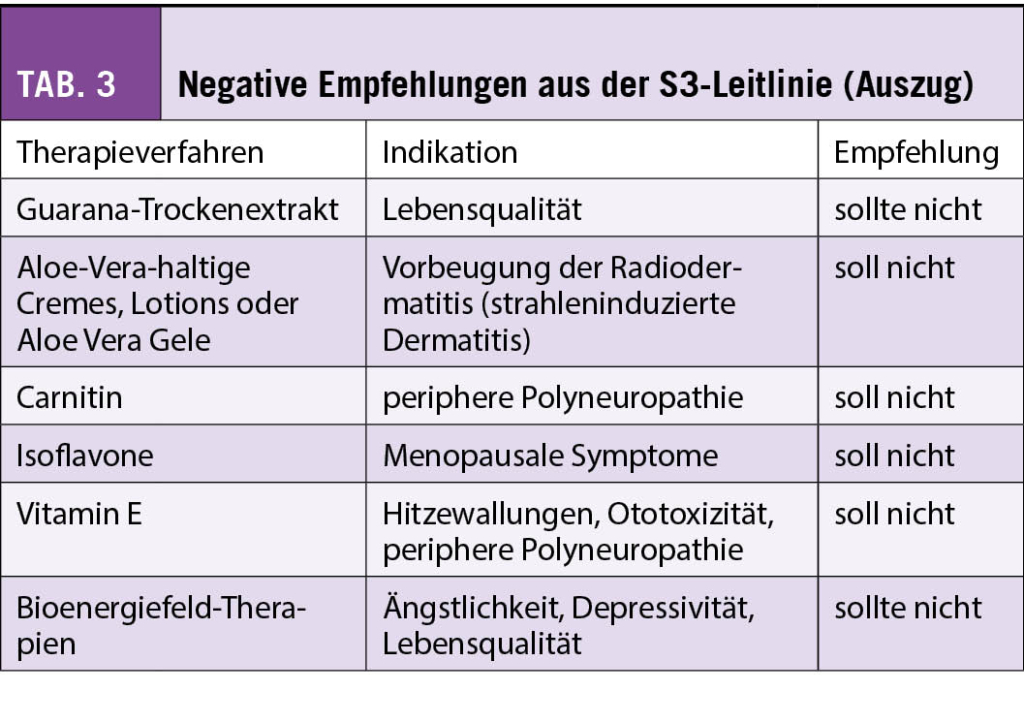
Hingegen liegt für Phytotherapeutika und Nahrungsergänzungsmittel weniger Evidenz vor, und diese sind eher mit einem Risiko der Interaktion mit der antitumoralen Behandlung assoziiert. In der Schweiz wird aber auch die Misteltherapie häufig von Patientinnen mit Brustkrebs nachgefragt. Nach der S3-Leitlinie kann die subkutan verabreichte Misteltherapie im Einzelfall zur Verbesserung der Lebensqualität empfohlen werden, während die Leitlinie der SIO sich aufgrund der unterschiedlichen Präparate und wenig Erfahrung mit Misteltherapie in den USA eher zurückhaltend äussert. In der S3-Leitlinie gibt es jedoch auch Therapien, von denen abgeraten wird. Diese sind in Tab. 3 zusammengefasst.
Die Patientin im Zentrum
Es ist wichtig die Empfehlungen zur Komplementärmedizin und das Gespräch dazu an die Patientin anzupassen, denn «one size fits all» widerspricht dem Prinzip einer Integrativen Onkologie. Es ist gut, die Werte und Wünsche der Patientin sowie mögliche kulturelle Einflüsse zu kennen oder zu erfragen, bevor man spezifische Empfehlungen ausspricht. Es gibt z.B. Patientinnen, denen achtsamkeitsbasierte Verfahren zu «spürig» sind, während andere sich davon stark angesprochen fühlen.
Auch Vorerfahrungen spielen eine Rolle. Viele Frauen haben bereits vor ihrer Brustkrebserkrankung Komplementärmedizin genutzt. Daraus entstehen Erwartungen, die sich auf die Auswahl und möglicherweise auch die Wirksamkeit komplementärer Therapien während der Brustkrebserkrankung auswirken können. Bisherige Forschung zu Erwartungen an das Therapieergebnis zeigt, dass positive Vorerfahrungen sich auf die Erwartungen auswirken und dass hohe Erwartungen an den Therapieoutcome den Placeboeffekt steigern können. Umgekehrt kann die Erwartung von Nebenwirkungen auch zu mehr Nebenwirkungen führen. Eine Beobachtungsstudie mit 111 Patientinnen über 24 Monate (5) weist z.B. darauf hin, dass negative Erwartungen bzgl. einer endokrinen Behandlung bei Brustkrebs das Risiko von behandlungsspezifischen Nebenwirkungen, Nocebo-Nebenwirkungen und Non-Adhärenz erhöhen können. Placebo und Nocebo spielen in der Medizin eine wichtige Rolle (6) und die Aufklärung der Patientin darüber kann helfen, Nebenwirkungen zu reduzieren (7). Es ist kein primär komplementärmedizinisches Thema, lässt sich aber im Gespräch gut damit kombinieren.
Das Interesse an Komplementärmedizin und die Vorerfahrungen mit Komplementärmedizin lassen sich gut anhand von Fragebögen erfassen. Verwendet man Fragebögen in der Praxis, ist es aber zwingend, diese auch zusammen mit den Patientinnen in der Sprechstunde zu besprechen, um die Sinnhaftigkeit des Ausfüllens aufzuzeigen.
Die Patientin zur aktiven Teilnehmerin am Behandlungsprozess machen
Die aktive Einbindung der Patientinnen in die Behandlung ist ein wichtiges Element in der integrativen Onkologie und eine Stärke einiger komplementärmedizinischer Therapien. Eine Akupressur (z.B. bei Übelkeit oder Fatigue), welche die Patientin selbst durchführen kann, hat sehr viel mehr aktiven Anteil als eine vom Behandler oder von der Behandlerin durchgeführte Akupunktur. Bei der aktiven Teilnahme geht es auch um eine Verbesserung der Selbstwirksamkeit. Selbstwirksamkeit wird von Schwarzer beschrieben als die subjektive Überzeugung, kritische Anforderungssituationen aus eigener Kraft erfolgreich bewältigen zu können (8). Dabei wird an neue oder schwierige Situationen aus allen Lebensbereichen gedacht sowie an Barrieren, die es zu überwinden gilt. Dabei wird auch von der Annahme ausgegangen, dass Menschen ihre Erfolgs- und Misserfolgserfahrungen sich selbst zuschreiben und danach generalisieren. Dies zeigt auch, wie wichtig es ist, mit der Patientin realistische Ziele bei geplanten Lebensstiländerungen zu vereinbaren. Bei zu hoch gesteckten Zielen (z.B. ich mache ab morgen jeden Tag 30 Minuten Sport) ist die Gefahr einer Misserfolgserfahrung zu gross. Auch ist es wichtig, Lebensstiländerungen mit sog. «Behavioural Change Techniques» zu begleiten, um die langfristige Umsetzung zu sichern. Zu den bewährten Techniken gehören z.B. die Setzung von realistischen Zielen, die Identifikation von Barrieren, eine Umsetzungsplanung sowie die soziale Unterstützung bei der Durchführung.
Integration in die Praxis und Zugang zu Ressourcen
Komplementärmedizin kann man unterschiedlich in den gynäkologischen Praxisalltag integrieren. Man kann Patientinnen Informationen zu dem Thema geben, mit Patientinnen komplementäre Therapien auswählen oder auch Patientinnen mit komplementären Therapien behandeln (9).
Viele Patientinnen erwarten von ihrer Gynäkologin oder von ihrem Gynäkologen zumindest eine kompetente Beratung zum Thema Komplementärmedizin oder besser noch ein konkretes Angebot. Die Leitlinien zeigen, dass es dabei nicht um die Verordnung von Vitaminen und Nahrungsergänzungsmitteln geht, sondern zumeist um nicht-pharmakologische Verfahren. Es geht aber auch darum, der Patientin Zugang zu entsprechenden qualitätsgesicherten Angeboten vermitteln zu können, wenn diese in der eigenen Praxis oder Klinik nicht vorhanden sind. Unser in einem wissenschaftlichen Konsensusprozess (10) entwickelte Flyer für seriöse Anbieter kann hier heruntergeladen und mit einem Verweis auf die eigene Praxis oder Klinik versehen werden: http://www.iki.usz.ch/forschung/Seiten/kokon-kto.aspx.
Auch Online-Angebote können hilfreich sein. Laut S3-Leitlinie «Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten» sollen jeder Krebspatientin Entspannungsverfahren empfohlen werden (11). Jedoch haben nicht alle Patientinnen dazu Zugang. Auf unserer Webseite am Universitätsspital Zürich ermöglichen wir einen kostenlosen Zugang zu Audios mit Entspannungsübungen für Menschen mit Krebserkrankungen: https://www.mbm-usz.ch/krebs/.
Möchte man sich selbst fortbilden, so bietet die Kommission Integrative Medizin der Arbeitsgemeinschaft gynäkologische Onkologie ein strukturiertes Fortbildungscurriculum zur integrativen Medizin (12) für Ärztinnen und Ärzte an, welches auch unser evidenzbasiertes Training beinhaltet und international abgestimmte Kompetenzen für integrative Onkologie vermittelt (13, 14).
Bei diesem Artikel handelt es sich um einen Zweitabdruck des in der «info@gynäkologie» 04-2021 erschienenen Originalartikels.
Copyright bei Aerzteverlag medinfo AG
Institut für komplementäre und integrative Medizin
Universitätsspital Zürich
Sonneggstrasse 6
8091 Zürich
claudia.witt@uzh.ch
Renate Rugieri Stiftung; Schweizer Fachverband Mind Body Medicine; International Association for Mind-Body-Medicine and -Health e.V. (IAM); Arbeitsgruppe Supportive and Palliative Care der Swiss Group for Clinical Cancer Research (SAKK); Arbeitsgruppe «Interprofessionalität» der Schweizerischen Akademie der Medizinischen Wissenschaften (SAMW); Arbeitsgemeinschaft Gynäkologische Onkologie;
Society of Integrative Oncology (SIO); Society of Acupuncture Research.
1. Keene MR, Heslop IM, Sabesan SS, Glass BD. Complementary and alternative medicine use in cancer: A systematic review. Complementary therapies in clinical practice 2019;35:33-47
2. Witt CM, Balneaves LG, Cardoso MJ, Cohen L, Greenlee H, Johnstone P, et al. A comprehensive definition for integrative oncology. J Natl Cancer Inst Monogr 2017;2017(52):lgx012
3. Lyman GH, Bohlke K, Cohen L. Integrative therapies during and after breast cancer treatment: ASCO endorsement of the SIO clinical practice guideline summary. Journal of oncology practice 2018;14(8):495-499
4. Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF. Leitlinienprogramm Onkologie: Leitlinie Komplementärmedizin in der Behandlung onkologischer PatientInnen. 2021 (Verfügbar: https://www.awmf.org/leitlinien/detail/ll/032-055OL.html)
5. Nestoriuc Y, von Blanckenburg P, Schuricht F, Barsky AJ, Hadji P, Albert US, et al. Is it best to expect the worst? Influence of patients’ side-effect expectations on endocrine treatment outcome in a 2-year prospective clinical cohort study. Ann Oncol 2016;27(10):1909-1915
6. Schedlowski M, Enck P, Rief W, Bingel U. Neuro-Bio-Behavioral Mechanisms of Placebo and Nocebo Responses: Implications for Clinical Trials and Clinical Practice. Pharmacol Rev 2015;67(3):697-730
7. Evers AWM, Colloca L, Blease C, Gaab J, Jensen KB, Atlas LY, et al. What Should Clinicians Tell Patients about Placebo and Nocebo Effects? Practical Considerations Based on Expert Consensus. Psychotherapy and psychosomatics 2021;90(1):49-56
8. Schwarzer RJ, Jerusalem M. Allgemeine Selbstwirksamkeitserwartung (SWE). 2021 (Verfügbar: www.selbstwirksam.de)
9. Witt C, Müller T. Komplementärmedizin in der gynäkologisch-onkologischen Sprechstunde: Wie mache ich mich fit dafür? Gynäkologe 2021;54:32-37
10. Rogge AA, Baur I, Blettner G, Holtkamp U, Horneber M, Jahn P, et al. Defining criteria for guiding cancer patients to find a reputable complementary medicine provider: Results of a literature review and a consensus procedure. Patient Preference and Adherence 2020;14:747-755
11. Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF. Leitlinienprogramm Onkologie: Leitlinie Psychoonkologie. 2021 (Verfügbar: https://www.leitlinienprogramm-onkologie.de/leitlinien/psychoonkologie/)
12. Arbeitsgemeinschaft Gynäkologische Onkologie e.V. AGO. Kommission IMed (Integrative Onkologie in der Medizin). 2021 (Verfügbar: https://www.ago-online.de/ago-kommissionen/kommission-imed)
13. Witt CM, Balneaves LG, Carlson LE, Cohen M, Deng G, Fouladbakhsh JM, et al. Education Competencies for Integrative Oncology-Results of a Systematic Review and an International and Interprofessional Consensus Procedure. J Cancer Educ 2020
14. Witt CM, Helmer SM, Schofield P, Wastell M, Canella C, Thomae AV, et al. Training oncology physicians to advise their patients on complementary and integrative medicine: An implementation study for a manual-guided consultation. Cancer 2020;126(13):3031-3041