Uterusmyome sind die häufigsten benignen gynäkologischen Tumore mit einer geschätzten Prävalenz zwischen 25-75%. Die Prävalenz ist abhängig von der Ethnie und stark abhängig vom Alter. Bei einer Frau gegen fünfzig sind Myome eher Regel denn Ausnahme. Sie sind in der gynäkologischen Praxis ein relevantes Thema (20, 1). Auch der Anteil von Patientinnen mit Myomen und Kinderwunsch hat zugenommen, da der Kinderwunsch in industrialisierten Ländern oft erst nach dem 30. Lebensjahr angestrebt wird.
Klinische Symptomatik von Myomen
Die Symptomatik von Myomen ist vielfältig und hängt von der Lokalisation der Myome ab (13,21). Je näher ein Myom am Endometrium liegt, desto häufiger sind Blutungsstörungen (Hypermenorrhoe 40%). Andere Symptome sind Dysmenorrhoe (28,2%) und Unterbauchschmerzen (14.9%) (1). Je nach Lokalisation können Myome Druckbeschwerden auf Blase und Darm erzeugen. Intraligamentäre Myome können selten auch den Ureter komprimieren und eine Hydronephrose verursachen.
Myome und Fertilität
Da die Myome verschiedene Effekte auf Endo- und Myometrium haben, können diese die Fertilität deutlich beeinträchtigen. Dies gilt besonders für submuköse Myome. Intramurale cavumnahe Myome verursachen Durchblutungsstörungen und lokale Entzündungsreaktion des Endometriums (18). Bei der Deformierung des Uteruscavum kann ein Raumproblem entstehen und die Implantation verhindert werden. Bei submukösen Myomen ist deren Grösse für die Therapie nicht so relevant, denn bereits bei kleineren Myomen (1-2cm) besteht ein Zusammenhang mit Fertilitätstörungen. Daher ist eine Entfernung anzuraten (4,18). Bei intramuralen, nicht das Cavum deformierenden Myomen ist ab 3 cm mit negativen Wirkungen auf Schwangerschaftsrate und Lebendgeburtsrate zu rechnen (7).
Myome und Therapie
Viele Myome sind asymptomatisch und brauchen darum auch keine Behandlung. Die Therapie wiederum ist zielgerichtet und individualisiert. 80% der betroffenen Frauen wünschen eine minimalinvasive Therapie und 51% möchten eine organerhaltende Therapie (3).
Medikamentöse Therapie-Optionen
Bei dem zunehmenden Wunsch der Patientinnen nach Organerhalt werden häufiger medikamentöse Therapien eingesetzt. Eine Wirkung am Endometrium haben alle medikamentösen Therapien, allerdings wirken nur GnRH-Analoga und Ulipristalacetat (UPA) direkt am Myom.
- Tranexamsäure
Das Antifibrinolytikum reduziert die lokale Enzymaktivität am Endometrium und führt zu einer circa 50%igen Reduktion der Blutungsstärke (22). Ein direkter Einfluss auf die Myomgrösse ist nicht bekannt. - Kombinierte orale Kontrazeptiva (KOK), Levonorgestrel-IUD
Zahlreiche Studien haben belegt, dass Patientinnen die KOK einnehmen, ein geringeres Risiko haben, Myome zu entwickeln. Bei Myomen können KOK im Langzyklus zur Behandlung der Blutungsstörungen angewandt werden. Ein direkter Effekt auf Myome ist nicht zu erwarten.
Das Levonorgestrel-IUD ist zur Therapie der idiopathischen Hypermenorrhoe zugelassen. Bei normalem Cavum ist das Levonorgestrel-IUD eine Therapieoption. - GnRH-Analoga
Vor Einführung von Ulipristalacetat (Esmya®) konnte man einzig mit GnRH Analoga Myome medikamentös verkleinern. Trotz eines direkten Effektes auf das Myom werden GnRH-Analoga aufgrund ihrer Nebenwirkungen heute nur selten eingesetzt. Sie führen nach 3-6 Monaten Therapie zu einer Reduktion der Myomgrösse von ca. 50%. Meist muss nach 2-3 Monaten zusätzlich eine Add-back-Therapie durchgeführt werden, um Hitzewallungen und Knochenmasseverlust zu vermeiden (14). GnRH-Analoga führen bei präoperativer Behandlung zu besseren Ausgangsbedingungen: Der Hämoglobin-Wert steigt an und die Myome werden kleiner. Für laparoskopische Eingriffe wurde oft, jedoch ohne wissenschaftliche Evidenz, über erschwerte Kapselpräparation berichtet. - Ulipristalacetat (Esmya®), UPA
UPA ist ein selektiver Progesteronrezeptormodulator, das heisst, dass UPA am Progesteronrezeptor sowohl antagonistische wie auch partiell agonistische Wirkung entfalten kann.
Es wurden folgende UPA-Wirkungen beschrieben (16):
An Myomen:
– Inhibition der Proliferation und Induktion der Apoptose
– Verkleinerung der Myome
Am Endometrium:
– Stoppt die uterine Blutung
– Reversible, gutartige Endometriumveränderungen (PAEC: Progesteron Receptor Modulator associated Endometrial Changes)
An den Ovarien:
– Amenorrhoe durch Hemmung der Ovulation
– Aufrechthaltung des Östradiolspiegels im mittleren Bereich
UPA wurde in den Zulassungsstudien PEARL I – IV untersucht (13): UPA ist in Bezug auf die Myombehandlung gleich effektiv wie GnRH-Analoga aber nebenwirkungsärmer. Es zeigten sich eine Amenorrhoe-Rate von über 80% und eine Myomvolumenreduktion um 70%. Hauptindikation zur Anwendung der UPA ist die präoperative Vorbereitung: Behandlung der präoperativen Anämie, über 10 cm grosse Myome vor laparoskopischer Myomenukleation, submucöse Typ-1- und -2-Myome über 4 cm vor einer hysteroskopischen Resektion.
Nach der Meldung von 4 transplantationsbedürftigen Leberschäden unter Therapie mit UPA hat die SGGG den Expertenbrief Nr. 54 publiziert: Die Esmya®-Behandlung ist weiterhin erlaubt, jedoch nur unter Kontrolle der Transaminasen vor Therapiebeginn und monatlich in den ersten beiden Behandlungszyklen.
Minimalinvasive Therapie
- Uterusarterienembolisation (UAE)
In einer 20-Jahre-Follow-up-Studie konnten bei ca. 2/3 der Patientinnen durch eine UAE die Hysterektomie vermieden werden (9). Unter UAE besteht das bis zu 5% Risiko einer vorzeitigen Menopause, bedingt durch eine Ovarialinsuffizienz (12). Wegen höheren Komplikationen in der Schwangerschaft (7), ist UAE bei Kinderwunsch kontraindiziert. Die postoperativen Schmerzen nach UAE sind vergleichbar mit solchen nach operativen Eingriffen. Das Postembolisationssyndrom, das bei bis zu 10% der Patientinnen auftritt, geht mit Unterbauchschmerzen und teilweise mit Fieber einher. Die Re-Interventionsrate nach UAE ist höher als nach chirurgischen Eingriffen (Hysterektomie, Myomenukleation) und beträgt zwischen 15 und 32 % versus ca. 7% nach operativer Entfernung (12). In neueren Analysen werden diese Unterschiede nicht mehr so deutlich (9,19). - Intrauterine, ultraschallgesteuerte Radiofrequenzablation SONATA®
Intramurale Myome sind hysteroskopisch nicht lokalisierbar und schon gar nicht resezierbar. Sie wurden üblicherweise durch einen abdominalen Eingriff entfernt.
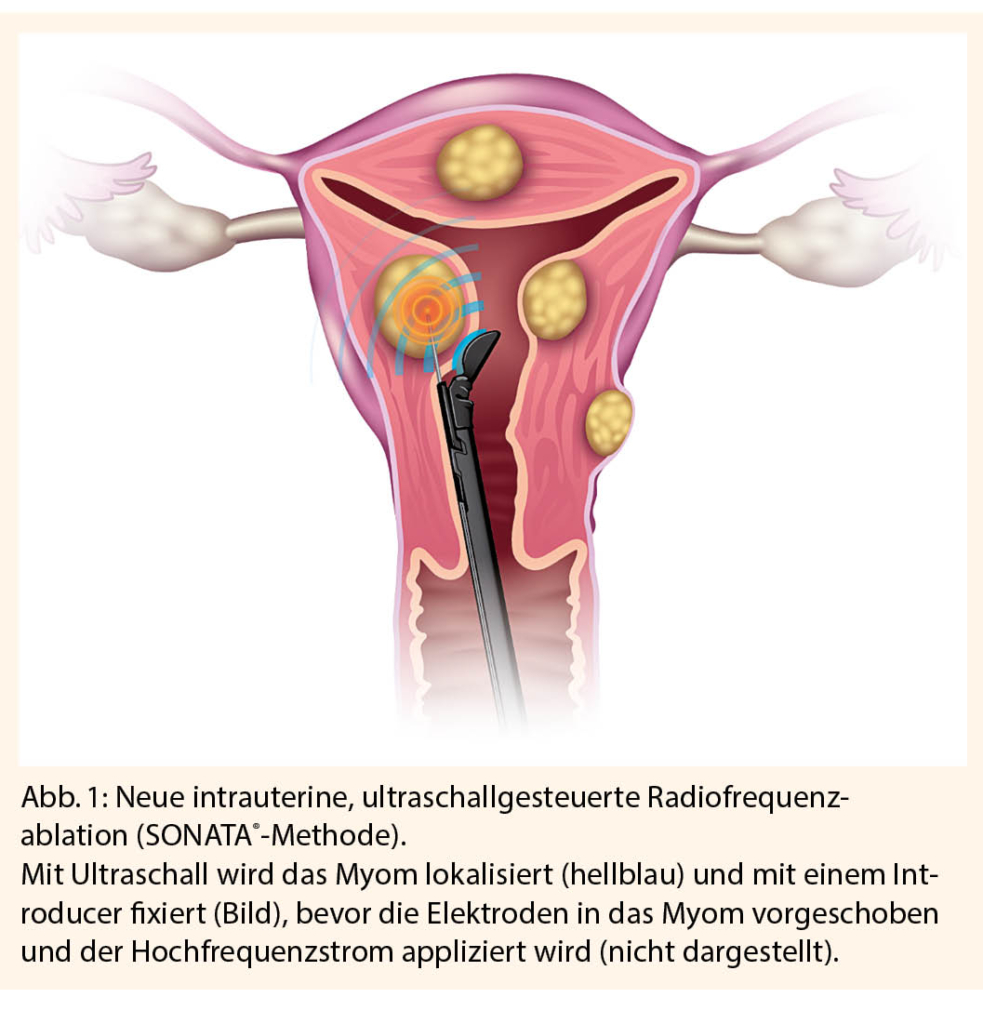
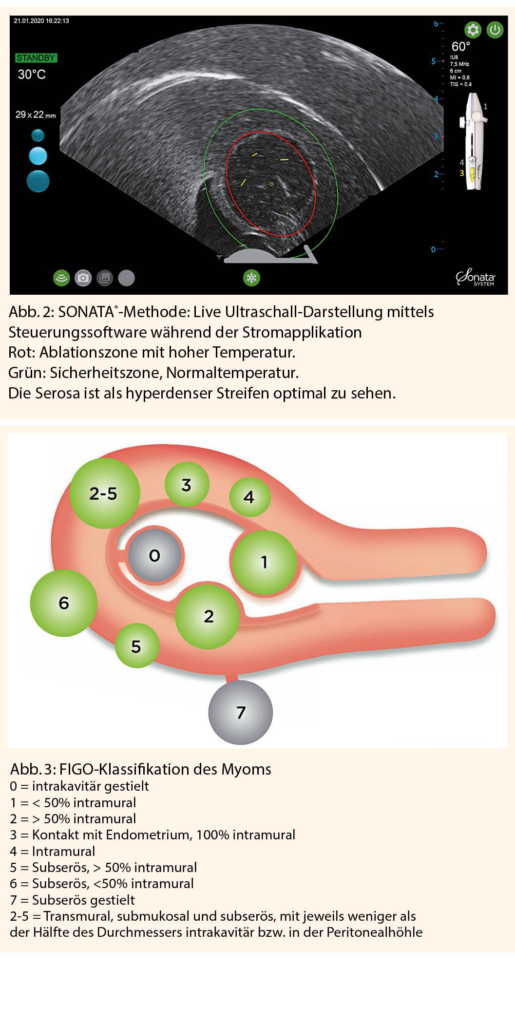
Das neu entwickelte SONATA®-System hat diesbezüglich die Therapiepalette relevant erweitert. Sonata® ist eine intrauterine applizierbare, ultraschallgesteuerte Sonde, die transzervikal eingeführt wird und eine monopolare Hochfrequenzablation von Myomen «ohne Operation» ermöglicht. Eine graphische Steuerungssoftware ermöglicht eine exakte Bestimmung der volumetrischen Ablationszone, die unter Echtzeit-Ultraschalldarstellung während der Stromapplikation kontrolliert bleibt. An 8 Elektrodenspitzen wird eine Temperatur bis 105°C erzeugt, die in Abhängigkeit der Myomgrösse über einen Zeitraum von bis zu 7 Minuten aufrechterhalten wird und das Myom thermoabladiert. In der FAST-EU-Study (5) konnte gezeigt werden, dass es zu einer Reduktion des perfundierten Volumens der Myome um 68% kommt. Dieser Effekt bestand bei einer Beobachtungsdauer von 12 Monaten.
Bei 75% der Patientinnen halbierte sich der monatliche Blutverlust während der Studie.
Die nekrotischen Myome verbleiben in situ und können für Nebenwirkungen im postoperativen Verlauf wie zum Beispiel «sludging» verantwortlich sein. Wenn intramurale Myome nach der Therapie ins Cavum prolabieren, kann eine hysteroskopische Re-Intervention sinnvoll sein. Relevante intraoperative Kompilationen sind bis dato nicht aufgetreten.
Der primäre Einsatz bei Kinderwunschpatientinnen wird derzeit nicht empfohlen, ist aber als Off-label-use möglich. Es wurde über erste Schwangerschaften nach SONATA®-Therapie berichtet (2). - Hysteroskopische (HSK) Myomentfernung
Die hysteroskopische Resektion ist die Methode der Wahl bei submukösen Myomen Typ 0 und I (4,18). Bipolare Resektionsgeräte sind günstig, da man physiologische Kochsalz- und nicht elektrolytfreie Lösungen als Dilatationsmedium benutzt.
Die präoperative Planung des Eingriffs mittels Ultraschall (Hydrosonographie) ist essentiell, intraoperativ muss man die Topographie der Myome kennen, da hysteroskopisch nur «die Spitze des Eisbergs» erkennbar ist. Die Resektion hat zwar den Vorteil, dass das Myomgewebe ganz entfernt wird, hat aber auch eine höhere Morbidität als beispielsweise die Sonatamethode: Perforation, Blutung und übermässige Einschwemmung sind mögliche Komplikationen.
Ein Sicherheitsabstand zwischen Myomkapsel und Serosa von mindestens 5 mm ist erforderlich (17) und je nach Gesundheitszustand der Patientin ist das eingeschwemmte Volumen und damit die Resektionszeit mehr oder weniger limitiert.
Nach Myomresektionen beträgt die Inzidenz von intrauterinen Adhäsionen ca. 10%, besonders bei sich gegenüberliegenden Myomen. Die Einlage eines CuIUD, eines kleinen intrauterinen Ballons, von intrauteriner Hyaluronsäure und der rasche medikamentöse Aufbau des Endometriums mit Estradiol sind diskutierte Strategien zur Adhäsionsprophylaxe. Bei multiplen und grossen Myomen oder Myomen mit relevantem intramuralem Anteil muss bei bis in ca. 20% der Fälle zweizeitig vorgegangen werden. - Laparoskopische (LSK) Myomenukleation
Will man intramurale und subseröse Myome chirurgisch entfernen, benötigt es einen abdominalen Zugang. Prinzipiell ist die Laparoskopie der offenen Chirurgie vorzuziehen. Auch hier sind die sorgfältige präoperative Planung, das Optimieren des präoperativen Hämoglobinwertes, blutungsreduzierende medikamentöse (adrenalinhaltige Lösung für Unterspritzung des Myoms, Misoprostol) und chirurgische Massnahmen, geeignete Instrumente (laparoskopische Myombohrer und Tentakulumzangen, RUMI-Manipulator) und geeignetes Nahtmaterial (barbed sutures) Schlüssel zum Erfolg. Bei der LSK ist das Bergen der Präparate ein Diskussionspunkt. Power-Morcellatoren sind heute mindestens ein medico-legales Problem. Auch wenn momentan grosse randomisierte Studien fehlen, verbessert die laparoskopische Myomenukleation oft die Fertilität (21).
Ab einer gewissen Anzahl und Grösse sind die Myomenukleationen einfacher offen durchzuführen: Eine angestrebte Schwangerschaft würde dann sowieso per Sectio beendet und der Pfannenstielschnitt,den man mit der Laparoskopie vermieden hätte, trotzdem durchgeführt.
Stadtspital Triemli
Frauenklinik
Birmensdorferstrasse 497
8063 Zürich
inna.joerg@triemli.zuerich.ch
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
daniel.passweg@triemli.zuerich.ch
Stadtspital Triemli
Frauenklinik
Birmensdorferstrasse 497
8063 Zürich
stephanie.vonorelli@zuerich.ch
Die Autoren verwenden sämtliche aufgezählte Methoden inklusive Sonata in ihrer Klinik, haben aber keine direkten finanziellen Interessen.
1. Ahrendt HJ, Tylkoski H, Rabe T, Szczes A, Friedrich C, Roehl FW, Kitay A, Roemer T, Foth D. Arch Gynecol Obstet. Prevalence of uterine myomas in women in Germany: data of an epidemiological study. Arch Gynecol Obstet. 2016 Jun;293(6):1243-53. doi: 10.1007/s00404-015-3930-8. Epub 2015 Nov
2. Bends R, Toub DB, Römer T. Normal spontaneous vaginal delivery after transcervical radiofrequency ablation of uterine fibroids: a case report. Int J Womens Health. 2018 Jul 16;10:367-369. doi: 10.2147/IJWH.S165959. eCollection 2018.
3. Borah BJ et al. The impact ot uterine leiomyomas: a national survey of affected women. Am J Obstet Gynecol. 2013,209:319.e1-319.e20.
4. Bosteels J, Kasius J, Weyers S, Broekmans FJ, Mol BW, D’Hooghe TM. Hysteroscopy for treating subfertility associated with suspected major uterine cavity abnormalities. Cochrane Database Syst Rev. 2013 Jan 31;(1):CD009461. doi: 10.1002/14651858.CD009461.pub2
5. Brölman H, Bongers M, Garza-Leal JG, et al. The FAST-EU trial: 12-month clinical outcomes of women after intrauterine sonography-guided transcervical radiofrequeny. Gynecol Surg. 2016; 13: 27–35. Published online 2015 Sep 28. doi: 10.1007/s10397-015-0915-3
6. Christansen JK. The facts about fibroids. Presentation and latest management options. Postgrad Med. 1993;94:129-37.
7. Christopoulos G, Vlismas A, Salim R et al. Fibroids that do not distort the uterine cavity and IVF succes rates: an observational study using extensive matching criteria. BJOG. 2017;124:615-21.
8. David M, Vössing P, Stupin J. Alternativmedizinische Methoden zur Myombehandlung. Frauenarzt. 2015;56:3925.
9. Davis MR, Soliman AM, Castelli-Haley J, Snabes MC, Surrey ES. Reintervention Rates after Myomectomy, Endometrial Ablation, and Uterine Artery Embolization for Patients with Uterine Fibroids. J Womens Health (Larchmt). 2018 Oct;27(10):1204-1214. doi: 10.1089/jwh.2017.6752. Epub 2018 Aug 7.
10. De Bruijn AM, Ankum WM, Reekers JA, et al. Uterine artery embolization vs hysterektomie in the treatment of symptomytic uterine fibroids: 10-year outcomes from the randomized EMMY trial. Am J Obstet. Gynecol. 2016;215:745,e1-745.e12.
11. Donnez J, Vázquez F, Tomaszewski J, Nouri K, Bouchard P, Fauser BC, Barlow DH, Palacios S, Donnez O, Bestel E1, Osterloh I, Loumaye E; PEARL III and PEARL III Extension Study Group. Long-term treatment of uterine fibroids with ulipristal acetate. Fertil Steril. 2014 Jun;101(6):1565-73.e1-18. doi: 10.1016/j.fertnstert.2014.02.008. Epub 2014 Mar 12
12. Gupta JK, Sinha A, Lumsden MA, Hickey M. Uterine artery embolization for symptomatic uterine fibroids. Cochrane Database Syst. Rev. 2014;12:CD005073.
13. Donnez J, Dolmans MM. Uterine fibroid management: from the present to the future. Hum Reprod Update. 2016;22:665-86.
14. Kleinstein J. GnRH-Analoga und Add-back-Verfahren Journal für Gynäkologische Endokrinologie 2008; 2 (2) (Ausgabe für Österreich), 40-43 Journal für Gynäkologische Endokrinologie 2008; 2 (2) (Ausgabe für Schweiz), 25-28
15. Kröncke T, David M. Uterine artery embolisation for fibroid treatment-results of the 5th radiological expert meeting. Rofo. 2015;187:483-5.
16. Rabe T, et al, Ulipristalacetat bei symptomatischem Uterus myomatosus und bei myombedingter Hypermenorrhoe. J. Reproduktionsmed Endokrinol. 2012;9:106-26.
17. Römer T. Diagnostik und Therapie der Hypermenorrhoe. Ärztliche Praxis Gynäkologie. 2013;9:20-7.
18. Römer T. Blutungsstörungen. Gynäkologische Endokrinologie. 2019;1.
19. Sandberg EM, Tummers FHMP, Cohen SL, van den Haak L, Dekkers OM, Jansen FW. Reintervention risk and quality of life outcomes after uterine-sparing interventions for fibroids: a systematic review and meta-analysis. Fertil Steril. 2018 Apr;109(4):698-707.e1. doi: 10.1016/j.fertnstert.2017.11.033
20. Stewart EA, Cookson CL, Gandolfo RA, Schulze-Rath R. Epidemiology of uterine fibroids: a system Review. BJOG. 2017;124:1501-12.
21. Tian YC, Wu JH, Wang HM, Dai YM. Improved fertility following enucliation of intramural myomas in infertile women. Chin. Med. J. 2017;130:1648-53.
22. Wöckel A, Scholz C, Hancke K, Janni W. Uterine Leiomyome – Indikationen für konservative Therapie. Gynäkologe. 2012;45(11).835-40.